Резюме
Незважаючи на десятиліття інтенсивних доклінічних і клінічних досліджень, все ще існує велика невизначеність щодо ефективності різних інфузійних стратегій при критичних станах. Нові концепції проникності судин обіцяють змінити підхід до інфузійних стратегій і в кінцевому підсумку привести до підвищення їх ефективності. Центральним елементом нових концепцій є ендотеліальний глікокалікс, що вистилає просвіт судин. Знання ендотеліального глікокаліксу дозволило переглянути класичний принцип Старлінга, щоб краще пояснити проходження рідини через ендотеліальний бар’єр. Ця модель ендотеліальної проникності значною мірою пояснює різницю в прогнозованому (1 : 3–1 : 5) порівняно зі спостережуваним (приблизно 1 : 1,3–1 : 1,4) співвідношенні колоїдів і кристалоїдів, необхідних для досягнення аналогічних гемодинамічних кінцевих точок у клінічній практиці. Сказане вище пояснює, чому інфузія ізоонкотичних колоїдів не змінює існуючий інтерстиціальний набряк і може в деяких ситуаціях привести до меншого збільшення обсягу і більшого набряку тканини, ніж кристалоїди, у критичних пацієнтів. Ефекти збільшення обсягу розчинів, що вводяться, також різняться залежно від швидкості інфузії, ступеня вазоконстрикції, цілісності ендотеліального глікокаліксу і волемічного статусу. Тому ефективність рідинної реанімації вважається контекстно-залежною. Пошкодження ендотеліального глікокаліксу, визване підвищеною проникністю, відбувається при низці критичних станів, включаючи сепсис і тяжку травму, а ступінь проникності пов’язаний із поганими наслідками. Ймовірно, але ще не доведено, що захист і відновлення ендотеліального глікокаліксу в цих умовах покращують результати лікування. Кілька фармакологічних методів лікування знаходяться на доклінічній стадії розробки, і поки немає достатніх даних, що підтверджували би їх клінічну ефективність. Проте з’являється все більше свідчень того, що інфузійні розчини, які зазвичай використовуються, захищають і відновлюють ендотеліальний глікокалікс і модулюють проникність ендотелію, але розрізняються за своєю здатністю робити це ефективно. Тому важливо, щоб при виборі рідин для ресусцитації при конкретній патології лікарі на додаток до онкотичних властивостей враховували їх здатність захищати і відновлювати ендотеліальний глікокалікс.
Несмотря на десятилетия интенсивных доклинических и клинических исследований, все еще существует большая неопределенность в отношении эффективности различных инфузионных стратегий при критических состояниях. Новые концепции проницаемости сосудов обещают изменить подход к инфузионным стратегиям и в конечном итоге привести к повышению их эффективности. Центральным элементом новых концепций является эндотелиальный гликокаликс, который выстилает просвет сосудов. Знание эндотелиального гликокаликса позволило пересмотреть классический принцип Старлинга, чтобы лучше объяснить прохождение жидкости через эндотелиальный барьер. Эта модель эндотелиальной проницаемости в значительной степени объясняет разницу в прогнозируемом (1 : 3–1 : 5) в сравнении с наблюдаемым (приблизительно 1 : 1,3–1 : 1,4) соотношении коллоидов и кристаллоидов, необходимых для достижения аналогичных гемодинамических конечных точек в клинической практике. Вышесказанное объясняет, почему инфузия изоонкотических коллоидов не изменяет существующий интерстициальный отек и может в некоторых ситуациях привести к меньшему увеличению объема и большему отеку ткани, чем кристаллоиды, у критических пациентов. Эффекты увеличения объема вводимых растворов также различаются в зависимости от скорости инфузии, степени вазоконстрикции, целостности эндотелиального гликокаликса и волемического статуса. Поэтому эффективность жидкостной реанимации считается контекстно-зависимой. Повреждение эндотелиального гликокаликса, вызванное повышенной проницаемостью, происходит при ряде критических состояний, включая сепсис и тяжелую травму, а степень проницаемости связана с плохими исходами. Вероятно, но еще не доказано, что защита и восстановление эндотелиального гликокаликса в этих условиях улучшают результаты лечения. Несколько фармакологических методов лечения находятся на доклинической стадии разработки, и пока нет достаточных данных, подтверждающих их клиническую эффективность. Тем не менее появляется все больше свидетельств того, что обычно используемые инфузионные растворы защищают и восстанавливают эндотелиальный гликокаликс и модулируют проницаемость эндотелия, но различаются по своей способности делать это эффективно. Поэтому важно, чтобы при выборе жидкостей для ресусцитации при конкретной патологии врачи в дополнение к онкотическим свойствам учитывали их способность защищать и восстанавливать эндотелиальный гликокаликс.
Despite decades of intense preclinical and clinical researches, there is still much uncertainty regarding the volume-expanding efficacy of different fluid resuscitation strategies across a range of diseases, particularly for critically ill patients. New concepts on vascular permeability promise to change the approaches to the fluid resuscitation and ultimately lead to improvements in its efficacy. Central to these new concepts is the endothelial glycocalyx, which lines the luminal aspect of the vascular endothelium. Knowledge of the endothelial glycocalyx has permitted to revise the classic Starling’s principle to better explain the observed flux of fluid across the endothelial barrier. This new model of endothelial permeability largely explains the difference in the predicted (1 : 3–1 : 5) versus the observed (approximately 1 : 1.3–1 : 1.4) ratio of colloid to crystalloid required to achieve similar hemodynamic end-points in clinical trials. It also explains why the infusion of an iso-oncotic colloid fluid will not reverse existing interstitial oedema, and may in some situations result in less volume expansion and greater tissue oedema than a crystalloid in critically ill patients. The volume expanding effects of infused fluids also differ depending on the rate of infusion, the degree of vasoconstriction, the integrity of the endothelial glycocalyx and the volume status. Because of this, the effectiveness of fluid resuscitation is said to be context-sensitive. Damage to the endothelial glycocalyx associated with increased permeability occurs in some critical illnesses, including sepsis and severe trauma, and the degree of shedding is associated with poor outcomes. It is likely but not yet proven, that protecting and restoring of the endothelial glycocalyx in these conditions will improve outcomes. Several pharmacologic therapies are being investigated but they involved the pre-clinical phase of the development and there is not yet enough evidence to support their clinical use. However, there is growing evidence that commonly used resuscitation fluids protect and restore the endothelial glycocalyx and modulate endothelial permeability, but differ in their ability to do so. It is therefore important that, when choosing resuscitation fluids for particular patients, clinicians consider factors additional to oncotic properties, including ability to protect and repair the endothelial glycocalyx.
Введение
Цель данного обзора: на основании анализа литературных данных о роли эндотелиального гликокаликса в регуляции проницаемости сосудов, реологии крови, механотрансдукции, воспаления, коагуляции и фибринолиза представить четыре основные модификации модели Старлинга, а также осветить дополнительные теоретические предположения и клинические последствия пересмотренной модели Старлинга.
1. Эндотелиальный гликокаликс
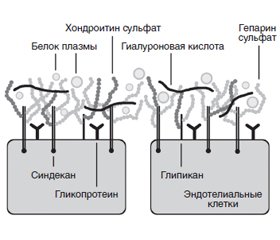
Эндотелиальный гликокаликс состоит из сети протеогликанов: трансмембраносвязанного синдекана и мембраносвязанного глипикана. С ними связаны пять типов боковых цепей гликозаминогликанов, преимущественно гепарансульфат, а также, в меньшем количестве, хондроитинсульфат и гиалуронан [7]. Гликопротеины также прикрепляются к эндотелию. Они разнообразны по функции и включают молекулы клеточной адгезии, рецепторы межклеточной передачи сигналов и рецепторы, участвующие в фибринолизе и коагуляции. В сеть включены многочисленные растворимые в эндотелии и плазме молекулы (рис. 1).
/24.jpg)
Эндотелиальный гликокаликс является ключевым регулятором функции эндотелия. Больше всего известно о его роли в регуляции проницаемости сосудов, но он также является неотъемлемой частью взаимодействий клетки и сосуда, межклеточного взаимодействия, реологии крови, механотрансдукции, воспаления, коагуляции и фибринолиза [1–7]. Хрупкая структура и небольшие размеры эндотелиального гликокаликса затрудняют его обнаружение и количественную оценку. Экспериментально эндотелиальный гликокаликс можно непосредственно визуализировать с помощью ряда методов, включая электронную микроскопию, прижизненную микроскопию, сравнение объемов распределения эндотелиальных проницаемых и непроницаемых гликокаликсных индикаторов, конфокальную микроскопию и иммуногистохимическое окрашивание [8]. Все эти методы инвазивны и не подходят для повторных измерений, если вообще используются в клинической практике.
С клинической целью обнаружение продуктов расщепления эндотелиального гликокаликса в плазме или сыворотке широко использовалось в исследованиях, но пока недоступно для клинической практики, и, действительно, клиническая значимость повышенных уровней не была подтверждена. Наиболее часто измеряется синдекан-1 (SDC-1) — основной структурный компонент эндотелиального гликокаликса [7]. Гепарансульфат, хондроитинсульфат и гиалуронан также использовались для выявления повреждения эндотелиального гликокаликса [8]. Как альтернатива для определения толщины эндотелиального гликокаликса в ногтевом ложе или слизистой оболочке полости рта в контексте клинических исследований использовалась визуализация с помощью камеры в темном поле с боковым потоком (SDF) или предшествующей спектральной визуализации с ортогональной поляризацией (OPS). Эти камеры оценивают толщину эндотелиального гликокаликса на основании скорости и деформации проходящих эритроцитов и лейкоцитов [8].
Утоньшение эндотелиального гликокаликса или повышение проницаемости гликокаликса обычно происходят при ряде заболеваний, включая травму и сепсис, и связаны с плохими исходами у пациентов [5]. Тем не менее не ясно, является ли разрушение эндотелиального гликокаликса просто маркером тяжести заболевания или же оно напрямую влияет на плохие результаты. Существует ряд биологически вероятных путей, посредством которых разрушенный эндотелиальный гликокаликс может вызывать повреждающие эффекты, но ни одно клиническое исследование не пыталось восстановить его, а в исследованиях на животных нет данных о результатах после восстановления [9].
Разнообразный набор медиаторов, которые, как известно, вызывают разрушение, — это зеркальное отражение состояний, связанных с повреждением эндотелиального гликокаликса. Они включают фактор некроза опухоли (TNF-α), активные формы кислорода (ROS), гепараназу, гипоперфузию, гипергликемию, бактериальные токсины и факторы роста (но не ограничиваются ими) [10]. В итоге общий путь многих медиаторов повреждения — это активация протеаз, которые отщепляют эндотелиальные компоненты гликокаликса с поверхности клетки [10].
2. Роль гликокаликса в регуляции проницаемости сосудов: пересмотренный принцип Старлинга
Движение жидкости через эндотелий до недавнего времени объяснялось классическим принципом Старлинга, который описывает скорость фильтрации как функцию двух противоположных сил — гидростатического давления и осмотического давления — через стенку сосуда [11]:
Jv/A = Lp[(Pc – Pi) – σ(Пc – Пi)],
где Jv/A — внешняя сила фильтрации для данной области, Lp — гидропроводность мембраны, Pc — гидростатическое давление в сосуде, Pi — гидростатическое давление в интерстиции, σ — коэффициент отражения макромолекул мембраны, Пc — осмотическое давление в сосуде, Пi — интерстициальное осмотическое давление.
Когда Старлинг впервые описал свою теорию в 1896 году [11], модель соответствовала экспериментальным данным, доступным в то время. Однако в последние годы современные технологии позволили наблюдать ряд противоречий в классическом уравнении. В частности, отсутствует венозная реабсорбция жидкости, скорость транскапиллярного кровотока ниже прогнозируемой, а концентрация интерстициального белка оказывает минимальное влияние на поток жидкости [2]. Это привело к четырем основным модификациям модели Старлинга, причем эндотелиальный гликокаликс занимает центральное место в данных модификациях.
2.1. Нет поглощения в устойчивом состоянии
Старлинг предположил, что после фильтрации из артериального конца капилляра (сегмент под пиком Pc) жидкость реабсорбируется на венозном конце (сегмент под низким уровнем Pc). Однако при проведении экспериментов было обнаружено, что, хотя существует транзиторный отклик, когда жидкость абсорбируется после внезапного снижения Pc, она быстро возвращается к обратной фильтрации даже в венозном конце капилляра. Эта кратковременная фаза абсорбции длится примерно 15–30 минут у людей после острого кровоизлияния, что позволяет абсорбировать или аутореанимировать примерно 0,5 л интерстициальной жидкости [2, 12]. В стационарном состоянии поглощения не наблюдается по всей длине большинства капилляров независимо от Pс (правило отсутствия поглощения) [2, 12]. Вместо этого жидкость удаляется из интерстиция через лимфатическую систему [12]. Только в определенных уникальных органах: в почечной, кишечной и лимфатической системах — абсорбция наблюдается в устойчивом состоянии благодаря механизмам, которые поддерживают низкий Пi и повышенный Pi [2].
Правило отсутствия абсорбции объясняет, почему внутривенное введение изо- или гиперонкотических коллоидных жидкостей не устраняет существующий интерстициальный отек [3] и связано с обратной зависимостью между скоростью капиллярной фильтрации и градиентом концентрации интерстициального белка, прилегающего к стенке сосуда. После начального уменьшения Pc баланс сил направляет жидкость внутрь просвета сосуда. Это движение жидкости концентрирует интерстициальные белки, увеличивая Пi, которое противодействует силе поглощения внутрь. В конце концов достигается новое устойчивое состояние, в котором баланс сил всегда приводит к внешней фильтрации [2].
2.2. Субгликокаликсное пространство
Оригинальная теория Старлинга предполагает, что Пi существенно ниже, чем Пc, что неверно. Интерстиций заполнен белками вследствие физиологической экстравазации белков плазмы, возможно, через большие поры, расположенные в венулярных сегментах капилляров, что приводит к тому, что Пi приближается к Пc [2, 4]. Но решение исходного уравнения с измеренными значениями Пi и Пc предсказывает гораздо более высокую скорость фильтрации, чем измеренная экспериментально [13]. Кроме того, модификация Пi экспериментально оказывает незначительное влияние на скорость фильтрации [2].
Расхождения между прогнозируемой и измеренной скоростями фильтрации устраняются путем пересмотра уравнения Старлинга и замены Пi осмотическим давлением в небольшой безбелковой зоне между эндотелиальным гликокаликсом и эндотелиальными клетками (рис. 2):
Jv/A = Lp[(Pc – Pi) – σ(Пc – Пg)],
где Пg — субгликокаликсное осмотическое давление. Так как осмотическое давление, противодействующее Пc, равно Пg, а не Пi, изменения Пi будут оказывать незначительное влияние на скорость фильтрации, как это и наблюдалось [2]. Уровень Пg практически низкий по сравнению с Пc, поэтому градиент осмотического давления приближается к Пc.
/25_2.jpg)
В субгликокаликсном пространстве поддерживается безбелковое состояние благодаря постоянной внешней фильтрации жидкости, что объясняется правилом отсутствия абсорбции и эффектом фильтрации белков плазмы интактного эндотелиального гликокаликса. Полученный ультрафильтрат протекает через субгликокаликсное пространство, а затем через межклеточные щели (через разрывы в плотных соединительных нитях) попадает в просвет сосуда [2]. Из-за их узости скорость в разрывах высока даже при низких скоростях фильтрации, что предотвращает перемещение интерстициального белка обратно в субгликокаликсное пространство [2].
2.3. Эндотелиальный гликокаликс является определяющим фактором гидравлической проводимости
Эндотелиальный гликокаликс также является важным фактором, определяющим гидравлическую проводимость. Гидравлическая проводимость (Lp) — это изменение скорости фильтрации при изменении трансэндотелиального давления, которая может рассматриваться как просачивание воды через стенку сосуда. Далеко не являясь статической переменной, Lp динамически зависит от эндотелиального гликокаликса и эндотелия. Эндотелиальный гликокаликс снижает Lp путем механического сопротивления потоку жидкости [2, 4]. Он также влияет на Lp путем механотрансдукции сдвигового усилия на нижележащие эндотелиальные клетки, которые реагируют на повышенное напряжение путем высвобождения оксида азота (NO) и изменения соединительных белков, что приводит к увеличению Lp [14]. Данный процесс физиологически уместен при удовлетворении повышенной потребности в метаболических субстратах для скелетных мышц во время упражнений, но актуальность у критических пациентов, у которых в большинстве случаев эндотелиальный гликокаликс повреждается, а сдвиговое напряжение низкое, еще предстоит выяснить.
Эндотелиальные клетки играют важную роль в регуляции Lp. Герметичные и адгезивные соединения способствуют высокому гидравлическому сопротивлению межклеточного пространства. Разрушение этих соединений происходит в ответ на различные медиаторы, такие как сосудистые эндотелиальные факторы роста (VEGF) и цитокины, увеличивая Lp [15]. Кроме того, апоптоз, митоз и трансклеточные пути, такие как аквапорины, могут способствовать увеличению Lp в зависимости от сосудистого русла и преобладающих патофизиологических состояний [15]. Транс- и параклеточные пути, которые опосредуют проницаемость эндотелия для жидкости, растворенных веществ и клеток при ряде заболеваний, являются сложными и не до конца понятны и рассматриваются в других работах [15].
2.4. Модифицированная модель Старлинга нелинейная при низких скоростях фильтрации
Влияние капиллярного гидростатического давления Pc на скорость фильтрации является более сложным, чем предполагалось ранее. Исходное и модифицированное уравнения Старлинга описывают соотношение между Jv/A и Pc как линейное, когда другие переменные постоянны. Это соотношение представлено следующим линейным уравнением:
Jv/A = LpPc + [Lp(–Pi – σПc + σПg/i)].
Однако из-за правила отсутствия поглощения при низких значениях Jv/A в установившемся режиме скорость потока только приближается к нулю, фактически никогда не достигая нуля или становясь отрицательной. Это приводит к асимптотической кривой (кривая на гладкой регулярной поверхности в евклидовом пространстве) при низких значениях Jv/A и линейной кривой при более высоких значениях. T.E. Woodcock и T.M. Woodcock [16] описали точку перегиба как J-точку и предположили, что при значениях Pc ниже J-точки и кристаллоиды, и коллоиды будут иметь почти одинаковые эффекты расширения объема из-за того, что скорость фильтрации обоих близка к нулю. Пересечение по Х, то есть Pc, когда Jv/A равно нулю (или, скорее, как было бы, если бы кривая была линейной при Jv/A, равной нулю), аппроксимирует точку J и определяется как:
J-точка = Pi + σПc – σПg/i.
Увеличение Pi или Пc сместит точку J вправо, тогда как увеличение Пg/i будет иметь противоположный эффект (рис. 3). С учетом клинического контекста это смещение вправо в J-точке выгодно для увеличения внутрисосудистого объема, так как можно вливать больше жидкости (и кристаллоид или коллоид будут иметь аналогичные эффекты увеличения объема) до того, как будет достигнут порог гидростатического давления для движения жидкости в интерстиции, в то время как сдвиг влево вреден для расширения объема — жидкость будет перемещаться внутрь интерстиция при более низком Pc и, следовательно, внутрисосудистом объеме. Увеличение Pi обычно происходит из-за образования отека, что нежелательно, поэтому лучший способ добиться правильного сдвига — увеличить Пc и избежать увеличения Пg/i.
/26_3.jpg)
В интактном эндотелиальном гликокаликсе Пg незначительно, и коллоидные частицы вводимой коллоидной жидкости остаются во внутрисосудистом пространстве благодаря эффекту фильтрации эндотелиального гликокаликса. Это приводит либо к отсутствию изменений, либо к смещению вправо точки J, низкой скорости фильтрации и постоянному расширению объема плазмы от вводимой жидкости. Приводит ли коллоид по сравнению с кристаллоидом к увеличению объема в этом контексте, зависит от Pc. Если Pc ниже J-точки, то, поскольку скорость фильтрации близка к нулю, как кристаллоиды, так и коллоиды будут иметь одинаковый эффект расширения объема. Если Pc выше J-точки, то коллоиды будут сохраняться во внутрисосудистом пространстве дольше, чем кристаллоиды.
Хотя в настоящее время нет способа измерить Pc у постели больного, существует слабая корреляция между измеримыми макроциркуляторными параметрами, такими как артериальное давление и параметры микроциркуляции [17], имеются признаки того, что у здоровых добровольцев J-точка действительно приближается к Рс, что считается нормоволемией. Когда у нормоволемиков-добровольцев эксфузировали 900 мл крови, объем кристаллоида, необходимый для восстановления нормоволемии, оценивался примерно в 1–2 раза больше объема кровопотери [18] в зависимости от скорости замещения. Для сравнения: в экспериментах, где кристаллоид вводили для достижения гиперволемии, было обнаружено, что всего 17 ± 10 % оставалось во внутрисосудистом пространстве [19].
Напротив, если эндотелиальный гликокаликс поврежден, J-точка смещается влево из-за более высокой Пi, заменяющей Пg [20], и эффект увеличения объема плазмы при инфузии любой жидкости снижается, то есть скорость внешней фильтрации будет выше нуля при меньшем объеме плазмы. Как это ни парадоксально, первоначально может показаться, что в этом контексте (с вероятностью, что Pc будет выше J-точки) коллоидная жидкость будет сохраняться во внутрисосудистом пространстве дольше, чем кристаллоид, но это не обязательно так, поскольку коллоидные частицы могут свободно перемещаться в интерстиций, еще больше увеличивая Пi и ухудшая сдвиг влево [20]. Повреждение гликокаликса также уменьшает σ, делая J-точку более зависимой от Pi и менее зависимой от разницы осмотического давления.
Данная концепция была экспериментально продемонстрирована M. Jacob et al. [4], которые измеряли перфузионное давление (приблизительно Pc) и поток транссудата (приблизительно Jv/A) в сердцах морских свинок ex vivo. Pc предполагаемой J-точки после инфузии кристаллоида составляло приблизительно 10 см вод.ст. и сохранялось до и после ферментативного расщепления эндотелиального гликокаликса, хотя перфузат без белка, вероятно, приводил к повреждению эндотелиального гликокаликса до ферментативной деградации. Положительная J-точка, вероятно, была вызвана увеличением Pi из-за движения жидкости в интерстиций. После инфузии коллоидов эта точка составляла 0 см вод.ст. в интактном эндотелиальном гликокаликсе, но после ферментативного расщепления она была снижена до –12 см вод.ст. — интерстиций, по существу, был «высасывающим» жидкость из внутрисосудистого пространства. Отрицательная J-точка, вероятно, была связана с увеличением Пi от перемещения коллоидных частиц в интерстиции. В аналогичном исследовании были обнаружены сходные уровни отека тканей после введения коллоида и кристаллоида в сосуды с оголенным гликокаликсом [20]. В исследовании T. Borup et al. увеличение Пi привело к повышению скорости фильтрации последующих вводимых растворов [21].
2.5. Дополнительные теоретические соображения
Вазоконстрикция и вазодилатация посредством экзогенных или эндогенных механизмов также влияют на Pc и скорость фильтрации, но в некоторой степени непредсказуемо, поскольку они зависят от баланса сужения/дилатации в венулах и артериолах [17]. Кроме того, повышенная скорость внутривенной инфузии жидкости теоретически должна приводить к увеличению экстравазации жидкости из-за кратковременного увеличения Pc, но экспериментальные данные не являются окончательными. Таким образом, взаимосвязь между быстрой скоростью инфузии жидкости, Pc, скоростью фильтрации и плохими клиническими исходами все еще плохо изучена. Кроме того, проницаемость интактного или частично интактного эндотелиального гликокаликса для макромолекул, таких как альбумин и полусинтетические коллоиды, также увеличивается с повышением Pc, добавляя дополнительную сложность взаимосвязи между Pi и Pc [17].
2.6. Клинические последствия пересмотренной модели Старлинга
Клинические методы измерения статуса эндотелиального гликокаликса пока недоступны вне контекста исследования и имеют неподтвержденную клиническую значимость. Тем не менее подавляющее количество доклинических и клинических данных свидетельствует о том, что эндотелиальный гликокаликс может быть поврежден у критических пациентов [5]. Введение изоонкотического коллоида у этих пациентов будет иметь эффект увеличения объема, аналогичный кристаллоидной жидкости. Насколько подобное будет зависеть от степени повреждения эндотелиального гликокаликса, проницаемости эндотелиального гликокаликса, состояния объема прединфузии у пациента, скорости инфузии и степени вазоконстрикции, клинически трудно предсказать из-за сложности взаимодействий между переменными. Это может объяснить, почему в крупных клинических исследованиях у критических пациентов объемные эффекты коллоидов по сравнению с кристаллоидами намного меньше, чем прогнозировалось. Например, в клинических исследованиях кристаллоида и гидроксиэтилкрахмала (CHEST) [22], а также физиологического раствора и альбумина (SAFE) [23] наблюдаемое соотношение коллоида с кристаллоидом для достижения тех же конечных точек гемодинамической ресусцитации составляло 1 : 1,3 и 1 : 1,4 соответственно, что заметно отличается от соотношения 1 : 3–1 : 5, предполагаемого по классическому принципу Старлинга [1].
Использование изоонкотического коллоида для потенциального, даже хотя бы незначительного эффекта увеличения объема не обходится без риска. Введение коллоидного раствора пациенту с поврежденным эндотелиальным гликокаликсом приводит к накоплению в интерстиции белка, что вызывает отек тканей до уровней, подобных тем, которые наблюдаются при инфузии кристаллоидов [4]. Как это ни парадоксально, в некоторых случаях отек ткани может быть на самом деле больше, а объемное расширение — меньше после инфузии коллоидов по сравнению с кристаллоидами [4]. Кроме того, использование полусинтетических коллоидов может иметь негативные последствия (например, аллергию, коагулопатию), не вызывая отеков [1], и они, по-видимому, экстравазатируют быстрее, чем альбумин [20]. Кроме того, из-за правила отсутствия абсорбции коллоидная инфузия не может ликвидировать существующий интерстициальный отек независимо от целостности эндотелиального гликокаликса.
Все эти соображения могут объяснить, почему, несмотря на несколько более выраженную склонность к объемному расширению, не было никаких существенных преимуществ в плане снижения смертности при использовании коллоида по сравнению с кристаллоидом в клинических исследованиях [1]. Эффект увеличения объема может быть настолько незначительным, что не имеется различий в результатах, или побочные эффекты нивелируют любое преимущество от большего расширения объема.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Finfer S., Myburgh J., Bellomo R. Intravenous fluid therapy in critically ill adults. Nat. Rev. Nephrol. 2018. № 14. Р. 541-557.
2. Levick J.R., Michel C.C. Microvascular fluid exchange and the revised Starling principle. Cardiovasc. Res. 2010. № 87. Р. 198-210.
3. Van der Heijden M., Verheij J., van Nieuw Amerongen G.P., Groeneveld A.B. Crystalloid or colloid fluid loading and pulmonary permeability, edema, and injury in septic and nonseptic critically ill patients with hypovolemia. Crit. Care Med. 2009. № 37. Р. 1275-1281.
4. Jacob M., Bruegger D., Rehm M. et al. The endothelial glycocalyx affords compatibility of Starling’s principle and high cardiac interstitial albumin levels. Cardiovasc. Res. 2007. № 73. Р. 575-586.
5. Johansson P., Stensballe J., Ostrowski S. Shock induced endotheliopathy (SHINE) in acute critical illness a unifying pathophysiologic mechanism. Crit. Care. 2017. № 21. Р. 25.
6. Schott U., Solomon C., Fries D., Bentzer P. The endothelial glycocalyx and its disruption, protection and regeneration: a narrative review. Scand. J. Trauma Resusc. Emerg. Med. 2016. № 24. Р. 48.
7. Reitsma S., Slaaf D.W., Vink H., van Zandvoort M.A., oude Egbrink M.G. The endothelial glycocalyx: composition, functions, and visualization. Pflug Arch. 2007. № 454. Р. 345-359.
8. Lekakis J., Abraham P., Balbarini A. et al. Methods for evaluating endothelial function: a position statement from the European Society of Cardiology Working Group on peripheral circulation. Eur. J. Cardiovasc. Prev. Rehabil. 2011. № 18. Р. 775-789.
9. Straat M., Muller M.C., Meijers J.C. et al. Effect of transfusion of fresh frozen plasma on parameters of endothelial condition and inflammatory status in non-bleeding critically ill patients: a prospective substudy of a randomized trial. Crit. Care. 2015. № 19. Р. 163.
10. Nam E.J., Park P.W. Shedding of cell membrane-bound proteoglycans. Methods Mol. Biol. 2012. № 836. Р. 291-305.
11. Starling E.H. On the absorption of fluids from the connective tissue spaces. J. Physiol. 1896. № 19. Р. 312-326.
12. Levick J.R. Revision of the Starling principle: new views of tissue fluid balance. J. Physiol. 2004. № 557(Pt 3). Р. 704.
13. Levick J.R. Capillary filtration-absorption balance reconsidered in light of dynamic extravascular factors. Exp. Physiol. 1991. № 76. Р. 825-857.
14. Yen W.Y., Cai B., Yang J.L. et al. Endothelial surface glycocalyx can regulate flow-induced nitric oxide production in microvessels in vivo. PLoS One. 2015. № 10. e0117133.
15. Trani M., Dejana E. New insights in the control of vascular permeability: vascular endothelial-cadherin and other players. Curr. Opin. Hematol. 2015. № 22. Р. 267-272.
16. Woodcock T.E., Woodcock T.M. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br. J. Anaesth. 2012. № 108. Р. 384-394.
17. Tatara T. Context-sensitive fluid therapy in critical illness. J. Intensive Care. 2016. № 4. Р. 20.
18. Hahn R.G. Fluid therapy in uncontrolled hemorrhage — what experimental models have taught us. Acta Anaesthesiol. Scand. 2013. № 57. Р. 16-28.
19. Jacob M., Chappell D., Hofmann-Kiefer K. et al. The intravascular volume effect of Ringer’s lactate is below 20%: a prospective study in humans. Crit. Care. 2012. № 16. Р. 86.
20. Jacob M., Bruegger D., Rehm M., Welsch U., Conzen P., Becker B.F. Contrasting effects of colloid and crystalloid resuscitation fluids on cardiac vascular permeability. Anesthesiology. 2006. № 104. Р. 1223-1231.
21. Borup T., Hahn R.G., Holte K., Ravn L., Kehlet H. Intra-operative colloid administration increases the clearance of a post-operative fluid load. Acta Anaesthesiol. Scand. 2009. № 53. Р. 311-317.
22. Myburgh J.A., Finfer S., Bellomo R. et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N. Engl. J. Med. 2012. № 367. Р. 1901-1911.
23. Finfer S., Bellomo R., Boyce N. et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N. Engl. J. Med. 2004. № 350. Р. 2247-2256.
/24.jpg) Эндотелиальный гликокаликс является ключевым регулятором функции эндотелия. Больше всего известно о его роли в регуляции проницаемости сосудов, но он также является неотъемлемой частью взаимодействий клетки и сосуда, межклеточного взаимодействия, реологии крови, механотрансдукции, воспаления, коагуляции и фибринолиза [1–7]. Хрупкая структура и небольшие размеры эндотелиального гликокаликса затрудняют его обнаружение и количественную оценку. Экспериментально эндотелиальный гликокаликс можно непосредственно визуализировать с помощью ряда методов, включая электронную микроскопию, прижизненную микроскопию, сравнение объемов распределения эндотелиальных проницаемых и непроницаемых гликокаликсных индикаторов, конфокальную микроскопию и иммуногистохимическое окрашивание [8]. Все эти методы инвазивны и не подходят для повторных измерений, если вообще используются в клинической практике.
Эндотелиальный гликокаликс является ключевым регулятором функции эндотелия. Больше всего известно о его роли в регуляции проницаемости сосудов, но он также является неотъемлемой частью взаимодействий клетки и сосуда, межклеточного взаимодействия, реологии крови, механотрансдукции, воспаления, коагуляции и фибринолиза [1–7]. Хрупкая структура и небольшие размеры эндотелиального гликокаликса затрудняют его обнаружение и количественную оценку. Экспериментально эндотелиальный гликокаликс можно непосредственно визуализировать с помощью ряда методов, включая электронную микроскопию, прижизненную микроскопию, сравнение объемов распределения эндотелиальных проницаемых и непроницаемых гликокаликсных индикаторов, конфокальную микроскопию и иммуногистохимическое окрашивание [8]. Все эти методы инвазивны и не подходят для повторных измерений, если вообще используются в клинической практике./25_2.jpg) В субгликокаликсном пространстве поддерживается безбелковое состояние благодаря постоянной внешней фильтрации жидкости, что объясняется правилом отсутствия абсорбции и эффектом фильтрации белков плазмы интактного эндотелиального гликокаликса. Полученный ультрафильтрат протекает через субгликокаликсное пространство, а затем через межклеточные щели (через разрывы в плотных соединительных нитях) попадает в просвет сосуда [2]. Из-за их узости скорость в разрывах высока даже при низких скоростях фильтрации, что предотвращает перемещение интерстициального белка обратно в субгликокаликсное пространство [2].
В субгликокаликсном пространстве поддерживается безбелковое состояние благодаря постоянной внешней фильтрации жидкости, что объясняется правилом отсутствия абсорбции и эффектом фильтрации белков плазмы интактного эндотелиального гликокаликса. Полученный ультрафильтрат протекает через субгликокаликсное пространство, а затем через межклеточные щели (через разрывы в плотных соединительных нитях) попадает в просвет сосуда [2]. Из-за их узости скорость в разрывах высока даже при низких скоростях фильтрации, что предотвращает перемещение интерстициального белка обратно в субгликокаликсное пространство [2]./26_3.jpg) В интактном эндотелиальном гликокаликсе Пg незначительно, и коллоидные частицы вводимой коллоидной жидкости остаются во внутрисосудистом пространстве благодаря эффекту фильтрации эндотелиального гликокаликса. Это приводит либо к отсутствию изменений, либо к смещению вправо точки J, низкой скорости фильтрации и постоянному расширению объема плазмы от вводимой жидкости. Приводит ли коллоид по сравнению с кристаллоидом к увеличению объема в этом контексте, зависит от Pc. Если Pc ниже J-точки, то, поскольку скорость фильтрации близка к нулю, как кристаллоиды, так и коллоиды будут иметь одинаковый эффект расширения объема. Если Pc выше J-точки, то коллоиды будут сохраняться во внутрисосудистом пространстве дольше, чем кристаллоиды.
В интактном эндотелиальном гликокаликсе Пg незначительно, и коллоидные частицы вводимой коллоидной жидкости остаются во внутрисосудистом пространстве благодаря эффекту фильтрации эндотелиального гликокаликса. Это приводит либо к отсутствию изменений, либо к смещению вправо точки J, низкой скорости фильтрации и постоянному расширению объема плазмы от вводимой жидкости. Приводит ли коллоид по сравнению с кристаллоидом к увеличению объема в этом контексте, зависит от Pc. Если Pc ниже J-точки, то, поскольку скорость фильтрации близка к нулю, как кристаллоиды, так и коллоиды будут иметь одинаковый эффект расширения объема. Если Pc выше J-точки, то коллоиды будут сохраняться во внутрисосудистом пространстве дольше, чем кристаллоиды.