Журнал «Медицина неотложных состояний» №6(101), 2019
Вернуться к номеру
Цитоенергетична і пробіотична оптимізація інтенсивної терапії синдрому гастроінтестинальної недостатності у новонароджених: оцінка клінічної ефективності
Авторы: Холод Д.А., Шкурупій Д.А.
Українська медична стоматологічна академія, м. Полтава, Україна
Відокремлений підрозділ Асоціації анестезіологів України в Полтавській області, м. Полтава, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
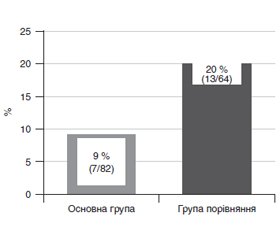
Актуальність. Патогенез гастроінтестинальної недостатності у новонароджених у критичних станах на тлі анатомо-функціональних особливостей обґрунтовує включення в терапію ергодинамічних сполук і пробіотиків. Мета дослідження: оцінка клінічної ефективності цитоенергетичної і пробіотичної оптимізації інтенсивної терапії синдрому гастроінтестинальної недостатності у новонароджених. Матеріали та методи. До групи дослідження ввійшли 146 новонароджених із гастроінтестинальною недостатністю в умовах інтенсивної терапії. До основної групи (n = 82) увійшли пацієнти, яким додатково призначали препарат меглюміну натрію сукцинату і пробіотик, що містить Lactobacillus acidophilus (spр. L.gasseri), Bifidobacterium infantis, Enterococcus faecium, у групу порівняння (n = 64) — пацієнти з традиційною лікувальної тактикою. Оцінювали клінічні прояви гастроінтестинальної недостатності, системної запальної відповіді, частоту використання прокінетиків, тяжкість стану, виживаність. Результати. На відміну від групи порівняння в основній групі в 1,42 раза частіше спостерігалося зменшення вираженості гастроінтестинальної недостатності, яка була зареєстрована у 71 % новонароджених (χ2 = 6,53; р = 0,011). Зменшилась потреба в призначенні прокінетиків у 2,2 раза, що було необхідним у 9 % пацієнтів (χ2 = 4,22; р = 0,04). Знизилася оцінка тяжкості стану в 1,06 раза, що спостерігалося у 88 % пацієнтів, хоча статистично значущої різниці з групою порівняння за цим параметром відзначено не було (χ2 = 0,73; р = 0,394). Збільшилась виживаність в 1,11 раза, що становило 99 % (χ2 = 6,51; р = 0,011). Також відзначені значимі зв’язки вираженості системної запальної відповіді (R = –0,21; р = 0,013), оцінки тяжкості стану (R = –0,18; p = 0,026), частоти призначення прокінетиків (R = –0,17; р = 0,04), виживаності (R = 0,21; p = 0,01) з оптимізованою тактикою лікування. Висновки. У новонароджених додаткове призначення меглюміну натрію сукцинату і пробіотика в комплексі інтенсивної терапії дозволяє зменшити прояви синдрому гастроінтестинальної недостатності, знизити потребу в прокінетиках, вплинути на вираженість системної запальної відповіді, тяжкість стану і збільшити виживаність.
Актуальность. Патогенез гастроинтестинальной недостаточности у новорожденных в критических состояниях на фоне анатомо-функциональных особенностей новорожденных обосновывает включение в терапию эргодинамических соединений и пробиотиков. Цель исследования: оценка клинической эффективности цитоэнергетической и пробиотической оптимизации интенсивной терапии синдрома гастроинтестинальной недостаточности у новорожденных. Материалы и методы. Группу исследования составили 146 новорожденных с гастроинтестинальной недостаточностью в условиях интенсивной терапии. В основную группу (n = 82) вошли пациенты, которым дополнительно назначали препарат меглюмина натрия сукцината и пробиотик, содержащий Lactobacillus acidophilus (spр. L.gasseri), Bifidobacterium infantis, Enterococcus faecium, в группу сравнения (n = 64) — пациенты с традиционной лечебной тактикой. Оценивали клинические проявления гастроинтестинальной недостаточности, системного воспалительного ответа, частоту использования прокинетиков, тяжесть состояния, выживаемость. Результаты. В отличие от группы сравнения в основной группе в 1,42 раза чаще наблюдалось уменьшение выраженности гастроинтестинальной недостаточности, которое было зарегистрировано у 71 % новорожденных (χ2 = 6,53; р = 0,011). Уменьшилась потребность в назначении прокинетиков в 2,2 раза, которое было необходимо у 9 % пациентов (χ2 = 4,22; р = 0,04). Снизилась оценка тяжести состояния в 1,06 раза, что наблюдалось у 88 % пациентов, хотя статистически значимой разницы с группой сравнения по этому параметру отмечено не было (χ2 = 0,73; р = 0,394). Увеличилась выживаемость в 1,11 раза, которая составляла 99 % (χ2 = 6,51; р = 0,011). Также отмечены значимые связи выраженности системного воспалительного ответа (R = –0,21; р = 0,013), оценки тяжести состояния (R = –0,18; p = 0,026), частоты назначения прокинетиков (R = –0,17; р = 0,04), выживаемости (R = 0,21; p = 0,01) с оптимизированной тактикой лечения. Выводы. У новорожденных дополнительное назначение меглюмина натрия сукцината и пробиотика в комплексе интенсивной терапии позволяет уменьшить проявления синдрома гастроинтестинальной недостаточности, снизить потребность в прокинетиках, оказать влияние на выраженность системного воспалительного ответа, тяжесть состояния и увеличить выживаемость.
Background. The pathogenesis of gastrointestinal failure in critically ill newborns against the background of the anatomical and functional features in newborns grounds the inclusion of ergodynamic compounds and probiotics in the therapy. The purpose of the work is to evaluate the clinical efficacy of cytoenergetic and probiotic therapy optimization in the intensive care of gastrointestinal failure syndrome in newborns. Materials and methods. The study group consisted of 146 newborns with gastrointestinal failure under conditions of intensive care. The main group (n = 82) included the patients who had additionally prescribed the drug meglumine sodium succinate and probiotic containing Lactobacillus acidophilus (spp. L.gasseri), Bifidobacterium infantis, Enterococcus faecium; the comparison group (n = 64) included the patients receiving traditional therapeutic tactics. Clinical manifestations of gastrointestinal failure, systemic inflammatory response, frequency of use of prokinetics, the condition severity, and survival were evaluated. Results. In contrast to the comparison group, in the main group demonstrated a decrease in the severity of gastrointestinal failure 1.42 times more often, which was registered in 71 % of newborns (χ2 = 6.53; р = 0.011). The need for the appointment of prokinetics decreased 2.2 times, which was necessary in 9 % of patients (χ2 = 4.22; р = 0.04). The grade of the condition severity decreased by 1.06 times (88 % of patients), although there was no statistically significant difference with the comparison group in this parameter (χ2 = 0.73; р = 0.394). Survival increased by 1.11 times, which was 99 % (χ2 = 6.51; р = 0.011). Also, the analysis results demonstrated significant correlation of the severity of the systemic inflammatory response (R = –0.21; p = 0.013), the condition severity (R = –0.18; p = 0.026), the frequency of prokinetics administration (R = –0.17; p = 0.04), survival rate (R = 0.21; p = 0.01) with optimized treatment tactics. Conclusions. In newborns, supplemental administration of meglumine sodium succinate and probiotics in the complex of intensive care can reduce the manifestations of gastrointestinal failure syndrome, reduce the need for prokinetics, influence the severity of the systemic inflammatory response, the severity of the condition and increase survival.
синдром гастроінтестинальної недостатності; сукцинат натрію; пробіотики; інтенсивна терапія
синдром гастроинтестинальной недостаточности; сукцинат натрия; пробиотики; интенсивная терапия
gastrointestinal failure; sodium succinate; probiotics; intensive care
Вступ
Матеріали та методи
Результати
/84.jpg)
Обговорення
Висновки
1. Pironi L., Arends J., Bozzetti F. et al. Home Artificial Nutrition & Chronic Intestinal Failure Special Interest Group of ESPEN. ESPEN guidelines on chronic intestinal failure in adults. Clin. Nutr. 2016. Vol. 35(2). P. 247-307. doi: 10.1016/j.clnu.2016.01.020. PubMed PMID: 26944585.
2. SRLF Trial Group. Hypoxemia in the ICU: prevalence, treatment, and outcome. Ann. Intensive Care. 2018. Vol. 13; 8(1). Р. 82. doi: 10.1186/s13613-018-0424-4. PubMed PMID: 30105416; PubMed Central PMCID: PMC6089859.
3. Ludewig S., Jarbouh R., Ardelt M. et al. Bowel Ischemia in ICU Patients: Diagnostic Value of I-FABP Depends on the Interval to the Triggering Event. Gastroenterol. Res. Pract. 2017. Vol. 2017. Р. 2795176. doi: 10.1155/2017/2795176. PubMed PMID:28630622; PubMed Central PMCID: PMC5467337.
4. Giorgi-Coll S., Amaral A.I., Hutchinson P.J.A., Kotter M.R., Carpenter K.L.H. Succinate supplementation improves metabolic performance of mixed glial cell cultures with mitochondrial dysfunction. Sci. Rep. 2017. Vol. 7(1). Р. 1003. doi: 10.1038/s41598-017-01149-w. PubMed PMID: 28432362; PubMed Central PMCID: PMC5430749.
5. Ferro A., Carbone Е., Zhang J. et al. Short-term succinic acid treatment mitigates cerebellar mitochondrial OXPHOS dysfunction, neurodegeneration and ataxia in a Purkinje-specific spinocerebellar ataxia type 1 (SCA1) mouse model. PLoS ONE. 2017. Vol. 12(12). Р. e0188425. doi: 10.1371/journal.pone.0188425.
6. Laukka T., Mariani C.J., Ihantola T. et al. Fumarate and Succinate Regulate Expression of Hypoxia-inducible Genesvia TET Enzymes. J. Biol. Chem. 2016. Vol. 291(8). Р. 4256-65. doi:10.1074/jbc.M115.688762. PubMed PMID: 26703470; PubMed Central PMCID: PMC4759199.
7. Haque S.Z., Haque М. The ecological community of commensal, symbiotic, and pathogenic gastrointestinal microorganisms — an appraisal. Clin. Exp. Gastroenterol. 2017. Vol. 10. Р. 91-103. doi: 10.2147/CEG.S126243. PubMed PMID: 28503071; PubMed Central PMCID: PMC5426469.
8. Thursby E., Juge N. Introduction to the human gut microbiota. Biochem. J. 2017. Vol. 474(11). Р. 1823-1836. doi: 10.1042/BCJ20160510. PubMed PMID: 28512250; PubMed Central PMCID: PMC5433529.
9. Manzanares W., Lemieux M., Langlois P.L., Wischmeyer P.E. Probiotic and synbiotictherapy in critical illness: a systematic review and meta-analysis. Crit. Care. 2016. Vol. 19. Р. 262. doi: 10.1186/s13054-016-1434-y. PubMed PMID: 27538711; PubMed Central PMCID: PMC4991010.
10. Wischmeyer P.E., McDonald D., Knight R. Role of the microbiome, probiotics, and “dysbiosis therapy” in critical illness. Curr. Opin. Crit. Care. 2016. Vol. 22(4). Р. 347-53. doi: 10.1097/MCC.0000000000000321. PubMed PMID: 27327243; PubMed Central PMCID: PMC5065053.
11. Niño D.F., Sodhi C.P., Hackam D.J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nat. Rev. Gastroenterol. Hepatol. 2016. Vol. 13(10). Р. 590-600. doi: 10.1038/nrgastro.2016.119. PubMed PMID: 27534694; PubMed Central PMCID: PMC5124124.
12. Shkurupii D. Nutritive support for newborns in critical conditions: semi-elemental formilas as a means of enteral nutrition. Wiad Lek. 2018. Vol. 71(2). Р. 266-270. PubMed PMID: 29786568.
13. Chen H., Zhang H., Li W., Wu S., Wang W. Acute gastrointestinal injury in the intensive care unit: a retrospective study. Ther. Clin. Risk Manag. 2015. Vol. 5(11). Р. 1523-9. doi: 10.2147/TCRM.S92829. PubMed PMID: 26491339. PubMed Central PMCID: PMC4599567.
14. Lin Y., Sun Z., Wang H., Liu M. The Effects of Gastrointestinal Function on the Incidence of Ventilator-associated Pneumonia in Critically Ill Patients. Open Med. (Wars.). 2018. Vol. 6(13). Р. 556-561. doi: 10.1515/med-2018-0082. PubMed PMID: 30564634. PubMed Central PMCID: PMC6287170.
15. Zhang D., Fu R., Li Y., Li Н. Comparison of the clinical characteristics and prognosis of primary versus secondary acute gastrointestinal injury in critically ill patients. J. Intensive Care. 2017. Vol. 20(5). Р. 26. doi:10.1186/s40560-017-0221-4. PubMed PMID: 28435684; PubMed Central PMCID: PMC5397695.
16. Wynn J.L. Defining neonatal sepsis. Curr. Opin. Pediatr. 2016. Vol. 28(2). Р. 135-40. doi: 10.1097/MOP. 0000000000000315. PubMed PMID: 26766602. PubMed Central PMCID: PMC4786443.
17. Curan G.R.F., Rossetto E.G. Scoring system for neonatal therapeutic intervention: a descriptive study. Online Brazilian Journal of Nursing. 2014. Vol. 13(4). URL: http://webcache.googleusercontent.com/search?q = cache:yKHxjrVZmnMJ:www.objnursing.uff.br/index.php/nursing/article/view/4632/html_346+&cd = 19&hl = ru&ct = clnk&gl = ua.
18. Сабдулаев Д.Ш., Багненко С.Ф., Дубикайтис П.А., Джусоев И.Г., Лапицкий А.В. Роль субстратных антигипоксантов в коррекции нарушений миоэлектрической активности желудочно-кишечного тракта у пострадавших с тяжелой сочетанной травмой. Вестник хирургии им. И.И. Грекова. 2015. № 6. С. 35-41. doi: 10.24884/0042-4625-2015-174-6-35-41.
19. Завьялкин В.А., Барская М.А., Варламов А.В. и др. Оптимизация лечения распространенного гнойного перитонита у детей. Хирургия. 2015. № 7. С. 65-68. doi: 10.17116/hirurgia2015765-68.
20. Connors J., Dawe N., Van Limbergen J. The Role of Succinate in the Regulation of Intestinal Inflammation. Nutrients. 2018. Vol. 22;11(1). Р. E25. doi: 10.3390/nu11010025. PubMed PMID: 30583500. PubMed Central PMCID: PMC6356305.
21. Nadjsombati M.S., McGinty J.W., Lyons-Cohen M.R. Detection of Succinate by Intestinal Tuft Cells Triggers a Type 2 Innate Immune Circuit. Immunity. 2018. Vol. 17; 49(1). Р. 33-41. doi: 10.1016/j.immuni.2018.06.016. PubMed PMID: 30021144. PubMed Central PMCID: PMC6084797.
22. Mithieux G. Gut nutrient sensing and microbiota function in the control of energy homeostasis. Curr. Opin. Clin. Nutr. Metab. Care. 2018. Vol. 21(4). Р. 273-276. doi: 10.1097/MCO.0000000000000478. PubMed PMID: 2984744.
23. Gyawali B., Ramakrishna K., Dhamoon A.S. Sepsis: The evolution in definition, pathophysiology, and management. SAGE Open. Med. 2019. Vol. 21(7). 2050312119835043. doi: 10.1177/2050312119835043. eCollection 2019. Review. PubMed PMID: 30915218; PubMed Central PMCID: PMC6429642.
24. Haussner F., Chakraborty S., Halbgebauer R., Huber-Lang M. Challenge to the Intestinal Mucosa During Sepsis. Front. Immunol. 2019. Vol. 30(10). Р. 891. doi: 10.3389/fimmu.2019.00891. PubMed PMID: 31114571. PubMed Central PMCID: PMC6502990.
25. Moreira J., Paixão A., Oliveira J. et al. Accuracy of quick sequential organ failure assessment score to predict mortality in hospitalized patients with suspected infection in an HIV/AIDS reference centre in Rio de Janeiro, Brazil. Clin. Microbiol. Infect. 2019. Vol. 25(1). Р. e1-113. doi: 10.1016/j.cmi.2018.08.003. PubMed PMID: 3011876.
26. Zhang D., Li Y., Ding L., Fu Y., Dong Х., Li Н. Prevalence and outcome of acute gastrointestinal injury in critically ill patients: A systematic review and meta-analysis. Medicine (Baltimore). 2018. Vol. 97(43). Р. e12970. doi: 10.1097/MD.0000000000012970. PubMed PMID: 30412121. PubMed Central PMCID: PMC6221717.

/84_2.jpg)