Международный эндокринологический журнал Том 15, №5, 2019
Вернуться к номеру
Показники трансферину та феритину в дітей із надлишковою масою тіла й ожирінням
Авторы: Сорокман Т.В., Сокольник С.В., Попелюк Н.О., Колєснік Д.І.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
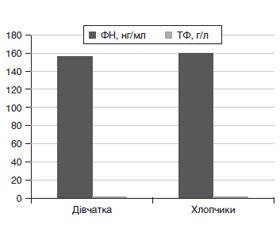
Актуальність. Ожиріння розглядається як хронічне системне запалення низької активності. Триває накопичення відомостей про біологічне і клінічне значення металопротеїнів у запальному процесі. Мета: дослідити показники феритину (ФН) та трансферину (ТФ) у крові дітей із надлишковою масою тіла й ожирінням. Матеріали та методи. Обстеження дітей із надлишковою масою тіла (НдМТ, 60 осіб), ожирінням (Ож, 45 осіб), нормальною масою тіла (НмМТ, 60 осіб), дефіцитом маси тіла (ДМТ, 30 осіб) віком 13–18 років включало збір анамнезу, антропометрію (зріст, маса тіла, індекс маси тіла, співвідношення окружність талії/окружність стегон), вміст глюкози, інсуліну, розрахунок HOMA-IR, вміст трансферину і феритину. Для статистичної обробки результатів використано статистичні модулі програми Statistica v.6.0 та MedStat та on-line калькулятор SISA. Результати. У загальній вибірці із 325 осіб НдМТ встановлено у 75 (23,1 %) дітей, Ож — у 45 (13,8 %), ДМТ — у 30 (9,2 %), у решти 175 (53,8 %) — НмМТ. Серед осіб із НдМТ переважали хлопчики, кількість яких становила 40 (53,3 %) і серед осіб із Ож — 25 (55,5 %). Вищий вміст ТФ відзначено в дітей віком 16–18 років (3,9 ± 0,7 г/л, n = 100; p < 0,05). Найвищий вміст ТФ зареєстровано в дітей із Ож II ступеня — 3,98 ± 0,90 г/л (n = 16) проти 3,05 ± 0,61 г/л (n = 29) (p < 0,05) у дітей із Ож I ступеня. Аналогічна тенденція встановлена і щодо показників ФН у плазмі крові обстежених дітей. Так, вірогідно вищі показники ФН встановлено в дітей із Ож II ступеня — 178,9 ± 22,8 нг/мл (n = 16) проти 125,8 ± 0,7 нг/мл (n = 29) (p < 0,05) у дітей із Ож I ступеня та у дітей віком 16–18 років — 176,2 ± 12,8 нг/мл (n = 25) проти 149,9 ± 11,3 нг/мл (n = 20) (p < 0,01) у дітей 13–15 років. Вірогідної різниці в гендерних показниках ТФ та ФН не встановлено. Висновки. Оцінка маркерів системного запалення як метод раннього виявлення ожиріння є актуальним і перспективним напрямком з оптимізації системи профілактики ожиріння.
Актуальность. Ожирение рассматривается как хроническое системное воспаление низкой активности. В настоящее время идет накопление сведений о биологическом и клиническом значении металлопротеинов в воспалительном процессе. Цель: исследовать показатели ферритина и трансферрина у детей с избыточной массой тела и ожирением. Материалы и методы. Обследование детей с избыточной массой тела (ИзМТ, 60 человек), ожирением (Ож, 45 человек), нормальной массой тела (НмМТ, 60 человек), дефицитом массы тела (ДМТ, 30 человек) в возрасте 13–18 лет включало сбор анамнеза, антропометрию (рост, масса тела, индекс массы тела, соотношение окружность талии/окружность бедер), содержание глюкозы, инсулина, расчет HOMA-IR, содержание трансферрина и ферритина. Для статистической обработки результатов использованы статистические модули программы Statistica v.6.0 и MedStat и on-line калькулятор SISA. Результаты. В общей выборке из 325 человек ИзМТ установлена у 75 (23,1 %) детей, Ож — у 45 (13,8 %), ДМТ — у 30 (9,2 %), у остальных 175 (53,8 %) — ИзМТ. Среди лиц с ИзМТ преобладали мальчики, число которых составляло 40 (53,3 %) и среди лиц с Ож — 25 (55,5 %). Высокое содержание ТФ отмечено у детей 16–18 лет (3,90 ± 0,70 г/л, n = 100; p < 0,05). Самое высокое содержание ТФ зарегистрировано у детей с Ож II степени — 3,98 ± 0,90 г/л (n = 16) против 3,05 ± 0,61 г/л (n = 29) (p < 0,05) у детей с Ож I степени. Аналогичная тенденция установлена по показателям ФН в плазме крови обследованных детей. Так, достоверно высокие показатели Фн установлены у детей с Ож II степени — 178,9 ± 22,8 нг/мл (n = 16) против 125,8 ± 0,7 нг/мл (n = 29) (p < 0,05) у детей с Ож I степени и у детей в возрасте 16–18 лет — 176,2 ± 12,8 нг/мл (n = 25) против 149,9 ± 11,3 нг/мл (n = 20) (p < 0,01) у детей 13–15 лет. Достоверной разницы в гендерных показателях ТФ и ФН не установлено. Выводы. Оценка маркеров системного воспаления как метод раннего выявления ожирения является актуальным и перспективным направлением по оптимизации системы профилактики ожирения.
Background. Today, obesity is seen as a chronic systemic inflammation of low activity. At present, the information about the biological and clinical significance of metal proteins in the inflammatory process is being accumulated. The purpose was to study transferrin and ferritin indices in overweight and obese children. Materials and methods. We have examined the children with overweight (OW, 60 persons), obesity (Os, 45 persons), normal body weight (NBW, 60 persons), body weight deficiency (BWD, 30 persons) aged 13–18 years. Examination included anamnesis, anthropometry (height, body weight, BMI, waist-to-thigh ratio (WTR)), content of glucose, insulin, HOMA-IR calculation, content of transferrin (TF) and ferritin (Fn). For statistical analysis of the results, statistic modules of Statistica v. 6.0, MedStat and on-line SISA calculator were used. Results. In the total sample of 325 patients, OW was observed in 75 (23.1 %), Os — in 45 (13.8 %) children, BWD — in 30 (9.2 %) persons, in the rest 175 (53.8 %) — NBW. Of the overweight children, the boys prevailed and accounted for 40 (53.3 %), and 38 (55.8%) obese boys. The highest content of transferrin was observed in children aged 16–18 years (3.90 ± 0.70 g/l, n = 100; p < 0.05). The highest content of TF was recorded in children with Os II grade — 3.98 ± 0.9 g/l (n = 16) versus 3.05 ± 0.61 g/l (n = 29) (p < 0.05) in children with Os I grade. A similar trend has been established with respect to the Fn blood plasma values in examined children. Thus, higher levels of ferritin were found in children with Os II degree — 178.9 ± 22.8 ng/ml (n = 16) versus 125.8 ± 0.7 ng/ml (n = 29) (p < 0.05) in children with Os I and in children aged 16–18 years old — 176.2 ± 12.8 ng/ml (n = 25) versus 149.9 ± 11.3 ng/ml (n = 20) (p < 0.01) in children of 13–15 years old. The probable difference in gender ratios of TF and Fn is not established. Conclusions. The evaluation of systemic markers as a method of early detection of obesity is an urgent and promising direction for optimizing the obesity prevention system.
діти; надлишкова маси тіла; ожиріння; феритин; трансферин
дети; избыточная масса тела; ожирение; ферритин; трансферрин
children; excess body weight; obesity; ferritin; transferring
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
1. Global status report on non communicable diseases 2014. Geneva: World Health Organization, 2014. 302 p.
2. Ball G.D.C., Savu A., Kaul P. Changes in the prevalence of overweight, obesity, and severe obesity between 2010 and 2017 in preschoolers: A population-based study. Pediatr. Obes. 2019. doi: 10.1111/ijpo.12561.
3. Centers for Disease Control and Prevention. National Center for Health Statistics. Available at: http://www.cdc.gov/growthcharts/. Accessed 17 March 2016.
4. Ogden C.L., Carroll M.D., Fryar C.D., Flegal K.M. Prevalence of obesity among adults and youth: United States, 2011–2014. NCHS Data Brief. 2015. 219. 1-8.
5. Javed A., Jumean M., Murad M.H. et al. Diagnostic performance of body mass index to identify obesity as defined by body adiposity in children and adolescents: a systematic review and meta-analysis. Pediatr. Obes. 2015. 10. 234-244. doi: 10.1111/ijpo.242.
6. Dabas A., Seth A. Prevention and Management of Childhood Obesity. Indian J. Pediatr. 2018. 85. 546-553. https://doi.org/10.1007/s12098-018-2636-x.
7. Chaput J.P., Lambert M., Gray-Donald K. et al. Short sleep duration is independently associated with overweight and obesity in Quebec children. Can. J. Public Health. 2011. 102. 369-374. PMID: 22032104.
8. Upton P., Taylor C., Erol R., Upton D. Family-based childhood obesity interventions in the UK: a systematic review of published studies. Community Pract. 2014. 87. 25-29.
9. Ek A., Delisle Nyström C., Chirita-Emandi A., Tur J.A., Nordin K., Bouzas C., Argelich E., Martínez J.A., Frost G., Garcia-Perez I., Saez M., Paul C., Löf M., Nowicka P. A randomized controlled trial for overweight and obesity in preschoolers: the More and Less Europe study — an intervention within the STOP project. BMC Public Health. 2019. 19(1). 945. doi: 10.1186/s12889-019-7161-y.
10. Arora M., Nazar G.P., Gupta V.K. et al. Association of breakfast intake with obesity, dietary and physical activity behavior among urban school-aged adolescents in Delhi, India: results of a cross-sectional study. BMC Public Health. 2012. 12. 881. doi.org/10.1186/1471-2458-12-881.
11. Franklin J., Denyer G., Steinbeck K.S. et al. Obesity and risk of low self-esteem: a statewide survey of Australian children. Pediatrics. 2006. 118. 2481-2487. DOI: 10.1542/peds.2006-0511.
12. Ahrens W., Pigeot I., Pohlabeln H. et al. Prevalence of overweight and obesity in European children below the age of 10. Int. J. Obes. (Lond.). 2014. 38(2). 99-107. doi: 10.1038/ijo.2014.140.
13. Dudina O.O., Moiseienko R.O., Zabolotna I.E. et al. The dynamics of the health of the children’s population. Annual report on the health status of the population, the sanitary and epidemiological situation and the results of the health system of Ukraine. Kyiv: Ministry of Health of Ukraine, 2017. Р. 43-69 (in Ukrainian).
14. Zelinska N.B., Rudenko N.H. Analysis of statistical indicators of the Children’s Endocrinology Service of Ukraine in 2015. Ukrainian Journal of Pediatric Endocrinology. 2016. 2. Р. 7-17 (in Ukrainian).
15. Maidannyk V.G., Khaitovych M.V., Pavlyshyn H.A. et al. Prevalence of excess body weight and high blood pressure among schoolchildren of different regions of Ukraine. International Journal of Pediatrics, Obstetrics and Gynecology. 2013. 1(3). 33-39.
16. Dyachuk D.D., Zabolotna I.E., Yaschenko Y.B. Analysis of the extension of childhood expectations and evaluation of the risks of the development of diseases associated with overweight. Wiad. Lek. 2018. 71. 3.
17. Вайнилович Е.Г. Частота абдоминального ожирения и ассоциированных с ним метаболических нарушений у детей 7–13 лет. Проблемы эндокринологии. 2011. 57(5). 15-23.
18. Величко В.І. Дитяче ожиріння як актуальна проблема сучасної педіатричної практики: результати моніторингу в Одеській області. Одеський медичний журнал. 2011. 5. 42-44.
19. The European health report 2015. Targets and beyond — Reaching new frontiers in evidence. Copenhagen: WHO Regional Office for Europe, 2015. 150 p.
20. Flynn A.C., Begum S., White S.L. et al. SCOPE and UBPEAT Consortiums. Relationships between Maternal Obesity and Maternal and Neonatal Iron Status. Nutrients. 2018. 10(8). doi: 10.3390/nu10081000.
21. Doğan G., Andiran N., Çelik N., Uysal S. Iron parameters, prohepcidin and soluble transferrin receptor levels in obese children. Minerva Pediatr. 2016.
22. Halitin S., Deutsch V., Tauman R. Hepcidin, soluble transferrin receptor and IL-6 levels in obese children and adolescents with and without type 2 diabetes mellitus/impaired glucose tolerance and their association with obstructive sleep apnea. J. Endocrinol. Invest. 2018. 41(8). 969-975.
23. Sharif M., Madani M., Tabatabaie F. Comparative Evaluation of Iron Deficiency among Obese and Non-obese Children. Iran. J. Ped. Hematol. Oncol. 2014. 4(4). 160-6.
24. Gartner A., Berger J., Bour A., E Ati J., Traissac P., Landais E. et al. Assessment of iron deficiency in the context of the obesity epidemic: importance of correcting serum ferritin concentrations for inflammation. Am. J. Clin. Nutr. 2013. 98(3). 821-6. doi: 10.3945/ajcn.112.054551.
25. Shattnawi K.K., Alomari M.A., Al-Sheyab N., Bani Salameh A. The relationship between plasma ferritin levels and body mass index among adolescents. Sci. Rep. 2018. 8(1). 15307. doi: 10.1038/s41598-018-33534-4.

/40.jpg)
/40_2.jpg)