Журнал «Медицина неотложных состояний» №7(102), 2019
Вернуться к номеру
Дослідження впливу амантадину сульфату на динаміку нейроапоптозу при експериментальній черепно-мозковій травмі
Авторы: Семененко С.І., Семененко А.І., Семененко О.М.
Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Залежно від характеру травми мозку та тяжкості постраждалих летальність при черепно-мозковій травмі (ЧМТ) коливається від 5 до 65 %. Частка некротичної та апоптотичної смерті нейронів у загальній масі ушкодженої нервової тканини на фоні ЧМТ є досить варіабельною і залежить від багатьох умов. Мета: охарактеризувати вплив амантадину сульфату та 0,9% розчину NaCl на фрагментацію ДНК (апоптоз) клітин кори головного мозку щурів на фоні ЧМТ. Матеріали та методи. Досліди проведено на щурах-самцях. Експериментальну модель тяжкої ЧМТ створювали із використанням пневматичного пістолету. Терапевтичну дію амантадину сульфату при ЧМТ оцінювали в дозі 5 мг/кг внутрішньовенно з інтервалом 2 рази на добу протягом 8 діб. Як лікувальний засіб для контрольної групи застосовували 0,9% NаСl в дозі 2 мл/кг. На 8-му добу після ЧМТ та декапітації тварин частини кори головного мозку були взяті для подальшої оцінки фрагментації ДНК у клітинах. Дослідження проводили проточною цитометрією. Результати. У контрольній групі інтенсивність фрагментації ДНК в ядрах нейронів часток кори головного мозку щурів на 8-му добу після моделювання ЧМТ вірогідно підвищилася на 198,2 %. Після курсового (упродовж 8 діб) введення щурам у гострий період травматичного пошкодження головного мозку амантадину сульфату в дозі 5 мг/кг в ядрах клітин кори головного мозку щурів визначались менші значення показників інтервалу Sub-G1 відносно аналогічного показника тварин контрольної групи в середньому на 26,2 %, але все ж таки досліджуваний показник залишався вищим за показники групи псевдооперованих тварин на 120,1 % (р < 0,05). Висновки. Посттравматичний період модельної ЧМТ у щурів супроводжується вірогідним зростанням відносно інтактних тварин рівня фрагментації ДНК в ядрах клітин кори головного мозку на 8-му добу експерименту в середньому у 3 рази. За величиною антиапоптотичного ефекту в умовах посттравматичного пошкодження головного мозку терапія розчином амантадину сульфату виявилась вірогідно кращою за інфузію 0,9% розчину NaCl в середньому на 26,2 % (р < 0,05).
Актуальность. В зависимости от характера травмы мозга и тяжести пострадавших летальность при черепно-мозговой травме (ЧМТ) колеблется от 5 до 65 %. Доля некротической и апоптотической смерти нейронов в общей массе поврежденной нервной ткани на фоне ЧМТ является достаточно вариабельной и зависит от многих условий. Цель: охарактеризовать влияние амантадина сульфата и 0,9% раствора NaCl на фрагментацию ДНК (апоптоз) клеток коры головного мозга крыс на фоне ЧМТ. Материалы и методы. Опыты проведены на крысах-самцах. Экспериментальную модель тяжелой ЧМТ создавали с использованием пневматического пистолета. Терапевтическое действие амантадина сульфата при ЧМТ оценивали в дозе 5 мг/кг
с интервалом 2 раза в сутки в течение 8 суток. В качестве лекарственного средства для контрольной группы применяли 0,9% NаСl в дозе 2 мл/кг. На 8-е сутки после ЧМТ и декапитации животных части коры головного мозга были взяты для дальнейшей оценки фрагментации ДНК в клетках. Исследования проводились при помощи проточной цитометрии. Результаты. В контрольной группе интенсивность фрагментации ДНК в ядрах нейронов долей коры головного мозга крыс на 8-е сутки после моделирования ЧМТ достоверно повысилась на 198,2 %. После курсового (в течение 8 дней) введения крысам в острый период травматического повреждения головного мозга амантадина сульфата в дозе 5 мг/кг в ядрах клеток коры головного мозга крыс определялись меньшие значения показателей интервала Sub-G1 относительно аналогичного показателя животных контрольной группы в среднем на 26,2 %, но все же исследуемый показатель оставался выше показатели группы псевдо-оперированных животных на 120,1 % (р < 0,05). Выводы. Посттравматический период модельной ЧМТ у крыс сопровождается вероятным ростом относительно интактных животных уровня фрагментации ДНК в ядрах клеток коры головного мозга на 8-е сутки эксперимента в среднем в 3 раза. По величине антиапоптотического эффекта в условиях посттравматического повреждения головного мозга терапия раствором амантадина сульфата оказалась достоверно лучше, чем инфузия 0,9% раствора NaCl, в среднем на 26,2 % (р < 0,05).
Background. Depending on the nature of brain injury and severity of the victims’ state, mortality in traumatic brain injury (TBI) ranges from 5 to 65 %. The share of necrotic and apoptotic neuron death in the total mass of damaged nerve tissue against the background of TBI is quite variable and depends on many conditions. The purpose: to characterize the effect of amantadine sulfate and 0.9% NaCl solution on DNA fragmentation (apoptosis) of rat cerebral cortex cells following TBI. Materials and methods. The experiments were performed on male rats. An experimental model of severe TBI was created using a pneumatic gun. The therapeutic effect of amantadine sulfate in TBI was evaluated at a dose of 5 mg/kg intravenously twice daily for 8 days. In the control group, 0.9% NaCl at a dose of 2 ml/kg was used. On day 8 after TBI and animal decapitation, samples of the cerebral cortex were taken to further evaluate DNA fragmentation in the cells. The studies were performed by flow cytometry. Results. In the control group, the intensity of DNA fragmentation in the nuclei of neurons of rat cerebral cortex significantly increased by 198.2 % on day 8 after TBI simulation. After the course introduction (for 8 days) of amantadine sulfate at a dose of 5 mg/kg to rats in the acute period of traumatic brain injury, lower values of Sub-G1, on average by 26.2 %, in the nuclei of the cells of the cerebral cortex of rats were determined compared to the same indicator in animals of the control group, but the studied index remained higher than in the group of pseudoperated animals — by 120.1 % (p < 0.05). Conclusions. The post-traumatic period of simulated TBI in rats is accompanied by a significant increase (on average 3-fold) in the level of DNA fragmentation in the nuclei of cortex cells of the brain on 8th experimental day compared to intact animals. By the size of anti-apoptotic effect in the conditions of post-traumatic damage to the brain, therapy with amantadine sulfate solution was significantly better than with the infusion of 0.9% NaCl solution — by an average of 26.2 % (p < 0.05).
амантадину сульфат; нейроапоптоз; черепно-мозкова травма
амантадина сульфат; нейроапоптоз; черепно-мозговая травма
amantadine sulfate; neuroapoptosis; traumatic brain injury
Вступ
Щорічно у світі понад 10 млн людей помирає або госпіталізується у зв’язку з черепно-мозковою травмою (ЧМТ) [1]. З кожним роком спостерігається тенденція до збільшення числа більш тяжких ушкоджень мозку [2]. Залежно від характеру травми мозку та тяжкості постраждалих летальність при ЧМТ коливається від 5 до 65 % [3]. Розробка та впровадження в практику лікарів невідкладної неврології та нейрохірургічної практики нових лікарських засобів (ЛЗ), що здатні впливати на вторинне пошкодження нейронів у хворих з травматичним та/або ішемічним генезом ушкодження, дозволило суттєво впливати на відновлення таких пацієнтів, зменшувати тривалість перебування у відділеннях інтенсивної терапії, знижувати летальність, покращити реабілітацію та відновлення когнітивних функцій постраждалих [4–6].
Частка некротичної та апоптотичної смерті ней-ронів у загальній масі ушкодженої нервової тканини на фоні ЧМТ є досить варіабельною і залежить від багатьох умов. Загибель клітини шляхом апоптозу не супроводжується розвитком запалення, і цілісність мембрани не порушується. Апоптотична загибель нейронів вважається меншим злом для головного мозку, ніж некротична, хоча загальна кількість клітин і зменшується [7, 8].
Науковці доводять, що одночасно з процесами вторинних ушкоджень у відповідь на травму в клітині запускаються процеси нейропротекції і нейрорегенерації, основну роль в яких відіграють ендогенні нейротрофічні фактори (НТФ) — специфічні внутрішньоклітинні нейрорегуляторні білки, які опосередковано впливають на геном клітини [9, 10]. Основними нейропротекторними властивостями НТФ є: обмеження ексайтотоксичності, гальмування процесів апоптозу тощо [11]. Для ґрунтовного з’ясування впливу ізоосмолярного розчину 0,9% NaCl та амантадину сульфату на перебіг ЧМТ досліджували вплив курсової терапії цими ЛЗ на апоптоз клітин кори головного мозку у щурів при травматичному пошкодженні головного мозку.
Мета: охарактеризувати вплив амантадину сульфату та 0,9% розчину NaCl на фрагментацію ДНК (апоптоз) клітин кори головного мозку щурів на фоні ЧМТ.
Матеріали та методи
Досліди проведено на білих щурах-самцях масою 160–190 г, які перебували у стандартних умовах віварію, з дотриманням етичних норм проведення експериментальних досліджень згідно із Загальними принципами роботи на тваринах, затвердженими I Національним конгресом з біоетики (м. Київ, Україна, 2001) та Законом України «Про захист тварин від жорстокого поводження» від 26.02.2006. Експериментальну модель ЧМТ викликали дією потоку вуглекислого газу під тиском, що створювали із використанням газобалонного пневматичного пістолету марки «Байкал МР-654К» (РФ, Іжевськ, № сертифікату РОСС RU МЖ03.В02518) та балонів вуглекислого газу (маса зрідженого СО2 — 12 г) під тиском (Crosman, США, № серії 456739). Щурам в умовах пропофолового наркозу (60 мг/кг), після катетеризації стегнової вени та налагодження можливості здійснювати інфузію через інфузомат, робили правобічну кістково-пластичну трепанацію черепа у проєкції середньої мозкової артерії, з діаметром отвору 5 мм2. Після фіксації щура в положенні на животі вниз головою здійснювали постріл з фіксованої відстані (постріл впритул), кістковий фрагмент на окісті разом із апоневрозом повертали на місце і рану зашивали пошарово. Таким чином моделювалася ЧМТ тяжкого ступеня.
Терапевтичну дію амантадину сульфату («ПК-Мерц», Merz Pharmaceuticals, Швейцарія), 1 флакон 500 мл концентрацією 200 мг/500 мл, на модельній ЧМТ оцінювали при застосуванні дози 5 мг/кг внутрішньовенно. Лікування відбувалось шляхом повільної внутрішньовенної (в/в) інфузії інфузоматом з інтервалом 2 рази на добу (через кожні 12 год) упродовж 8 діб. Лікування розпочинали через 1 год після моделювання патологічного стану. Псевдооперованих тварин піддавали всім втручанням (наркоз, розріз шкіри, кістково-пластична трепанація черепа), за виключенням маніпуляцій, які безпосередньо могли б призвести до травматичного ураження мозку, що нівелювало вплив травматичних умов експерименту. Їм також вводили еквівалентну кількість 0,9% розчину NаСl до дози амантадину сульфату. Як лікарський засіб для контрольної групи застосовували 0,9% розчин NаСl в дозі 2 мл/кг в/в у тому ж режимі.
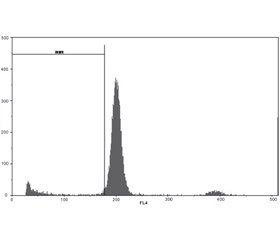
Оцінку рівня фрагментації ДНК в ядрах нейронів часток кори головного мозку як маркера ней-роапоптозу проводили в умовах модельної ЧМТ у щурів. Дослідження виконували методом протокової цитометрії [12]. На 8-му добу ЧМТ вилучали частки кори головного мозку. Суспензії ядер отримували при додаванні до тканини спеціального розчину для дослідження ядерної ДНК СуStain DNA фірми Partec (Німеччина) відповідно до протоколу-інструкції виробника. Цей розчин забезпечує одночасну екстракцію ядер та мітку ядер ДНК діамідинофеніліндолом, що є його складовою. Для приготування ядерних суспензій використовували спеціальні одноразові фільтри CellTrics 50 мкм (Partec, Німеччина). Ядерні суспензії біоптатів кори часток головного мозку щурів готували негайно після забору матеріалу та промивки холодним (+4...+8 °С) фосфатносольовим буфером рН 7,4 (Sigma). Визначали на багатофункціональному науково-дослідному протоковому цитометрі Partec РАS фірми Partec, Німеччина. Для збудження флуоресценції діамідинофеніліндолом використовували ультрафіолетову лампу. З кожного зразка ядерної суспензії здійснювався аналіз 10 тис. подій. Протоковий аналіз фрагментації ДНК виконували засобами програмного забезпечення FloMax (Partec, Німеччина) шляхом виділення Sub-G1 ділянки на ДНК-гістограмах [12].
Отримані результати обробляли за допомогою програми статистичної обробки StatPlus 2009 з використанням парного критерію Вілкоксона. Відмінності вважали статистично значущими при p < 0,05.
Результати
Вивчення можливих механізмів захисної дії досліджуваних 0,9% розчину NаСl та амантадину сульфату на травматично пошкоджений головний мозок показало, що у групі контрольної патології (ЧМТ + 0,9% розчин NaCl) інтенсивність фрагментації ДНК в ядрах нейронів часток кори головного мозку щурів на 8-му добу після моделювання ЧМТ вірогідно підвищилася у 3 рази, або на 198,2 % (рис. 1, 2, табл. 1).
Після курсового (впродовж 8 діб) введення щурам у гострий період травматичного пошкодження головного мозку амантадину сульфату в дозі 5 мг/кг в ядрах клітин кори головного мозку щурів визначались менші значення показників інтервалу Sub-G1 відносно аналогічного показника тварин контрольної групи в середньому на 26,2 %, але все ж таки досліджуваний показник залишався вищим за показники групи псевдооперованих тварин на 120,1 % (р < 0,05) (табл. 1; рис. 1–3).
Обговорення
Оцінюючи зростання фрагментації ДНК у групі контрольної патології (ЧМТ + 0,9% розчин NaCl), можна говорити про процес інтенсивного формування посттравматичного вогнища саме за рахунок нейроцитів, які перебувають у стані апоптотичної смерті.
Отримані дані свідчать про деяке зменшення процесів апоптотичного пошкодження клітин кори головного мозку щурів на фоні експериментального лікування травматичного ураження головного мозку амантадином сульфатом. Через те, що саме при ЧМТ глутаматна ексайтотоксичність є одним із тригерних факторів, що впливають на розвиток лактат-ацидозу, ангіоспазму та ендотеліальної дисфункції, утворення реактивних вільних радикалів кисню, активацію перекисного окислення ліпідів, набряку мозку, індукуючи процеси апоптозу і некрозу клітин [13–15] з урахуванням позитивного модулюючого впливу амантадину сульфату на NMDA-рецептори, отримані результати щодо нейропротекторної дії амантадину сульфату пов’язані саме з модулюючим впливом на активність NMDA-рецепторів, у тому числі за рахунок зменшення апоптозу.
Таким чином, при порівнянні ефективності досліджуваних розчинів 0,9% NaCl та амантадину сульфату за показником фрагментації ДНК (SUB-G1) ядер клітин кори часток ГМ у щурів з ЧМТ встановлено, що терапія розчином амантадину сульфату в дозі 5 мг/кг на 27,2 % краще (11,47 ± 0,02 % проти 15,76 ± 0,42 %) (р < 0,05) призводить до гальмування процесів нейроапоптозу порівняно із розчином 0,9% NaCl. На нашу думку, пригнічення інтенсивності нейроапоптозу в корі травматично пошкодженого головного мозку щурів на тлі амантадину сульфату свідчить про зменшення вогнища нейродеструкції за рахунок збереження числа морфологічно непошкоджених нейроцитів і є одним із провідних механізмів його церебропротекторної дії при травматичних пошкодженнях головного мозку.
Висновки
1. Посттравматичний період модельної ЧМТ у щурів супроводжується вірогідним зростанням відносно інтактних тварин рівня фрагментації ДНК у ядрах клітин кори ГМ на 8-му добу експерименту в середньому у 3 рази.
2. За величиною антиапоптотичного ефекту в умовах посттравматичного пошкодження ГМ терапія розчином амантадину сульфату виявилась вірогідно кращою за інфузію 0,9% розчину NaCl в середньому на 26,2 % (р < 0,05).
3. Для підтвердження отриманих даних та оцінки механізму дії різних церебропротекторів перспективним слід вважати дослідження з використанням специфічних маркерів ушкодження ГМ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Abou El Fadl M.H., O’Phelan K.H. Management of Traumatic Brain Injury: An Update. Neurosurg. Clin. N. Am. 2018. № 29(2). Р. 213-221.
2. Smith C. Neurotrauma. Handb. Clin. Neurol. 2017. № 145. Р. 115-132.
3. Rickels E. Focus on traumatic brain injury. Eur. J. Trauma Emerg. Surg. 2017. № 43(6). Р. 729-730.
4. Gardner R.C., Dams-O’Connor K., Morrissey M.R., Manley G.T. Geriatric Traumatic Brain Injury: Epidemiology, Outcomes, Knowledge Gaps, and Future Directions. J. Neurotrauma. 2018 Feb 15. doi: 10.1089/neu.2017.5371.
5. Llompart-Pou J.A, Pérez-Bárcena J. Geriatric traumatic brain injury: An old challenge. Med. Intensiva. 2019 Jan-Feb. № 43(1). Р. 44-46.
6. Arun P., Ariyannur P.S., Moffett J.R., Xing G., Hamilton K., Grunberg N.E., Ives J.A., Namboodiri A.M. Metabolic acetate therapy for the treatment of traumatic brain injury. J. Neurotrauma. 2010. № 27(1). P. 293-298.
7. Waring P., Kos F.J., Mullbacher A. Apoptosis or programmed cell death. Med. Res. Rev. 2008. № 11. Р. 219-236.
8. Манских В.Н. Морфологические методы верификации и количественной оценки апоптоза. Бюллетень сибирской медицины. 2004. № 1. С. 63-70.
9. McGinn M.J., Povlishock J.T. Pathophysiology of Traumatic Brain Injury. Neurosurgery Clinics of North America. 2016. № 27(4). Р. 397-407.
10. Werner C., Engelhard K. Pathophysiology of traumatic brain injury. Br. J. Anaesth. 2007. № 99. Р. 4-9.
11. Mettang M., Reichel S.N., Lattke M., Palmer A., Abaei A., Rasche V., Huber-Lang M., Baumann B., Wirth T. IKK2/NF-κB signaling protects neurons after traumatic brain injury. FASEB J. 2018. № 32(4). Р. 1916-1932. doi: 10.1096/fj.201700826R.
12. Ходаківський О.А., Черешнюк І.Л. Дослідження впливу похідного адамантану адемолу на фрагментацію ДНК ядер нейронів лобних часток кори за ішемії-реперфузії головного мозку у щурів. Український вісник психоневрології. 2013. Т. 21, № 1(74). С. 26-28.
13. Carney N., Totten A.M., O’Reilly C. Guidelines for the Management of Severe Traumatic Brain Injury 4th Edition Reviewed for evidence-based integrity and endorsed by the American Association of Neurological Surgeons and the Congress of Neurological Surgeons. September 2016/https://braintrauma.org/uploads/03/12/Guidelines for Management of Severe TBI 4th_Edition.pdf.
14. Hatefi M., Behzadi S., Dastjerdi M.M., Ghahnavieh A.A., Rahmani A., Mahdizadeh F., Hafezi Ahmadi M.R., Asadollahi K. Correlation of Homocysteine with Cerebral Hemodynamic Abnormality, Endothelial Dysfunction Markers, and Cognition Impairment in Patients with Traumatic Brain Injury. World Neurosurg. 2017. № 97. Р. 70-79. doi: 10.1016/j.wneu.2016.09.080.
15. Eroğlu O., Deniz T., Kisa Ü., Atasoy P., Aydinuraz K. Effect of hypothermia on apoptosis in traumatic brain injury and hemorrhagic shock model. Injury. 2017. № 48(12). Р. 2675-2682. doi: 10.1016/j.injury.2017.09.032.

/14-1.jpg)
/14-2.jpg)