Международный неврологический журнал №7 (109), 2019
Вернуться к номеру
Новые патогенетические аспекты взаимосвязи некоторых факторов риска цереброваскулярных заболеваний и болезни Паркинсона
Авторы: Герцев В.Н., Стоянов А.Н., Мащенко С.С., Антоненко С.А.
Одесский национальный медицинский университет, г. Одесса, Украина
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Взаємозв’язок порушень вегетативної нервової системи з розвитком цереброваскулярних захворювань і ідіопатичної хвороби Паркінсона досі є недостатньо вивченим. У низці робіт виявлено, що діабет, паління в анамнезі, високий артеріальний тиск, підвищення рівня глюкози, холестерину і тригліцеридів у крові значно рідше спостерігаються у пацієнтів з ідіопатичною хворобою Паркінсона. Також повідомляється про зниження ризику розвитку інсульту у пацієнтів з хворобою Паркінсона. Водночас в інших роботах виявлено, що ризик розвитку інсульту у пацієнтів з хворобою Паркінсона підвищується, а діабет і артеріальна гіпертензія пов’язані з підвищеним ризиком розвитку захворювання. Встановлено, що хвороба Паркінсона і серцево-судинні чинники ризику є незалежними чинниками розвитку когнітивних порушень. Суперечливими є результати робіт про вплив прийому статинов на виникнення і перебіг хвороби Паркінсона. Виявлені протиріччя частково можуть бути пояснені можливим впливом грибкової флори, яка, як відомо, широко представлена у пацієнтів з хворобою Паркінсона. Відомо, що статини є продуктами життєдіяльності грибкових мікроорганізмів. Істотний вклад у патогенез хвороби Паркінсона вносить зміна мікробіоти кишечника; дисфункція шлунково-кишкового тракту при хворобі Паркінсона є одним із перших немоторних проявів захворювання, що виникає за декілька років до розвитку типової клінічної картини. При цьому малий кишковий дисбактеріоз у більшої частини пацієнтів пов’язаний із порушенням всмоктування внаслідок високої бактерійної щільності. Отже, аналізуючи наведене вище, можна припустити, що мікробіота кишечника та шкіри у частини пацієнтів продукує природні статини, а застосування протипаркінсонічних та інших препаратів впливає на цю функцію, тому такі суперечливі отримані результати досліджень. Вивчення етіопатогенезу такого роду взаємовідносин вимагає подальших масштабних інтердисциплінарних досліджень на базі доказової медицини. Перспективним напрямком у вивченні етіології і патогенезу хвороби Паркінсона є поглиблена оцінка ролі грибкової мікрофлори в її розвитку. Вивчення взаємовідносин, наведених вище, дозволить визначити нові біомаркери і лікарські мішені для розробки модифікуючих хворобу методів терапії.
Взаимосвязь нарушений вегетативной нервной системы с развитием цереброваскулярных заболеваний и идиопатической болезни Паркинсона до сих пор является недостаточно изученной. В ряде работ выявлено, что диабет, курение в анамнезе, высокое артериальное давление, повышение уровня глюкозы, холестерина и триглицеридов в крови значительно реже наблюдаются у пациентов с идиопатической болезнью Паркинсона. Также сообщается о снижении риска развития инсульта у пациентов с болезнью Паркинсона. В то же время в других работах обнаружено, что риск развития инсульта у пациентов с болезнью Паркинсона повышается, а диабет и артериальная гипертензия связаны с повышенным риском развития заболевания. Установлено также, что болезнь Паркинсона и сердечно-сосудистые факторы риска являются независимыми факторами развития когнитивных нарушений. Противоречивыми являются результаты работ о влиянии приема статинов на возникновение и течение болезни Паркинсона. Обнаруженные противоречия отчасти могут быть объяснены возможным влиянием грибковой флоры, которая широко представлена у пациентов с болезнью Паркинсона. Известно, что статины являются продуктами жизнедеятельности грибковых микроорганизмов. Существенный вклад в патогенез болезни Паркинсона вносят изменения микробиоты кишечника; дисфункция желудочно-кишечного тракта при болезни Паркинсона является одним из первых немоторных проявлений заболевания, возникающим за несколько лет до развития типичной клинической картины. При этом малый кишечный дисбактериоз у большей части пациентов связан с нарушением всасывания из-за высокой бактериальной плотности. Таким образом, анализируя приведенное выше, можно допустить, что микробиота кишечника и кожных покровов у части пациентов продуцирует природные статины, а применение противопаркинсонических и других препаратов влияет на эту функцию, поэтому столь противоречивы полученные результаты исследований. Изучение этиопатогенеза такого рода взаимоотношений требует дальнейших масштабных интердисциплинарных исследований на базе доказательной медицины. Перспективным направлением в изучении этиологии и патогенеза болезни Паркинсона является углубленная оценка роли грибковой микрофлоры в ее развитии. Изучение взаимоотношений, приведенных выше, позволит определить новые биомаркеры и лекарственные мишени для разработки болезнь-модифицирующих методов терапии.
Role of the disorders of the autonomous nervous system in the development of cerebrovascular diseases and Parkinson’s disease is studied not enough until now. In a number of works it was found that diabetes, history of smoking, high blood pressure, increased level of glucose, cholesterol and triglycerides in the blood are considerably rarer observed in patients with idiopathic Parkinson’s disease. It is also reported about the reduced risk of stroke development in patients with Parkinson’s disease. At the same time, in other works it was found that the risk of stroke in patients with Parkinson’s disease increases, and diabetes and high blood pressure are associated with increased risk of developing this disease. It is also known that Parkinson’s disease and cardiovascular risk factors are independent factors for the development of cognitive disorders. Rеsults of works about the influence of statins on the onset and course of Parkinson’s disease are controversial. These contradictions partly can be explained by possible influence of fungal flora that, as known, is widely presented in patients with Parkinson’s disease. It is known that statins are produced by fungal microorganisms. Changes in the intestinal microbiota play a significant role in pathogenesis of Parkinson’s disease; gastrointestinal disorders in Parkinson’s disease are one of the first non-motor symptoms, which appear a few years before typical clinical presentation. In this case, small intestinal dysbiosis in most patients is associated with malabsorption due to high bacterial density. Thus, analyzing the above mentioned, it is possible to assume that intestinal and skin microbiota produces natural statins, and the use of antiparkinson and other drugs influences this function, that is why results of researches are contradictory. Studying etiopathogenesis of this relations requires further interdisciplinary researches on the base of evidential medicine. Perspective direction in the study of etiology and pathogenesis of Parkinson’s disease is a deep evaluation of the role of fungal microflora. A study of the relationships given above will allow us to identify new biomarkers and drug targets for the development of disease-modifying therapies.
хвороба Паркінсона; вегетативна система; судинна патологія мозку; порушення ліпідного обміну; грибкова мікрофлора
болезнь Паркинсона; вегетативная система; сосудистая патология мозга; нарушение липидного обмена; грибковая микрофлора
Parkinson’s disease; autonomous system; cerebrovascular disease; blood lipids; fungal microflora
Несмотря на то, что точная причина возникновения болезни Паркинсона (БП) не установлена, известно большое количество факторов риска развития этого заболевания. Обсуждается комплексность их влияния. В то же время взаимосвязь нарушений функционирования вегетативной нервной системы (ВНС) при БП является недостаточно изученной. Как известно, ВНС играет важную роль в контроле сердечно-сосудистой деятельности и метаболизма глюкозы и липидов. Повышенная симпатическая активность, ассоциированная с высокой частотой диабета, дислипидемии, гипертонии и ожирения, была зарегистрирована у пациентов с шизофренией. Противоположная ситуация наблюдается при БП, из-за которой снижение активности ВНС, вызванное болезнью, связано с уменьшением частоты сосудистых факторов риска, особенно при лечении дофаминергическими препаратами [1]. На низкий риск васкулярных нарушений у пациентов с БП указывает G. Scigliano с соавт. (2006) [2]. В проведенном ретроспективном исследовании 178 пациентов с идиопатической БП и 533 пациентов из группы контроля, сходных по возрасту и полу и имеющих другие неврологические заболевания, выявлено, что диабет, курение в анамнезе, высокое артериальное давление (АД), содержание глюкозы, уровень холестерина и триглицеридов в крови значительно реже встречались у пациентов с идиопатической БП, чем у пациентов контрольной группы. Авторы предполагают, что идиопатическая БП является естественной моделью нарушения активности оси «гипоталамус — гипофиз — надпочечники» и генерализованной симпатической денервации, и связывают нелеченную БП с меньшим риском развития цереброваскулярных заболеваний из-за снижения функциональной активности ВНС, закономерно делая вывод о том, что вегетативная гиперактивность играет ключевую роль в патогенезе сосудистых дисгемий.
Дофамин, полученный из леводопы, модулирует симпатическую активность и снижает АД, но его влияние на метаболизм глюкозы и липидов не изучалось у больших групп пациентов. G. Scigliano с соавт. (2009) ретроспективно обследовали 483 последовательных пациента с паркинсонизмом, поступивших в медицинское учреждение между 1970 и 1987 годами, то есть до того времени, как стали доступны статины [3]. Авторы сравнили факторы риска сердечно-сосудистой патологии у 305 пациентов, принимавших леводопу, и у 178 пациентов, которые никогда ее не получали. При поступлении получавшие леводопу пациенты имели значительно более низкие уровни триглицеридов, общего холестерина и липидов в плазме и более низкую частоту диабета и гипертонии, чем не получавшие леводопу. Средний индекс массы тела, АД в покое, уровень глюкозы в плазме натощак и частота курения не различались между группами. Через год после поступления 160 пациентов были повторно госпитализированы; из них 63 начали принимать леводопу во время первой госпитализации. У этих пациентов общий уровень холестерина, триглицеридов и липидов снизился до уровней, сопоставимых с таковыми у пациентов, длительно получавших леводопу. Авторами был сделан вывод о том, что применение леводопы у пациентов с паркинсонизмом связано с уменьшением сосудистых факторов риска. Предполагается, что это может быть связано с ингибирующим действием дофамина на симпатический отдел ВНС.
О снижении риска развития инсульта у пациентов с болезнью Паркинсона сообщается в работах L.K. Struck с соавт. (1990) и A. Korten с соавт. (2001) [4, 5].
Однако в более позднем исследовании выявлено, что риск развития инсульта у пациентов с БП повышается [6]. В течение трехлетнего периода наблюдения у 328 пациентов с БП и у 156 пациентов в контрольной группе развился ишемический инсульт. Коэффициент выживаемости при этом в группе пациентов с БП был значительно ниже, чем в контроле (р < 0,0001). Отношение риска развития инсульта для группы пациентов с БП составило 2,37 (95% доверительный интервал (ДИ) 1,92–2,93; р < 0,0001) в сравнении с контрольной группой.
Диабет и артериальная гипертензия связаны с повышенным риском развития БП [7–11]. В исследование E. Cereda с соавт. (2012), проведенное по схеме «случай — контроль», из когорты всех новых пациентов с идиопатической БП без сосудистых заболеваний (n = 783), принятых и оцененных в течение 3-летнего периода (2007–2010), были включены все пациенты с диагнозом диабета до начала БП (n = 89) и отобрана контрольная группа (n = 89), соответствующая (1 : 1) по полу, индексу массы тела и продолжительности БП [7]. На момент начала исследования пациенты с диабетом были схожи с пациентами контрольной группы с точки зрения большинства демографических характеристик, образа жизни и общих медицинских характеристик, за исключением приема статинов (18,0 % против 3,4 %; р = 0,003). Диабет был связан с более высокими показателями двигательной активности UPDRS (22,3 ± 9,0 против 19,3 ± 7,9; р = 0,019) и активности в повсе-дневной жизни (9,7 ± 5,1 против 8,3 ± 4,3; р = 0,049), более тяжелой стадией Hoehn & Yahr (p = 0,009) и более высокими лечебными дозами леводопы (448 ± ± 265 мг/день против 300 ± 213 мг/день; р < 0,0001; 5,8 ± 4,0 мг/кг/день против 3,8 ± 2,9 мг/кг/день; р < 0,0001). Эти данные подтверждают гипотезу о том, что диабет играет роль в этиопатогенезе БП.
В исследовании E. Schernhammer с соавт. (2011) обследован 1931 пациент с впервые установленным диагнозом БП в период с 2001 по 2006 год. Также случайным образом отобран 9651 пациент для контрольных групп. Наличие диабета было связано с повышением риска развития БП на 36 % (отношение шансов (ОШ) 1,36; 95% ДИ 0,8–1,71). Диабет с использованием любых противодиабетических препаратов был связан с повышением риска БП на 35 % (ОШ 1,35; 95% ДИ 1,10–1,65). Когда возникновение диабета связали с использованием пероральных противодиабетических препаратов, то этот эффект был наибольшим у женщин (ОШ 2,92; 95% ДИ 1,34–6,36). Когда же диабет связали с любым противодиабетическим препаратом, то выяснилось, что пациенты с ранним началом БП были подвержены наибольшему риску (ОШ 3,07; 95% ДИ 1,65–5,70). Таким образом, обнаружено, что диабет в значительной степени ассоциировался с повышенным риском развития БП, особенно в случае раннего начала.
Общеизвестно, что инсулин играет важную роль в нормальной работе мозга, а инсулинорезистентность может привести к нейродегенеративным заболеваниям, о чем свидетельствует масштабное исследование, в котором сообщается о более высокой частоте болезни Альцгеймера у мужчин, у которых в середине жизни развился диабет [12].
Установлено, что БП и сердечно-сосудистые факторы риска являются независимыми для когнитивных нарушений [13]. В исследовании J.D. Jones (2017) выборка включала 67 пациентов с БП и 61 пациента из группы контроля. Участники прошли нейропсихологическое оценивание исполнительных и основных составляющих высшей нервной деятельности. Сердечно-сосудистый риск оценивали с помощью специфического индекса Framingham. На МРТ в режимах T1, T2 и FLAIR измеряли общий и регионарный лейкоареоз (перивентрикулярный, глубокий подкорковый и инфракортикальный). Иерархическая регрессия показала, что более серьезный сердечно-сосудистый риск был связан с ухудшением исполнительных функций, скоростью функционирования и задержкой словесного отклика у пациентов с БП и в контрольной группе, а также с ухудшением речевого функционирования в группе пациентов с БП, но не в группе контроля. Напротив, лейкоареоз был связан как с сердечно-сосудистым риском, так и с исполнительным функционированием в контрольной группе, но не в группе с БП. В целом результаты показали, что БП и сердечно-сосудистые факторы риска являются независимыми для когнитивных нарушений и были одинаковы как для пациентов с БП, так и для пациентов контрольной группы.
Также противоречивыми являются результаты работ о влиянии приема статинов на возникновение БП.
В исследовании X. Huang с соавт. (2015) проспективно изучали содержание липидов в плазме и использование статинов в связи с БП в исследовании риска развития атеросклероза в сообществах (ARIC) [14]. Использование статинов и уровни липидов в плазме оценивались в начале исследования (посещение 1, 1987–1989 гг.) и после трехлетних визитов (посещения 2–4) до 1998 года. Потенциальные случаи БП были подтверждены несколькими экспертами и прошли процедуру валидизации. Первичный анализ ограничивался случаями БП, диагностированными в период между 1998 и 2008 годом. Коэффициенты шансов и 95% доверительные интервалы были получены по многомерным моделям логистической регрессии. Прием статинов был редок в начале исследования (0,57 %), но увеличился до 11,2 % при последующих посещениях. За это время уровень общего холестерина снизился, особенно у пациентов, принимавших статины. Пятьдесят шесть случаев БП были выявлены после 1998 года. Использование последних до 1998 года было связано со значительно более высоким риском БП после 1998 года (ОШ 2,39; 95% ДИ 1,11–5,13) с корректировкой на общий уровень холестерина и других факторов. И наоборот, его повышение было связано с меньшим риском развития БП после использования статинов. По сравнению с наименьшим терцилем среднего общего холестерина отношение шансов для БП составило 0,56 (0,30–1,04) для второго и 0,43 (0,22–0,87) для третьего терциля (р trend = 0,02). Авторами сделан вывод о том, что использование статинов может быть связано с более высоким риском развития БП, тогда как более высокий уровень общего холестерина может быть связан с более низким риском развития БП. Таким образом, полученные данные не соответствуют гипотезе о том, что статины защищают от БП.
В недавнем исследовании G. Liu с соавт. (2017) также была установлена роль статинов в повышении риска развития БП [15]. Авторами был проведен ретроспективный анализ «случай — контроль». Для этого были отобраны 2322 пациента с БП, наблюдавшиеся в течение не менее 2,5 года, а также 2322 пациента контрольной группы, которые были сопоставимы индивидуально по возрасту, полу и периоду наблюдения, для изучения взаимосвязи использования статинов с частотой БП. Использование последних в существенной степени связано с риском развития БП, причем наиболее сильные ассоциации были связаны с липофильными (ОШ 1,58; р < 0,0001) по сравнению с гидрофильными (ОШ 1,19; р = 0,25) статинами, статинами и нестатинами (ОШ 1,95; р < 0,0001), и для начального периода после начала приема статинов (ОШ: < 1 года = 1,82; 1–2,5 года = 1,75; ≥ 2,5 года = 1,37; р trend < 0,0001).
В обзоре других эпидемиологических исследований, в которых сообщалось о количественных оценках связи между применением статинов и развитием БП, опубликованных до февраля 2016 года, были получены противоречивые результаты о влиянии статинов [16]. Изучены результаты 10 работ, в которых оценивалось влияние применения статинов на развитие БП. Среди 6 исследований, в которых не учитывался уровень холестерина, наблюдался их защитный эффект (относительный риск (ОР) 0,75; 95% ДИ 0,60–0,92) и не наблюдался в 4 исследованиях с учетом уровня холестерина (ОР 0,91; 95% ДИ 0,68–1,22). Оценка эффекта для исследований с поправкой на холестерин составляла 1,04 (95% ДИ 0,68–1,59).
K. Gudala с соавт. (2013) проанализировали восемь исследований, в которых участвовало в общей сложности 246 112 человек, включая 5488 случаев БП [17]. Комбинированный анализ не выявил существенной связи между уровнем сывороточного холестерина и риском развития БП (ОШ 0,87; 95% ДИ 0,67–1,13; р = 0,41).
H. Xicoy, B. Wieringa, G.J.M. Martens (2019) установили сильную корреляцию между БП и нарушениями липидного обмена [18]. А именно связи между БП и уровнями жирных ацилов, глицеролипидов, глицерофосфолипидов, сфинголипидов, стеринов и липопротеинов различной плотности, в том числе между фолдингом, агрегацией и распределением α-синуклеина и липидов, которые управляют некоторыми нейропатологическими признаками БП. Тем не менее в настоящее время неясно, существуют ли связи между БП и некоторыми эйкозаноидами, глицерофосфолипидами и липопротеинами. Одна из основных проблем результатов, обобщенных в этом обзоре, заключается в том, что в отношении большинства классов липидов не обнаружена их взаимосвязь с БП. Такие параметры, как пол, возраст, этиология БП, специфические полиморфизмы ДНК или микробиом, могли повлиять на результаты. Исходя из этого, правильная стратификация пациентов с БП необходима для понимания биологических последствий наблюдаемых липидных изменений. Кроме того, более точное описание липидных профилей плазмы, ликвора или фибробластов у пациентов с БП поможет точнее классифицировать пациентов. Еще одна проблема состоит в том, что большинство исследований было сосредоточено на наличии липидов в плазме, но они могут не коррелировать с их уровнем в мозге, например, концентрация некоторых видов ганглиозидов повышается в плазме, но не в мозге пациентов с БП [19, 20]. Кроме того, часто неясно, отражают ли изменения в уровнях липидов патологический или компенсаторный механизм. Наконец, исследования на клеточных и животных моделях БП не всегда показывают ту же направленность изменений уровня липидов, что и у пациентов с БП. Таким образом, имеется достаточно доказательств центральной роли липидов при болезни Паркинсона, но современная картина все еще слишком фрагментирована, что препятствует раскрытию специфических патологических механизмов, в которых участвуют липиды. Внедрение современных технологических достижений для лучшей характеристики липидома и изучения функций конкретных видов липидов вместе с дополнительными исследованиями ликвора и/или мозговой ткани у пациентов с БП в настоящее время необходимо. Это также углубит наше понимание патобиологии взаимоотношений между БП и липидами и поможет определить биомаркеры и лекарственные мишени для разработки модифицирующих болезнь методов лечения.
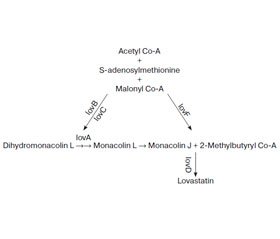
С нашей точки зрения, приведенные выше противоречивые факты отчасти могут быть объяснены возможным влиянием грибковой флоры, широко представленной у пациентов с БП. Гипотеза о том, что БП может быть связана с грибами или актинобактериями, была выдвинута еще 16 лет назад [21]. Известно, что статины являются продуктами жизнедеятельности грибковых микроорганизмов, в частности Aspergillus terreus, или их синтетическими аналогами [22]. Все грибы, продуцирующие ловастатин или компактин, используют следующий биохимический путь [23] (рис. 1).
Постоянно ведутся поиски новых натуральных источников статинов, так, из вида грибов Penicillium steckii HDN13-279 недавно было выделено семь новых поликетидов, названных танзаваиновыми кислотами (tanzawaic acid) [24]. Пять из этих соединений значительно снижали накопление липидов, вызванных олеиновой кислотой в клетках печени, среди которых четыре соединения значительно уменьшали уровни внутриклеточного общего холестерина, а три — уровни внутриклеточных триглицеридов. При этом возможности снижения уровней триглицеридов в ряде соединений были сопоставимы с таковыми у симвастатина.
Свой вклад в патогенез БП вносят и изменения микробиоты кишечника. В настоящее время дисфункция желудочно-кишечного тракта при БП является общепризнанной, являясь одним из первых немоторных проявлений заболевания, возникающих за несколько лет до развития типичной клинической картины [25, 26]. При этом малый кишечный дисбактериоз (дисбиоз) встречается от 54 до 67 % случаев и связан с нарушением всасывания из-за бактериальной плотности выше 105 колониеобразующих единиц/мл аспирата [27–31].
Таким образом, анализируя приведенное выше, можно допустить, что микробиота кишечника и кожных покровов у части пациентов с БП продуцирует природные статины, а применение противопаркинсонических и других препаратов влияет на эту функцию, поэтому столь противоречивые результаты об уровне липидов, применении статинов и риске развития БП и других взаимоотношениях получены в настоящее время. Безусловно, требуется дальнейшее изучение данной проблемы и проведение масштабных, тщательно спланированных междисциплинарных исследований для выяснения существующих взаимосвязей.
Выводы
1. Результаты исследований о взаимосвязи и взаимовлияниях болезни Паркинсона с вегетативными и сосудистыми дисгемиями достаточно противоречивы. Этиопатогенез такого рода взаимоотношений требует дальнейшего изучения.
2. Необходимо проведение масштабных исследований на базе доказательной медицины о влиянии статинов и нарушений липидного обмена на возникновение и развитие болезни Паркинсона.
3. Перспективным направлением в изучении этиологии и патогенеза болезни Паркинсона является дальнейшая оценка роли грибковой микрофлоры.
4. Углубленное изучение такого рода взаимоотношений позволит определить новые биомаркеры и лекарственные мишени для разработки модифицирующих болезнь методов терапии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Scigliano G., Ronchetti G., Girotti F. Autonomic nervous system and risk factors for vascular disease. Effects of autonomic unbalance in schizophrenia and Parkinson's disease. Neurol. Sci. 2008 Feb. Vol. 29(1). P. 15-21. doi: 10.1007/s10072-008-0853-1. Epub 2008 Apr 1.
2. Scigliano G., Musicco M., Soliveri P., Piccolo I., Ronchetti G., Girotti F. Reduced risk factors for vascular disorders in Parkinson disease patients: a case-control study. Stroke. 2006 May. Vol. 37(5). P. 1184-8. Epub 2006 Mar 30.
3. Scigliano G., Ronchetti G., Girotti F., Musicco M. Sympathetic modulation by levodopa reduces vascular risk factors in Parkinson di-sease. Parkinsonism Relat. Disord. 2009 Feb. Vol. 15(2). P. 138-43. doi: 10.1016/j.parkreldis.2008.04.036. Epub 2008 Jun 16.
4. Korten A., Lodder J., Vreeling F., Boreas A., van Raak L. et al. Stroke and idiopathic Parkinson’s disease: Does a shortage of dopamine offer protection against stroke? Mov. Disord. 2001. Vol. 16. P. 119-123.
5. Struck L.K., Rodnitzky R.L., Dobson J.K. Stroke and its modification in Parkinson’s disease. Stroke. 1990. Vol. 21. P. 1395-1399.
6. Huang Y.-P., Chen L.-S., Yen M.-F., Fann C.-Y., Chiu Y.-H., Chen H.-H. et al. Parkinson’s Disease Is Related to an Increased Risk of Ischemic Stroke — A Population-Based Propensity Score-Matched Follow-Up Study. PLoS One. 2013. Vol. 8(9). e68314. https://doi.org/10.1371/journal.pone.0068314.
7. Cereda E., Barichella M., Cassani E., Caccialanza R., Pezzoli G. Clinical features of Parkinson disease when onset of diabetes came first. Neurology. 2012. Vol. 78. P. 1507-1511.
8. Schernhammer E., Hansen J., Rugbjerg K., Wermuth L., Ritz B. Diabetes and the Risk of Developing Parkinson’s Disease in Denmark. Diabetes Care. 2011. Vol. 34. P. 1102-1108.
9. Sun Y., Chang Y.H., Chen H.F., Su Y.H., Su H.F. et al. Risk of Parkinson Disease Onset in Patients With Diabetes. Diabetes Care. 2012. Vol. 35. P. 1047-1049.
10. Cereda E., Barichella M., Pedrolli C., Klersy C., Cassani E. et al. Diabetes and Risk of Parkinson’s Disease. Diabetes Care. 2011. Vol. 34. P. 2614-2623.
11. Qiu C., Hu G., Kivipelto M., Laatikainen T., Antikainen R. et al. Association of Blood Pressure and Hypertension With the Risk of Parkinson Disease. Hypertension 2011. Vol. 57. P. 1094-1100.
12. Rönnemaa T. Intensive glycemic control and macrovascular disease in type 2 diabetes: a report on the 44th Annual EASD Meeting, Rome, Italy, September 2008. Rev. Diabet. Stud. 2008. Vol. 5. P. 180-183. pmid: 19099091.
13. Jones J.D., Tanner J.J., Okun M., Price C.C., Bowers D. Are Parkinson’s Patients More Vulnerable to the Effects of Cardiovascular Risk: A Neuroimaging and Neuropsychological Study. J. Int. Neuropsychol. Soc. 2017 Apr. Vol. 23(4). P. 322-331. doi: 10.1017/S1355617717000017. Epub 2017 Feb 6.
14. Huang X., Alonso A., Guo X., Umbach D.M., Lichtenstein M.L., Ballantyne C.M., Mailman R.B., Mosley T.H., Chen H. Statins, plasma cholesterol, and risk of Parkinson’s disease: a prospective study. Mov. Disord. 2015 Apr. Vol. 30(4). P. 552-9. doi: 10.1002/mds.26152. Epub 2015 Jan 14.
15. Liu G., Sterling N.W., Kong L., Lewis M.M., Mailman R.B., Chen H., Leslie D., Huang X. Statins may facilitate Parkinson’s di-sease: Insight gained from a large, national claims database. Mov. Di–sord. 2017 Jun. Vol. 32(6). P. 913-917. doi: 10.1002/mds.27006. Epub 2017 Apr 3.
16. Bykov K., Yoshida K., Weisskopf M.G., Gagne J.J. Confoun–ding of the association between statins and Parkinson disease: systematic review and meta-analysis. Pharmacoepidemiol. Drug Saf. 2017 Mar. Vol. 26(3). P. 294-300. doi: 10.1002/pds.4079. Epub 2016 Aug 16.
17. Gudala K., Bansal D., Muthyala H. Role of serum cholesterol in Parkinson’s disease: a meta-analysis of evidence. J. Parkinsons Dis. 2013 Jan 1. Vol. 3(3). P. 363-70. doi: 10.3233/JPD-130196.
18. Xicoy H., Wieringa B., Martens G.J.M. The Role of Lipids in Parkinson’s Disease. Cells. 2019 Jan 7. Vol. 8(1). pii: E27. doi: 10.3390/cells8010027.
19. Seyfried T.N., Choi H., Chevalier A., Hogan D., Akgoc Z., Schneider J.S. Sex-Related Abnormalities in Substantia Nigra Lipids in Parkinson’s Disease. ASN Neuro. 2018. Vol. 10. doi: 10.1177/1759091418781889.
20. Kurup R.K., Kurup P.A. Hypothalamic digoxin-mediated model for Parkinson’s disease. Int. J. Neurosci. 2003. Vol. 113. P. 515-536. doi: 10.1080/00207450390162263.
21. Broxmeyer L. Parkinson’s: another look. Med. Hypotheses. 2002. Vol. 59(4). P. 373-377.
22. Ухолкина Г.Б. Статины — прошлое, настоящее, будущее. Ліки України. 2013. № 4. С. 45-50.
23. Campbell C.D., Vederas J.C. Biosynthesis of lovastatin and related metabolites formed by fungal iterative PKS enzymes. Biopolymers. 2010. Vol. 93. P. 755-763. doi:10.1002/bip.21428.
24. Guihong Yu, Shuai Wang, Lu Wang, Qian Che, Tianjiao Zhu, Guojian Zhang, Qianqun Gu, Peng Guo, and Dehai Li. Lipid-Lowering Polyketides from the Fungus Penicillium Steckii HDN13-279. Mar. Drugs. 2018. Vol. 16. P. 25. doi: 10.3390/md16010025.
25. Joong-Seok Kim, Hye-Young Sung. Gastrointestinal Autonomic Dysfunction in Patients with Parkinson’s Disease. JMD. 2015. Vol. 8(2). P. 76-82.
26. Ferrer I., Martinez A., Blanco R., Dalfó E., Carmona M. Neuropathology of sporadic Parkinson disease before the appearance of parkinsonism: preclinical Parkinson disease. J. Neural. Transm. 2011. Vol. 118. P. 821-839.
27. Gasbarrini A., Lauritano E.C., Gabrielli M., Scarpellini E., Lupascu A., Ojetti V. et al. Small intestinal bacterial overgrowth: diagnosis and treatment. Dig. Dis. 2007. Vol. 25. P. 237-240.
28. Gabrielli M., Bonazzi P., Scarpellini E., Bendia E., Lauritano E.C., Fasano A. et al. Prevalence of small intestinal bacterial overgrowth in Parkinson’s disease. Mov. Disord. 2011. Vol. 26. P. 889892.
29. Fasano A., Bove F., Gabrielli M., Petracca M., Zocco M.A., Ragazzoni E. et al. The role of small intestinal bacterial overgrowth in Parkinson’s disease. Mov. Disord. 2013. Vol. 28. P. 1241-1249.
30. Dobbs R.J., Charlett A., Dobbs S.M., Weller C., Ibrahim M.A., Iguodala O. et al. Leukocyte-subset counts in idiopathic parkinsonism provide clues to a pathogenic pathway involving small intestinal bacterial overgrowth. A surveillance study. Gut. Pathog. 2012. Vol. 4. P. 12.
31. Dobbs S.M., Charlett A., Dobbs R.J., Weller C., Iguodala O., Smee C. et al. Antimicrobial surveillance in idiopathic parkinsonism: indication-specific improvement in hypokinesia following Helicobacter pylori eradication and non-specific effect of antimicrobials for other indications in worsening rigidity. Helicobacter. 2013. Vol. 18. P. 187-196.

/40-1.jpg)