Газета «Новости медицины и фармации» №12 (700), 2019
Вернуться к номеру
Інфекція Helicobacter pylori: сучасний погляд на фактори вірулентності та патогенності
Авторы: Сорокман Т.В., Попелюк Н.О., Колєснік Д.І.
Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Гелікобактеріоз належить до повільних інфекцій, і тільки у 20 % інфікованих осіб розвивається конкретна нозологічна форма хвороби. Ця інфекція є однією з найбільш поширених. Від 30 до 50 % населення земної кулі є носіями Helicobacter pylori (H. pylori) [1]. Це стало вагомою причиною детального вивчення даних мікроорганізмів. Відомо, що не у всіх носіїв діагностують гастродуоденіт чи виразкову хворобу, а саме, за даними літератури, у хворих на гастродуоденіт Н. pylori виявляється в 60–80 випадках, а на виразкову хворобу — у 98–100 [2].
H. pylori — грамнегативна спіралеподібна бактерія, виявлена в епітелії шлунка людини. З моменту свого першого опису Маршаллом і Уорреном (1984) цей вид отримав значну увагу дослідників через його клініко–еволюційне значення [3].
! Мета роботи: провести аналіз інформації, що викладена в джерелах літератури, щодо факторів вірулентності та патогенності Helicobacter pylori.
Бактерія насамперед передається в сім’ях і набувається в дитинстві. За відсутності адекватного лікування шлункова колонізація протягом життя може призвести до низки захворювань, таких як хронічний гастрит, виразкова хвороба шлунка і рак шлунка [4, 5]. Зв’язок між раком шлунка, одним з найбільш поширених злоякісних новоутворень, та інфек–цією H. pylori викликає великий інтерес у всьому світі [6]. Міжнародна агенція з дослідження раку (IARC) класифікує H. pylori як «групу 1 (певний канцероген)» [7].
H. pylori і людина спільно розвивалися принаймні 100 000 років. Упродовж цього часу бактерія розробила широкий спектр стратегій для адаптації до мінливих умов [8] і стала однією з найбільш різноманітних бактеріальних видів і, можливо, найбільш успішним людським патогеном, відомим на сьогодні [9]. Однак, незважаючи на їх високу генетичну різноманітність, штами H. pylori є генетично структурованими та демонструють філогеографічні закономірності [10]. Популяційна генетика та філогенетичні відносини між ізолятами дозволили точно відобразити локальні та глобальні демографічні історії людської еволюції [11]. Генетика H. pylori обіцяє пролити світло на поки що невідому динаміку людської еволюції.
H. pylori забруднює навколишнє середовище перорально–оральним або орально–фекальним шляхами, вона може вижити у вигляді кокової форми або в біоплівці [12]. Життєздатність некультивованих кокових форм H. pylori й утворення біоплівки тривало дискутувалися [13]. Однак електронно–мікроскопічні дослідження показали, що H. pylori може існувати в трьох формах: життєздатна спіральна форма, життєздатна кокоподібна форма і нежиттєздатна дегенеративна кокоподібна форма [14]. Життєздатні спіральні і кокоподібні форми мають інтактні структури цитоплазми і клітинну мембрану, що характерне для грамнегативних бактерій. Нежиттєздатні кокоподібні форми мають дегенеративні органели і дезінтегровану клітинну мембрану. Дослідження показали, що вміст білка залишається незмінним під час перетворення спіральної форми в кокоподібну форму H. pylori і бактерія залишається генетично незмінною, що, за словами авто–рів, підтверджує її життєздатність [15]. H. pylori може виживати як культивована форма в дистильованій воді і фізіологічному розчині протягом 14 днів і в штучній морській воді протягом 7 днів [16].
H. pylori реалізує свою патогенність шляхом регуляції експресії різних генів тою мірою, якою це диктується реакцією макроорганізму. Мікро– і макроорганізм створюють тонко налагоджену систему рівноваги, в результаті порушення якої і формується конкретна хвороба з певними клінічними ознаками і прогнозом. Взаємодія H. pylori з клітинами–хазяїнами призводить до індукції запальних реакцій через вивільнення цитокіну/хемокіну, апоптозу або проліферації, що нарешті призводить до стійкої колонізації, тяжкого запалення і порушення епітеліальної бар’єрної функції [17]. Цей процес може сприяти транслокації факторів вірулентності H. pylori і медіаторів запалення в кровообіг і сприяти або інтенсифікувати розвиток системної запальної відповіді і можливих клінічних ефектів інфекцій H. pylori поза шлунком [18].
Н. pylori має досить широкий набір чинників патогенності, які умовно можна розподілити на фактори колонізації (рухливість, адгезини, уреаза), фактори персистенції (ферменти, продукти метаболізму, ліпополісахариди, кокові форми) і фактори, що викликають захворювання (прозапальні фактори, фосфоліпази, ліпо–полісахариди, вакуолізуючий цитотоксин, цитотоксинасоційований антиген, перехресно реагуючі антигени) [19, 20].
H. pylori розробив механізм акліматизації до кислотного середовища шлунка шляхом регулювання уреазної активності. Уреазний генний кластер складається із семи генів, у тому числі каталітичних суб–одиниць (ureA/B), каналу із сечовиною, що містить кислоту (ure I), і допоміжних монтажних білків (ureE–H) [21]. Поперед–ні дослідження показали, що джгутики–опосередкована моторика є суттєвою для колонізації H. pylori слизової шлунка [22], і джгутики можна вважати фактором вірулентності. Джгутики H. pylori в основному складаються з базального тіла, гачка та джгутикової нитки. Джгутикова нитка складається з двох флагелінів (flaA і flaB), кодованих flaA і flaB [23]. Гачок складається з flaE, і він пов’язує базальне тіло і джгутикові нитки [24]. Для повної моторики H. pylori flaA і flaB є необхідними. Отже, flaA можна використовувати як неінвазивний маркер наявності H. pylori–інфекції. Титр анти–flaA антитіл зростає зі збільшенням щільності колонізації H. pylori. Понад 40 білків беруть участь у біосинтезі джгутиків.
Гени розподілені на три класи: сигма–фактор s80 (RpoD, що регулює гени класу 1), сигма–фактор s54 (RpoN, що регулює гени класу 2) і s28 (FliA, що регулює гени класу 3). Нещодавно було показано, що CsrA, зв’язуючий РНК білок, конт–ролює H. pylori шляхом регуляції експресії RpoN і формування джгутиків [25].
Штами H. pylori мають різні гени, що кодують фактори вірулентності, важливі для розвитку захворювання [26–28], які або секретуються, або пов’язані з мем–браною, або переносяться в цитозоль клітин–хазяїнів через систему секреції IV типу, де вони можуть впливати на функції клітини хазяїна. Добре вивчені адгезини, зокрема антигензв’язуючий білок A (BabA) і зв’язуючий сіалову кислоту адге–зин (SabA) [29–32]. Існує кілька інших відомих адгезинів у H. pylori для адаптації до різних тканин, включаючи нейтрофілактивуючий білок (NAP) [33], білок теплового шоку 60 (Hsp60) [34], асоційовані білки (AlpA і AlpB) [35], мембранний білок (HopZ) [36] і lacdiNAc–зв’язуючий адгезин (LabA) [37].
Понад 30 генів містять «острів патогенності» (cagPAI), виявлений у 60 % штамів H. pylori. Кодовані ним білки функціонують як система секреції бактеріальних факторів, які уражають слизову оболонку хазяїна [38]. На підставі проведених досліджень можна припустити, що гени «острова патогенності» визначають й особливості колонізації слизової оболонки, і особливості клінічних проявів захворювання.
Цитотоксин CagA — це фенотиповий маркер вірулентності бактеріального штаму. Інфікування таким штамом призводить до більш тяжкого перебігу захворювання з вираженими клінічними проявами виразкової хвороби, атрофічного запалення слизової оболонки шлунка, карциноми шлунка. У дітей також виявлено зв’язок між інфікуванням штамом CagA і виразкою дванадцятипалої кишки [39]. Установлене патогенетичне значення цитотоксину CagA: він індукує запальний процес, стимулюючи клітини епітелію хазяїна до продукції IL–8 та інших цитокінів.
H. pylori CagA є високоімуногенним білком, що може викликати запальні реакції в тканинах шлунка хазяїна і може впливати на морфологію, полярність і проліферацію клітин; CagA також модулює активність імунних клітин і підвищує ризик виникнення тяжких наслідків, таких як виразка шлунка і рак [40]. Завдяки лізису бактеріальних клітин CagA та інші фактори вірулентності H. pylori також можуть доставлятися до слизової оболонки шлунка в розчинній формі і впливати на клітини імунітету хазяїна. Крім того, H. pylori безперервно продукує фосфоліпідні везикули, які можуть поширюватися циркуляцією і функціонувати як вторинне екстрагастритичне джерело CagA та інших факторів вірулентності. Розпізнавання CagA через слизову оболонку пов’язане зі стимуляцією епітеліальних клітин, які продукують підвищені рівні різних цитокінів, включаючи IL–1b, IL–6 і IL–8, що супроводжується посиленою інфільтрацією активованих нейтрофілів і тяжким запаленням слизової [41].
Крім того, були досліджені флагеліни й, особливо, ліпополісахариди (ЛПС), щоб визначити їх роль у патогенезі H. pylori через активацію експресії NF–kB і хемокінів [42]. Попередні дослідження показали, що ЛПС H. pylori мають імуномодулюючі властивості, а саме знижують ефективність фагоцитозу, цитотоксичну активність і розширення NK–клітин і Т–лімфоцитів.
Автоантитіла, індуковані H. pylori, можуть відігравати важливу роль у H. pylori–асоційованій запальній реакції і викликати шкідливі ефекти. Ці антитіла можуть бути стимульовані різними антигенами Lewis (Le) (Lex, Ley і Lex/y), які наявні в ЛПС–структурі багатьох ізолятів H. pylori [43] і на людських клітинах, включаючи поліморфноядерні лейкоцити, епіте–ліальні клітини шлунка й ендотеліальні клітини. Інші антигени груп крові, включаючи H тип 1, Lea, Leb, нефукозильований полілактозо–амін (i–антиген), сіаліл Lex, і група крові A, але не тип 2, були виявлені в різних ізолятах H. pylori. Крім того, були описані штами, що містять два або три антигени групи крові в їх ЛПС [44]. Варіація фази ЛПС H. pylori, що визначається як випадкова оборотна зміна фенотипу в діапазоні детермінант групи крові, була описана як для референтних, так і для клінічних штамів. Під час інфекції H. pylori різні екологічні чинники, включаючи кислотність шлункового соку, можуть сприяти відбору бактерій із кращим фенотипом за вірулентністю. У моделі «макак–резус — інфекція H. pylori» було показано, що фенотип слизової оболонки шлунка в організмі–хазяїні Ley обирає фенотип Ley–позитивного H. pylori, а фенотип шлунка хазяїна Lex — Lex–позитивної бактерії [45]. Описані також варіації фази від Lex до i–Ag і назад до Lex, від Lex до Lex плюс Ley і від Lex до Ley і формування Lea [46, 47]. Молекулярний механізм зміни фази ЛПС H. pylori залежить від мутацій у генах, що кодують a3–фукозилотрансферази, активності цих білків і їх переваги до вуглеводних залишків, що визначають антигенну специфічність [48].
Експерименти, проведені з використанням моноклональних анти–Le–антитіл, індукованих імунізацією мишей H. pylori, показали, що ці антитіла реагували як із мишачою, так і з людською слизовою шлунка, фовеолярними і залозистими епітеліальними клітинами і парієтальними клітинними каналами. Показано, що моноклональні анти–Lex–антитіла, викликані H. pylori, реагують із поліморфноядерними лейкоцитами, муцином шлунка і H+/K+ –АТФазами [49]. Одним із можливих механізмів, що лежать в основі даного ефекту, є диверсифікація H. pylori в організмі людини через зміну фази ЛПС, зумовлену гетерологічною експресією гена альфа–1,3–фукозилтрансферази. Було висунуто гіпо–тезу, що анти–Le–антитіла, ініційовані H. pylori, якщо вони пов’язані з епітелієм шлунка, можуть викликати комплементзалежний лізис клітин, що сприяє надмірній запальній реакції.
VacA — це екзотоксин, названий за його здатність індукувати вакуолізацію клітин–хазяїнів [50]. VacA описаний як мультирецепторний білок, що має плейотропні ефекти, включаючи деполяризацію мембран, мітохондріальну дисфункцію, автофагію, активацію міто–генактивованих протеїнкіназ, інгібування функції Т–клітин й індукцію апоптозу. Ці функції сприяють стійкій колонізації H. pylori. Описано передбачувану структуру стовбурової петлі в 5–нетрансльованій ділянці, що впливає на транскрипцію vacA і призводить до більш високої експресії і токсичності VacA. Екстратравне місце розташування функціональної VacA в легенях призвело до припущення, що VacA відіграє роль у патогенезі респіраторних захворювань шляхом індукування IL–8 і IL–6. Yahiro et al. [52] описали новий сигнальний шлях для VacA–індукованого апоптозу, який опосередкований цитоплазматичним накопиченням конексину–43 (Cx43), члена родини конексинів, який відіграє роль у розриві і формуванні клітинно–клітинних каналів. Крім того, Chang et al. [53] описали роль кортактину, актинзв’язуючого білка, в регуляції апоптозу, індукованого VacA.
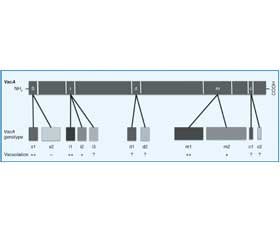
VacA включає N–кінцевий домен 33 кДа, пов’язаний із цитотоксичністю, і C–кінцевий домен 55 кДа, що беруть участь у зв’язуванні бактерії з рецепторами клітинної поверхні. Майже всі штами H. pylori мають ген VacA, однак алельні поліморфізми білка показують клінічне значення і токсичну активність, які пов’язані зі специфічною комбінацією трьох регіонів: сигнального пептиду (варіанти s1 і s2), проміжного регіону (варіанти i1, i2, i3) і середнього регіону (варіанти m1 і m2). Молекулярні епідеміологічні дослідження виявили два нові поліморфні регіони, делеції (варіанти d1 і d2) та c–ділянки (варіанти c1 та c2), розташовані в 3–кінцевій ділянці VacA (рис. 1) [54].
Вони тісно пов’язані з вакуолізуючою активністю H. pylori. Різні типи цих ділянок пов’язані з відмінностями вакуолізації, специфічності та клінічного результату. Тип s1, m1, i1 був класифікований як повністю активний VacA і пов’язаний із більш високим ризиком розвитку раку шлунка, ніж s2, m2 або i2. На відміну від типу s1, s2 форми VacA не мають виявленої вакуолізуючої активності в більшості аналізів in vitro. Порівняно з типами m1/i1 типи m2/i2 значно менш активні і практично нетоксичні. Функція i3 залишається невизначеною. D–ділянка вважається пов’язаною зі зв’язуванням VacA з клітинами шлунка хазяїна і вакуолізуючою активністю, однак переконливих доказів на підтримку цього все ще бракує. Функція c–регіону залишається загадкою. Генотипи s1 і m1 далі класифікували на три підтипи: s1a, s1b, s1c і m1a, m1b, m1c відповідно.
Для генотипу s1/m1 експресія VacA є високоактивною і може пошкодити клітини більш гостро. Було показано, що штами VacA s1 і m1 H. pylori пов’язані з високою активністю запалення слизової оболонки шлунка і підвищеним ризиком розвитку атрофії шлунка і карциноми порівняно з менш вірулентними штамами VacA s2 і m2 [55]. Крім того, генотип VacA і1 сильно пов’язаний з VacA s1, VacA m1 і CagA–позитивними генотипами, тоді як генотипи VacA i2 тісно пов’язані з VacA s2, VacA m2 і CagA–негативними генотипами. Попереднє дослідження показало, що в пацієнтів із раком шлунка субтипи VacA s1a і s1c менш поширені, тоді як вони більш поширені в пацієнтів із виразковою хворобою і хронічним гастритом [55].
Висловлюється думка, що інфекція H. pylori може викликати формування авто–фагосом і ці автофагічні везикули пристосовані для розмноження H. pylori в хазяїна [56]. Однак цей факт внутрішньо–клітинного розмноження H. pylori ще недостатньо вивчений.
Отже, постійна, складна взаємодія між патогеном й імунітетом хазяїна може сприяти порушенню імунітету і подальшому розвитку автоімунітету в сприйнятливих пацієнтів. З огляду на це висловлюється гіпотеза про те, що H. pylori, що має антигени, подібні за структурою клітинам, тканинам і деяким гуморальним сполукам людини, які відіграють важливу структурну та фізіологічну роль завдяки індукції гуморальних і можливих клітинних імунних реакцій, може стимулювати руйнування тканин і розвиток патологічної запальної відповіді. Хронічний вплив на специфічні клітини пам’яті забезпечує їх стійку стимуляцію і перетворення у ефекторні лімфоцити, які можуть брати участь в автоімуноопосередкованому руйнуванні тканин. Необхідні подальші дослідження і глибший аналіз, щоб продемонструвати автоімунний потенціал специфічних антигенів H. pylori.
Висновок
До сьогодні біологічна функція і структура факторів вірулентності та патогенності, а також відкриття нових кандидатів в цьому напрямку є надзвичайно актуальною проблемою, що продовжує розвиватися. Виправданим є подальше вивчення імунологічної відповіді на інфекційні агенти, включаючи H. pylori, та їх ролі в патогенезі автоімунних захворювань.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список літератури знаходиться в редакції

/m/4-1.jpg)