Газета «Новости медицины и фармации» №12 (667), 2018
Вернуться к номеру
Обзор рекомендаций AHA/ACC/HRS по ведению пациентов с желудочковой аритмией и профилактике внезапной сердечной смерти — 2017. Часть 1
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
1.5. Аббревиатуры
АД — артериальное давление
АКШ — аортокоронарное шунтирование
ВСО — внезапная остановка сердца
ВСС — внезапная сердечная смерть
ГКМП — гипертрофическая кардиомиопатия
ЖА — желудочковая аритмия
ЖТ — желудочковая тахикардия
ИБС — ишемическая болезнь сердца
ИКД — имплантированный кардиовертер–дефибриллятор
ИМ — инфаркт миокарда
КТ — компьютерная томография
ЛЖ — левый желудочек
ЛЖТ — левожелудочковая тахикардия
МРТ — магнитно–резонансная томография
НЖТ — неустойчивая желудочковая тахикардия
ОИМ — острый инфаркт миокарда
ОКС — острый коронарный синдром
ПЖК — преждевременный желудочковый комплекс
ПЧКВ — первичное чрескожное коронарное вмешательство
ПЭТ — позитронно–эмиссионная томография
РКИ — рандомизированное контролируемое исследование
СЛР — сердечно–легочная реанимация
СН — сердечная недостаточность
СРТ — сердечная ресинхронизирующая терапия
ФЖ — фибрилляция желудочков
ФВ — фракция выброса
ФВ ЛЖ — фракция выброса левого желудочка
ЭКГ — электрокардиограмма
ЭхоКГ — эхокардиография
2. Эпидемиология
2.1. Общие понятия
Желудочковая аритмия (ЖА) включает в себя патологию в диапазоне от преждевременного желудочкового комплекса (ПЖК) до фибрилляции желудочков (ФЖ) и клинически проявляется по–разному — от полного отсутствия симптомов до остановки сердца. Наиболее опасные для жизни ЖА ассоциируются с ишемической болезнью сердца (ИБС), особенно у пациентов старшего возраста [1]. Риски ЖА и внезапной сердечной смерти (ВСС) варьируются в каждой конкретной популяции с разными заболеваниями сердца, а также с конкретным семейным анамнезом и генетическими вариантами, и эти вариации имеют важное значение для изучения методов лечения и их применения.
2.1.1. Преждевременные желудочковые комплексы и неустойчивая ЖТ
ПЖК являются распространенным явлением, и их частота увеличивается с возрастом. Хотя на ЭКГ в 12 отведениях среди здоровых военных ПЖК были выявлены только у 0,6 % лиц младше 20 лет и 2,7 % — старше 50 лет [5], долгосрочный мониторинг продемонстрировал, что ПЖК наблюдаются у 50 % всех людей с сердечной недостаточностью или без нее [6]. Наличие ПЖК в течение 2 минут мониторинга пациентов среднего возраста в исследовании ARIC (Atherosclerosis Risk In Communities — «Риск атеросклероза в сообществах») ассоциировалось с повышенным риском ишемических событий и смертности от сердечно-сосудистых заболеваний с преобладанием ишемической болезни сердца или без него [7, 8]. В общей популяции частые ПЖК, которые определяются как наличие по меньшей мере 1 ПЖК на ЭКГ в 12 отведениях или более 30 ПЖК в час, ассоциируются с повышенным риском сердечно-сосудистых заболеваний и повышенной смертностью [9]. В исследовании, проведенном в Тайване, у пациентов без устойчивой ЖT или структурной болезни сердца, которым проводили 24-часовой мониторинг по Холтеру для клинической оценки, мультифокальные ПЖК ассоциировались с повышенным риском смерти и нефатальными сердечно-сосудистыми неблагоприятными исходами [10]. В той же популяции неустойчивая желудочковая тахикардия (НЖТ) независимо ассоциировалась с повышенным риском смерти и другими сердечно-сосудистыми неблагоприятными исходами, включая инсульт [11]. В популяции ARIC также наблюдалась ассоциация ПЖК с повышенным риском развития инсульта [8].
Поскольку в некоторых исследованиях показана связь ПЖК с неблагоприятными исходами, обнаружение ПЖК, особенно если они являются многофокальными и частыми, как правило, считается фактором риска развития неблагоприятных сердечно-сосудистых исходов. Таких пациентов обычно обследуют, чтобы убедиться, что у них нет сопутствующих заболеваний (например, ишемической болезни сердца, дисфункции левого желудочка (ЛЖ)), которые требуют дальнейшего лечения для снижения риска. ПЖК и НЖТ у пациентов с сердечно-сосудистыми заболеваниями являются распространенными, и ассоциируются с неблагоприятными исходами [12, 13]. В CAST (исследования подавления сердечной аритмии) при лечении пациентов, перенесших инфаркт миокарда (ИМ), прием антиаритмических препаратов (например, флекаинид, энцаинид, морицизин) увеличивал риск смерти, несмотря на подавление ЖА [14, 15]. Не было продемонстрировано, что при лечении ПЖК антиаритмическими препаратами снижается смертность, а в популяции пациентов, перенесших ИМ, при лечении препаратами, блокирующими натриевые каналы класса I (например, хинидин, флекаинид), повышается риск смерти [15, 16]. Аналогично у пациентов со сниженной фракцией выброса (ФВ) ЛЖ класса I препараты, блокирующие натриевые каналы и d-соталол, повышают риск смерти [16, 17]. Бета-блокаторы, блокаторы кальциевых каналов недигидропиридинов и некоторые антиаритмические препараты могут замедлить учащенное сердцебиение [18].
ПЖК, которые возникают во время теста с физической нагрузкой, ассоциируются с более высоким риском смерти [19]. В одном исследовании ПЖК, которые появились в период отдыха после физической нагрузки, были более сильным предиктором смерти, чем ПЖК, возникающие только при физической нагрузке [20]. Тем не менее ПЖК распространены у тренированных спортсменов, у которых отмечается учащенное сердцебиение и у которых в исследованиях с участием небольшого числа спортсменов не установлен повышенный риск смерти, по крайней мере у тех, у кого нет других сердечно-сосудистых нарушений [21, 22]. Сложные ПЖК у выносливых спортсменов могут быть недоброкачественными. Для оценки аритмогенного риска у пациентов может потребоваться проведение электрофизиологического исследования [22]. У некоторых пациентов очень частые ПЖК, от 10 000 до 20 000 в день, могут быть связаны со сниженной функцией ЛЖ, которая обратима при контроле ПЖК и проявляется как ПЖК-индуцированная кардиомиопатия [23, 24] (см. также раздел 8.5. «Кардиомиопатия, индуцированная ПЖК»). Очень редко у пациентов без структурной болезни сердца идиопатические ПЖК могут быть триггером злокачественной ЖА [25, 26].
2.1.2. ЖТ и ФЖ при ОКС
Приблизительно половина пациентов с внегоспитальной остановкой сердца, первые сердечные сокращения после которой идентифицировались как ФЖ и при которой пациент выживает до госпитализации, имеют признаки острого ИМ (ОИМ) [27]. При более чем 50 % всех внебольничных остановок сердца при острой коронарной ангиографии будут выявляться значительные поражения коронарной артерии [27]. У 5–10 % пациентов, госпитализированных с ОИМ, до поступления в стационар наблюдалась ФЖ или устойчивая ЖT, а еще у 5 % — ФЖ или устойчивая ЖT после прибытия в больницу, в большинстве случаев в течение 48 часов после госпитализации. В исследовании пациентов с ОКС без элевации сегмента ST, которым в течение 48 часов была выполнена катетеризация сердца, у 7,6 % установлена ЖТ/ФЖ, причем 60 % этих случаев развились в течение 48 часов после поступления в стационар [28]. Ускоренный идиовентрикулярный ритм является распространенным видом аритмии у пациентов с ОИМ, включая пациентов с ИМ с элевацией сегмента ST, перенесших первичное чрескожное коронарное вмешательство (ПЧКВ). Ускоренный идиовентрикулярный ритм более тесно связан со степенью инфаркта, чем с самой реперфузией [29].
Устойчивая ЖА, которая развивается при ОКС, чаще всего представляет собой не мономорфную ЖТ, а полиморфную ЖT или ФЖ. Факторы риска ЖT/ФЖ включают артериальную гипертензию, ИМ в анамнезе, изменения сегмента ST и хроническую обструктивную болезнь легких [30]. Общенациональное датское исследование продемонстрировало, что у 11,6 % пациентов с ИМ с элевацией сегмента ST, которым выполняли ПЧКВ, до этой процедуры отмечалась ФЖ, которая ассоциировалась с употреблением алкоголя, предынфарктной стенокардией, передним инфарктом и полной окклюзией коронарных артерий во время коронарной ангиографии [31].
В выбранной группе у 5,7 % пациентов, которым в клиническом исследовании выполнялось ПЧКВ, развивались устойчивая ЖТ или ФЖ, причем в двух третях случаев эти события происходили до окончания катетеризации и в 90 % — в течение 48 часов после процедуры. ЖT или ФЖ после ПЧКВ ассоциировались с более низким артериальным давлением, более высокой частотой сердечных сокращений, снижением коронарного кровотока в конце процедуры и неполным снижением элевации сегмента ST [32]. Важно отметить, что в отличие от некоторых ранее проведенных исследований ЖТ или ФЖ в любой момент ассоци-
ировались с существенно более высоким риском смерти в течение 90 дней. Поздние ЖТ или ФЖ (через 48 часов и более после госпитализации) были связаны с более высоким риском смерти, чем ранние ЖТ или ФЖ (в течение 48 часов после госпитализации) [33].
2.1.3. Устойчивая ЖT и ФЖ, не ассоциированные с ОКС
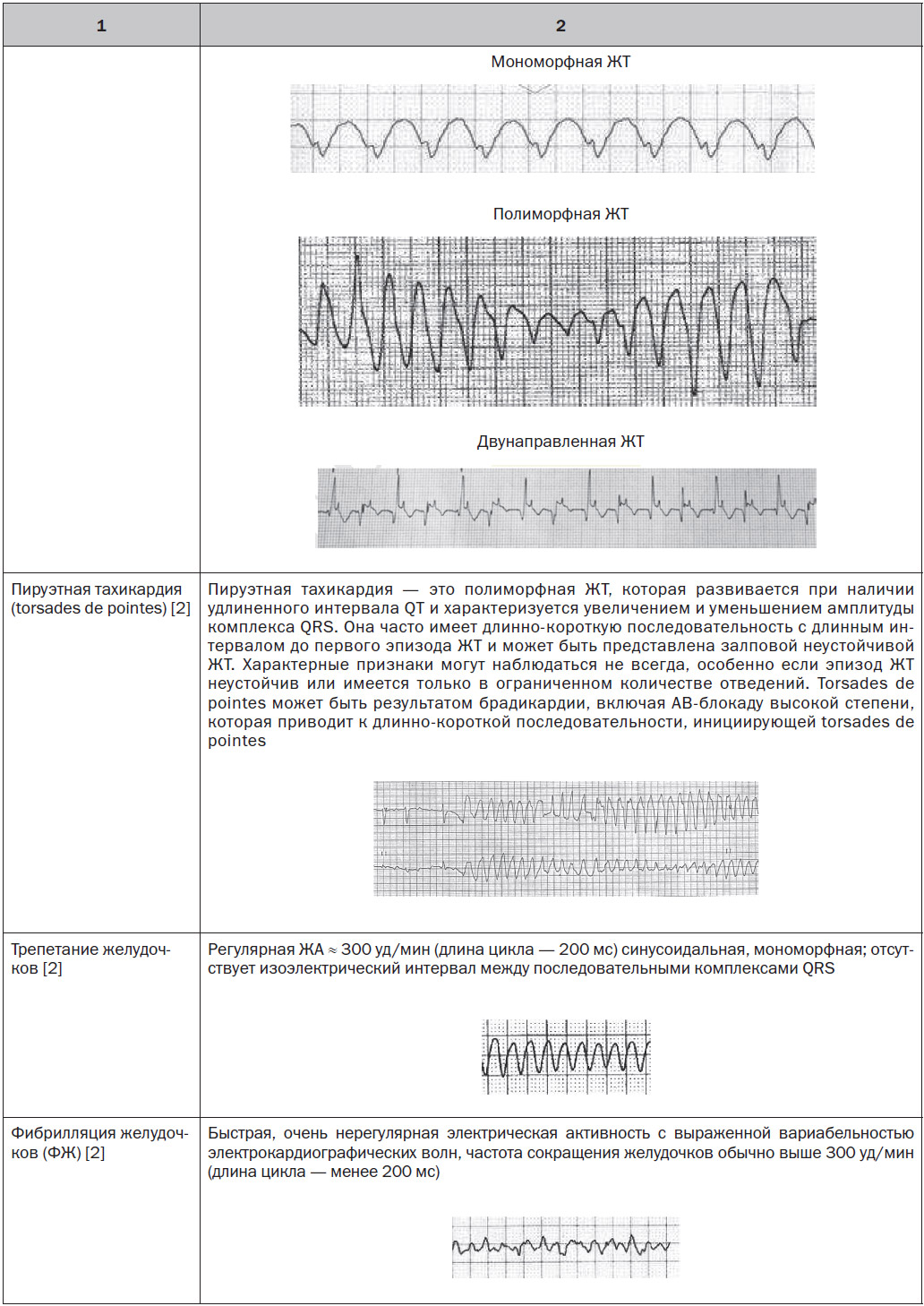
Пациенты со структурной патологией сердца имеют повышенный риск устойчивой ЖT и ФЖ. Устойчивая ЖТ, которая не связана с ОКС, часто мономорф-на, поскольку она обычно развивается по механизму reentry, но может трансформироваться в ФЖ [34]. Риск и предикторы ЖT у пациентов со структурной патологией сердца зависят от типа, тяжести и длительности течения структурной патологии, увеличиваясь при нарастании выраженности дисфункции желудочков и развитии СН. Мономорфную ЖT, развивающуюся при отсутствии структурной патологии сердца, обычно называют идиопатической ЖT, и она часто связана с наличием автоматического очага в характерном месте, что проявляется типичной картиной на ЭКГ. Полиморфные ЖТ и ФЖ при отсутствии структурной патологии сердца развиваются редко и могут ассоци-ироваться с сердечными каналопатиями [35, 36], медикаментозно индуцированным удлиненным интервалом QT [36] или могут быть идиопатическими [37, 38].
3. Механизмы ЖА
3.1. Клеточные механизмы и субстраты
Механизмы ЖA включают повышенную нормальную автоматичность, аномальную автоматичность, триггерную активность, вызванную ранней или поздней постдеполяризацией, и механизм reentry [1–3]. Для reentry необходим триггер для инициирования аритмии и субстрат для ее поддержания. Триггером может являться ПЖК, который может быть вызван патологической автоматичностью. Субстратом может быть структурное ремоделирование, вторичное по отношению к основному заболеванию, и часто это рубец после ИМ или хирургического вмешательства, или фиброз при кардиомиопатии или гипертрофии. Изменения функций ионного канала или транспортера и/или экспрессии и связывания клеток с клетками, вторичные по отношению к основному заболеванию, могут изменять инициирование или распространение кардиального потенциала действия. На электрофизиологический субстрат оказывает динамическое влияние целый ряд факторов, включая сердечный метаболизм, электролиты, сигнальные пути и вегетативные эффекты. Повышенная автоматичность или патологическая автоматичность, вызывающая ЖA, могут возникать из клеток-пейсмекеров в системе Гиса — Пуркинье или миокарда желудочков.
3.2. Автоматичность
Нормальная автоматичность является результатом спонтанной деполяризации фазы 4 потенциала транс-мембранного действия, возникающей из нормального потенциала покоя, достигая порога и инициируя потенциал действия [1, 3]. Инициирующий ток (If) отвечает за спонтанную деполяризацию фазы 4 в синусовом узле. Скорость определяется интеграцией максимального диастолического потенциала в конце реполяризации, крутизной деполяризации фазы 4 и пороговым потенциалом. Напротив, патологическая автоматичность возникает из-за частично деполяризованного мембранного потенциала, который обычно близок к потенциалу активации кальциевых каналов в клеточной мембране [1, 3]. В острой фазе ИМ или во время транзиторной ишемии повышенный уровень внеклеточного калия вызывает частичную деполяризацию мембраны, находящейся в потенциале покоя, создавая повреждающие токи между зоной инфаркта/ишемии и здоровым миокардом. Эти повреждающие токи могут инициировать спонтанную активность. При ишемии патологическая автоматичность может возникать как в миоцитах желудочков, так и в волокнах Пуркинье, а также может улучшаться нормальная автоматичность в волокнах Пуркинье в зоне ишемии.
3.3. Триггерная активность
Ранняя постдеполяризация происходит на поздней фазе 2 или на ранней фазе 3 потенциала действия [3–5], обычно при удлинении потенциала действия из-за увеличения внутренних токов (поздний ток натрия, внутренний кальциевый ток или натриево-кальциевый переменный ток) или уменьшения реполяризации калиевых токов. В этих условиях ранняя постдеполяризация может развиться, когда реактивация кальциевого канала L-типа происходит до того, как мембранный потенциал станет более отрицательным, чем требуется для реактивации кальциевого канала. Спонтанное выделение кальция из саркоплазматического ретикулума может также приводить к активации деполяризующего натриево-кальциевого тока. Ранняя постдеполяризация является триггером для пируэтной ЖТ, ассоциированной с удлиненным интервалом QT, обусловленным применением лекарственных препаратов или другими приобретенными факторами, или мутациями ионных каналов, вызывающими синдром удлиненного QT.
В этих случаях, возможно, ранняя постдеполяризация/триггерная активность является триггером, который обусловливает полиморфную ЖT/ФЖ.
Отсроченная постдеполяризация развивается после полной реполяризации мембраны и возникает в условиях внутриклеточной перегрузки кальцием. Факторы, способствующие повышению внутриклеточной нагрузки кальцием, включают тахикардию, катехоламины, гипокалиемию, интоксикацию дигоксином, гипертрофию сердца и СН [6, 7].
Повышенное содержание саркоплазматического кальция или повышенная чувствительность рианодинового рецептора могут инициировать спонтанное высвобождение кальция, которое активирует переходный внутренний ток, обусловленный преимущественно обменным натриево-кальциевым током. Если деполяризация мембраны достаточно велика, активируется ток натрия внутрь клетки, что приводит к триггеру потенциала действия. Отсроченные постдеполяризации являются основным механизмом ЖT при интоксикации дигоксином, катехоламинергической полиморф-ной ЖT и идиопатической ЖА. Отсроченные постдеполяризации также считаются важным триггером ЖA при СН. Клетки Пуркинье более восприимчивы к спонтанному высвобождению кальция из саркоплазматического ретикулума, чем миоциты желудочков, что указывает на то, что отсроченные постдеполяризации могут быть важным механизмом для некоторых ЖА, связанных с волокнами Пуркинье [3, 8, 9].
3.4. Механизм reentry
Reentry (повторный вход возбуждения) является основным механизмом развития большинства устойчивых ЖА при наличии структурной патологии сердца [1–3, 10–12]. Механизм reentry может возникать вокруг фиксированного анатомического препятствия, такого как рубец после ИМ или после хирургического вмешательства по поводу врожденного порока сердца. При этом волновой фронт возбуждения отделяется от участка рефрактерности. Существование структурных субстратов reentry дает обоснование для абляции ЖТ [11, 12].
Также может произойти функциональный повторный вход возбуждения вокруг областей функционального блока без анатомических препятствий. Предложены две основные модели функционального повторного входа возбуждения [2, 3]. Модель ведущего круга имеет функционально рефрактерную сердцевину и отсутствие «окна возбудимости». Спиральная волна reentry управляется ротором с изогнутым волновым фронтом и хвостом, вращающимся вокруг возбудимого, но невозбужденного ядра. Остается много споров о точном механизме (-ах) ФЖ (ротор против множественного reentry). Оба механизма могут возникать в разных фазах ФЖ [10].
Фаза 2 механизма reentry может развиваться из-за неоднородности реполяризации желудочков. Электротонические токи могут переходить из участков эндокарда с длительными потенциалами действия к эпикарду с более коротким потенциалом действия, и когда эти участки восстановятся от рефрактерности, может развиться их повторное возбуждение. Считается, что это является одним из потенциальных механизмов ЖТ/ФЖ при синдроме Бругада [3], который также может развиваться при ишемии.
4. Общая оценка состояния пациента с установленной ЖА или с подозрением на ЖА
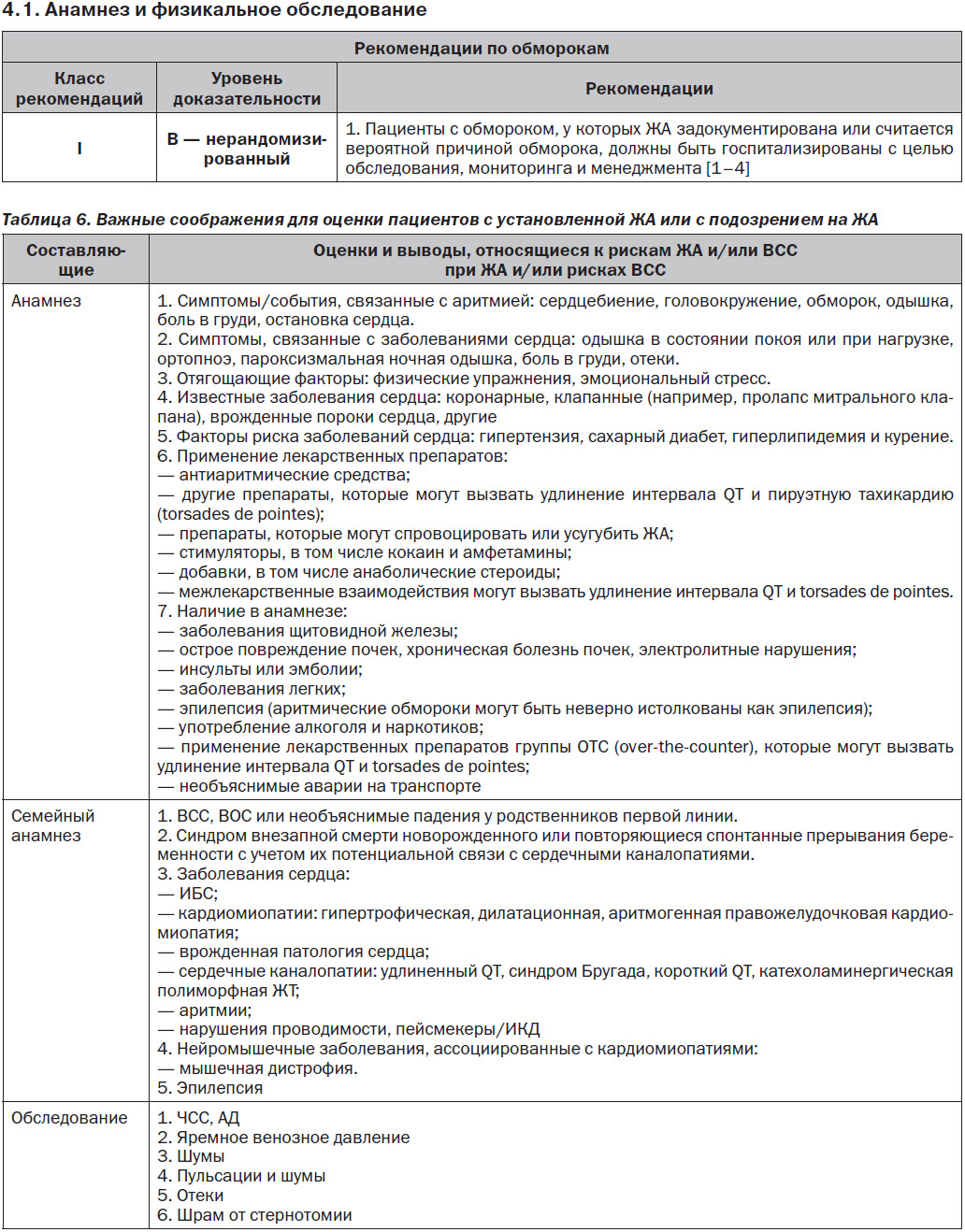
4.2. Неинвазивные методы оценки
4.3. Инвазивные методы обследования
5. Методы лечения и профилактики ЖА
5.1.1. Лекарственные средства с преимущественной блокадой натриевых каналов
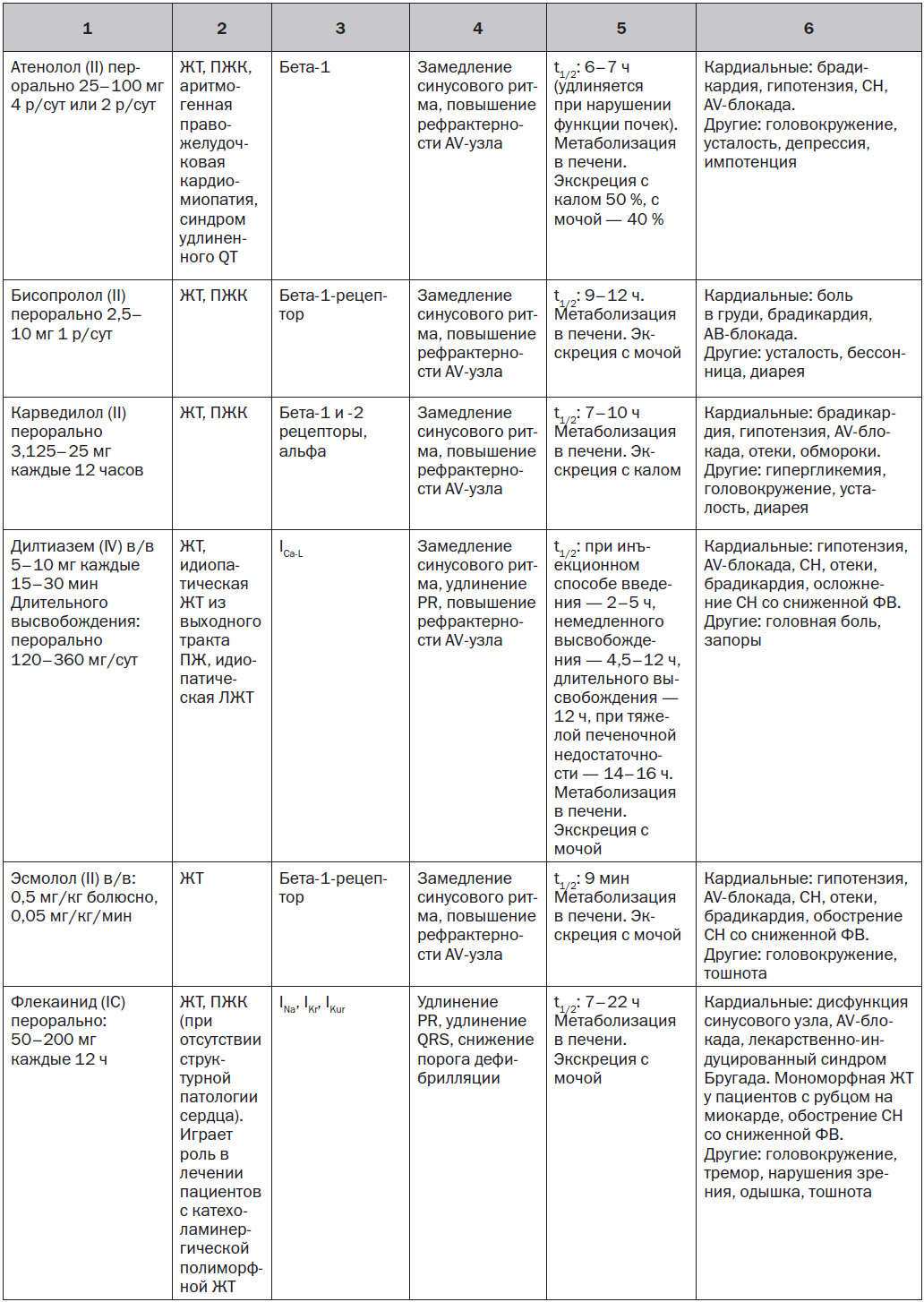
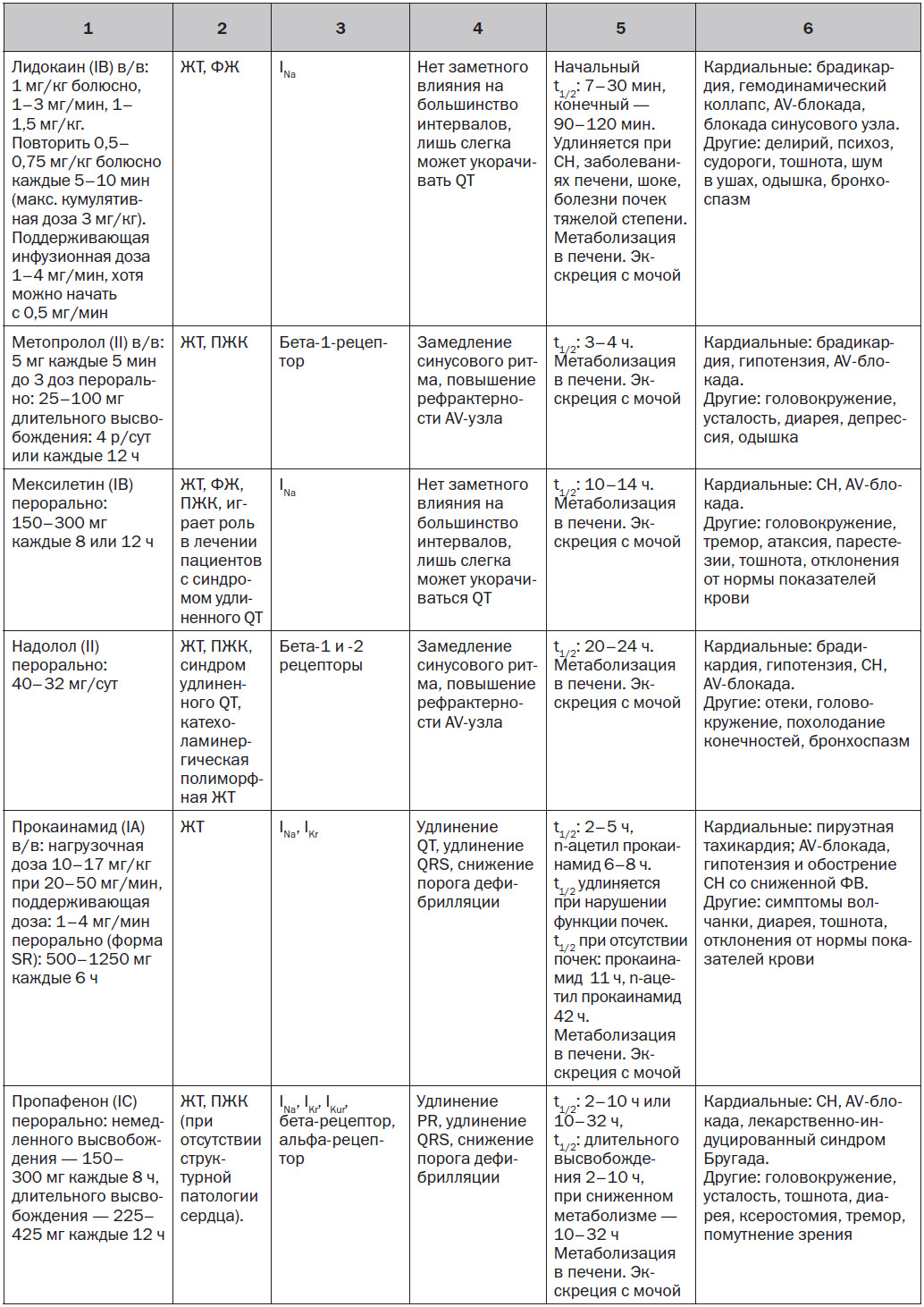
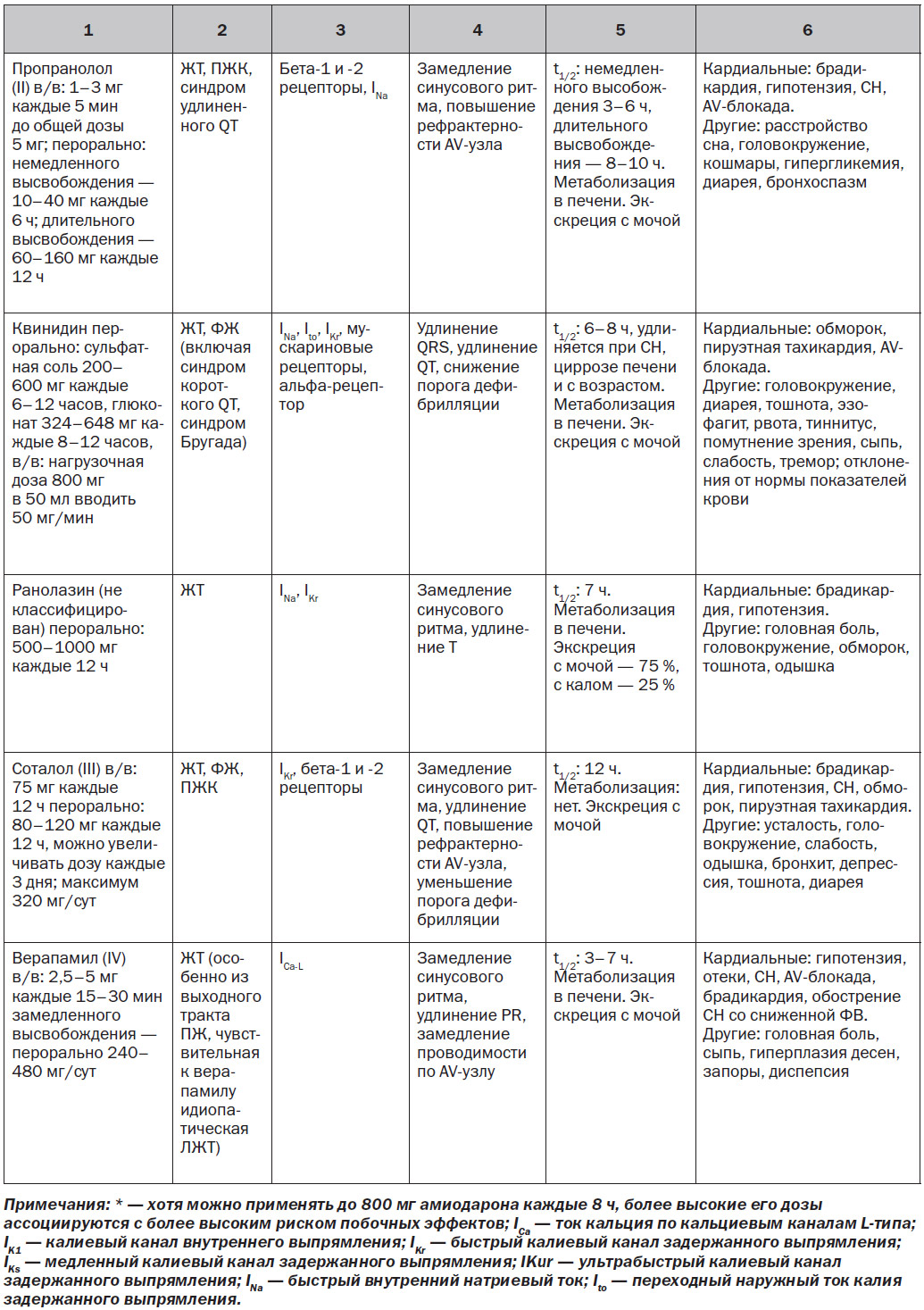
За исключением особых обстоятельств, блокаторы натриевых каналов (I класса по классификации Vaughn — Williams) играют ограниченную роль в профилактике ЖT/ВСС. Данное утверждение сделано на основании отсутствия влияния на выживаемость и увеличения смертности при хроническом применении этих препаратов у пациентов с ИБС (см. раздел 10.7). Особые обстоятельства, при которых блокаторы натриевых каналов использовались для лечения ЖT/ВСС, включают: в/в введение лидокаина пациентам с рефрактерной ЖT/остановкой сердца [3]; пероральное применение мексилетина при врожденном синдроме удлиненного QT [4]; хинидин у пациентов с синдромом Бругада; флекаинид у пациентов с катехоламинергической полиморфной желудочковой тахикардией [5]. Эти препараты могут также использоваться у пациентов с ИБС с лекарственной и рефрактерной к абляции ЖТ.
Одним из новых потенциально полезных лекарственных препаратов на основании очень ограниченного числа данных является ранолазин. Этот препарат, разработанный и одобренный FDA в качестве антиангинального средства, обеспечивает относительно специфическую позднюю блокаду натриевых каналов в дополнение к менее выраженной блокаде фазы 3 реполяризующего тока калия, то есть действует на быстрый калиевый канал задержанного выпрямления, IKr. Потенциал клинической антиаритмической эффективности подтверждается базовыми исследованиями и экспериментальными моделями [6]. Клинические данные скудны. В исследовании, проведенном у 12 пациентов, ранолазин снижал необходимость в использовании ИКД у 11 пациентов с резистентной к лекарственным средствам ЖT/ФЖ [7]. В MERLIN TIMI-36 (метаболическая эффективность ранолазина в уменьшении степени ишемии при остром коронарном синдроме без подъема сегмента ST — тромболизисе при инфаркте миокарда-36) ранолазин не уменьшал частоту ВСС, но уменьшал частоту ЖT в первые несколько дней после ОКС без подъема сегмента ST [8]. В 1 РКИ больные с высоким риском ИБС с ишемической или неишемической кардиомиопатией были случайным образом распределены на группы применения ранолазина 1000 мг два раза в сутки или плацебо [9]. Высокий риск определялся как: 1) первичная профилактика ВСС при отсутствии документированной ЖT/ФЖ в анамнезе и с наличием одного из следующих условий: азот мочевины в крови ≥ 26 мг/дл, QRS > 120 мс, фибрилляция предсердий, или неишемическая кардиомиопатия, или > 500 преждевременных сокращений желудочков при 24-часовом холтеровском мониторировании; 2) первичная профилактика ВСС при документированной ЖT/ФЖ, которую лечили с помощью ИКС, или нелеченой неишемической кардиомиопатии; или 3) вторичная профилактика ВСС после документированной ЖT/ФЖ или остановки сердца. Ранолазин достоверно не снижал первичную конечную точку ЖT/ФЖ, было необходимо адекватное применение ИКД, или наступала смерть. В предварительном вторичном анализе установлено, что ранолазин ассоциировался с достоверным сокращением эпизодов ЖT, которые лечились средствами, замедляющими сердечный ритм [9].
5.1.2. Бета-блокаторы
Бета-блокаторы часто являются антиаритмическими препаратами первой линии ввиду их превосходного профиля безопасности и эффективности лечения ЖА и снижения риска ВСС [10, 11]. Их антиаритмическая эффективность обусловлена блокадой адренергических рецепторов и влиянием на симпатически опосредованные триггерные механизмы, замедлением синусового ритма и, возможно, ингибированием избыточного выделения кальция рианодиновым рецептором [12].
Бета-блокаторы снижают смертность от всех причин и ВСС у пациентов с СН со сниженной ФВ [13–15]. Хотя уже давно доказано, что бета-блокаторы уменьшают смертность после ИМ [16], данные реестра подтверждают, что раннее применение бета-блокатора у пациентов с ИМ и факторами риска шока (> 70 лет, симптомы <12 ч (пациенты с ИМ с элевацией ST), систолическое артериальное давление < 120 мм рт.ст. и ЧСС > 110 уд/мин при поступлении) ассоциируется с повышенным риском шока или смерти [17]. Применение бета-блокаторов снижает смертность при развитии полиморфной ЖT после ИМ [18]. Бета-блокаторы подавляют ЖА у некоторых пациентов со структурно нормальным сердцем [19]. При использовании в сочетании с мембраностабилизирующими антиаритмическими препаратами бета-блокаторы могут усилить их антиаритмическую эффективность [20]. Бета-блокаторы (например, надолол, пропранолол) также являются препаратами первой линии терапии при некоторых сердечных каналопатиях (например, синдром удлиненного QT, катехоламинергическая полиморфная желудочковая тахикардия).
5.1.3. Амиодарон и соталол
Амиодарон характеризуется широким спектром действия, который включает блокаду бета-рецепторов и токов натрия, кальция и калия (т.е. он является мультиканальным блокатором). Его долгосрочное влияние на выживание является спорным, причем в большинстве исследований не продемонстрировано четкое преимущество амиодарона перед плацебо. В нескольких исследованиях и метаанализе нескольких крупных исследований было показано снижение ВСС при использовании амиодарона у пациентов с дисфункцией ЛЖ, обусловленной ИМ и неишемической кардиомиопатией [21–23], но в исследовании SCD-HeFT (исследование «ВСС при СН») не продемонстрированы преимущества амиодарона в отношении показателя выживаемости по сравнению с плацебо [24]. Вторичный анализ исследования SCD-HeFT показал повышенный риск смертности с амиодароном у пациентов с симптомами класса III по NYHA [25]. В результате систематического обзора литературы у пациентов с высоким риском (ФВ ЛЖ < 40 %, с ишемической болезнью или без нее) был сделан вывод о том, что применение амиодарона в качестве первичной профилактики снижает риск ВСС (отношение рисков 0,76, 95% ДИ 0,66–0,88) и смертности от всех причин (коэффициент риска 0,88; 95% ДИ 0,78–1,00) по сравнению с отсутствием лечения или плацебо, но качество доказательств было очень низким [26]. Касательно вторичной профилактики ВСС в этом же обзоре при применении амиодарона не установлено какой-либо пользы или риска [26]. По сравнению с терапией бета-блокаторами и другими антиаритмическими препаратами (включая соталол) амиодарон снижает риск ВСС и смертности от всех причин [26]. Внутривенный амиодарон играет роль в уменьшении рецидивов ФЖ и ФЖ во время реанимационных мероприятий [3, 27–29].
Хроническое введение амиодарона ассоциируется с комплексными межлекарственными взаимодействиями и множеством побочных эффектов со стороны легких, печени, щитовидной железы, кожи и нервной системы. Как правило, чем дольше длительность лечения и чем более высокая доза амиодарона, тем больше вероятность развития неблагоприятных эффектов, требующих прекращения приема препарата [26]. По этой причине хроническое лечение амиодароном молодых пациентов следует использовать как резервный метод, применяемый перед определенными вариантами лечения, такими как катетерная абляция. Базовая оценка пациентов может включать ЭКГ, исследование лабораторных показателей функции печени, функции щитовидной железы, рентгенографию грудной клетки и легочные функциональные тесты (включая диффузионную способность легких по монооксиду углерода). Мониторинг токсичности обычно включает периодическое физикальное обследование и сбор анамнеза, а также ЭКГ, рентгенографию грудной клетки и оценку функции щитовидной железы, печени и легких. КТ грудной полости с высоким разрешением, как правило, выполняется при подозрении на токсическое поражение легких [30].
Хотя соталол является эффективным в купировании ЖА, он обладает значительными проаритмическими эффектами и, как было показано, не улучшает выживаемость [31]. В исследовании SWORD (Survival With Oral d-Sotalol) было продемонстрировано, что d-соталол увеличивает риск смерти у пациентов с сердечной недостаточностью [32]. В отличие от амиодарона и многих других антиаритмических препаратов соталол, по-видимому, снижает порог дефибрилляции [33]. Кроме того, соталол может приводить к декомпенсации СН, и поэтому рекомендуется избегать применять его у пациентов с ФВ ЛЖ < 20 %.
5.1.4. Блокаторы кальциевых каналов
Негидропиридиновые блокаторы кальциевых каналов не играют никакой роли в лечении большинства ЖА. Фактически внутривенный верапамил, назначенный при устойчивой ЖТ, ассоциировался с гемодинамическим коллапсом, особенно у пациентов с предшествующим ИМ [34, 35]. У пациентов со структурно нормальным сердцем верапамил или дилтиазем могут подавлять ток ионов [35–39]. Пероральный и внутривенный верапамил эффективны при лечении идиопатической межфасцикулярной ЛЖТ [38]. Блокаторы кальциевых каналов не следует назначать пациентам с ЖT при СН со сниженной ФВ.
5.1.5. Неантиаритмические препараты и методы лечения
5.1.5.1. Электролиты
В качестве вспомогательных средств для профилактики ЖА были предложены калий и магний [40, 41]. Гипокалиемия и гипомагниемия являются распространенными последствиями лечения диуретиками при СН, и оба эти состония ассоциируются с ЖA во время острого ИМ [41, 42] и могут увеличить риск появления пируэтной тахикардии у пациентов с удлиненным интервалом QT [43]. В действительности у пациентов с пируэтной тахикардией внутривенное введение магния является терапией первой линии [44]. У пациентов с дефицитом магния и калия необходимо создать переизбыток магния с целью облегчения замены калия [45]. Рекомедуется поддерживать уровень калия в пределах 4,5–5 ммоль/л
для предотвращения ЖА и ВСС [46, 47]. В крупном обсервационном исследовании пациентов с острым ИМ продемонстрировано, что самые низкие показатели смертности наблюдались у пациентов с концентрацией калия в сыворотке в пределах 3,5–4,5 ммоль/л [48]. Интересно, что скорость ЖA не повышалась, если уровень калия был менее 3 ммоль/л или ≥ 5 ммоль/л. Аналогично большое рандомизированное двойное слепое исследование применения внутривенного магния в постинфарктном периоде продемонстрировало отсутствие пользы в отношении 30-дневной смертности [40]. Остается вполне целесообразным контролировать уровни калия и магния во время агрессивного диуреза и в постинфарктном периоде.
5.1.5.2. Омега-3 жирные кислоты и липиды
В профилактике ВСС играют роль как омега-3 полиненасыщенные жирные кислоты, так и статины, действие которых обусловлено стабилизацией билипидного слоя мембраны миоцитов, участвующих в поддержании градиентов электролитов [49]. Ранние данные касательно влияния омега-3 полиненасыщенных жирных кислот на снижение частоты сердечно-сосудистых событий и ВСС были многообещающими. В 2006 году большой метаанализ 19 наблюдений и РКИ продемонстрировал достоверную ассоциацию между применением омега-3 полиненасыщенных жирных кислот и профилактикой ВСС [50]. Рандомизированное исследование GISSI (Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto) у пациентов, недавно перенесших ИМ, показало, что рыбий жир 1 г/сут снижает смертность благодаря снижению числа ВСС [51]. Однако в последующих РКИ данные преимущества не были выявлены, а было продемонстрировано, что омега-3 полиненасыщенные жирные кислоты являются неэффективными [52–56]. Поскольку исследования показали постоянное отсутствие вреда от омега-3 полиненасыщенных жирных кислот, пациенты, которые их принимают, могут быть уверены в безопас-ности этих средств. Мы надеемся, что результаты долгосрочных исследований прояснят противоречивые результаты.
Напротив, препараты статинов снижают смерт-ность и уменьшают риск ВСС, связанный с ишемической болезнью сердца [57]. Преобладающий механизм этого эффекта остается невыясненным. Предполагается предотвращение разрыва бляшек коронарных артерий или прямой кардиопротекторный эффект, который снижает частоту ЖА. Кардиопротекторный эффект статинов показан в экспериментальных моделях ишемии/реперфузии, а у людей этот эффект продемонстрирован в крупном обсервационном анализе [42, 56–58]. В дальнейшем он дополнительно изучался при СН в нескольких вторичных анализах пациентов, которые получали статины в исследованиях профилактики ИКД, в том числе в MADIT-CRT (мультицентровое исследование имплантации автоматического дефибриллятора — сердечной ресинхронизирующей терапии (СРТ)), SCD-HeFT, AVID («Антиаритмические препараты против имплантируемых дефибрилляторов») [59] и DEFINITE («Оценка дефибрилляторов при лечении неишемической кардиомиопатии»), где был продемонстрирован меньший риск ВСС у пациентов, получающих статины [58, 60–62]. Однако этот общий эффект при СН не был подтвержден в двух проспективных РКИ розувастатина при СН — CORONA («Контролируемое многонациональное исследование розувастатина при СН») и GISSI-HF (Gruppo Italiano per lo Studio della Sopravvivenza nell’Insufficienza Heartiaca-Heart Failure) [63, 64]. По-видимому, положительные эффекты статинов относятся к популяции, страдающей атеросклеротической кардиоваскулярной патологией или имеющей риск ее развития и/или ишемией, а не СН в целом.
5.3. Дефибрилляторы в лечении ЖА и ВСС
Дефибрилляция очень эффективна при терминальной, приводящей к летальному исходу ЖA. Данный вид лечения можно осуществить с помощью трансвенозного ИКД, подкожно имплантируемого кардиовертера–дефибриллятора, носимого кардиовертера–дефибриллятора или внешнего дефибриллятора. Эти устройства постоянно мониторят сердечный ритм и выполняют лечебную процедуру в ответ на тахикардию, которая соответствует запрограммированным частотам и продолжительности аритмии. Подавляющее большинство трансвенозных ИКД имплантируют в подключичную область под контролем рентгеноскопии. Подкожно имплантируемые кардиовертеры–дефибрилляторы имплантируются в левую половину грудной клетки над шестым ребром между левой среднеподмышечной и левой переднеподмышечной линиями. ИКД с эпикардиальным датчиком все еще имплантируют некоторым пациентам, особенно тем, у кого отмечаются определенные врожденные пороки сердца.
Внутривенный ИКД применяется в клинической практике более 3 десятилетий, а надежные данные из высококачественных РКИ подтверждают целесообразность его использования в различных популяциях пациентов, включая выживших после остановки сердца, пациентов с ЖT и структурной патологией сердца, а также пациентов с выраженой дисфункцией ЛЖ.
5.4. Катетерная абляция
5.4.1. Общие положения
Катетерная абляция является важным способом лечения пациентов с ЖА, когда антиаритмические препараты неэффективны, не переносятся или пациент против их применения. Катетерная абляция может удалить субстрат мономорфных ЖА. Абляция является способом лечения для отдельных пациентов с полиморфным ЖT/ФЖ только в том случае, если можно идентифицировать иници–ирующий импульс или субстрат преждевременного сокращения желудочков. Стратегия, риски и результаты абляции связаны с механизмом и локализацией ЖА. Большинство ЖА развиваются из очага вблизи субэндокарда, доступ к которому осуществляется с помощью трансвенозной (для правого желудочка) или трансаортальной/трансептальной (для левого желудочка) катетеризации. При развитии ЖА из очага из субэпикарда доступ к нему осуществляется с помощью эпикардиального картирования и абляции. Перикардиальный доступ обычно достигается путем чрескожной субксифоидальной пункции. Процедура катетерной абляции обычно включает в себя попытки индуцировать ЖT посредством запрограммированной электрической стимуляции, чтобы подтвердить диагноз и определиться, как осуществлять абляцию. Проблемы, ограничивающие успешность процедуры, включают в себя невозможность вызвать аритмию для картирования (распространено при идиопатической ЖA) или происхождение аритмий из недоступного места в миокарде (распространенное явление при некоторых кардиомиопатиях).
5.4.2. ЖA у пациентов без явной структурной патологии сердца
ЖA, которые не ассоциируются со структурной патологией сердца или генетическим синдромом аритмии, обычно называют идиопатическими. Большинство идиопатических ЖA мономорфны и основаны на фокальном механизме триггерной активности или аномальной автоматичности; некоторые из них развиваются по механизму reentry. У пациентов с наличием симптомов, у которых антиаритмические препараты неэффективны, плохо переносятся или если пациенты не желают их применять, вариантом лечения является катетерная абляция. Стратегия абляции заключается в том, чтобы идентифицировать место происхождения аритмии, манифестирующее на самом раннем участке электрической активации, или, когда это нецелесообразно, — путем картирования. Катетерную абляцию идиопатической ЖА обычно выполняют с помощью эндокардиальной катетеризации, хотя иногда может потребоваться эпикардиальный доступ через коронарную венозную систему или с помощью субксифоидальной перикардиальной пункции. Неудачная абляция идиопатической ЖА часто обусловлена неспособностью провоцировать аритмию с целью картирования в электрофизиологической лаборатории или происхождением из недоступного участка.
5.4.3. ЖТ, связанная с наличием рубца
У большинства пациентов со структурной патологией сердца устойчивая мономорфная ЖТ обу–словлена повторным входом возбуждения через участки выживших волокон миокарда, связанных с участками фиброзного рубца. Стратегия абляции этого круга повторного входа возбуждения заключается в выявлении и устранении каналов выжившего миокарда в рубце, которые часто ассоциируются с медленной проводимостью, облегчающей повторный вход возбуждения. Субстрат большинства ЖТ, связанных с предшествующим ИМ, находится на субэндокардиальной поверхности левого желудочка. При неишемической кардиомиопатии круги повторного входа возбуждения более вариабельны в локализации (при этом часто вовлекается эпикардиальная поверхность желудочка), часто распространяются на середину миокарда, где абляция может быть затруднена с любой поверхности. Специфические пути повторного входа возбуждения установлены при тетраде Фалло [1]. Обычно используется электроанатомическое картирование, которое помогает прояснить связь электрофизиологических аномалий с сердечной анатомией. Области рубца можно оценить как области относительно низкого напряжения электрограммы. Для ЖТ, связанных с рубцом, гемодинамическая непереносимость часто ограничивает картирование во время ЖT. Затем абляцию часто проводят с помощью картирования субстрата, в котором области рубца и потенциального повторного входа возбуж–дения обозначены в электроанатомических картах на основе характеристик электрокардиографии и стимуляции, оцененных во время гемодинамически стабильного синусового ритма. Катетерная абляция ЖT, связанной с наличием рубца, требует повышенного опыта оператора, электрофизиологического персонала лаборатории и анестезиологов, а также наличия хирургического резервного и специализированного оборудования для картирования, визуализации и абляции [2, 3].
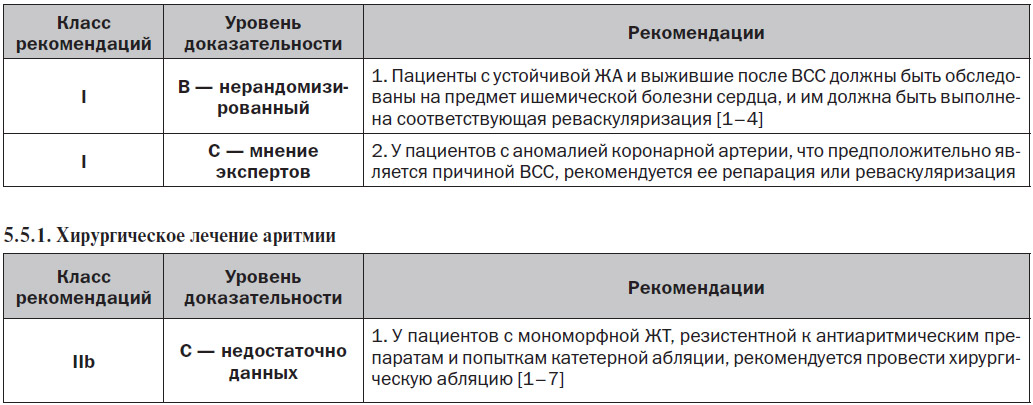
5.5. Хирургические вмешательства и проведение реваскуляризации у пациентов с ишемической болезнью сердца
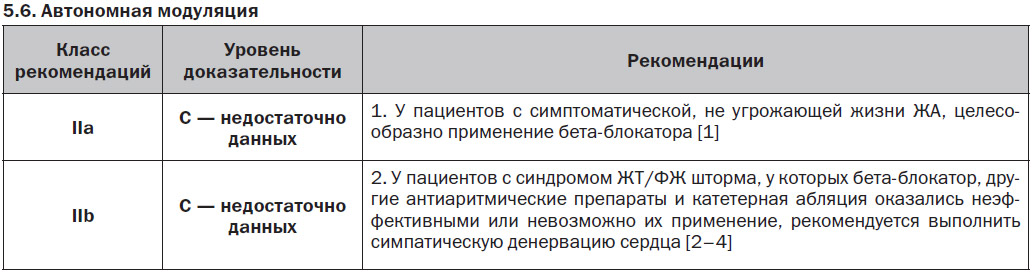
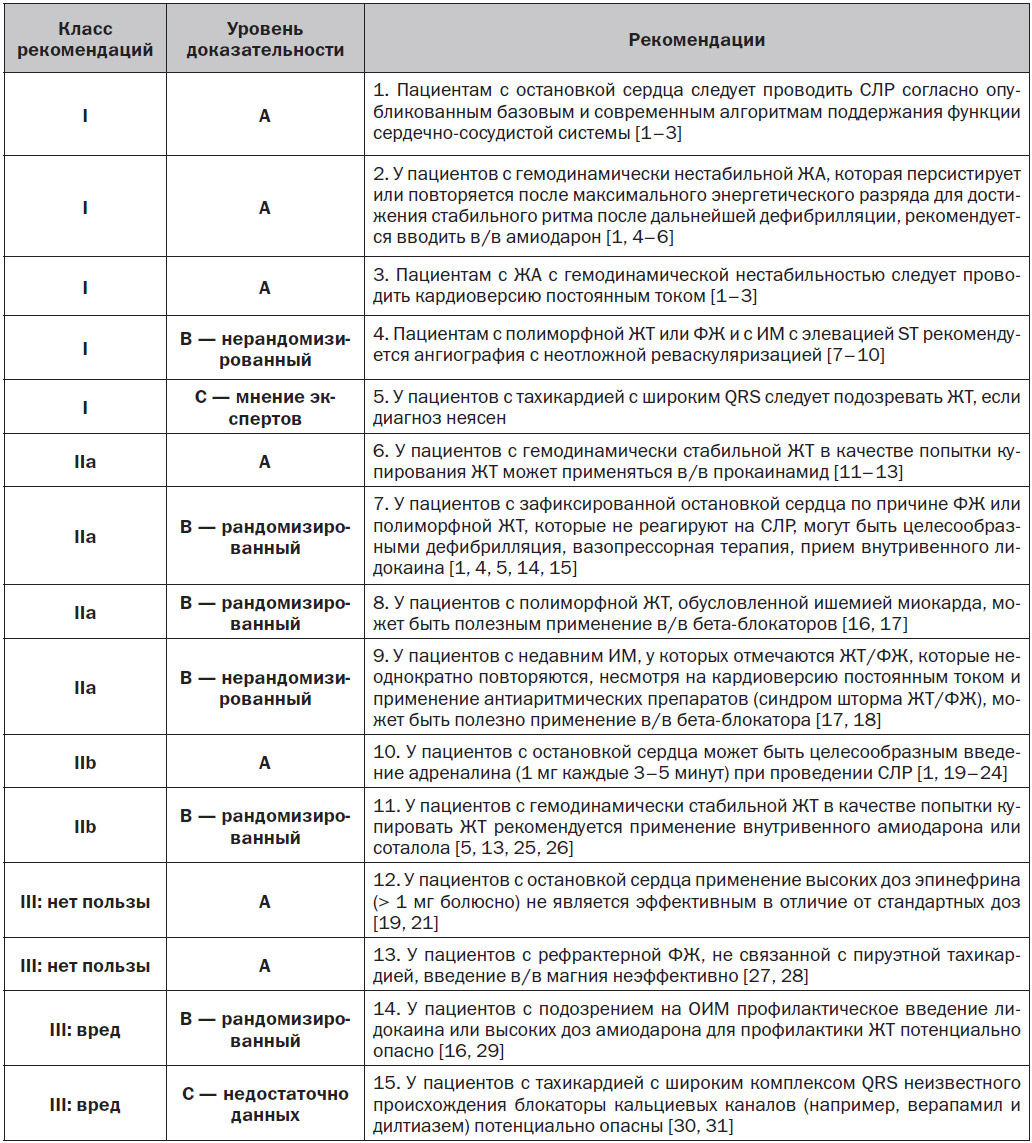
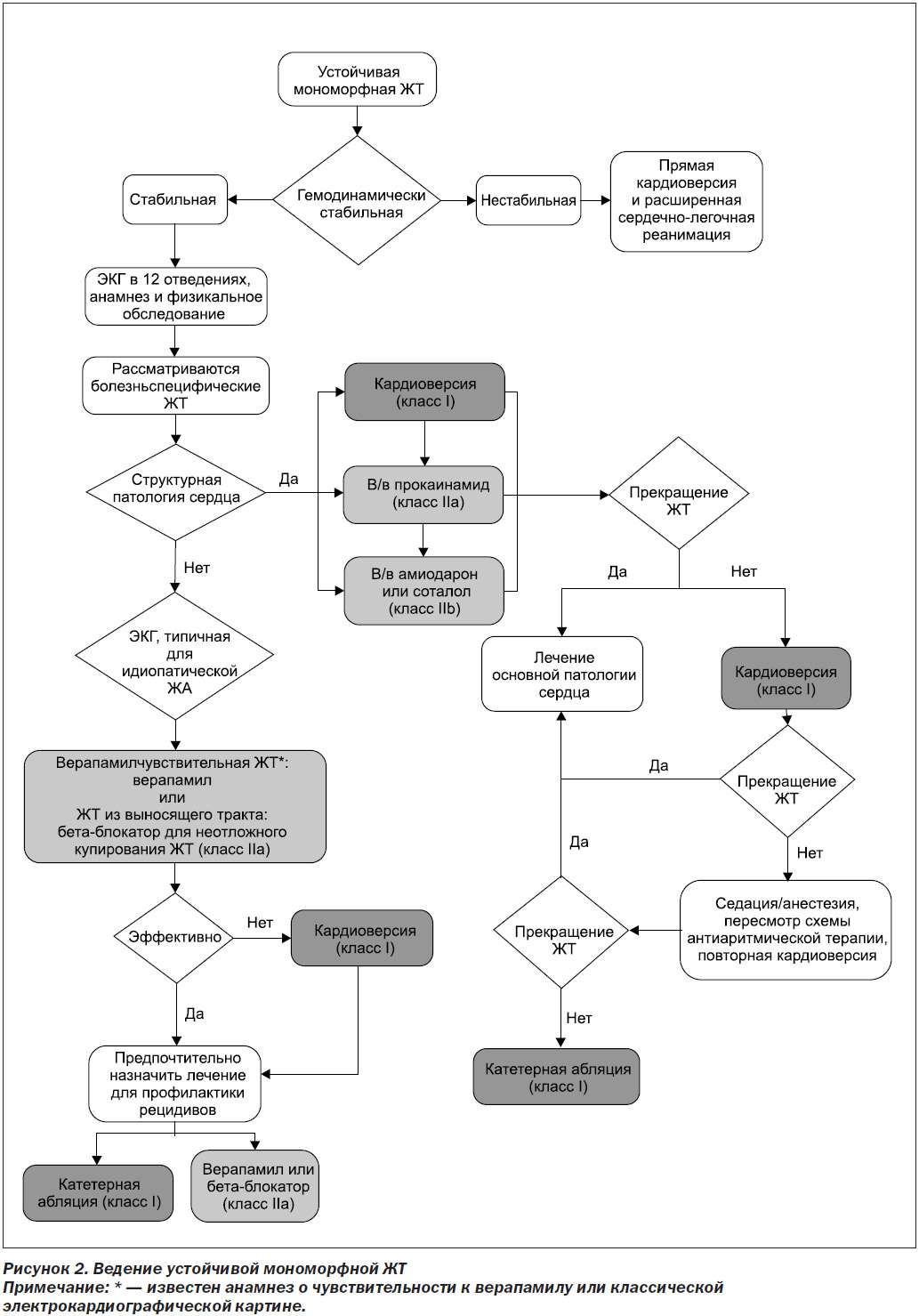
6. Неотложное ведение неспецифических ЖА
7. Непрерывный менеджмент рисков ЖА и ВСС, связанных с какой-либо конкретной патологией
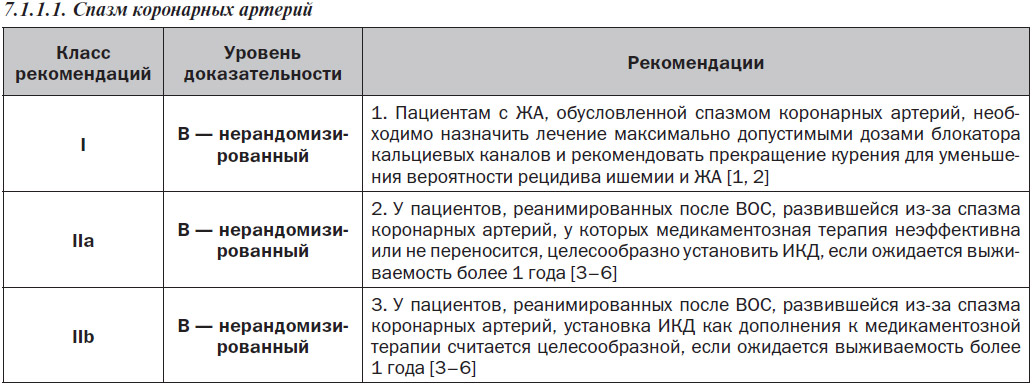
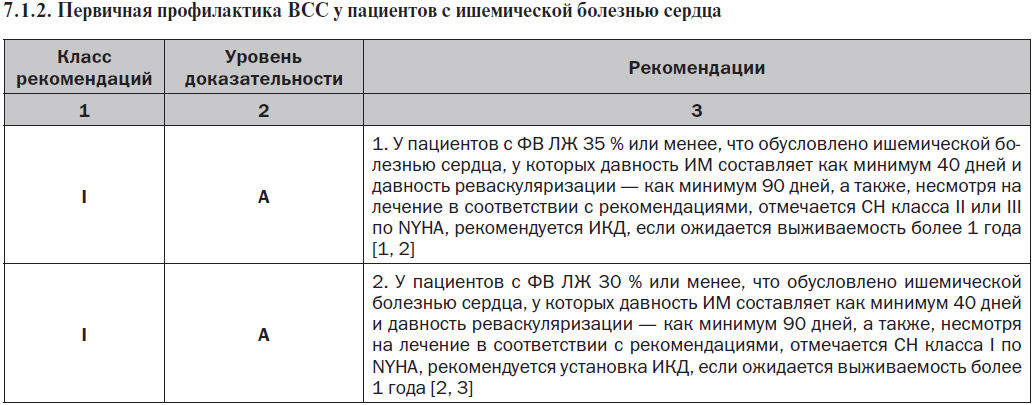
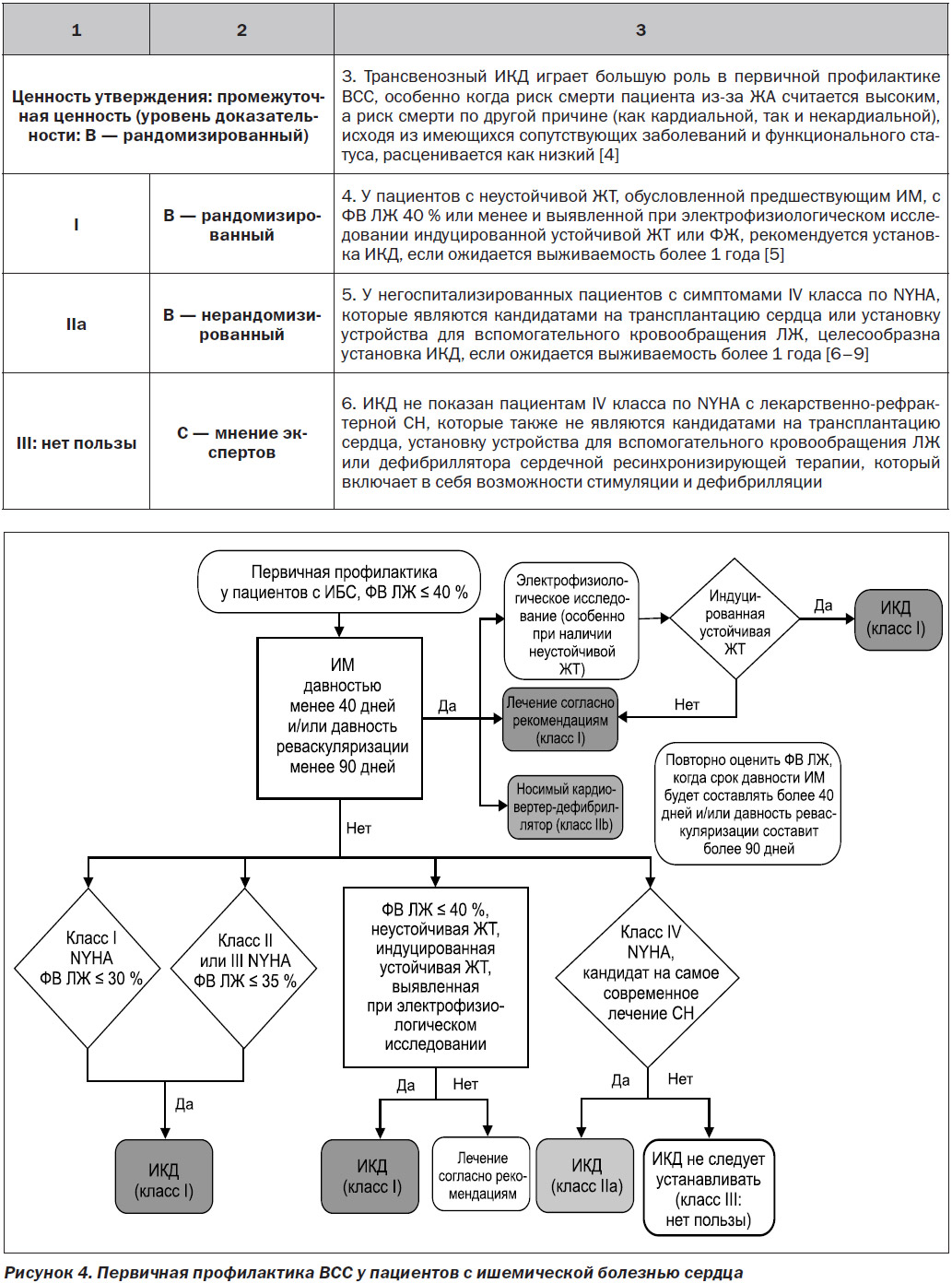
7.1.1.2. ЖТ/ФЖ после аортокоронарного шунтирования
Частота устойчивых ЖT или ФЖ на раннем этапе после аортокоронарного шунтирования (АКШ) является низкой, но эти ЖА ассоциируются с высоким уровнем внутригоспитальной смертности [1]. ФВ, возникающие очень рано (интраоперационно или в течение 24 часов после операции), могут быть обусловлены транзиторными реперфузионными, электролитными и кислотно-основными нарушениями, а также использованием препаратов с инотропным действием. У пациентов с ФЖ или полиморфной ЖT в послеоперационном периоде чаще развивается ишемия, тогда как у пациентов с мономорфной ЖT обычно отмечаются старый инфаркт и рубцы миокарда желудочков [2]. Полиморфная ЖT/ФЖ, возникающая после АКШ, требует терапевтического подхода, нацеленного на лечение ишемии миокарда, включая возможную необходимость оценки проходимости трансплантата, а также идентификацию и лечение механических осложнений и острых электролитных или кислотно-основных нарушений. К факторам риска мономорфной ЖT в раннем периоде после АКШ относятся предшествующий ИМ, постинфарктный рубец в области желудочка, дисфункция ЛЖ и размещение обходного трансплантата через неколлатеральный окклюзированный коронарный сосуд в зоне хронического инфаркта [3]. В отличие от полиморфных ЖT и ФЖ развитие устойчивой мономорфной ЖT обычно не обусловлено острой ишемией. У многих из этих пациентов при электрофизиологическом исследовании выявляется индуцированная устойчивая ЖТ. Ведение симптоматической ЖА в раннем периоде после АКШ осуществляется согласно рекомендациям по острому и постоянному ведению ЖТ, подобно тому, как указано в данном документе. У пациентов без устойчивой ЖT или ФЖ, но с дисфункцией ЛЖ до проведения АКШ установка ИКД не приводила к улучшению показателя выживаемости [4]. У пациентов с дисфункцией ЛЖ, которым выполняют реваскуляризацию, существует вероятность улучшения функции ЛЖ, поэтому многие авторы рекомендуют повторно оценить функцию ЛЖ через 3 месяца после реваскуляризации до принятия решения об установке ИКД [5]. У пациентов с частотой неустойчивой ЖТ и сниженной ФВ ЛЖ для стратификации риска рекомендуется электрофизиологическое исследование; пациентам с индуцированной устойчивой ЖT может быть полезна установка ИКД [6]. Носимый кардиовертер-дефибриллятор у пациентов с риском ВСС на ранней стадии после реваскуляризации может быть полезен в плане обеспечения времени для восстановления функции желудочка [7].