Журнал «Почки» Том 8, №4, 2019
Вернуться к номеру
Нові позитронно-емісійні радіофармпрепарати в урологічній радіонуклідній візуалізації
Авторы: Король П.О.(1, 2), Щербіна О.В.(2)
(1) — Київська міська клінічна лікарня № 12, м. Київ, Україна
(2) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
У статті розглянуто історичні аспекти та ключові питання клінічного застосування нових радіофармпрепаратів (РФП) для позитронно-емісійної томографії (ПЕТ). Золотим стандартом для вимірювання ефективного ренального плазмотоку є p-[18F] фторгіпурат ([18F] PFH) завдяки структурі, що подібна до р-аміноімпурату. [18F] FDS — новий потенціальний трейсер для діагностики гострої ниркової недостатності. ПЕТ-трейсери Re (CO) 3 ([18F] FEDA) і [18F] PFH є ефективними сурогатними маркерами з метою відбору пацієнтів для ендорадіотерапії з потенційним нефротоксичним профілем, у хворих на гемопоетичні злоякісні пухлини, рак передміхурової залози. ПЕТ-візуалізація нирок і сечовидільної системи може мати додаткове значення у складних клінічних ситуаціях і забезпечувати ефективну підтримку у прийнятті діагностичних рішень, зокрема у педіатричних пацієнтів. Подальший науковий діагностичний пошук повинен бути спрямований на синтезування нових РФП, які матимуть ідеальні властивості для ренальної функціональної візуалізації, низьке зв’язування з білками плазми, високу метаболічну стабільність та низький гепатобіліарний кліренс.
В статье рассмотрены исторические аспекты и ключевые вопросы клинического применения новых радиофармпрепаратов (РФП) для позитронно-эмиссионной томографии (ПЭТ). Золотым стандартом для измерения эффективного ренального плазмотока является p-[18F] фторгиппурат ([18F] PFH) благодаря структуре, схожей с р-аминоимпуратом. [18F] FDS — новый потенциальный трейсер для диагностики острой почечной недостаточности. ПЭТ-трейсеры Re (CO) 3 ([18F] FEDA) и [18F] PFH являются эффективными суррогатными маркерами с целью отбора пациентов для эндорадиотерапии с потенциальным нефротоксическим профилем, у больных с гемопоэтическими злокачественными опухолями, раком предстательной железы. ПЭТ-визуализация почек и мочевыделительной системы может иметь дополнительное значение в сложных клинических ситуациях и обеспечивать эффективную поддержку в принятии диагностических решений, в частности у педиатрических пациентов. Дальнейший научный диагностический поиск должен быть направлен на синтезирование новых РФП, которые будут иметь идеальные свойства для почечной функциональной визуализации, низкое связывание с белками плазмы, высокую метаболическую стабильность и низкий гепатобилиарный клиренс.
The literature review examines the historical aspects and key issues of the clinical application of new radiopharmaceuticals (RF) for positron emission tomography (PET). The gold standard for measuring effective renal plasma flow is p-[18F] fluorohippurate ([18F] PFH) due to its structure close to p-aminoimpurate one. [18F] FDS is a new potential tracer for the diagnosis of acute renal failure. PET tracers Re (CO) 3 ([18F] FEDA) and [18F] PFH are effective as surrogate markers for the selection of patients for endoradiotherapy with a potential nephrotoxic profile, in patients with hematopoietic malignant tumours and prostate cancer. PET imaging of the kidneys and urinary system can be of additional importance in difficult clinical situations and provide effective support in making diagnostic decisions, in particular in paediatric patients. Further scientific diagnostic research should focus on the synthesis of new radiopharmaceuticals that will have ideal properties for renal functional imaging, low binding to plasma proteins, high metabolic stability and low hepatobiliary clearance.
радіонуклідна візуалізація; позитронно-емісійна томографія; радіофармпрепарат; нирки; швидкість клубочкової фільтрації; ефективний нирковий плазмотік; огляд
радионуклидная визуализация; позитронно-эмиссионная томография; почки; радиофармпрепарат; скорость клубочковой фильтрации; эффективный почечный плазмоток; обзор
radionuclide imaging; positron emission tomography; radiopharmaceutical; kidneys; glomerular filtration rate; effective renal plasma flow; review
Вступ
У сучасній клінічній практиці показник швидкості клубочкової фільтрації (ШКФ) оцінюється за допомогою креатиніну у сироватці крові; однак результати цього методу можуть бути неточними, а оцінка окремих функцій нирок неможливою [4, 17, 31]. Для найбільш вірогідної та точної оцінки ШКФ золотим стандартом вважається застосування методики екзогенного маркерного інсуліну. Однак через технічні труднощі та високу вартість методу він рідко використовується у клінічній практиці [43]. Кліренс крові визначають за допомогою [51Cr] етилендіамінтетраоцтової кислоти ([51Cr] EDTA), що може вважатись привабливою альтернативою. Але слід зазначити, що відомостей про роздільну функцію нирок за допомогою даного методу отримати неможливо і потреба в декількох заборах крові обмежує її широке застосування [5]. У зв’язку з цим саме ниркову радіонуклідну візуалізацію з використанням однофотонного випромінювача [99mTc] діетилентриамінпентаоцтової кислоти ([99mTc] DTPA) регулярно застосовують у клінічній практиці, оскільки вона дає можливість визначати роздільну функцію нирок у контексті оцінки ШКФ [15, 23]. Ця методика досить активно впроваджується в центрах ядерної медицини для обчислення ниркового кровотоку та оцінки односторонньої функції нирок [23, 30, 42].
Однак процедури із застосуванням [99mTc] DTPA, що передбачають повторні дослідження крові та сечі, є тягарем як для пацієнтів, так і для клініцистів. Дана методологія також може призводити до недотримання процедурних інструкцій і недоліків у заборі зразків [6].
Як інший маркер функціональної активності паренхіми нирок ефективний нирковий плазмотік (ЕНП) може бути одержаний з кліренсу інфузії параамінопіпуринової кислоти. Незважаючи на те, що дана методологія є еталонним стандартом для оцінки ЕНП, такий підхід неефективний для клінічної практики. Останніми роками [99mTc] меркаптоацетилтригліцин ([99mTc] MAG3) регулярно застосовувався для вимірювання трубної екстракції [2, 52]. З впровадженням у клінічну практику методів гібридної візуалізації із застосуванням однофотонної емісійної комп’ютерної томографії/комп’ютерної томографії (ОФЕКТ/КТ) пропонується тривимірна анатомічна візуалізація, але тривалий термін отримання дагностичних даних і низький просторово-часовий дозвіл все ще обмежують потенціал даного методу для кількісної оцінки [14, 15]. Однак слід зазначити, що ОФЕКТ/КТ у чистому вигляді як стандартна методика візуалізації при захворюванні нирок не використовується у зв’язку з тим, що не несе додаткової діагностичної інформації для урологів порівняно з КТ. У данному випадку застосовується тільки ОФЕКТ.
Методика розрахунку ЕНП і ШКФ полягає у визначенні кліренсу нефротропних радіофармпрепаратів (РФП) на основі визначення загального кліренсу без взяття проб крові та сечі та базується на математичній обробці серцевої кривої. Зниження радіоактивності ниркових РФП в часі описується експонентою.
Для РФП із клубочковим механізмом елімінації стандартизований об’єм розподілу приймається за 7,5 % маси тіла, для канальцевих РФП — за 17 %. Величину кліренсу нормують на стандартну поверхню тіла — 1,73 м2. Слід зазначити, що ЕНП та ШКФ розраховують окремо для кожної нирки відносно до радіоактивності нирки на ренограмі з відсіченням фону тіла на третій хвилині — для клубочкових РФП та на другій хвилині — для канальцевих [24]. Слід зазначити, що сучасні програми та моделі кінетики ниркових РФП враховують глибину залягання пухлини залежно від антропометричних даних пацієнта. Це також справедливо і для хворих з опущенням та ротацією нирки. У даному випадку повинна виконуватись бокова проєкція або ОФЕКТ з подальшою корекцією параметрів ШКФ та ЕНП за площею діагностичних зображень [24].
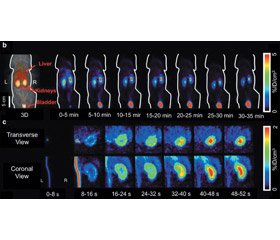
Позитронно-емісійна томографія (ПЕТ) в урології застосовується з метою оцінки функціональної активності паренхіми нирок та має декілька ключових переваг, таких як краща просторово-часова роздільна здатність, абсолютна кількісна оцінка діагностичних параметрів і швидка тривимірна візуалізація. У зв’язку з цим з метою оцінки функціональної активності паренхіми нирок на сучасному етапі активно вивчається низка ниркових ПЕТ-радіотрейсерів, включаючи [68Ga] EDTA, [18F] Re (CO) 3-N-(флуороетил) імінодіацетна кислота (Re (CO) 3 ([18F] FEDA)) та фторосорбіт 2-дезокси-2-[18F] ([18F] FDS) тощо [20, 27, 48, 57] (рис. 1).
Ниркова перфузія. Ниркова перфузія може бути визначена шляхом візуальної та кількісної оцінки радіотехнічного транзиту РФП після ін’єкції (через черевну та ниркову артерії) [46].
Відносне поглинання нирок. Відносне поглинання нирок здійснюється шляхом оцінки диференціальної функції нирок, наприклад за допомогою розміщення ділянок, що становлять інтерес (ROI) над нирками, і вимірювання інтегралу підрахунків в ROI після внутрішньовенного введення РФП [46]. Така роздільна оцінка ниркової функції окремо лівої і правої нирки має надзвичайно важливе значення в контексті донорства нирок [40].
Максимальна паренхіматозна активність (Tmax і T1/2max). Tmax визначається як час, що минув від ін’єкції до висоти піку ренограми, тоді як T1/2max — час зменшення ниркової активності до 50 % від його максимального значення. Останній параметр зазвичай використовується як показник екскреторної здатності нирок та оцінки різного ступеня його порушень. На цей параметр можуть впливати різні чинники (стан гідратації, тип РФП, що застосовується, наявність патології сечового міхура тощо) [46, 47], що успішно нівелюється за рахунок правильної та послідовної підготовки хворого до дослідження
Планарні методи ниркової радіонуклідної візуалізації мають низку недоліків, що включають обмежену просторово-часову роздільну здатність і відсутність анатомічної інформації. Зокрема, гібридні пристрої для обробки зображень, такі як сканери ОФЕКТ/КТ, дозволяють отримувати тривимірну оцінку та анатомічну корекцію, хоча ці ознаки зазвичай не використовуються в клінічній рутинній роботі. Крім того, необхідна корекція на ослаблення м’яких тканин, наприклад, шляхом оцінки глибини залягання нирок або шляхом застосування коефіцієнта ослаблення [46]. На відміну від ОФЕКТ ПЕТ-візуалізація має низку переваг, які можна вважати ключовими характеристиками для більш ретельної оцінки функції нирок. До них відноситься покращений просторово-часовий дозвіл, абсолютні квантові підходи до кількісного визначення і мультиспіральна КТ для анатомічної реєстрації. Однак найважливішою перевагою ПЕТ-візуалізації порівняно зі звичайною ОФЕКТ є значно вища швидкість рахунку, що, у свою чергу, дозволяє персоналу отримувати значно менші дози опромінення. Наприклад, для дослідження нирок за допомогою ПЕТ з [68Ga] EDTA зазвичай застосовуюється РФП активністю 40 МБк. Ефективна доза ПЕТ-компонента становить 1,6 мЗв, що дорівнює приблизно 320 МБк [99mTc] DTPA [15, 57]. Як результат, опромінення мінімізується без шкоди для якості зображення.
Отже, використання ПЕТ для ниркової візуалізації, в тому числі оцінка ШКФ, може поліпшити ідентифікацію структурних аномалій і кількісного визначення обструктивних процесів у пацієнтів як дитячого, так і дорослого віку. Зокрема, у пацієнтів дитячого віку застосовується потенційно менша доза опромінення від ПЕТ-радіоіндикаторів [4, 57]. Впровадження технології «польоту», вдосконалення технології детекторів та оптимізовані реконструктивні алгоритми можуть дозволити подальше зниження кількості введеної активності [15]. Крім того, внутрішня здатність ниркових ПЕТ-випромінювачів забезпечувати томографічні зображення нирок може дозволити усунути фонову активність від оточуючих органів, таких як великі судини і селезінка [4]. Отже, криві «активність — час» здатні генеруватися виключно за рахунок поглинання РФП в нирках і автоматично застосовувати стандартизований поріг величини поглинання для визначення активності в системі збору [15] на відміну від ниркової сцинтиграфії, в якій ROI охоплює всю поверхню нирки. [99mTc] DTPA має більш виражений зв’язок з білками плазми, ніж інші радіоіндикатори, які застосовуються для оцінки ШКФ. Показано, що зв’язування білків змінюється на 10–13 %, а завдяки позаклітинній локалізації DTPA вони негативно впливають на точність діагностичного процесу [36]. Однак ПЕТ-радіоіндикатори, такі як [68Ga] EDTA, [18F] FDS і Re (CO) 3 ([18F] FEDA), можуть мати чудову фармакокінетику профілів, головним чином через низьке зв’язування з білками плазми і високу метаболічну стабільність (рис. 1) [15, 27, 48].
[68Ga]-мічені радіоіндикатори для дослідження функції нирок
[68Ga] EDTA
M.S. Hofman та R.J. Hicks [15] першими повідомили про використання ПЕТ-радіоіндикатора [68Ga] EDTA в клінічній практиці з метою оцінки функції нирок, який виводиться з організму шляхом клубочкової фільтрації. Після введення даного радіоіндикатора він спочатку концентрується в крові, в той час як аорта (або серце) потенційно може використовуватися для забезпечення функцій кінетичного аналізу. Згодом активність РФП збільшується в паренхімі нирки, після чого відбувається поступове розмежування і транзит введеної активності в систему збору, що спостерігається через 3–4 хв після ін’єкції. Hofman et al. вивчали пацієнтів з нирково-клітинною карциномою, яким було здійснено ОФЕКТ/КТ з [99mTc] DMSA та ПЕТ/КТ з [68Ga] EDTA до проведення стереотаксичної променевої терапії [15]. За даними аналізу результатів ОФЕКТ/КТ та ПЕТ-візуалізації, виявлено, що [68Ga] EDTA може надавати додаткову інформацію щодо функціональної оцінки нирок на ранній фазі ниркового паренхіматозного транзиту [14, 15].
[68Ga] DTPA
Враховуючи, що 99mTc-мічений DTPA застосовується з метою визначення функціональної оцінки нирок вже протягом кількох десятиліть, Gundel et al. [23] було досліджено нирковий ПЕТ-випромінювач [68Ga] DTPA порівняно з [68Ga] EDTA in vitro та in vivo у копенгагенськіх щурів чоловічої статі. Тільки у 30 % піддослідних [68Ga] DTPA виводилася через нирки, в той час як [68Ga] EDTA виводився через нирки у 90 % піддослідних [11]. Порівняно з [68Ga] DTPA [68Ga] EDTA демонструє кращу діагностичну ефективність [11, 15]. Крім того, слід зазначити, що DTPA має найнижчий відсоток фіксації з білками плазми крові, розміри його молекули дозволяють вірогідно оцінювати ШКФ.
[68Ga] 1,4,7-триазациклопропан-1,4,7-триоцтова кислота ([68Ga] NOTA)
J.Y. Lee et al. [24] оцінювали 68Ga-комплекси (EDTA, DTPA і NOTA) і вимірювали зв’язування з сироваткою та еритроцитами поряд із порівнянням значення ШКФ при застосуванні [51Cr] EDTA у мишей. Слід зазначити, що при використанні [68Ga] NOTA отримано низьке зв’язування з сироватковими білками, а також більш низький рівень ШКФ порівняно із показником еталонного стандарту [51Cr] EDTA. Отже, [68Ga] NOTA може мати значний потенціал як нирковий ПЕТ-агент [14]. Вже в 1960-х роках [68Ga] EDTA застосовувався як радіоіндикатор у хворих з гліобластомою з використанням позитронної сцинтиляційної камери [39] і став ініціюючим чинником в розробці та вивченні [68Ga] NOTA [15].
[68Ga] IRDye800-тилметакрилат
Діабетична нефропатія є основною причиною ниркової недостатності [1]. Qin et al. вперше застосовували радіоіндикатор [68Ga] IRDye800-тильмонофосфат для оцінки ШКФ у щурів. На графічних кривих «активність — час» авторами було отримано рецепторно-опосередковане накопичення РФП в нирках. Досліджуючи локалізацію тильманоцементного рецептора (CD206) і IRDye800-тильмонофосфату в межах клубочків, було підтверджено накопичення радіоіндикатора в мезангіальних клітинах. У недіабетичних щурів спостерігалась однофазна крива «активність — час» з низьким накопиченням РФП в сечовому міхурі, в той час як у щурів з діабетом було отримано мультифазну криву «активність — час» з високим накопиченням радіоіндикатора. Враховуючи вирішальну роль мезангіальних клітин при прогресуванні діабетичної нефропатії, автори дійшли висновку, що [68Ga] IRDye800-тильмонофосфат може стати новим рецерторним біомаркером ПЕТ (ОФЕКТ)-візуалізації для вивчення моніторингу прогресування діабетичної нефропатії [35].
Радіомаркери з міткою 18F для дослідження функції нирок
Радіоіндикатори з міткою 18F мають перевагу за рахунок меншої енергії позитронів, що, в свою чергу, надає можливість застосовувати значно менші активності РФП без негативних наслідків щодо якості візуалізації та покращує контрастні та шумові характеристики зображень [38]. Також слід зазначити, що 18F має значно більший період напіввиведення (110 хв), ніж 68Ga (68 хв), що дозволяє своєчасно доставляти РФП із центральних закладів, що мають в наявності циклотрон, до інших відділень ядерної медицини, що не мають циклотрону [53, 55]. Циклотронне виробництво РФП має значно кращий потенціал щодо кількісного напрацювання радіонуклідів на відміну від генераторного виробництва. У зв’язку з цим збільшується коефіцієнт корисної ефективності застосування ПЕТ-2-дезокси-2-[18F] фтор-D-глюкози ([18F] FDG) [7]. Більше того, триваліший період напіввиведення дозволяє отримувати більшу гнучкість у дизайні дослідження шляхом застосування протоколів затримки візуалізації, які можуть забезпечити подальше розуміння кінетики радіонуклідів у нирковій системі.
[18F] FDS
На початковому етапі розвитку ядерної медицини [18F] FDS було розроблено з метою візуалізації в онкології та при запальних захворюваннях, зокрема в діагностиці інфекційних процесів, що спричинені Enterobacteriaceae [22, 25]. [18F] FDS можна легко синтезувати з [18F] FDG, і, таким чином, [18F] FDS може бути доступним у найближчій перспективі на багатьох сайтах, які мають радіохімічну інфраструктуру [26, 41]. З огляду на структуру сорбіту, що лежить в основі [18F] FDS, можна припустити, що він успадковує кінетичні особливості, які майже ідентичні до кінетики інуліну. [18F] FDS було вперше досліджено на здорових щурах з метою визначення його основних властивостей біорозподілу як ниркового ПЕТ-маркера, включаючи кліренс через системні ниркові шляхи, зв’язування білка плазми та метаболічну трансформацію. Виявлено, що після початкової фази кровотоку через нижню порожнисту вену спостерігалося поступове розмежування РФП в нирковій корі. Крім того, було виявлено залежне від часу збільшення слідової радіоактивності в сечовому міхурі. Слід зазначити, що вже під час другого кадру (8–16 с) ПЕТ-візуалізації спостерігалось швидке поглинання радіоіндикатора у кірковій речовині нирок. Після цього на томографічних зрізах спостерігалося тимчасове підвищення радіоактивності в корі нирок з подальшим транзитом радіомаркера до системи збору. За результатами аналізу, нирки мають найвищий захват даного радіомаркера навіть через 60 хв після введення. Слід зазначити, що концентрація радіоіндикатора у кишечнику та печінці залишалася стабільною з часом, що свідчить про низький гепатобіліарний кліренс та ниркову секрецію [18F] FDS. Низька концентрація радіоактивно мічених метаболітів в крові та сечі через 35 хв після ін’єкції була підтверджена результатами тонкошарової радіохроматографії. Таким чином, можна припустити, що [18F] FDS вільно фільтрується в ниркових клубочках, і це відповідає попереднім висновкам, що показують швидкий кліренс екзогенного введеного сорбіту, який є ідентичним до кліренсу інуліну [48].
Зв’язування білка з плазмою також має великий вплив на кінетику радіонуклідів. За даними літературних джерел, білкове зв’язування [99mTc] DTPA знаходиться в діапазоні від 2 до 10 % [21, 37], тоді як [18F] FDS демонструє мінімальне in vivo зв’язування з білками сироватки крові в межах < 0,1 % [37]. У світлі цієї інформації ниркові розлади було досліджено на двох моделях щурів з метою визначення потенційної клінічної користі радіотрактора [18F] FDS. По-перше, гостру ниркову недостатність було індуковано у щурів внутрішньом’язовою ін’єкцією гліцерину. По-друге, односторонню непрохідність сечоводу було модифіковано шляхом повного перев’язування лівого сечоводу. У той час як здорові контрольні щури показали нормальну фізиологічну схему розподілу радіомаркера, у щурів з гострою нирковою недостатністю спостерігалось значно зменшене поглинання в нирковій корі поряд із відносно низьким показником екскреції через сечовидільну систему. Ренограми показали нефункціональну схему із зниженою секрецією радіоіндикатора в нирках щурів з нирковою недостатністю на відміну від здорових контрольних тварин. З іншого боку, щури з односторонньою непрохідністю сечоводу продемонстрували значну затримку захоплення радіомаркера в області перешкоди на відміну від контралатерального сечоводу, в якому спостерігався нормальний розподіл [18F] FDS. Ренограми показали типову обтураційну криву без подальшого піку під час паренхіматозної фази [57]. У першому дослідженні на людях, у яких спостерігали кінетику препарату [18F] FDS, [18F] FDS-ПЕТ дослідження у динамічному режимі було проведено двом волонтерам без наявності ниркової патології. Після внутрішньовенного введення РФП у нирковій паренхімі поступово збільшувалась кількість радіоіндикатора до 60 с після початку введення (судинна фаза), після чого радіомаркер поступово виводився із організму. За результатами кількісного аналізу функціональних ренограм волонтерів було отримано показники фізіологічної норми, в тому числі параметри судинної, паренхіматозної та екскреторної фази. Максимальна паренхіматозна активність (Тmax через 3 хв після введення) відповідала результатам, що були отримані при дослідженні з [99mTc] DTPA та [99mTc] MAG3 [10, 56].
Re (CO) 3 ([18F] FEDA)
На відміну від [68Ga] EDTA та [18F] FDS, які в основному використовуються для оцінки ШКФ, останніми роками увага наковців була зосереджена на розробці та впровадженні інших ниркових ПЕТ-маркерів, що відображають функціональну активність паренхіми нирок, наприклад Re (CO) 3 ([18F] FEDA) та його аналог для ОФЕКТ-візуалізації — [99mTc] (CO) 3 (FEDA) [3]. [99mTc] (CO) 3 (FEDA) демонстрував у піддослідних щурів швидку ниркову екскрецію, подібну до ортойодогіпурату [131I] ([131I] OIH) [20, 28]. Re (CO) 3 ([18F] FEDA) виявляв високу ниркову специфічність, високу in vitro та in vivo стабільність, а також швидку ниркову екскрецію, що корелювала з аналогом [99mTc] (CO) 3 (FEDA) [27]. Фармакокінетичні властивості Re (CO) 3 ([18F] FEDA) також можна порівняти з ортойодогіпуратом [131I] [8, 27]. Також слід зазначити, що маркер [99mTc] (CO) 3 (FEDA) є економічно більш доступним — у п’ять разів дешевший, ніж Re (CO) 3 ([18F] FEDA) [27].
Al [18F] NODA-масляна кислота
Дослідження біорозподілу Al [18F] NODA-масляної кислоти у звичайних щурів та щурів з імітованою нирковою недостатністю доводить, що Al [18F] NODA-масляна кислота секретується виключно через ниркову систему. Таким чином, цей радіотрейсер також може надавати вірогідну кількісну оцінку уродинамічних процесів [29].
p-[18F] фторгіпурат ([18F] PFH)
[18F] PFH має структуру, що подібна до р-аміногіпурату, що вважається золотим стандартом для вимірювання ефективного ренального плазмотоку. Awasthi et al. ідентифікували [18F] PFH як потенційний ПЕТ-трейсер [3]. Pathuri et al. [34] було надано порівняльну характеристику ренограм, отриманих за допомогою [18F] PFH, з результатами аналізу досліджень, що було виконано за допомогою [125I] OIH та [99mTc] MAG3. Зокрема, порівняно з похідними параметрами уродінамики (Tmax, T1/2max), отриманими з [99mTc] MAG3, показники, що було одержано за допомогою [18F] PFH, були подібні до параметрів, що отримано з [125I] OIH. Однак візуалізація з [18F] PFH забезпечувала кращу якість зображення [34]. Інше дослідження, що проведено у щурів з повільно прогресуючим автосомно-домінантним полікістозом нирок, показало, що [18F] PFH може бути сурогатним маркером прогресування даного захворювання, що ще більше підкреслює потенційну клінічну корисність цього трейсера в майбутніх проспективних досліджннях [33].
[18F] FDG
[18F] FDG як ПЕТ-трейсер бере участь у численних фізіологічних процесах і, таким чином, може не бути ідеальним специфічним маркером для оцінки функції нирок. Проте [18F] FDG має дуже широкий спектр застосування в онкологічнії практиці, дає можливість під час аналізу ефективно розраховувати кількісні та якісні параметри функціонування нирок [9].
Клінічні показання до ниркової ПЕТ-візуалізації
ПЕТ має низку переваг перед звичайною сцинтиграфією, хоча високі економічні витрати на дослідження ПЕТ зазвичай визначають ступінь частоти застосування даної діагностичної методики та дорогих ПЕТ-трейсерів [4]. [68Ga] ЕDТА є оптимальним радіомаркером для моніторингу вираженого стенозу ниркової артерії [12, 15, 45]. Blaufox et al. запропонували ПЕТ-моніторинг з [68Ga] ЕDТА з метою оцінки функціональної активності паренхіми нирок під час проведення хіміотерапії, променевої терапії, визначення показань для донорства нирки тощо [4, 12, 13, 19]. Слід зазначити, що загальні сцинтиграфічні/ОФЕКТ підходи можуть призводити до недооцінки зниження функціональної активності паренхіми однієї з нирок (наприклад, викликаного мальротацією), що має значення не тільки при селективному відборі донорів для трансплантації нирок, а також при іншій патології нирок [49, 50]. У даному випадку доречно застосовувати гібридну візуалізацію ПЕТ/КТ, що включає сучасну програму анатомічної корекції [3]. Окрім цих міркувань, теоретичні підходи до лікування нейроендокринних пухлин (NET) з використанням [68Ga] DOTA-D-Phe-Tyr3-октреотат/октреотид ([68Ga] DOTA-TATE/TOC) та [177Lu] DOTA-TATE/TOC все частіше використовуються у клінічній практиці [44]. Аналоги соматостатину здатні викликати зниження функції нирок, у зв’язку з чим було висунуто гіпотезу, що [99mTc] MAG3 може бути придатним маркером для оцінки ранніх стадій патології нирок у пацієнтів, які зазнали повторних циклів ендорадіотерапії [52]. Таким чином, ПЕТ-агенти для оцінки функціонального стану нирок, включаючи Re (CO) 3 ([18F] FEDA) і [18F] PFH, можуть бути кращими сурогатними маркерами з метою відбору пацієнтів для ендорадіотерапії з потенційним нефротоксичним профілем, у хворих на гемопоетичні злоякісні пухлини або рак передміхурової залози [16, 32].
Також розглянуто сучасні аспекти застосування ПЕТ нирок та сечовидільної системи у педіатричних хворих [4, 15, 48, 51]. ПЕТ нирок та сечовидільної системи надає цінну діагностичну інформацію для ефективного прийняття рішень, оскільки дозволяє одночасно оцінювати функцію нирок і анатомічно-морфологічну складову в одному дослідженні. Крім того, швидкість збору діагностичної інформації ПЕТ вища, ніж звичайної сцинтиграфії, і, таким чином, є меншим променеве навантаження на пацієнтів і медичний персонал [15]. ПЕТ-візуалізація нирок і сечовидільної системи може мати додаткове значення у складних клінічних ситуаціях і забезпечити ефективну підтримку у прийнятті діагностичних рішень, зокрема у педіатричних пацієнтів [54]. Подальший науковий діагностичний пошук повинен бути спрямований на синтезування нових РФП, що матимуть ідеальні властивості для ренальної функціональної візуалізації, низьке зв’язування з білками плазми, високу метаболічну стабільність та низький гепатобіліарний кліренс [54].
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Abrass C.K. Diabetic nephropathy. Mechanisms of mesangial matrix expansion. West J. Med. 1995. Vol. 162. P. 318-321.
2. Arroyo A.J. Effective renal plasma flow determination using technetium-99m MAG3: comparison of two camera techniques with the Tauxe method. J. Nucl. Med. Technol. 1993. Vol. 21. P. 162-166.
3. Awasthi V., Pathuri G., Agashe H.B. Synthesis and in vivo evaluation of p-18F-fluorohippurate as a new radiopharmaceutical for assessment of renal function by PET. J. Nucl. Med. 2011. Vol. 52. P. 147-153. Doi: 10.2967/jnumed.110.075895.
4. Blaufox M.D. PET measurement of renal glomerular filtration rate:is there a role in nuclear medicine? J. Nucl. Med. 2016. Vol. 57. P. 1495-1496. doi: 10.2967/jnumed.116.174607.
5. Chantler C., Garnet E.S., Parsons V. et al. Glomerular filtration rate measurement in man by the single injection methods using 52 Cr-EDTA. Clin. Sci. 1969. Vol. 37. P. 169-180.
6. De Santo N.G., Anastasio Р., Cirillo М. et al. Measurement of glomerular filtration rate by the 99mTc-DTPA renogram is less precise than measured and predicted creatinine clearance. Nephron. 1999. Vol. 81. P. 136-140. https://doi.org/10.1159/000045268.
7. Ducharme J., Goertzen A.L., Patterson J. Practical aspects of 18F-FDGPET when receiving 18F-FDG from a distant supplier. Jnucl. Med. Technol. 2009. Vol. 37. P. 164-169. Doi: 10.2967/jnmt.109.062950.
8. Eshima D. 99mTc renal tubular function agents: current status. Semin. Nucl. Med. 1990. Vol. 20. P. 28-40.
9. Geist B.K., Baltzer P., Fueger B. et al. Assessing the kidney function parameters glomerular filtration rate and effective renal plasma flow with dynamic FDG-PET/MRI in healthy subjects. EJNMMI Res. 2018. Vol. 8. P. 37. doi: 10.1186/s13550-018-0389-1.
10. Gordon I., Piepsz А., Sixt R. Auspices of Paediatric Committee of European Association of Nuclear Medicine. Guidelines for standard and diuretic renogram in children. Eur. J. Nucl. Med. Mol. Imaging. 2011. Vol. 38. P. 1175-1188. Doi: 10.1007/s00259-011-1811-3.
11. Gundel D. Assessing glomerular filtration in small animals using [(68)Ga]DTPA and [(68)Ga]EDTA with PET imaging. Mol. Imaging. Biol. 2018. Vol. 20. P. 457-464. doi. 10.1007/s11307-017-1135-1.
12. Hanssen O., Erpicum Р., Lovinfosse Р. et al. Non-invasive approaches in the diagnosis of acute rejection in kidney transplant recipients. Part I. In vivo imaging methods. Clin. Kidney J 2017. Vol. 10. P. 97-105. Doi: 10.1093/ckj/sfw062.
13. Hartlev L.B., Boeje C.R., Bluhme H. et al. Monitoring renal function during chemotherapy. Eur. J. Nucl. Med. Mol. Imaging. 2012. Vol. 39. P. 1478-1482. doi. 10.1007/s00259-012-2158-0.
14. Hofman M., Binns D., Johnston V. 68Ga-EDTA PET/CTimaging and plasma clearance for glomerular filtration rate quantification: comparison to conventional 51Cr-EDTA. J Nucl Med. 2015. Vol. 56. P. 405-409. https://doi.org/10.2967/jnumed.114.147843.
15. Hofman M.S., Hicks R.J. Gallium-68 EDTA PET/CT for renal imaging. Semin. Nucl. Med. 2016. Vol. 46. P. 448-461. doi: 10.1053/j.semnuclmed.2016.04.002.
16. Hofman M.S., Violet J., Hicks R.J. et al. [(177)Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study. Lancet Oncol. 2018. Vol. 19. P. 825-833. Doi: 10.1016/S1470-2045(18)30198-0.
17. Inker L.A., Schmid C.H., Tighiouart H. et al. Estimating glomerular filtration rate from serum creatinine and cystatin. N. Engl. J. Med. 2012. Vol. 367. P. 20-29. https:// doi.org/10.1056/NEJMoa1114248.
18. Inoue Y., Yoshikawa К., Suzuki Т. et al. Attenuation correction in evaluating renal function in children and adults by a camera-based method. J. Nucl. Med. 2000. Vol. 41. P. 823-829.
19. Jackson P., Foroudi F., Pham D. et al. Short communication: timeline of radiation-induced kidney function loss after stereotactic ablative body radiotherapy of renal cell carcinoma as evaluated by serial (99m)Tc-DMSA SPECT/CT. Radiat. Oncol. 2014. Vol. 9. P. 253. doi: 10.1186/s13014-014-0253-z.
20. Klenc J., Taylor А., Lipowska М. Synthesis and evaluation of 99mTc(CO)3(FEDA): a new dual-purpose 99mTc/18F renal imaging agent. J. Nucl. Med. 2015. Vol. 56. Suppl. 3. P. 654.
21. Klopper J.F., Hauser W., Atkins H.L. et al. Evaluation of 99m Tc-DTPA for the measurement of glomerular filtration rate. J. Nucl. Med. 1972. Vol. 13. P. 107-110.
22. Kobayashi R., Chen Х., Werner R.A. et al. New horizons in cardiac innervationimaging: introduction ofnovel (18)F-labeled PET tracers. Eur. J. Nucl. Med. Mol. Imaging. 2017. Vol. 44. P. 2302-2309. Doi: 10.1007/s00259-017-3828-8.
23. Korol P., Tkachenko М. The role of radioactive methods in the diagnostic type of hydronephrosis in clean-up workers of chornodil accident. Problems of radiation medicine and radiobiology. 2018. Vol. 23. P. 351-358.
24. Kundin V., Pospelov S. Dynamic renoscintigraphy in urjljgical practice. Urology. 2012. Vol. 16. № 4. P. 5-24.
25. Li Z.B., Wu Z., Cao Q. et al. The synthesis of 18F-FDS and its potential application in molecular imaging. Mol. Imaging. Biol. 2008. Vol. 10. P. 92-98. Doi: 10.1007/s11307-007-0125-0.
26. Li J., Zheng Н., Fodah R. Validation of 2-(18)F-fluorodeoxysorbitol as a potential radiopharmaceutical for imaging bacterial infection in the lung. J. Nucl. Med. 2018. Vol. 59. P. 134-139. Doi: org/10.2967/jnumed.117.195420.
27. Lipowska M., Jarkas N., Voll R.J. et al. Re(CO)3([18F]FEDA), a novel (18)F PET renal tracer: radiosynthesis and preclinical evaluation. Nucl. Med. Biol. 2018. Vol. 58. P. 42-50. Doi: 10.1016/j.nucmedbio.2017.12.001.
28. Lipowska M., Klenc J., Jarkas N. et al. Monoanionic (99m)Tc-tricarbonyl-aminopolycarboxylate complexes with uncharged pendant groups: radiosynthesis and evaluation as potential renal tubular tracers. Nucl. Med. Biol. 2017. Vol. 47. P. 48-55. Doi: 10.1016/j.nucmedbio.2016.12.008.
29. Lipowska M., Klenc J., Shetty D. et al. Al18F-NODA-butyric acid: biological evaluation of a new PET renal radiotracer. Nucl. Med. Biol. 2014. Vol. 41. P. 248-253. Doi: 10.1016/j.nucmedbio.2013.12.010.
30. Ma Y.C., Zuo L., Zhang C.L. et al. Comparison of 99mTc-DTPA renal dynamic imaging with modified MDRD equation for glomerular filtration rate estimation in Chinese patients in different stages of chronic kidney disease. Nephrol. Dial. Trаnsplant. 2007. Vol. 22. P. 417-423. Doi: 10.1093/ndt/gfl603.
31. Matsushita K., van der Velde М., Astor В.С. et al. Associationof estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010. Vol. 375. P. 2073-2081. doi: org/10.1016/S0140-6736(10)60674-5.
32. Maurer S., Herhaus Р., Lippenmeyer R. Side effects of CXC-chemokine receptor 4-directed endoradiotherapy with pentixather prior to hematopoietic stem cell transplantation. J. Nucl. Med. 2019. Doi: 10.2967/jnumed.118.223420.
33. Pathuri G., Hedrick А., Awasthi V. et al. Evaluation of Para-18F-fluorohippurate PET renography to predict future disease progression in a rat model of ADPKD. J. Nucl. Med. 2015. Vol. 56. P. 1077.
34. Pathuri G., Sahoo К., Awasthi V. et al. Renogram comparison of p-(18)F]fluorohippurate with o-[(125)I] iodohippurate and [(99m)Tc]MAG3 in normal rats. Nucl. Med. Commun. 2011. Vol. 32. P. 908-912. Doi: 10.1097/MNM.0b013e32834a6db6.
35. Qin Z., Hoh C.K., Olson E.S. et al. Molecular imaging of the glomerulus via mesangial cell uptake of radiolabeled tilmanocept. J. Nucl. Med. 2019. doi: 10.2967/jnumed.118.223727.
36. Rehling M., Nielsen L.E., Marqversen J. Protein binding of 99Tc-DTPA compared with other GFR tracers. Nucl. Med. Commun. 2001. Vol. 22. P. 617-623.
37. Rehling M. Stability, protein binding and clearance studies of [99mTc]DTPA. Evaluation of a commercially available dry-kit. Scand. J. Clin. Lab. Invest. 1988. Vol. 48. P. 603-609.
38. Sanchez-Crespo A. Comparison of gallium-68 and fluorine-18imaging characteristics in positron emission tomography. Appl. Radiat. Isot. 2013. Vol. 76. P. 55-62. doi: 10.1016/j.apradiso.2012.06.034.
39. Schaer L.R., Anger Н.О., Gottschalk А. Gallium edetate 68Ga experiences in brain-lesion detection with the positron camera. JAMA. 1966. Vol. 198. P. 811-813.
40. Shokeir A.A., Gad H.M., el-Diasty T. Role of radioisotope renal scans in the choice of nephrectomy side in live kidney donors. Jurol. 2003. Vol. 170. P. 373-376. Doi: 10.1097/01.ju.0000074897.48830.58.
41. Smith W.W., Finkelstein N., Smith N.F. et al. Renal excretion of hexitols (sorbitol, mannitol, and dulcitol) and their derivatives (sorbitan, isomannide, and sorbide) and of endogenous creatinine-like chromogen in dog and man. J. Biol. Chem. 1940. Vol. 135. P. 231-250.
42. Sobh M., Neamatallah А., Sheashaa Н. Sobh formula: a new formula for estimation of creatinine clearance in healthy subjects and patients with chronic renal disease. Int. Urol. Nephrol. 2005. Vol. 37. P. 403-408. doi: 10.1007/s11255-004-1262-x.
43. Soveri I., Berg U.B., Bjork J. et al. Measuring GFR: a systematic review. Am. J. Kidney Dis. 2014. Vol. 64. P. 5.
44. Strosberg J., El-Haddad G., Wolin Е. et al. Phase 3 trial of (177)Lu-Dotatate for midgut neuroendocrine tumors. N. Engl. J. Med. 2017. Vol. 376. P. 125-135. Doi: 10.1056/NEJMoa1607427.
45. Szabo Z., Xia J., Mathews W.B. et al. Future direction of renal positron emission tomography. Semin. Nucl. Med. 2006. Vol. 36. P. 36-50. Doi: 10.1053/j.semnuclmed.2005.08.003.
46. Taylor A.T. Radionuclides in nephrourology, part 1: radiopharmaceuticals, quality control, and quantitative indices. J. Nucl. Med. 2014. Vol. 55. P. 608-615. Doi: 10.2967/jnumed.113.133447.
47. Taylor A.T. Radionuclides in nephrourology, part 2: pitfalls and diagnostic application. J. Nucl. Med. 2014. Vol. 55. P. 786-798. doi: 10.2967/jnumed.113.133454.
48. Wakabayashi H., Werner R.A., Hayakawa N. Initial preclinical evaluation of 18F-fluorodeoxysorbitol PET as a novel functional renal imaging agent. J. Nucl. Med. 2016. Vol. 57. P. 1625-1628. https://doi.org/10.2967/jnumed.116.172718.
49. Weinberger S., Bader M., Scheurig-Munkler С. et al. Optimizing evaluation of split renal function in a living kidney donor using scintigraphy and calculation of the geometric mean: a case report. Case Rep. Nephrol. Urol. 2014. Vol. 4. P. 1-4. Doi: 10.1159/000358007.
50. Weinberger S., Baeder М., Scheurig-Muenkler С. et al. Optimizing scintigraphic evaluation of split renal function in living kidney donors using the geometric mean method: a preliminary retrospective study. J. Nephrol. 2016. Vol. 29. P. 435-441. Doi: 10.1007/s40620-015-0223-z.
51. Weinstein E.A., Ordonez А.А., De Marco V.P. et al. Imaging Enterobacteriaceae infection in vivo with 18F-fluorodeoxysorbitol positron emission tomography. Sci. Transl. Med. 2014. Vol. 6. P. 259. doi: 10.1126/scitranslmed.3009815.
52. Werner R.A., Beykan S., Higuchi Т. et al. The impact of 177Lu-octreotide therapy on 99mTc-MAG3 clearance is not predictive for late nephropathy. Oncotarget. 2016. Vol. 7. P. 41233-41241.
53. Werner R.A., Chen Х., Hirano М. SPECT vs. PET in cardiac innervation imaging: clash of the titans. Clin. Transl. Imaging. 2018. Vol. 6. P. 293-303. doi: 10.1007/s40336-018-0289-4.
54. Werner R.A., Chen Х., Lapa С. et al. The next era of renal radionuclide imaging: novel PET radiotracers. Eur. J. Nucl. Med. Mol. Imaging. 2019. Vol. 46. P. 1773-1786.
55. Werner R.A., Chen Х., Rowe S.P. et al. Recent paradigm shifts in molecular cardiac imaging — establishing precision cardiology through novel 18F-labeled PET radiotracers. Trends Cardiovasc. Med. 2019. doi: 10.1016/j.tcm.2019.02.007.
56. Werner R.A., Ordonez A.A., Sanchez-Bautista J. et al. Novel functional renal PETimaging with 18F-FDS in human subjects. Clin. Nucl. Med. 2019. Vol. 44. Р. 410-411. doi: /10.1097/RLU.0000000000002494.
57. Werner R.A., Wakabayashi Н., Chen Х. et al. Functional renal imaging with 2-deoxy-2-(18)F-fluorosorbitol PETin rat models of renal disorders. J. Nucl. Med. 2018. Vol. 59. P. 828-832. doi: org/10.2967/jnumed.117.203828.

/72-1.jpg)