Международный эндокринологический журнал Том 15, №6, 2019
Вернуться к номеру
Вплив інфекції Нelicobacter рylori на гормонально-метаболічні показники й маркери хронічного запалення у жінок, хворих на синдром полікістозних яєчників
Авторы: Архипкіна Т.Л., Бондаренко В.О., Любимова Л.П.
ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета: дослідити вплив інфекції Helicobacter pylori (H.рylori) на гормонально-метаболічні показники й маркери хронічного запалення у хворих на синдром полікістозних яєчників (СПКЯ). Матеріали та методи. Обстежено 60 хворих із СПКЯ (середній вік — 26,4 ± 0,2 року) та 40 здорових жінок відповідного віку. Досліджували ліпідний спектр крові, показники вуглеводного обміну, загальний тестостерон (Тзаг.), естрадіол, сексстероїдзв’язуючий глобулін (ССЗГ), С-реактивний білок (СРБ), інтерлейкін-6 (ІЛ-6), антитіла IgG до H.pylori, гомоцистеїн. Оцінку визначених показників проводили залежно від наявності або відсутності інфекції H.pylori. Результати. Встановлено, що в контрольній групі підвищений рівень антитіл IgG до H.pylori зустрічався у 17,5 % обстежених, у них спостерігалось зниження концентрації ССЗГ та підвищення рівнів СРБ і гомоцистеїну. Серед пацієнток зі СПКЯ інфекція Н.pylori зустрічалась значно частіше (χ2 = 7,7; Р < 0,01), а її наявність посилювала існуючі дисліпідемію, інсулінорезистентність (ІР), гіперандрогенемію за рахунок підвищення рівня Тзаг. і зниження ССЗГ та супроводжувалась формуванням гіпергомоцистеїнемії й значним підвищенням маркерів запалення. Встановлено, що у пацієнток із СПКЯ підвищення рівня СРБ в сироватці пов’язане з наявною ІР і дисліпідемією, а збільшення рівнів ІЛ-6 — зі ступенем вираженості ІР й гіперандрогенемії. Висновки. Отримані результати вказують на тісний зв’язок між СПКЯ та інфекцією H.pylori, яка посилює наявні метаболічні і гормональні порушення, притаманні СПКЯ, призводить до підвищення СРБ та ІЛ-6. Однак не можна стверджувати, що дана інфекція є новим патогенетичним фактором формування СПКЯ.
Цель: изучить влияние инфекции Helicobacter pylori (H.рylori) на гормонально-метаболические показатели и маркеры хронического воспаления у больных с синдромом поликистозных яичников (СПКЯ). Материалы и методы. Обследовано 60 больных с СПКЯ (средний возраст — 26,4 ± 0,2 года) и 40 здоровых женщин соответствующего возраста. Исследовали липидный спектр крови, показатели углеводного обмена, общий тестостерон (Тобщ.), эстрадиол, сексстероидсвязывающий глобулин (СССГ), С-реактивный белок (СРБ), интерлейкин-6 (ИЛ-6), антитела IgG к H.pylori, гомоцистеин. Оценку изучаемых показателей проводили в зависимости от наличия или отсутствия инфекции H.pylori. Результаты. Установлено, что в контрольной группе повышенный уровень антител IgG к H.pylori встречался у 17,5 % обследованных женщин, у них наблюдалось снижение концентрации СССГ и повышение уровня СРБ и гомоцистеина. Среди пациенток с СПКЯ инфекция Н.pylori встречалась значительно чаще (χ2 = 7,7; р < 0,01), а ее наличие усугубляло существующие дислипидемию, инсулинорезистентность (ИР), гиперандрогенемию за счет повышения уровня Тобщ. и снижения СССГ, сопровождалось формированием гипергомоцистеинемии и значительным повышением маркеров воспаления. Установлено, что у пациенток с СПКЯ повышение уровня СРБ в сыворотке связано с имеющейся ИР и дислипидемией, а повышение уровня ИЛ-6 — со степенью выраженности ИР и гиперандрогенемии. Выводы. Полученные результаты указывают на тесную связь между СПКЯ и инфекцией H.pylori, которая усиливает имеющиеся метаболические и гормональные нарушения, характерные для СПКЯ, приводит к повышению СРБ и ИЛ-6. Однако нельзя утверждать, что данная инфекция является новым патогенетическим фактором формирования СПКЯ.
Background. The purpose of this study was to evaluate the impact of Helicobacter pylori (H.pylori) infection on hormonal and metabolic parameters, markers of chronic inflammation in patients with polycystic ovary syndrome (PCOS). Materials and methods. Sixty patients with PCOS (26.4 ± 0.2 years) and 40 healthy women of corresponding age were examined. We have investigated blood lipid spectrum, parameters of carbohydrate metabolism, levels of total testosterone, estradiol, sex hormone-binding globulin, C-reactive protein, interleukin-6, IgG antibodies to H.pylori, homocysteine. Evaluation of these indicators was performed depending on the presence or absence of H.pylori infection. Results. It was found that in the control group, elevated levels of IgG antibodies to H.pylori were detected in 17.5 % of women, and they had a decrease in the concentration of sex hormone-binding globulin and an increase in the level of C-reactive protein and homocysteine. Among patients with PCOS, H.pylori infection was significantly more common (χ2 = 7.7; p < 0.01), and its presence exacerbated existing dyslipidemia, insulin resistance, hyperandrogenemia by increasing the levels of total testosterone and decreasing the content of sex hormone-binding globulin, it was accompanied by the formation of hyperhomocysteinemia and a significant increase in inflammatory markers. It was found that in patients with PCOS, increased concentration of C-reactive protein in the blood serum was associated with insulin resistance and dyslipidemia, and increased levels of interleukin-6 — with the severity of insulin resistance and hyperandrogenemia. Conclusions. The results indicate a strong relationship between PCOS and H.pylori infection, which enhances the existing metabolic and hormonal disorders characteristic of PCOS, leads to an increase in C-reactive protein and interleukin-6 levels. However, it cannot be said that this infection is a new pathogenic factor for the formation of PCOS.
синдром полікістозних яєчників; інфекція Helicobacter pylori; гіперандрогенемія; дисліпідемія; інсулінорезистентність; С-реактивний білок; інтерлейкін-6
синдром поликистозных яичников; инфекция Helicobacter pylori; гиперандрогенемия; дислипидемия; инсулинорезистентность; С-реактивный белок; интерлейкин-6
polycystic ovary syndrome; Helicobacter pylori infection; hyperandrogenemia; dyslipidemia; insulin resistance; C-reactive protein; interleukin-6
Вступ
Синдром полікістозних яєчників (СПКЯ) — складне багатофакторне захворювання з мультигенним успадкуванням, що формується під впливом епігенетичних факторів і факторів навколишнього середовища [1]. За останні 5 років опубліковано понад 4500 статей з проблеми СПКЯ, велика частина з яких присвячена етіології і патогенезу цього захворювання. Добре вивчено гормональні та метаболічні порушення при СПКЯ, встановлено, що додаткову роль в патогенезі можуть відігравати оксидативний стрес, порушення ангіогенезу, а також формування хронічного системного запального процесу [2]. Хоча етіологія системного запалення при СПКЯ залишається неясною, останні дані вказують на інтригуючий зв’язок між СПКЯ, запаленням і хронічними інфекційними агентами, такими як Helicobacter pylori (H.pylori) [3]. H.pylori вражає приблизно 50 % населення світу, а в країнах, що розвиваються, ця інфекція — більше 70 % населення [4]. В Україні зберігається високий рівень як поширеності, так і захворюваності на H.рylori [5].
Наслідки зараження H.pylori пов’язані з розвитком різних шлунково-кишкових захворювань, таких як хронічний гастрит, виразкова хвороба та злоякісні новоутворення шлунка. Інфекція викликає хронічну клітинну запальну відповідь у слизовій оболонці шлунка і кишечника. Однак ефекти цього локального запалення не обме–жуються тільки травним трактом, а можуть поширюватися на тканини або органи, що знаходяться поза кишечником [6]. Останніми роками багато статей було опубліковано на актуальну тему екстрагастро–дуоденальних проявів хелікобактерної інфекції, в тому числі гематологічних, серцево-судинних, ней–родегенеративних і алергічних захворювань [7, 8]. Хоча наявні сьогодні дані не забезпечують доказів її ролі в більшості з цих захворювань, в той же час не можна виключати їх потенційний взаємозв’язок. Так, багатьма епідеміо–логічними дослідженнями підтверджено зв’язок між інфекцією H.pylori і метаболічним синдромом [9]. T.P. Chen і співавт. продемонстрували, що серед осіб, інфікованих H.pylori, була більш висока поширеність метаболічного синдрому, ніж серед пацієнтів без інфекції [10]. У цьому контексті припустили, що інфекція H.pylori може бути причиною різних ендокринних розладів, таких як ожиріння, інсулінорезистентність (ІР) та дисліпідемія [11].
Надлишкова маса тіла та ожиріння є глобальною проблемою, особливо в розвинених країнах, і одним з найбільш важливих факторів ризику метаболічного синдрому [12]. Однак питання щодо наявності зв’язку між ожирінням і інфекцією H.рylori на сьогодні залишається суперечливим. Одні науковці висловлюють припущення, що ожиріння або надлишкова маса тіла можуть бути пов’язані зі збільшенням частоти колонізації H.pylori [13]. У той же час іншими дослідниками цей зв’язок не підтверджується [14]. В огляді Dhurandhar і співавт. [15] повідомлялося про збільшення маси тіла після ерадикації H.pylori, тобто є зворотна кореляція між інфекцією H.pylori і ожирінням. Між тим вказано, що більш виражений вплив на індекс маси тіла (ІМТ) інфекція Н.pylori має у пацієнтів віком до 50 років, коли H.рylori активна і більшою мірою впливає на ІР [16]. Polyzos і співавт. провели літературний огляд, який включав дев’ять досліджень, і показали позитивний зв’язок між інфекцією H.pylori і резистентністю до інсуліну [17]. Надалі іншими дослідниками ці дані були підтверджені [18]. При хронічному запаленні ІР, індукована H.pylori, може бути викликана побічно або безпосередньо шляхом активації певних сигнальних шляхів. Хронічне запалення, що викликане H.pylori, може посилювати експресію C-реактивного білка (СРБ), фактора некрозу пухлини α (TNF-α) і інтерлейкіну-6 (ІЛ-6) [19]. Ці цитокіни активують шляхи IKK/NF-κB і JNK, які можуть запускати ІР внаслідок збільшення фосфорилювання рецептора інсуліну на серині [20] або пригнічення фосфорилювання субстрату-1 рецептора інсуліну на залишках тиро–зину [21].
Одним із патернів, за допомогою яких реалізується вплив H.рylori-інфекції на системне запалення, є вплив його на ліпідний обмін. G. Chimienti і співавт. зауважили, що хронічна H.рylori-інфекція модифікує ліпідний профіль сироватки крові, а саме призводить до зростання рівнів загального холестерину (ХС), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), триглицеридів (ТГ), аполіпопротеїну, індексу атерогенності та зниження рівня холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), також впливає на концентрації таких прозапальних маркерів, як ліпопротеїн (а) [22]. H.pylori здатна модифікувати ліпідний профіль крові за допомогою дії прозапальних цитокінів, таких як ІЛ-6, інтерферон α і TNF-α. Ці цитокіни по-різному впливають на метаболізм ліпідів, включаючи активацію ліпопротеїнліпази жирової тканини, стимуляцію синтезу жирних кислот в печінці і впливу на ліполіз [23].
Гіпотеза про те, що інфекція H.pylori може підвищити ризик безплідності у жінок, вперше була розглянута в 2002 р. [24]. Через кілька років ці дані були підтверджені японськими дослідниками, які обстежили 204 пацієнтки [25]. В подальшому з’явилися повідомлення, які свідчили, що H.pylori була значно більш поширена серед жінок зі СПКЯ, ніж серед здорових відповідного віку [26]. На сьогодні доведено, що СПКЯ є прозапальним станом, з’являються дані про те, що хронічне запалення слабкого ступеня також може бути пов’язане з такими важливими аспектами цього захворювання, як ІР, дисліпідемія, збільшення вісцерального ожиріння, до того ж запалення вважається ключовою ознакою ендотеліальної дисфункції (ЕД) [27]. Останні повідомлення вказують на можливість зв’язку між СПКЯ, запаленням і хронічними інфекційними агентами низького класу, такими як Н.pylori [28].
Відомо, що СПКЯ пов’язаний з маркерами хронічного запалення низького ступеня, до яких відносяться СРБ, ІЛ-6 і TNF-α [29]. СРБ є реактивом гострої фази, продукується гепатоцитами під стимулюючим контролем прозапальних цитокінів, таких як ІЛ-6 і TNF-α. СРБ може не тільки викликати запальні захворювання, але й посилювати запальний процес шляхом подальшої активації моноцитів та ендотеліальних клітин [30]. ІЛ-6 також є раннім маркером і ключовим медіатором хронічного запального процесу при СПКЯ [31]. На додаток до вищезазначених біомаркерів існують інші прозапальні маркери. Деякі з досліджень показали зв’язок між вищезгаданими циркуляторними маркерами хронічного запалення та гіперінсулінемією і ІР [32].
Однак досі питання щодо участі інфекції H.pylori в розвитку запальних розладів або в погіршенні клінічних проявів СПКЯ залишається невирішеним [33].
Незважаючи на те, що бактерія H.pylori вважається патогенною для людини, існують дані, які свідчать про те, що вона також може бути коменсальною (синантропною). Ця думка підтверджується простим спостереженням, що бактерії присутні у дуже багатьох людей, але викликають відносно мало симптомів або патологій. У зв’язку з цим виникає питання про те, чи слід називати H.pylori синантропною або патогенною, оскільки патології, ймовірно, пов’язані не тільки зі специфічними ознаками H.pylori, але також з низкою станів, які притаманні хворим із СПКЯ [34].
Мета: дослідити вплив інфекції H.рylori на гормонально-метаболічні показники та маркери хронічного запалення у хворих із СПКЯ.
Матеріали та методи
Нами відібрано 60 хворих із СПКЯ і безплідністю (середній вік — 26,4 ± 0,2 року), яким проводили лікування в клініці ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України» з 2017 по 2019 рік.
Групу порівняння становили 40 здорових жінок з нормальною менструальною функцією, які звернулися в клініку для уточнення стану репродуктивної системи перед плануванням вагітності. Хворі обох груп були порівнянні за віком і масою тіла.
ІМТ розраховували за формулою G. Brey: маса тіла (кг)/довжина тіла (м2) [35]. Для оцінки розподілу жирової тканини визначали співвідношення «окружність талії (ОТ)/окружність стегон (ОС)». Окружність талії понад 0,80 м при співвідношенні ОТ/ОС більше 0,85, згідно з критеріями IDF (2009) та робочою версією критеріїв IDF, NHLBI, AHA, WHF, IAS, IASO (2009), розцінювалась як ознака абдомінального (андроїдного) типу ожиріння.
Для верифікації ІР розраховували гомеостатичний індекс HOMA-IR [36]. Індекс HOMA-IR = рівень імунореактивного інсуліну (ІРІ) натще (мкОД/мл) × рівень глюкози натще (ммоль/л)/22,5. Значення показника НОМА-IR вище 2,5 розцінювали як об’єктивний критерій ІР. ІРІ сироватки крові визначали за допомогою наборів фірми DRG (США). Концентрацію ІРІ понад 12,5 мкОД/мл розцінювали як наявність ІР [37].
Показники ліпідного обміну вивчали шляхом використання ферментативних колорометричних методів. Визначення ХС і ТГ проводили за допомогою наборів фірми «СпайнЛаб» (Харків, Україна), ХС ЛПВЩ — за допомогою набору фірми BioSystems (Коста-Брава, Іспанія). Концентрації ХС ЛПНЩ та холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ) обчислювали розрахунковим методом за загальновизнаними формулами: ХС ЛПДНЩ = ТГ × 0,45; ХС ЛПНЩ = ХС – ХС ЛПДНЩ – ХС ЛПВЩ.
Для визначення гормонального стану досліджували рівні загального тестостерону (Тзаг.) (тест-системи фірми «Алкор Био», Росія), естра–діолу (Е2), сексстероїдзв’язуючого глобуліну (ССЗГ) (тест-системи фірми DRG, США). Визначення рівня секреції гормонів в сироватці крові проводили на 2–3-й день самостійного або індукованого менструального циклу. Індекс вільних андрогенів (ІВА) розраховували за формулою: ІВА = (Тзаг./ССЗГ) × × 100 % [38].
Визначення рівня гомоцистеїну (ГЦ) в сироватці крові проводили з використанням наборів Architect system (Німеччина). На сьогодні існують розбіжності у визначенні норми концентрації ГЦ. Дані літератури свідчать, що нормальна концентрація ГЦ в крові жінок репродуктивного віку (18–40 років) не повинна перевищувати 8–10 мкмоль/л [39]. У подальшій роботі концентрацію в крові ГЦ 10 мкмоль/л розглядали як верхню межу норми.
Рівні СРБ в сироватці крові досліджували турбідиметричним методом з використанням реактивів BioSystems (Іспанія). Рівні ІЛ-6 та антитіл IgG до H.pylori в сироватці крові визначали імунометричним методом з використанням наборів Siemens (Німеччина).
Дослідження було схвалено Комісією з біоетики (протокол № 4 від 23 березня 2016 року) та підтверджено його відповідність морально-етичним нормам і принципам Гельсінської декларації, Конвенції Ради Європи про права людини та біомедицини (1997), положенням Всесвітньої організації охорони здоров’я (ВООЗ), Міжнародної ради медичних наукових товариств, Міжнародного кодексу медичної етики (1983), вимогам і нормам ІСН GSP (2002), Типовому положенню про комісії з питань етики при лікувально-профілактичних закладах, у яких проводять клінічні випробування, Наказ МОЗ України № 523 від 12.07.2012 р. та відповідним законам України щодо дотримання прав людини.
Статистичний аналіз отриманих даних проводили з використанням пакета статистичних розрахунків Excel Microsoft. Для аналізу залежностей між кількісними показниками був використаний кореляційний аналіз Пірсона (r). З огляду на нормальний характер розподілу дані в таблицях наведені як середнє арифметичне ± стандартна помилка середнього арифметичного. Середні значення порівнювали за допомогою t-критерію Стьюдента. Значимість розбіжностей між групами оцінювали методом χ2. Результати дослідження вважали вірогідними, відмінності між показниками значущими при ймовірності безпомилкового прогнозу не менше 95 % (р < 0,05).
Результати
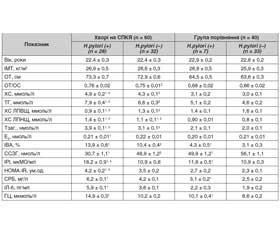
У результаті проведеної роботи встановлено, що у 28 (46,7 %) хворих із СПКЯ спостерігалося зростання рівня антитіл до H.pylori. У групі порівняння інфекція Н.pylori відзначалася у 7 (17,5 %) обстежених жінок. Тобто інфекція Н.pylori значно частіше (χ2 = 7,7; р < 0,01) траплялася серед пацієнток із СПКЯ, ніж серед здорових жінок, що узгоджується з даними літератури [40].
Перш ніж оцінювати інфекцію H.рylori як додатковий прояв захворювань, не пов’язаних із травною системою, пов’язаних з формуванням запального процесу у хворих із СПКЯ, нами проведено аналіз взаємозв’язку між інфекцією H.рylori та гормональними і метаболічними показниками у пацієнток групи порівняння. Встановлено, що в обстежених, серопозитивних до H.рylori, ІМТ, індекси НОМА-IR були дещо вищими, а рівні ХС ЛПВЩ нижчими, проте ці відмінності не були значущими (табл. 1). Ми не знайшли кореляційної залежності між показником антитіл до інфекції H.pylori та концентрацією ХС (r = 0,193; р > 0,05), ТГ (r = 0,251; р > 0,05). Водночас у жінок групи порівняння за наявності інфекції H.pylori виявлене вірогідне зниження рівня ССЗГ (р < 0,001) при показнику Тзаг., відповідному референтним значенням норми, що призводило до підвищення ІВА (р < 0,05). Низька концентрація ССЗГ є сурогатним маркером ІР, що дозволяє прогнозувати підвищену чутливість до розвитку метаболічного синдрому. Також виявлено помірне зростання (р < 0,05) середнього значення показника маркера хронічного запалення — СРБ та концентрації ГЦ, що може бути одним із чинників формування ЕД.
Щодо пацієнток із СПКЯ, то за відсутності інфекції H.pylori вони мали вірогідно (р < 0,05) більш високі рівні Тзаг., ІВА, ГЦ, ІРІ, індексу НОМА-IR, ХС, ТГ, ХС ЛПНЩ та більш низькі рівні ХС ЛПВЩ, ССЗГ в сироватці крові порівняно з серонегативними жінками групи порівняння (табл. 1).
За наявності інфекції H.pylori у хворих із СПКЯ встановлено значне підвищення показників ІРІ (р < 0,001), індексу HOMA-IR (р < 0,02), ХС (р < 0,02), ТГ (р < 0,02), ХС ЛПНЩ (р < 0,05) та зниження рівня ХС ЛПВЩ (р < 0,02) порівняно з пацієнтами, у яких інфекція була відсутня. Крім того, у жінок із СПКЯ, серопозитивних до H.рylori, виявлено більш високий ІВА (р < 0,001) за рахунок підвищення концентрації Тзаг. (р < 0,001) і зниження вмісту ССЗГ (р < 0,001) в сироватці крові (табл. 1).
В обох підгрупах хворих із СПКЯ рівні СРБ та ІЛ-6 вірогідно перевищували показники жінок групи порівняння, та ці маркери були вірогідно вищими за умов наявності H.рylori. Дані літератури вказують, що одним з факторів, що призводить до зростання цих маркерів, може бути надлишкова маса тіла [41]. У нашому дослідженні у хворих із СПКЯ та жінок групи порівняння ІМТ вірогідно не розрізнявся, водночас ступінь підвищення рівнів циркулюючих в сироватці крові СРБ та ІЛ-6 був статистично значущо вищим за умов наявності СПКЯ. Водночас привертало увагу, що у пацієнток із СПКЯ існувало вірогідне (р < 0,001) підвищення коефіцієнта ОТ/ОС за рахунок збільшення показника ОТ (р < 0,001), що вказувало на наявність схильності у них до абдомінальної кумуляції жиру. Відомо, що саме абдомінальна жирова тканина є джерелом ІЛ-6, який стимулює синтез СРБ у печінці [41]. Можливо припустити, що високий відсоток надлишкової жирової тканини у хворих із СПКЯ є одним з чинників, який й призводить до зростання цих маркерів. Крім того, проведене нами дослідження показало, що підвищені рівні СРБ в сироватці крові також пов’язані й з іншими особливостями, притаманними СПКЯ. Зокрема, встановлена кореляційна залежність між СРБ та ІРІ (r = 0,301; р < 0,02), індексом НОМА-IR (r = 0,346; р < 0,01), ХС (r = 0,283; р < 0,05), ТГ (r = 0,314; р < 0,02), ХС ЛПНЩ (r = 0,291; р < 0,05) й не виявлено зв’язку СРБ з Тзаг. (r = 0,165; р > 0,05) і ССЗГ (r = 0,109; р > 0,05). Наявність інфекції H.pylori посилювала ці зв’язки.
Більш виражене підвищення рівнів ІЛ-6 також спостерігалось серед обстежених зі СПКЯ, які були серопозитивними до H.pylori. При цьому встановлено залежність рівня ІЛ-6 від показників індексу HOMA-IR (r = 0,290; р < 0,05) і Тзаг. (r = 0,337; р < 0,02). Можна припустити, що у жінок із СПКЯ формуванню хронічного запалення сприяють гормональні і метаболічні фактори, притаманні для СПКЯ, а наявність інфекції H.рylori посилює дану патологію.
Хронічне запалення слабкого ступеня вираженості тісно пов’язане з запаленням ендотелію й подальшим розвитком ЕД [42]. Останніми роками з’явилися докази, що одним із факторів, який призводить до ЕД, може бути підвищена концентрація сироваткового рівня ГЦ, амінокислоти, яка містить сірку та утворюється в результаті метаболізму метіоніну [43]. Під впливом гіпергомоцистеїнемії (ГГЦ) відбувається підвищення експресії прозапальних цитокінів, зміна біодоступності NO, індукція оксидативного стресу, активація апоптозу і дефектного метилювання, що інгібує ооцитарну та фолікулярну матурацію, а також стероїдогенез в яєчниках та ускладнює настання вагітності [44]. Проведений кореляційний аналіз виявив наявність прямої статистично значущої залежності між ГЦ та Тзаг. (r = 0,321; р < 0,02), Тзаг./Е2 коефіцієнтом (r = 0,387; р < 0,01), що дає можливість припустити існування впливу порушень тестостерон-естрадіолових зв’язків на формування ГГЦ. Крім того, наявність інфекції H.pylori також супроводжується значним підвищенням концентрації ГЦ. Хоча більшість ендокринних і метаболічних розладів, обумовлених СПКЯ, пов’язані зі зростанням рівнів СРБ і ГЦ в сироватці крові, кореляційного взаємозв’язку між ГЦ і СPБ нами не виявлено (r = 0,192; р > 0,05), що може вказувати на різні патофізіологічні шляхи формування.
Обговорення
Інфекція H.рylori — це ще одна проблема, яка викликає суперечки і заслуговує подальшого вивчення. На сьогодні H.pylori розглядається як альтеруючий агент, здатний не тільки безпосередньо спричинити місцеву запальну реакцію в слизовій оболонці шлунка та дванадцятипалої кишки, але й опосередковано впливати на процеси системного запалення шляхом впливу на біохімічні ланки метаболізму [9–11, 13]. У процесі проведеного дослідження було виявлено, що у молодих жінок наявність інфекції H.рylori супроводжується зниженням концентрації ССЗГ та помірним підвищенням рівня СРБ в сироватці крові. На думку низки вчених, виявлені зміни підвищення пов’язані з загрозою формування метаболічного синдрому, що в майбутньому може прискорити розвиток ІР та цукрового діабету [45]. Іншим, не менш важливим фактором у формуванні метаболічного синдрому може стати виявлене підвищення рівня ГЦ [46]. Комбінація підвищеного СРБ з ГГЦ, за даними літератури, є найбільш небезпечною щодо формування метаболічних порушень та ЕД [47].
Даний аналіз чітко вказує, що СПКЯ — прозапальний стан, пов’язаний зі значним підвищенням маркерів запалення СРБ та ІЛ-6. Зростання цих маркерів обумовлене розладами, притаманними СПКЯ, а саме дисліпідемією та наявністю надлишкової жирової тканини. Однак за умов інфекції H.рylori зміни цих показників є більш вираженими. Крім того, у серопозитивних до H.рylori хворих зі СПКЯ виявлено більш високий ступінь вираженості гіперандрогенемії за рахунок підвищення рівня Тзаг., зниження ССЗГ і порушення Тзаг./Е2 співвідношення. У свою чергу, порушення андроген/естрагенового балансу є одним із предикторів формування ГГЦ [48], а поєднання підвищених рівнів СРБ і ГЦ ще більше підсилює патологічні процеси, притаманні СПКЯ. Проведене дослідження дозволяє зробити припущення, що у пацієнтів зі СПКЯ підвищення рівня СРБ в сироватці пов’язане з наявною ІР і дисліпідемією, а збільшення рівнів ІЛ-6 корелює зі ступенем вираженості ІР і гіперандрогенемії.
Зв’язок між H.pylori і СПКЯ заслуговує на подальше вивчення, оскільки поєднання цих патологічних станів посилює метаболічні і гормональні розлади при СПКЯ та сприяє зростанню маркерів хронічного запалення.
Висновки
1. Інфекція H.pylori трапляється значно частіше серед хворих із СПКЯ (46,7 %), ніж серед здорових жінок.
2. У молодих жінок за наявності інфекції H.рylori відбувається зниження рівня ССЗГ та помірне підвищення показників СРБ й ГЦ в сироватці крові, що може прискорювати розвиток метаболічних порушень та ендотеліальної дисфункції.
3. У хворих зі СПКЯ та наявністю інфекції H.pylori встановлено більш виражені зміни у метаболічних і гормональних показниках, а також підвищені маркери запалення, такі як СРБ та ІЛ-6. Проведені дослідження дозволяють припустити, що зростання рівня СРБ в сироватці пов’язане з наявними ІР і дисліпідемією, а ІЛ-6 — зі ступенем вираженості ІР та гіперандрогенемії.
4. Аналіз отриманих результатів вказує на тісний зв’язок між інфекцією H.pylori та СПКЯ, проте не можна стверджувати, що дана інфекція є новим патогенетичним фактором формування СПКЯ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при виконанні роботи та написанні статті.
- Nandi A, Chen Z, Patel R, Poretsky L. Polycystic ovary syndrome. Endocrinol Metab Clin North Am. 2014;43(1):123-47. doi: 10.1016/j.ecl.2013.10.003.
- Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E; American Association of Clinical Endocrinologists (AACE); American College of Endocrinology (ACE); Androgen Excess and PCOS Society (AES). State clinical review: guide to the best practices in the evaluation and treatment of polycystic ovary syndrome – part 1. Endocr Pract. 2015;21(11):1291-300. doi: 10.4158/EP15748.DSC.
- Yavasoglu I, Kucuk M, Cildag B, Arslan E, Gok M, Kafkas S. A novel association between polycystic ovary syndrome and Helicobacter pylori. Am J Med Sci. 2009 Sep;338(3):174-7. doi: 10.1097/MAJ.0b013e3181a63c8a.
- Albaker WI. Helicobacter pylori infection and its relationship to metabolic syndrome: is it a myth or fact? Saudi J Gastroenterol. 2011 May-Jun;17(3):165-9. doi: 10.4103/1319-3767.80377.
- Kolesnikova OV, Kozyreva TE. Is Infection Helicobacter pylori only problem of gastroenterology? Modern Gastroenterology. 2014;6(80):137-141. (in Ukrainian).
- Wong F, Rayner-Hartley E, Byrne MF. Extraintestinal manifestations of Helicobacter pylori: a concise review. World J Gastroenterol. 2014.20(34):11950-11961. doi: 10.3748/wjg.v20.i34.11950.
- Bravo D, Hoare A, Soto C, Valenzuela MA, Quest AF. Helicobacter pylori in human health and disease: Mechanisms for local gastric and systemic effects. World J Gastroenterol. 2018 Jul 28;24(28):3071-3089. doi: 10.3748/wjg.v24.i28.3071.
- Tsay FW, Hsu PI. Helicobacter pylori infection and extra-gastroduodenal diseases. J Biomed Sci. 2018 Aug 29;25(1):65. doi: 10.1186/s12929-018-0469-6.
- Polyzos SA, Kountouras J, Zavos C, Deretzi G. The association between Helicobacter pylori infection and insulin resistance: a systematic review. Helicobacter. 2011 Apr;16(2):79-88. doi: 10.1111/j.1523-5378.2011.00822.x.
- Chen TP, Hung HF, Chen MK, et al. Helicobacter Pylori Infection is Positively Associated with Metabolic Syndrome in Taiwanese Adults: a Cross-Sectional Study. Helicobacter. 2015;20(3):184-91. doi: 10.1111/hel.12190.
- Papamichael KX, Papaioannou G, Karga H, Roussos A, Mantzaris GJ. Helicobacter pylori infection and endocrine disorders: Is there a link? World J Gastroenterol. 2009 Jun 14;15(22):2701-7. doi: 10.3748/wjg.15.2701.
- Chen LW, Kuo SF, Chen CH, Chien CH, Lin CL, Chien RN. A community-based study on the association between Helicobacter pylori infection and obesity. Sci Rep. 2018;8(1):10746. doi: 10.1038/s41598-018-28792-1.
- Arslan E, Atilgan H, Yavaşoğlu I. The prevalence of Helicobacter pylori in obese subjects. Eur J Intern Med. 2009;20(7):695-697. doi: 10.1016/j.ejim.2009.07.013.
- Carabotti M, D’Ercole C, Iossa A, Corazziari E, Silecchia G, Severi C. Helicobacter pylori infection in obesity and its clinical outcome after bariatric surgery. World J Gastroenterol. 2014;20(3):647-653. doi: 10.3748/wjg.v20.i3.647.
- Dhurandhar NV, Bailey D, Thomas D. Interaction of obesity and infections. Obes Rev. 2015;16(12):1017-29. doi: 10.1111/obr.12320.
- Chen LW, Chien CY, Yang KJ, Kuo SF, Chen CH, Chien RN. Helicobacter pylori Infection Increases Insulin Resistance and Metabolic Syndrome in Residents Younger than 50 Years Old: A Community-Based Study. PLoS One. 2015;10(5):e0128671. doi: 10.1371/journal.pone.0128671.
- Polyzos SA, Kountouras J, Zavos C, Deretzi G. The association between Helicobacter pylori infection and insulin resistance: a systematic review. Helicobacter. 2011;16(2):79-88. doi: 10.1111/j.1523-5378.2011.00822.x.
- Hossain IA, Akter S, Bhuiyan FR, Shah MR, Rahman MK, Ali L. Subclinical inflammation in relation to insulin resistance in prediabetic subjects with nonalcoholic fatty liver disease. BMC Res Notes. 2016;9:266. doi: 10.1186/s13104-016-2071-x.
- Yildirim Z, Bozkurt B, Ozol D, et al. Increased Exhaled 8-Isoprostane and Interleukin-6 in Patients with Helicobacter pylori Infection. Helicobacter. 2016;21(5):389-94. doi: 10.1111/hel.12302.
- Hotamisligil GS, Johnson RS, Distel RJ, Ellis R, Papaioannou VE, Spiegelman BM. Uncoupling of obesity from insulin resistance through a targeted mutation in aP2, the adipocyte fatty acid binding protein. Science.1996;274(5291):1377-9. doi: 10.1126/science.274.5291.1377.
- Dandona P, Aljada A, Bandyopadhyay A. Inflammation: the link between insulin resistance, obesity and diabetes. Trends Immunol. 2004;25(1):4-7. doi: 10.1016/j.it.2003.10.013.
- Chimienti G, Russo F, Lamanuzzi BL, et al. Helicobacter pylori is associated with modified lipid profile: impact on Lipoprotein(a). Clin Biochem. 2003;36(5):359-65. doi: 10.1016/s0009-9120(03)00063-8.
- Ruggiero P. Helicobacter pylori and inflammation. Curr Pharm Des. 2010;16(38):4225-36. doi: 10.2174/138161210794519075.
- Figura N, Piomboni P, Ponzetto A, et al. Helicobacter pylori infection and infertility. Eur J Gastroenterol Hepatol. 2002;14(6):663-9. doi: 10.1097/00042737-200206000-00012.
- Kurotsuchi S, Ando H, Iwase A, Ishida Y, Hamajima N, Kikkawa F. The plausibility of Helicobacter pylori-related infertility in Japan. Fertil Steril. 2008;90(3):866-868. doi: 10.1016/j.fertnstert.2007.06.097.
- Yavasoglu I, Kucuk M, Cildag B, Arslan E, Gok M, Kafkas S. A novel association between polycystic ovary syndrome and Helicobacter pylori. Am J Med Sci. 2009;338(3):174-177. doi: 10.1097/MAJ.0b013e3181a63c8a.
- Tokmak A, Doğan Z, Sarıkaya E, Timur H, Kekilli MJ. Helicobacter pylori infection and polycystic ovary syndrome in adolescent and young adult patients. Obstet Gynaecol Res. 2016;42(12):1768-1772. doi: 10.1111/jog.13103.
- Duleba AJ, Dokras A. Is PCOS an inflammatory process? Fertil Steril. 2012;97(1):7-12. doi:10.1016/j.fertnstert.2011.11.023.
- Nehir Aytan A, Bastu E, Demiral I, Bulut H, Dogan M, Buyru F. Relationship between hyperandrogenism, obesity, inflammation and polycystic ovary syndrome. Gynecol Endocrinol. 2016;32(9):709-713. doi: 10.3109/09513590.2016.1155208.
- Castell JV, Gómez-Lechón MJ, David M, et al. Interleukin-6 is the major regulator of acute phase protein synthesis in adult human hepatocytes. FEBS Lett. 1989;242(2):237-239. doi: 10.1016/0014-5793(89)80476-4.
- Tumu VR, Govatati S, Guruvaiah P, Deenadayal M, Shivaji S, Bhanoori M. An interleukin-6 gene promoter polymorphism is associated with polycystic ovary syndrome in South Indian women. J Assist Reprod Genet. 2013;30(12):1541-1546. doi: 10.1007/s10815-013-0111-1.
- Diamanti-Kandarakis E, Alexandraki K, Piperi C. Inflammatory and endothelial markers in women with polycystic ovary syndrome. Eur J Clin Invest. 2006;36(10):691-697. doi: 10.1111/j.1365-2362.2006.01712.x.
- Moretti E, Figura N, Collodel G, Ponzetto A. Can Helicobacter pylori infection influence human reproduction? World J Gastroenterol. 2014;20(19):5567-5574. doi:10.3748/wjg.v20.i19.5567.
- Bravo D, Hoare A, Soto C, Valenzuela M, Quest AFG. Helicobacter pylori in human health and disease: Mechanisms for local gastric and systemic effects. World J Gastroenterol. 2018;24(28):3071-3089. doi: 10.3748/wjg.v24.i28.3071.
- Ezeh U, Pall M, Mathur R, Azziz R. Association of fat to lean mass ratio with metabolic dysfunction in women with polycystic ovary syndrome. Hum Reprod. 2014;29(7):1508-1517. doi: 10.1093/humrep/deu096.
- Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28(7):412-419. doi: 10.1007/bf00280883.
- Dale PO, Tanbo T, Ertzeid G, Bjercke S, Oldereid N, Fedorcsák P, Abyholm T. The impact of insulin resistance on the outcome of laparoscopic ovarian electrocautery in infertile women with the polycystic ovary syndrome. Gynecol Endocrinol. 2004;19(4):182-9. doi: 10.1080/09513590400012093.
- Kandaraki E, Chatzigeorgiou A, Livadas S, et al. Endocrine disruptors and polycystic ovary syndrome (PCOS): elevated serum levels of bisphenol A in women with PCOS. J Clin Endocrinol Metab. 2011;96(3):480-4. doi: 10.1210/jc.2010-1658.
- Salehpour S, Manzor-al-ajdad O, Neisani Samani E, Abadi A. Evaluation of homocysteine levels in patients with polycystic ovary syndrome. Int J Fertil Steril. 2011;4(4):168-171.
- Duleba AJ, Dokras A. Is PCOS an inflammatory process? Fertil Steril. 2012;97(1):7-12. doi:10.1016/j.fertnstert.2011.11.023.
- Moshage HJ, Roelofs HM, van Pelt JF. et al. The effect of interleukin-1, interleukin-6 and its interrelationship on the synthesis of serum amyloid A and C-reactive protein in primary cultures of adult human hepatocytes. Biochem Biophys Res Commun. 1988;155(1):112-117. doi: 10.1016/s0006-291x(88)81056-8.
- Diamanti-Kandarakis E, Alexandraki K, Piperi C. et al. Inflammatory and endothelial markers in women with polycystic ovary syndrome. Eur J Clin Invest. 2006;36(10):691-697. doi: 10.1111/j.1365-2362.2006.01712.x.
- Gromnitskaya EE. Homocysteine exchange in women with polycystic ovary syndrome. Problemy reproduktsii. 2010;16(3):49-52. (in Russian).
- Dube R. Does endothelial dysfunction correlate with endocrinal abnormalities in patients with polycystic ovary syndrome? Avicenna J Med. 2016;6(4):91-102. doi: 10.4103/2231-0770.191445.
- Ridker PM. A Test in Context: High-Sensitivity C-Reactive Protein. J Am Coll Cardiol. 2016;67(6):712-723. doi: 10.1016/j.jacc.2015.11.037.
- Sreckovic B, Sreckovic VD, Soldatovic I. Homocysteine is a marker for metabolic syndrome and atherosclerosis. Diabetes Metab Syndr. 2017;11(3):179-182. doi: 10.1016/j.dsx.2016.08.026.
- Kim J, Pyo S, Yoon DW, et al. The co-existence of elevated high sensitivity C-reactive protein and homocysteine levels is associated with increased risk of metabolic syndrome: A 6-year follow-up study. PLoS One. 2018;13(10):e0206157. doi:10.1371/journal.pone.0206157.
- Arkhypkina TL. Features of homocysteinemia in young women with polycystic ovary syndrome. World of Medicine and Biology. 2015;48(1):9-13. (in Ukrainian).

/438-1.jpg)