Международный эндокринологический журнал Том 15, №6, 2019
Вернуться к номеру
Метаболічні предиктори та дефіцит вітаміну D у пацієнтів із цукровим діабетом 2-го типу
Авторы: Алудван М.Б., Кобиляк Н.М., Комісаренко Ю.І.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Останнім часом дефіцит вітаміну D вважається одним із факторів розвитку цукрового діабету 2-го типу (ЦД2). Метою даного дослідження було оцінити зміни антропометричних параметрів, показників вуглеводневого та ліпідного обмінів у пацієнтів із ЦД2 відповідно до статусу вітаміну D. Матеріали та методи. Згідно з рекомендаціями Європейської асоціації ендокринологів всі пацієнти були розподілені на 3 групи: група 1 — з оптимальним рівнем вітаміну D (30 нг/мл); група 2 — із недостатністю вітаміну D (21–29 нг/мл) і група 3 — із дефіцитом вітаміну D (< 20 нг/мл). Чутливість до інсуліну та функціональну активність β-клітин оцінювали за допомогою моделі НОМА-2. Результати. Середнє значення індексу маси тіла (ІМТ) зростало паралельно зі зменшенням концентрації вітаміну D у сироватці. Найвищий ІМТ та поширеність ожиріння, в тому числі морбідного (16,7 %), спостерігалися в групі дефіциту вітаміну D. Індекс HOMA-2-IR (2,12 ± 0,71 проти 2,25 ± 0,95, р = 0,963) та чутливість до інсуліну (S% — 57,11 ± 32,07 проти 54,69 ± 32,5, р = 0,965) у групі оптимального рівня вітаміну D та його недостатності (група 2) були практично ідентичними. При дефіциті вітаміну D індекс HOMA-2-IR був статистично вірогідно вищим на 46,2 % (р = 0,004), а чутливість до інсуліну нижчою на 27,5 % (р = 0,027). Функціональна активність β-клітин статистично вірогідно не змінилась між усіма групами незалежно від статусу вітаміну D. Між концентрацією вітаміну D і глікованим гемоглобіном, індексом HOMA-2-IR, С-пептидом та S% встановлено обернений кореляційний зв’язок. Серед параметрів ліпідного обміну в групі дефіциту вітаміну D діагностовано статистично вірогідно вищий рівень тригліцеридів та ліпопротеїнів дуже низької щільності. У кореляційно-регресійному аналізі індекси інсулінорезистентності, показники глікемічного контролю, ліпідограми та прийом метформіну незалежно асоційовані з дефіцитом вітаміну D. Висновки. Дефіцит вітаміну D у пацієнтів із ЦД2 пов’язаний із більш вираженою інсулінорезистентністю, ожирінням і неадекватним глікемічним контролем порівняно з оптимальним рівнем або його недостатністю.
Актуальность. В последнее время дефицит витамина D считается одним из факторов развития сахарного диабета 2-го типа (СД2). Целью данного исследования было оценить изменения антропометрических параметров, показателей углеводного и липидного обменов у пациентов с СД2 в соответствии со статусом витамина D. Материалы и методы. Cогласно рекомендациям Европейской ассоциации эндокринологов все пациенты были разделены на 3 группы: группа 1 — с оптимальным уровнем витамина D (30 нг/мл), группа 2 — с недостаточностью витамина D (21–29 нг/мл) и группа 3 — с дефицитом витамина D (< 20 нг/мл). Чувствительность к инсулину и функциональную активность β-клеток оценивали с помощью модели НОМА-2. Результаты. Среднее значение индекса массы тела (ИМТ) увеличивалось параллельно с уменьшением концентрации витамина D в сыворотке. Самый высокий ИМТ и распространенность ожирения, в том числе морбидного (16,7 %), наблюдались в группе дефицита витамина D. Индекс HOMA-2-IR (2,12 ± 0,71 против 2,25 ± 0,95, р = 0,963) и чувствительность к инсулину (S% — 57,11 ± 32,07 против 54,69 ± 32,5, р = 0,965) в группе оптимального уровня D и его недостаточности (группа 2) были практически идентичными. При дефиците витамина D индекс HOMA-2-IR был статистически достоверно выше на 46,2 % (р = 0,004), а чувствительность к инсулину на 27,5 % ниже (р = 0,027). Функциональная активность β-клеток статистически достоверно не изменилась между всеми группами независимо от статуса витамина D. Между концентрацией витамина D и гликированным гемоглобином, индексом HOMA-2-IR, С-пептидом и S% установлена обратная корреляционная связь. Среди параметров липидного обмена в группе дефицита витамина D диагностирован статистически достоверно более высокий уровень триглицеридов и липопротеинов очень низкой плотности. В корреляционно-регрессионном анализе индексы инсулинорезистентности, показатели гликемического контроля, липидограммы и прием метформина независимо ассоциированы с дефицитом витамина D. Выводы. Дефицит витамина D у пациентов с СД2 связан с более выраженной инсулинорезистентностью, ожирением и неадекватным гликемическим контролем по сравнению с оптимальным уровнем или его недостаточностью.
Background. Recently, vitamin D deficiency is considered one of the factors for the development of type 2 diabetes mellitus. The purpose of this study was to evaluate changes in anthropometric parameters, indicators of carbohydrate and lipid metabolism in patients with type 2 diabetes mellitus depending on vitamin D status. Materials and methods. According to the recommendations of the European Society of Endocrinology, all patients were divided into 3 groups: group 1 — optimal vitamin D level (30 ng/ml); group 2 — vitamin D deficiency (21–29 ng/ml); and group 3 — vitamin D deficiency (< 20 ng/ml). Insulin sensitivity and β-cell functional activity were evaluated using the HOMA-2 calculator. Results. The average body mass index increased in parallel with a decrease in the serum vitamin D concentration. The highest body mass index and prevalence of obesity, including morbid obesity (16.7 %), were observed in the vitamin D deficiency group. HOMA-2-IR (2.12 ± 0.71 vs 2.25 ± 0.95, p = 0.963) and insulin sensitivity (S% — 57.11 ± 32.07 vs 54.69 ± 32.5, p = 0.965) in the group of the optimal level of vitamin D and its insufficiency (group 2) were almost identical. In vitamin D deficiency, HOMA-2-IR was statistically significantly higher — by 46.2 % (p = 0.004), and insulin sensitivity was by 27.5 % lower (p = 0.027). The functional activity of β-cells did not change statistically significantly between all groups, regardless of the vitamin D status. An inverse correlation was established between the concentrations of vitamin D and glycated hemoglobin, HOMA-2-IR, C-peptide and S%. Among the parameters of lipid metabolism in the vitamin D deficiency group, a statistically significantly higher level of triglycerides and very low density lipoproteins was found. In the correlation and regression analysis, insulin resistance parameters, glycemic control indices, lipid profiles and metformin intake were independently associated with vitamin D deficiency. Conclusions. Vitamin D deficiency in patients with type 2 diabetes mellitus is associated with more pronounced insulin resistance, obesity and inadequate glycemic control compared to the optimal level or its insufficiency.
вітамін D; цукровий діабет 2-го типу; інсулінорезистентність; функція β-клітин; ожиріння
витамин D; сахарный диабет 2-го типа; инсулинорезистентность; функция β-клеток; ожирение
vitamin D; type 2 diabetes mellitus; insulin resistance; β-cell function; obesity
Вступ
Цукровий діабет (ЦД) визначений Всесвітньою організацією охорони здоров’я (ВООЗ) як неінфекційна епідемія, саме у зв’язку з цим 2006 року ухвалено резолюцію ООН про боротьбу з ЦД. Якщо на початку 80-х років минулого століття число хворих на ЦД становило близько 30 млн, то у 2015 році у світі зареєстровано близько 422 млн осіб із ЦД. За прогнозами експертів ВООЗ та Міжнародної діабетичної федерації, до 2040 року очікується, що ця цифра сягне понад 642 млн [1, 2]. В Україні станом на 2013 рік зареєстровано понад 1,3 млн пацієнтів, а щорічний приріст оцінюється в 4–5 % [3, 4]. Поширеність ЦД в усьому світі швидко зростає і досягає в середньому 2–4 % від загальної популяції. З віком частота ЦД зростає, досягаючи в осіб, старших від 65 років, 7–8 % [4].
ЦД 2-го типу (ЦД2) є найбільш поширеним типом діабету, на який припадає близько 90 % всіх випадків [5]. Зазвичай він характеризується інсулінорезистентністю (ІР), патологічним станом, при якому спостерігається недостатня біологічна відповідь клітин на дію інсуліну при його достатній концентрації в крові. Також як важлива медико-соціальна та клінічна проблема сьогодні розглядається метаболічний синдром (МС), що охоплює близько 25 % дорослого населення [6, 7]. Відповідно до сучасних уявлень, ЦД2 є МС поліетіологічного характеру, який проявляється хронічною гіперглікемією з порушенням обміну вуглеводів, жирів і білків у результаті дефекту секреції інсуліну, його дії і/або одночасно обох факторів [7].
Дефіцит вітаміну D на сьогодні визнаний пандемією з вираженими клінічними ефектами. Його поширеність залежить від географічного положення, сезону та етнічної приналежності. На 2008 рік у світі нараховується 1 мільярд осіб, які мають дефіцит або недостатність вітаміну D, і на сьогодні це число, найімовірніше, вище [8]. Попри певні відмінності в лабораторних підходах, які використовуються для визначення порогової величини D та його дефіциту в різних країнах, очевидним є той факт, що практично в усіх регіонах світу реєструються субоптимальні рівні 25(ОН)D у широких верств населення. Зокрема, гіповітаміноз D є більш вираженим взимку в усіх вікових групах жителів Азії [9, 10], Європи [11, 12], Латинської Америки [13], Близького Сходу [14], Північної Америки [15] та Океанії [16].
Традиційно вітамін D вважався регулятором мінерального обміну, але нові наукові досягнення дозволили розширити уявлення про фізіологічну роль цього вітаміну. Останнім часом гіповітаміноз D вважається одним із факторів ризику розвитку ЦД2 і MС, що сприяє збільшенню ІР і зниженню секреції інсуліну [17]. Відкриття рецепторів до гормонально активних форм вітаміну D (VDR) та їх синтезу в клітинах «нетрадиційних» для цього вітаміну органів і тканин передбачає ширший спектр фізіологічних ефектів вітаміну. Існує декілька механізмів впливу вітаміну D на ендокринну частину підшлункової залози, включаючи пряму стимуляцію секреції інсуліну шляхом активації VDR в β-клітинах. Внаслідок іншого спостерігається локальна активація вітаміну D за допомогою ферменту 1α-гідроксилази, що призводить до внутрішньоклітинної регуляції кальцію та, відповідно, підвищує секрецію інсуліну. Також активна форма D3 здатна безпосередньо впливати на транскрипцію гена інсуліну [18].
Також установлено, що шляхом регуляції концентрації позаклітинного кальцію, наявності VDR у скелетних м’язах та активації PPAR-δ-фактора транскрипції, що бере участь у метаболізмі жирних кислот у жировій тканині і скелетних м’язах, вітамін D може покращувати чутливість периферичних тканин до інсуліну [19, 20]. Отже, вітамін D бере активну участь як у секреції інсуліну, так і в ІР, двох основних ланках патогенезу ЦД2.
Метою даного дослідження було оцінити ІР, функціональну активність β-клітин та параметри метаболічного профілю в пацієнтів із ЦД залежно від забезпеченості організму пацієнтів вітаміном D.
Матеріали та методи
На базі Київського міського клінічного ендокринологічного центру було проведено перехресне одноцентрове дослідження, в яке було включено 109 пацієнтів із ЦД2. Основними критеріями включення були: вік від 18 до 75 років, наявність ЦД2, встановленого на підставі критеріїв Американської діабетичної асоціації (глюкоза плазми натще ≥ 7,0 ммоль/л; глюкоза плазми при випадковому вимірюванні ≥ 11,1 ммоль/л; рівень HbA1c ≥ 6,5 % або глюкоза вище 11,1 ммоль/л через 2 години після проведення тесту толерантності з 75 г глюкози) [21], пацієнти, які до моменту включення отримували стабільну дозу інсуліну і/або пероральних гіпоглікемічних засобів щонайменше протягом трьох місяців та глікований гемоглобін (HbA1c) < 12,0 %.
Критерії виключення включали наявність ЦД 1-го типу або вторинного діабету, злоякісних новоутворень і наявність в анамнезі гіперпаратиреозу, остеопорозу, нефролітіазу або гіперкальціємії. Також у дослідження не включали пацієнтів, які повідомили, що за 3 місяці до початку приймали протисудомні препарати або біологічні добавки з кальцієм чи вітаміном D.
Протокол був затверджений комісією з етики при Київському міському клінічному ендокринологічному центрі (протокол № 21 від 18.02.2019 р.), а саме дослідження проводилося згідно з основними рекомендаціями Гельсінської декларації (1979 р.). До початку та перед проведенням будь-яких процедур мета і методологія дослідження були повністю роз’яснені учасникам, після чого всі пацієнти дали письмову інформовану згоду на участь у даному дослідженні.
Після підписання інформованої згоди в пацієнтів натще були зібрані зразки сироватки крові і негайно заморожені при t –20 °С. Для кожного пацієнта отримано відповідні клінічні і демографічні дані. Антропометричні параметри включали вимірювання маси тіла та зросту з точністю до 100 г і 0,5 см відповідно. Індекс маси тіла (ІМТ) розраховували як масу тіла в кілограмах, поділену на квадрат зросту в метрах (вага/зріст2). Окружність талії (ОТ) пацієнта вимірювалась без одягу, на 1 cм вище верхніх передніх гребенів клубової кістки, на видиху в положенні стоячи, при цьому пацієнт був без взуття, стопи торкались одна одної, а руки були вільно опущені. Нееластичну вимірювальну стрічку розташовували перпендикулярно поздовжньої осі тіла і паралельно підлозі; вона була натягнута та щільно прилягала до вимірювальної поверхні.
Концентрацію 25(OH)D у сироватці крові оцінювали за допомогою електрохемілюмінестцентного білок-опосередкованого методу, що використовується для кількісного визначення (Roche Diagnostics, Mannheim, Німеччина) із внутрішньо- та міждослідницьким коефіцієнтом варіації < 5,5 % та < 7,0 % відповідно. Для аналізу використовується білок, що зв’язує вітамін D (vitamin D binding protein — VDBP) як каркасний білок, який зв’язується з обома формами — 25-OH D3 і 25-ОН D2 [22]. В основі методу лежить трьохетапний процес інкубації тривалістю 27 хвилин. На першому етапі зразок сироватки інкубують із реагентом для попередньої обробки, який вивільняє загальний 25(ОН)D від VDBP. На етапі 2 попередньо оброблений зразок інкубують із міченим рутенієм VDBP, створюючи комплекс між 25-(ОН)D та VDBP [23]. Третій етап інкубації передбачає додавання покритих мікрочастинок стрептавідином і міченого біотином 25(ОН)D. Вільні сайти рутенільованого VDBP стають зайнятими, утворюючи комплекс, що складається з міченого рутенієм VDBP і міченого біотином 25(OH)D. Весь комплекс зв’язується з твердою фазою через взаємодію біотину і стрептавідину.
Для оцінки функції β-клітин (B%) і чутливості до інсуліну (S%) була використана модель HOMA-2-IR, яка є модернізованою версією структурної математичної моделі на основі визначення концентрації глюкози плазми та інсуліну натще — HOMA (homeostasis model assesment), з визначенням індексу НОМА-IR за формулою: імунореактивний інсулін (мкОД/мл) × глюкоза плазми натще/22,5, вперше запропонованою Matthews et al. Ця модель може бути розрахована з використанням програмного забезпечення, що поставляється Оксфордським центром ендокринології, діабету та метаболізму, і доступна за посиланням: http://www.dtu.ox.ac.uk/homacalculator/index.php.
НОМА-2 має такі переваги: можливість розрахунку за допомогою С-пептиду замість інсуліну натще; розширений діапазон значень для інсуліну до 1–300 мОД/л та 20–460 мг/дл для глюкози з поправкою на гіперінсулінемію та гіперглікемічні стани; поправка на печінкову та периферичну ІР і рівень циркулюючого проінсуліну.
Глюкозу в крові визначали, використовуючи глюкозооксидазний метод за Трінде. Рівень інсуліну в крові вимірювали за допомогою методу електрохемілюмінесцентного імуноаналізу (ECLIA) із діапазоном референтних значень 2,6–24,9 мОД/л (Cobas 6000, Roche Diagnostics, Базель, Швейцарія). С-пептид вимірювали з використанням методу хемілюмінесцентного імуноаналізу комерційними наборами (Immulite, Siemens AG, Німеччина) із значенням в нг/мл. HbA1c вимірювали за допомогою імунотурбодиметричного аналізу на автоматичному аналізаторі Cobas 6000 (Roche Diagnostics, Базель, Швейцарія) із діапазоном референтних значень від 4,8 до 5,9 %. Рівень HbA1c був стандартизований еталонним методом, узгодженим із DCCT (Diabetes Control and Complications Trial) та Національною програмою стандартизації глікованого гемоглобіну NGSP (National Glycohemoglobin Standardization Program).
Тригліцерид-глюкозний індекс (TyG) є новим методом скринінгу ІР, оскільки простий у використанні та вимагає визначення лише двох лабораторних визначень: ln [тригліцерид натще (мг/дл) × × глюкоза натще (мг/дл)]/2. Згідно з даними Salazar et al., порогове значення TyG-індексу, при якому констатують ІР, становить > 4,49 із чутливістю 82,6 % та специфічністю 82,1 % (AUC = 0,889, 95% ДІ 0,854–0,924).
Концентрацію загального холестерину (ЗХ), холестерину ліпопротеїнів високої щільності (ЛПВЩ) та тригліцеридів (ТГ) вимірювали з використанням ферментативних наборів зі стандартизованими реагентами (BioVendor, Чехія). Ліпопротеїни низької (ЛПНЩ) і дуже низької щільності (ЛПДНЩ) розраховували за формулою Friedewald, тільки якщо рівень ТГ був нижчим за 5,5 ммоль/л; при перевищені зазначеного порога концентрація ЛПНЩ була виміряна за допомогою електрофорезу і денситометрії (BioVendor, Чехія).
Статистичний аналіз виконували за допомогою стандартного пакета програм SPSS версії 21.0. Кількісні зміні наведені у вигляді середньої величини та стандартного відхилення середньої величини (М ± SD), якісні — у відсотках. Для перевірки гіпотези про нормальний розподіл використовували одновибірковий тест Колмогорова — Смирнова. Для оцінки відмінності кількісних показників використовували однофакторний дисперсійний аналіз (One-Way ANOVA), і якщо результат був вірогідним, виконувався апостеріорний тест Tuckey. Дані з непараметричним розподілом аналізували з використанням критерію Крускалла — Уолліса. При аналізі якісних змінних застосовували критерій χ2. Зв’язок між концентрацією вітаміну D та метаболічними параметрами оцінювали за допомогою одновимірного кореляційного аналізу Пірсона.
Одновимірний та множинний логістичний регресійний аналіз був використаний для виявлення незалежних факторів, які асоційовані з дефіцитом вітаміну D. Для цього дефіцит D використовували як залежну змінну, а в ролі предикторів протестували клініко-лабораторні параметри, зміни яких були статистично вірогідними в одновимірній моделі. Дані наведені у вигляді відношення шансів (OR) з 95% довірчими інтервалами (95% ДІ). Рівень значущості вважали вірогідним при p < 0,05.
Результати
Усі пацієнти були розподілені згідно із сучасними рекомендаціями Європейської ендокринологічної асоціації щодо забезпеченості вітаміном D [24] на 3 групи: група 1 (n = 11) — без встановленого дефіциту, з оптимальним рівнем вітаміну D (> 30 нг/мл), середній вік хворих становив 57,45 ± 8,49 року, тривалість ЦД — 13,82 ± 9,62 року; група 2 (n = 38) — із недостатністю вітаміну D (21–29 нг/мл), середній вік пацієнтів — 61,97 ± 9,79 року, тривалість ЦД — 12,05 ± 5,90 року, та група 3 (n = 60) — із дефіцитом вітаміну D, що був діагностований при значенні < 20 нг/мл, середній вік учасників — 60,43 ± 10,47 року, тривалість ЦД — 12,95 ± 6,90 року. Групи хворих, включених у дослідження, були однотипними за віком (р = 0,412) і статтю. Між обстежуваними групами не відзначалося статистично вірогідної різниці за тривалістю ЦД2 (р = 0,705). Рівень сироваткового вітаміну D за групами наведений на рис. 1.
Результати антропометричних, клінічних та лабораторних показників представлені в табл. 1.
ІМТ був підвищений у всіх пацієнтів, а його середнє значення зростало паралельно зі зменшенням концентрації вітаміну D у сироватці. Найвищий ІМТ спостерігався в групі дефіциту D — 32,92 ± 6,82 кг/м2, проте порівняно з пацієнтами інших обстежуваних груп статистично вірогідних відмінностей не виявлено (р = 0,107). Поширеність ожиріння (визначалось як ІМТ > 30,0 кг/м2) у пацієнтів з оптимальним рівнем D (група 1) становила 45,5 % та 50,0 % — у групі з його недостатністю. Найвищу частота ожиріння діагностовано в пацієнтів із дефіцитом D — 58,3 %, проте статистично вірогідної різниці між групами за даним показником не спостерігалося (р = 0,600).
Морбідне ожиріння (ІМТ > 40,0 кг/м2) діагностовано лише в пацієнтів із зниженою концентрацією вітаміну D. У групі з дефіцитом D морбідне ожиріння спостерігалось у 10 (16,7 %) пацієнтів, що статистично вірогідно не відрізнялось від групи недостатності D (група 2), в якій страждали від даної патології двоє (5,3 %) учасників (р = 0,100). З іншого боку, дефіцит вітаміну D асоційований із вісцеральним ожирінням (табл. 1). Нами відзначалося статистично вірогідне збільшення ОТ у групі дефіциту D порівняно з пацієнтами з його оптимальним рівнем (92,91 ± 9,60 проти 105,83 ± 18,44 см, р = 0,030). Також ОТ у даній групі був вищим порівняно з пацієнтами з недостатністю D3, проте зміни були невірогідними (р = 0,125). Також лише в пацієнтів із D-дефіцитом спостерігався обернений кореляційний зв’язок середньої сили між вітаміном та ІМТ (рис. 2А) і ОТ (рис. 2В).
Найтяжче порушення вуглеводного обміну діаг–ностовано в пацієнтів із дефіцитом вітаміну D. Згідно з отриманими результатами ми спостерігали практично ідентичні значення індексу HOMA-2-IR (2,12 ± 0,71 проти 2,25 ± 0,95, р = 0,963) та чутливості до інсуліну (S% — 57,11 ± 32,07 проти 54,69 ± 32,5, р = 0,965) відповідно в групі оптимального рівня D та його недостатності (група 2). Значення індексу HOMA-2-IR було статистично вірогідно вищим на 46,2 % (р = 0,004), а чутливості до інсуліну — на 27,5 % (р = 0,027) нижчим у групі дефіциту D порівняно з його недостатністю (група 2).
Крім того, статистично вірогідне підвищення C-пептиду як маркера ІР відзначалося в групі дефіциту вітаміну D порівняно з обома іншими групами обстежуваних (табл. 1). Ці зміни також супроводжуються неадекватним глікемічним контролем. Середнє значення для HbA1c понад 9 % спостерігалось лише в групі дефіциту вітаміну D, що було статистично вірогідно вище порівняно з пацієнтами з оптимальним рівнем вітаміну, у яких даний показник становив 7,75 ± 1,06 % (р = 0,016). Функціо–нальна активність β-клітин статистично вірогідно не змінилась між усіма групами незалежно від статусу вітаміну D (табл. 1).
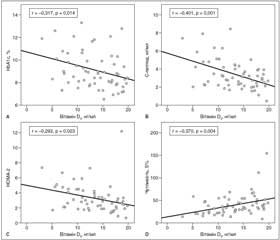
В одновимірному кореляційному аналізі за Пірсоном статистично вірогідні кореляційні зв’язки виявлено лише в групі пацієнтів із D-дефіцитом. Показниками, для яких виявлено негативний кореляційний зв’язок із концентрацією вітаміну D, були HbA1c, HOMA-2-IR та чутливість до інсуліну (рис. 3A–D). Обернений зв’язок максимальної сили виявлений між вмістом вітаміну D та С-пептидом (r = –0,401, p = 0,001) (рис. 3В, табл. 2).
Зрушення ліпідних параметрів різного ступеня вираженості діагностувалося в пацієнтів всіх обстежуваних групи. Загалом ми відмічали підвищення проатерогенних частинок (ЗХ, ТГ, ЛПНЩ і ЛПДНЩ) паралельно зі зменшенням протекторних ЛПВЩ.
Найбільш виражені зміни були констатовано в групі дефіциту вітаміну D. Згідно з отриманими результатами середнє значення ТГ становило 2,69 ± 1,87 (p = 0,033), ЛПДНЩ — основного транс–портера ТГ — 1,21 ± 0,85 ммоль/л (р = 0,039), що практично вдвічі статистично вірогідно вище порівняно з групою з оптимальним рівнем вітаміну D.
З іншого боку, спостерігалась лише тенденція до зростання даного класу ліпідів порівняно з групою недостатності вітаміну D (р = 0,284 для ТГ та р = 0,246 для ЛПДНЩ відповідно). Також у пацієнтів із D-дефіцитом ми виявили статистично вірогідний обернений зв’язок слабкої сили між вітаміном D та концентрацією ТГ (r = –0,290, p = 0,025) і ЛПДНЩ (r = –0,297, p = 0,021) відповідно (рис. 4В, С, табл. 2). Рівень антиатерогенних ЛПВЩ був практично ідентичний у пацієнтів груп 2 і 3 — із зниженою концентрацією вітаміну D. У групі з оптимальним забезпеченням вітаміном D у середньому спостерігалась вища на 0,3 ммол/л концентрація ЛПВЩ, проте зміни в міжгруповому аналізі були незначущими (р = 0,434). Рівень ЗХ статистично вірогідно не змінився в міжгруповому аналізі незалежно від забезпеченості вітаміном D. З іншого боку, в кореляційному аналізі Пірсона лише в групі D-дефіциту виявлено негативний слабкий зв’язок між вітаміном D3 та ЗХ (r = –0,352, p = 0,006) (рис. 4А, табл. 2).
Нещодавно TyG-індекс був запропонований як новий простий маркер ІР. У нашому дослідженні паралельно з погіршенням D-статусу спостерігалось зростання TyG-індексу. Максимального значення TyG індекс досяг у пацієнтів із дефіцитом вітаміну D — 5,17 ± 0,41, проте рівня статистичної вірогідності порівняно з іншими групами досягнуто не було (р = 0,197). У пацієнтів із дефіцитом вітаміну D спостерігався негативний слабкий кореляційний зв’язок між даним індексом та концентрацією вітаміну D (r = –0,318, p = 0,013) (рис. 4D, табл. 2).
В одновимірному аналізі Пірсона статистично вірогідний кореляційний взаємозв’язок, як уже вище зазначалося, був виявлений лише в групі дефіциту вітаміну D. За нашими даними, обернений, різний за силою, проте здебільшого слабкий кореляційний зв’язок установлено між рівнем вітаміну D та антропометричними параметрами, рівнем ліпідів, показниками глікемічного контролю та маркерами ІР (табл. 2, рис. 2–4). Корекція ІМТ, вік і стать — предиктори, які можуть вплинути на D-статус. Після корекції ІМТ статистично вірогідний зв’язок, проте меншої сили залишився лише для HbA1c (r = –0,264; p = 0,047), C-пептиду (r = –0,394; p = 0,003 ), чутливості до інсуліну, S% (r = 0,277; p = 0,037), TyG-індексу (r = –0,285; р = 0,032), ЗХ (r = –0,298; р = 0,025) та ЛПДНЩ (r = –0,264; р = 0,047) (табл. 2).
В одновимірному логістичному регресійному аналізі незалежними предикторами, асоційованими з дефіцитом вітаміну D у пацієнтів із ЦД2, були такі фактори: HbA1c (ОR 2,269; 95% ДІ 1,163–4,427; р = 0,038), HOMA-2-IR (OR 2,204; 95% ДІ 1,046–4,643; р = 0,038), C-пептид (OR 1,907; 95% ДІ 1,003–3,625; р = 0,049), ОТ (OR 1,075; 95% ДІ 1,0–1,154; р = 0,049), ТГ (OR 3,280; 95 % ДІ 1,135–9,478; р = 0,028) і ЛПВЩ (0,180; 95% ДІ 0,030–1,080, р = 0,049).
Усі змінні, які були статистично значущими в одновимірному аналізі, були включені в покроковий множинний логістичний регресійний аналіз. Як видно з табл. 3, нами було побудовано декілька регресивних моделей. Відповідно до них незадовільний глікемічний контроль, установлений за рівнем HbA1c, був незалежно від прийому метформіну (R2 Нейджелкерка = 0,274) і рівня ЛПВЩ (R2 Нейджелкерка = 0,218) асоційований із дефіцитом вітаміну D.
Обговорення
Вітамін D проявляє біологічну дію головним чином через VDR (vitamin D receptor), що належить до суперродини ядерних рецепторів і регулює експресію генів ліганд-опосередкованим чином. Недавнє дослідження продемонструвало, що β-клітини підшлункової залози мають VDR і метаболіти вітаміну D стимулюють секрецію і вивільнення інсуліну [25]. Крім того, VDR-дефіцитні (–/–) миші мають більш високу поширеність ЦД2 [26], при цьому припускають, що сигнальний шлях вітаміну D може мати відношення до патогенезу даного захворювання. Інші дослідники [27] включили в дослідження групу з 903 практично здорових дорослих (середній вік — 74 роки) без ознак предіабету або цукрового діабету під час відвідин клініки з 1997 по 1999 рік, а потім спостерігали за учасниками до 2009 року. Було встановлено, що в осіб із сироватковим рівнем 25(OH)D менше 30 нг/мл спостерігається в 5 разів вищий ризик розвитку ЦД2 порівняно з учасниками з рівнями понад 50 нг/мл.
Найбільш важливим, на нашу думку, є встановлення в регресійному аналізі незалежного від глікемічного контролю зв’язку між дефіцитом вітаміну D3 і прийомом метформіну (OR 5,191; 95% ДІ 0,966–27,903). Підсилює дане твердження той факт, що ми не виявили статистичної вірогідної різниці за процентним співвідношенням між пацієнтами різних груп, які отримують метформін (р = 0,264), так само як і середньодобова доза для метформіну була зіставлена для всіх груп (р = 0,317). Дана знахідка стає ще більш актуальною з урахуванням попередньо встановленого факту, що прийом метформіну здатний індукувати дефіцит вітаміну В12 у пацієнтів із ЦД2 [28]. На відміну від наших результатів недавнє ретроспективне дослідження в пацієнтів із ЦД2 (n = 706) не виявило негативного впливу метформіну на рівень вітаміну D. Рівень 25(OH)D статистично вірогідно не відрізнявся навіть після корекції, між пацієнтами на метформіні та тими, хто отримував іншу антидіабетичну терапію (p = 0,297; 95% ДІ для середньої різниці = –0,7–2,2 нг/мл). Паралельно в цій когорті було відзначено статистично вірогідно нижчий рівень вітаміну В у пацієнтів на терапії метформіном [29]. При дослідженні впливу додаткового призначення вітаміну D на дієту, інсулін та/або пероральні гіпоглікемічні засоби порівнювали зміни з когортою пацієнтів без ЦД. Вченими було встановлено, що лише в групі прийому метформіну спостерігався вірогідний приріст рівня сироваткового вітаміну D3 приблизно на 50–60 % порівняно з початковим рівнем (р < 0,001) [30].
Відзначаються різні можливі пояснення цих суперечливих результатів, включаючи методи, які використовують для визначення активної форми вітаміну D, а також фактори, які впливають на забезпеченість вітаміном D, а саме вік, раса, харчова поведінка та рівень фізичної активності, які, як відомо, також асоційовані з ризиком розвитку ЦД2.
Висновки
Дефіцит вітаміну D у пацієнтів із ЦД2 пов’язаний із більш вираженою ІР, ожирінням і неадекватним глікемічним контролем порівняно з оптимальним рівнем або його недостатністю.
Регресійний аналіз продемонстрував, що прийом метформіну асоційований із дефіцитом вітаміну D у пацієнтів із ЦД2 незалежно від рівня HbA1c. З іншого боку, ми не виявили вірогідних зв’язків між D-статусом і функціональною активністю β-клітин у пацієнтів із ЦД2.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- International Diabetes Federation. IDF Diabetes Atlas. 6th ed. 2013. Available from: http://www.idf.org/diabetesatlas.
- Mechanick JI. Global dimensions of diabetes information and synthesis. Ann Glob Health. 2015 Nov-Dec;81(6):733-4. doi: 10.1016/j.aogh.2015.12.015.
- Kobyliak N, Falalyeyeva T, Mykhalchyshyn G, Kyriienko D, Komissarenko I. Effect of alive probiotic on insulin resistance in type 2 diabetes patients. Randomized clinical trial. Diabetes Metab Syndr. 2018 Sep;12(5):617-624. doi: 10.1016/j.dsx.2018.04.015.
- Pankiv VI. Association between metformin use and vitamin B12 deficiency in patients with type 2 diabetes. Mìžnarodnij endokrinologìčnij žurnal. 2019;15(1):47-54. doi: 10.22141/2224-0721.15.1.2019.158691. (in Ukrainian).
- Kyriachenko Y, Falalyeyeva T, Korotkyi O, Molochek N, Kobyliak N. Crosstalk between gut microbiota and antidiabetic drug action. World J Diabetes. 2019 Mar 15;10(3):154-168. doi: 10.4239/wjd.v10.i3.154.
- Mykhalchyshyn G, Kobyliak N, Bodnar P. Diagnostic accuracy of acyl-ghrelin and it association with non-alcoholic fatty liver disease in type 2 diabetic patients. J Diabetes Metab Disord. 2015 May 19;14:44. doi: 10.1186/s40200-015-0170-1.
- Pankiv VI. Disorders of carbohydrate metabolism in clinical practice. Mìžnarodnij endokrinologìčnij žurnal. 2017;13(1):39-44. doi: 10.22141/2224-0721.13.1.2017.96754. (in Ukrainian).
- James WP. 22nd Marabou Symposium: the changing faces of vitamin D. Nutr Rev. 2008 May;66(5):286-90. doi: 10.1111/j.1753-4887.2008.00034.x.
- Malhotra N, Mithal A, Gupta S, Shukla M, Godbole M. Effect of vitamin D supplementation on bone health parameters of healthy young Indian women. Arch Osteoporos. 2009 Dec;4(1-2):47-53. doi: 10.1007/s11657-009-0026-8.
- Goswami R, Gupta N, Goswami D, Marwaha RK, Tandon N, Kochupillai N. Prevalence and significance of low 25-hydroxyvitamin D concentrations in healthy subjects in Delhi. Am J Clin Nutr. 2000 Aug;72(2):472-5. doi: 10.1093/ajcn/72.2.472.
- Van der Meer IM, Boeke AJ, Lips P, et al. Fatty fish and supplements are the greatest modifiable contributors to the serum 25-hydroxyvitamin D concentration in a multiethnic population. Clin Endocrinol (Oxf). 2008 Mar;68(3):466-72. doi: 10.1111/j.1365-2265.2007.03066.x.
- Wicherts IS, van Schoor NM, Boeke AJ, et al. Vitamin D status predicts physical performance and its decline in older persons. J Clin Endocrinol Metab. 2007 Jun;92(6):2058-65. doi: 10.1210/jc.2006-1525.
- Fradinger EE, Zanchetta JR. Vitamin D status in women living in Buenos Aires. Medicina (B Aires). 1999;59(5 Pt 1):449-52. (in Spanish).
- Kaminskyi OV, Pankiv VI, Pankiv IV, Afanasyev DE. Vitamin D content in population of radiologically contaminated areas in Chernivtsi region (pilot project). Probl Radiac Med Radiobiol. 2018 Dec;23:442-451. doi: 10.33145/2304-8336-2018-23-442-451.
- Thomas MK, Lloyd-Jones DM, Thadhani RI, et al. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998 Mar 19;338(12):777-83. doi: 10.1056/NEJM199803193381201.
- Pasco JA, Henry MJ, Nicholson GC, Sanders KM, Kotowicz MA. Vitamin D status of women in the Geelong Osteoporosis Study: association with diet and casual exposure to sunlight. Med J Aust. 2001 Oct 15;175(8):401-5.
- Hyppönen E, Läärä E, Reunanen A, Järvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001 Nov 3;358(9292):1500-3. doi: 10.1016/S0140-6736(01)06580-1.
- Al-Shoumer KA, Al-Essa TM. Is there a relationship between vitamin D with insulin resistance and diabetes mellitus? World J Diabetes. 2015 Jul 25;6(8):1057-64. doi: 10.4239/wjd.v6.i8.1057.
- Komisarenko YI, Bobryk MI. Vitamin D Deficiency and Immune Disorders in Combined Endocrine Pathology. Front Endocrinol (Lausanne). 2018 Oct 9;9:600. doi: 10.3389/fendo.2018.00600.
- Mazanova A, Shymanskyi I, Lisakovska O, Hajiyeva L, Komisarenko Y, Veliky M. Effects of Cholecalciferol on Key Components of Vitamin D-Endo Para Autocrine System in Experimental Type 1 Diabetes. Int J Endocrinol. 2018 Feb 6;2018:2494016. doi: 10.1155/2018/2494016.
- American Diabetes Association. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes—2018. Diabetes Care. 2018;41(1):13-27. doi: 10.2337/dc18-S002.
- Cobas. E411 Vitamin D Total Reagent Insert (06268668001V1). Available from: http://www.captodayonline.com/productguides/instruments/automated-immunoassay-analyzers-july-2012/roche-diagnostics-cobas-e411-immunoassay-analyzers-june-2011.html. Accessed: 19 March 2019.
- Abdel-Wareth L, Haq A, Turner A, et al. Total vitamin D assay comparison of the Roche Diagnostics “Vitamin D total” electrochemiluminescence protein binding assay with the Chromsystems HPLC method in a population with both D2 and D3 forms of vitamin D. Nutrients. 2013 Mar 22;5(3):971-80. doi: 10.3390/nu5030971.
- Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011 Jul;96(7):1911-30. doi: 10.1210/jc.2011-0385.
- Wolden-Kirk H, Overbergh L, Christesen HT, Brusgaard K, Mathieu C. Vitamin D and diabetes: its importance for beta cell and immune function. Mol Cell Endocrinol. 2011 Dec 5;347(1-2):106-20. doi: 10.1016/j.mce.2011.08.016.
- Park SK, Garland CF, Gorham ED, Budoff L, Barrett-Connor E. Plasma 25-hydroxyvitamin D concentration and risk of type 2 diabetes and pre-diabetes: 12-year cohort study. PLoS One. 2018 Apr 19;13(4):e0193070. doi: 10.1371/journal.pone.0193070.
- Bell DS. Metformin-induced vitamin B12 deficiency presenting as a peripheral neuropathy. South Med J. 2010 Mar;103(3):265-7. doi: 10.1097/SMJ.0b013e3181ce0e4d.
- Mazokopakis EE, Starakis IK. Recommendations for diagnosis and management of metformin-induced vitamin B12 (Cbl) deficiency. Diabetes Res Clin Pract. 2012 Sep;97(3):359-67. doi: 10.1016/j.diabres.2012.06.001.
- Kos E, Liszek MJ, Emanuele MA, Durazo-Arvizu R, Camacho P. Effect of metformin therapy on vitamin D and vitamin B levels in patients with type 2 diabetes mellitus. Endocr Pract. 2012 Mar-Apr;18(2):179-84. doi: 10.4158/EP11009.OR.
- Alkharfy KM, Al-Daghri NM, Sabico SB, et al. Vitamin D supplementation in patients with diabetes mellitus type 2 on different therapeutic regimens: a one-year prospective study. Cardiovasc Diabetol. 2013 Aug 7;12:113. doi: 10.1186/1475-2840-12-113.

/462-1.jpg)
/462-2.jpg)
/463-1.jpg)
/464-1.jpg)
/465-1.jpg)
/466-1.jpg)