Журнал «Практическая онкология» Том 2, №3, 2019
Вернуться к номеру
Прогностичне значення вихідних гематологічних та біохімічних параметрів у хворих на рак шийки матки з пізніми променевими ускладненнями за цисплатинвмісної хіміопроменевої терапії
Авторы: Гладких Ф.В., Кулініч Г.В.
Державна установа «Інститут медичної радіології ім. С.П. Григор’єва Національної академії медичних наук України», м. Харків, Україна
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
Актуальність. Рак шийки матки (РШМ) є однією з найпоширеніших форм злоякісних новоутворень у жінок. Згідно з прогнозами Global Cancer Observatory, до 2050 року захворюваність на зазначену нозологію зросте вдвічі та сягне 1 млн нових випадків на рік. Мета: провести порівняльний аналіз клініко-лабораторних показників пацієнток з пізніми радіаційними ускладненнями та без них після комбінованого хіміопроменевого лікування із застосуванням цисплатину з приводу раку шийки матки. Матеріали та методи. Проведено ретроспективний аналіз 92 історій хвороби пацієнток, розподілених на дві групи: основна (44 пацієнтки) — хворі з пізніми променевими ускладненнями (ППУ) після цисплатинвмісної хіміопроменевої терапії (ХПТ) та контрольна (48 пацієнток) — хворі без відстроченої радіаційної токсичності після аналогічного лікування. Результати. Аналіз гематологічних показників пацієнток показав, що у хворих на РШМ із ППУ після ХПТ до лікування відзначались нижчі кількості тромбоцитів на 21,2 % (р = 0,002) і лейкоцитів на 17,4 % (р = 0,07), а також нижча швидкість осідання еритроцитів на 16,7 % (р = 0,2) відносно показників пацієнток контрольної групи в аналогічні строки дослідження. Привертають увагу і вищі значення вихідних показників АлАТ та АсАТ у хворих на РШМ із ППУ на 6,7 % (р = 0,3) та 5,8 % (р = 0,06) відповідно щодо показників пацієнток контрольної групи. Характеризуючи показники системи згортання крові на тлі ХПТ хворих на РШМ, автори встановили, що у хворих із ППУ відзначено статистично вірогідно (р = 0,01) вищий на 23,4 % активований парціальний тромбопластиновий час (38 [35; 40] с), а також вищий на 11,6 % (р = 0,09) час згортання відносно показників хворих без ППУ в ті самі строки дослідження. Висновки. У хворих на РШМ при проведенні цисплатинвмісної ХПТ прогностичними маркерами пізньої променевої токсичності є послаблення окремих ланок судинно-тромбоцитарного гемостазу. З боку біохімічних показників у хворих на РШМ прогностично несприятливими щодо розвитку різних променевих ускладнень у хворих після цисплатинвмісної ХПТ є вищі значення печінкових ферментів.
Актуальность. Рак шейки матки (РШМ) является одной из самых распространенных форм злокачественных новообразований у женщин. Согласно прогнозам Global Cancer Observatory, к 2050 году заболеваемость указанной нозологией вырастет вдвое и достигнет 1 млн новых случаев в год. Цель: провести сравнительный анализ клинико-лабораторных показателей пациенток с поздними радиационными осложнениями и без них после комбинированного химиолучевого лечения с применением цисплатина по поводу рака шейки матки. Материалы и методы. Проведен ретроспективный анализ 92 историй болезни пациенток, распределенных на две группы: основная (44 пациентки) — больные с поздними лучевыми осложнениями (ПЛО) после цисплатинсодержащей химиолучевой терапии (ХЛТ) и контрольная (48 пациенток) — больные без отсроченной радиационной токсичности после аналогичного лечения. Результаты. Анализ гематологических показателей пациенток показал, что у больных РШМ с ПЛО после ХЛТ до лечения отмечались более низкие количества тромбоцитов на 21,2 % (р = 0,002) и лейкоцитов на 17,4 % (р = 0,07), а также ниже скорость оседания эритроцитов на 16,7 % (р = 0,2) относительно показателей пациенток контрольной группы в аналогичные сроки исследования. Привлекают внимание и высшие значения исходных показателей АлАТ и АсАТ у больных РШМ с ПЛО на 6,7 % (р = 0,3) и 5,8 % (р = 0,06) соответственно относительно показателей пациенток контрольной группы. Характеризуя показатели свертывающей системы крови на фоне ХЛТ больных РШМ, авторы установили, что у больных с ПЛО отмечено статистически достоверно (р = 0,01) выше на 23,4 % активированное парциальное тромбопластиновое время (38 [35; 40] с), а также выше на 11,6 % (р = 0,09) время свертывания относительно показателей больных без ПЛО в те же сроки исследования. Выводы. У больных РШМ при проведении цисплатинсодержащей ХЛТ прогностическими маркерами поздней лучевой токсичности является ослабление отдельных звеньев сосудисто-тромбоцитарного гемостаза. Со стороны биохимических показателей у больных РШМ прогностически неблагоприятными по развитию различных лучевых осложнений у больных после цисплатинсодержащей ХЛТ являются высшие значения печеночных ферментов.
Background. Cervical cancer is one of the most common forms of malignancies in women. According to Global Cancer Observatory prognosis, the incidence of this nosology will double by 2050 and reach 1 million new cases a year. The purpose was to conduct a comparative analysis of clinical and laboratory parameters of patients with and without late radiation complications after combined chemoradiation therapy with the use of cisplatin for cervical cancer. Materials and methods. A retrospective analysis was performed of 92 case histories of patients who were divided into two groups: main (n = 44) — women with late radiation complications after cisplatin-based chemotherapy, and control (n = 48) — patients without late radiation complications after the same therapy. Results. Analysis of hematologic parameters showed that cervical cancer patients with late radiation complications after chemoradiation therapy showed lower platelet (by 21.2 %; p = 0.002) and leukocyte (by 17.4 %; p = 0.07) counts, as well as lower erythrocyte sedimentation rate (by 16.7 %; p = 0.2) before treatment compared to patients in the control group within the same study period. Higher values of baseline ALT and AST (by 6.7 %; p = 0.3, and by 5.8 %; p = 0.06, respectively) in cervical cancer patients with late radiation complications compared to the indicators of patients in the control group should also be noted. Characterizing the indicators of the blood coagulation system against chemoradiation therapy in cervical cancer, it was found that in patients with late radiation complications, partial thromboplastin time was statistically significantly (by 23.4 %; p = 0.01) higher (38 [35; 40] s), as well as clotting time (by 11.6 %; p = 0.09) compared to indicators of cervical cancer patients without late radiation complications for the same study periods. Conclusions. In patients with cervical cancer when carrying out cisplatin-based chemoradiation therapy, the prognostic marker of late radiation toxicity is the attenuation of individual links of vascular-platelet hemostasis. Higher values of liver enzymes are biochemical parameters that are prognostically unfavorable for the development of various radiation complications after cisplatin-based chemoradiation therapy in patients with cervical cancer.
рак шийки матки; променева терапія; цисплатин; пізні променеві ускладнення
рак шейки матки; лучевая терапия; цисплатин; поздние лучевые осложнения
cervical cancer; radiation therapy; cisplatin; late radiation complications
Вступ
Рак шийки матки (РШМ) є однією з найпоширеніших форм злоякісних новоутворень у жінок. Згідно з прогнозами GLOBOCAN (Global Cancer Observatory), до 2050 року захворюваність на РШМ зросте вдвічі та сягне 1 млн нових випадків на рік [1–3]. Значну роль вказана патологія відіграє в жінок віком до 30 років, оскільки летальність в цій віковій групі сягає 10,3 % [1–3].
Променева терапія (ПТ) як самостійна методика або як компонент комбінованого лікування застосовується майже у 90,0 % хворих на РШМ. Найсучаснішими підходами до лікування є 3D-конформна ПТ (three-dimensional conformal radiation therapy — 3D CRT) та ПТ із модульованою інтенсивністю (intensity modulated radiation therapy — IMRT), які дозволяють створювати поле необхідної форми та здійснювати опромінення з різною інтенсивністю під час одного сеансу. Однак, незважаючи на вдосконалення оснащення та впровадження нових підходів до ПТ, можливості зазначеного методу лікування є й досі обмеженими, що пов’язано з ушкоджуючою дією іонізуючого опромінення на оточуючі пухлину структури з високим ризиком розвитку променевих ускладнень у суміжних органах і тканинах [4–6]. За терміном виникнення прийнято виділяти ранні (< 3 міс.) та пізні променеві ускладнення (ППУ), які розвиваються через більше ніж 100 днів після ПТ [3, 4].
Сучасна ПТ передбачає поєднання дистанційної ПТ (ДПТ) та внутрішньопорожнинної ПТ (ВППТ). Крім того за місцево поширеного РШМ (IB2–IVA стадії) загальноприйнятим є проведення одночасної хіміо–променевої терапії (ХПТ).
На сьогодні стандартною схемою хіміотерапії (ХТ) під час ПТ є застосування цисплатину 40 мг/м2 1 раз на тиждень (р/тижн.). Доведено, що платин–вмісна поєднана хіміопроменева терапія (цисплатин 50 мг/м2 + 5-фторурацил 500 мг/м2 1 р/3 тижн., цисплатин 50 мг/м2 + топотекан 0,75 мг/м2 1 р/3 тижн., цис–платин 50 мг/м2 + гемцитабін 1000 мг/м2 1 р/3 тижн., цисплатин 40 мг/м2 + іринотекан 60 мг/м2 1 р/3 тижн. та ін.) є оптимальним співвідношеннями ефективності та безпечності порівняно з монотерапією іншими хіміо–терапевтичними препаратами (блеоміцин, вінкристин, мітоміцин, паклітаксел, геміблатин, доксорубіцин, іфосфамід, мітоксантрон та ін.) [5–7].
Мета роботи — провести порівняльний аналіз клініко-лабораторних показників пацієнток з пізніми радіаційними ускладненнями та без ППУ після комбінованого хіміопроменевого лікування із застосуванням цисплатину з приводу РШМ.
Матеріали та методи
Проведено ретроспективний аналіз 254 історій хвороби пацієнток зі злоякісними новоутвореннями шийки матки, які перебували на стаціонарному лікування у ДУ «Інститут медичної радіології ім. С.П. Григор’єва НАМН України» за період 1994–2018 рр. Критерієм включення у дослідження було проведення комбінованого лікування при раку шийки матки, що включало хіміопроменеву терапію із застосуванням похідного платини — препарату цисплатину. Для подальшого дослідження відібрано 92 історій хвороби пацієнток, розподілених на дві групи: основну (44 пацієнтки) — хворі із ППУ після комбінованого лікування та контрольну (48 пацієнток) — хворі без ППУ після комбінованого лікування.
Відповідно до мети та завдань дослідження проведено оцінку показників загальноклінічного аналізу крові: еритроцити (red blood cells (RBС), ´1012/л), гемоглобін (hemoglobin (Hb), г/л), кольоровий показник (КП), середній вміст гемоглобіну в еритроциті (mean cell hemoglobin (MCH), пг), середній об’єм еритроциту (mean corpuscular volume (MCV), фл), тромбоцити (platelets (PLT), ´109/л), гематокрит (hematocrit (HCT), %), лейкоцити (white blood cells (WBC), ´109/л), швидкість осідання еритроцитів (ШОЕ, мм/год); біохімічні показники — загальний білок (г/л), сечовина (ммоль/л), креатинін (мкмоль/л), білірубін (мкмоль/л), глюкоза (мкмоль/л), аланінамінотрансфераза (АлАТ, мкмоль/год ´ л), аспартатамінотрансфераза (АсАТ, мкмоль/год ´ л), а також показники системи згортання крові — протромбіновий час (ПТЧ, с), протромбіновий індекс (ПТІ, ум.од.) активований частковий (парціальний) тромбопластиновий час (АЧТЧ, с), час згортання (хв), міжнародне нормалізоване відношення (МНВ, ум.од.), фібриноген (г/л), розчинні фібрин-мономерні комплекси (РФМК, мг/дл). Зазначені показники оцінювали в динаміці (до та після ПТ). Крім того проведено комплексний аналіз даних анамнезу, клініко-інструментальних методів дослідження, лікувальної тактики та строків розвитку і клінічної картини радіаційних ускладнень.
Індекс маси тіла (ІМТ, кг/м2 за А. Кетле) інтерпретували згідно з класифікацією ВООЗ (1997): < 18,5 кг/м2 — знижена вага; 18,5–24,9 кг/м2 — нормальна вага, 25,0–29,9 кг/м2 — надлишкова вага, 30,0–34,9 кг/м2 — ожиріння І ступеня, 35,0–39,9 кг/м2 — ожиріння ІІ ступеня, > 40 кг/м2 — ожиріння ІІІ ступеня.
Дослідження проведено відповідно до основних біоетичних норм Гельсінської декларації Всесвітньої медичної асоціації «Етичні принципи медичних досліджень за участю людини як об’єкта дослідження» (1964–2013), Міжнародного керівництва з етики для біомедичних досліджень Ради міжнародних організацій медичних наук (The Council for International Organizations of Medical Sciences — CIOMS, 2016), Конвенції Ради Європи про права людини та біомедицину (2007), рекомендацій Комітету з біоетики при президії НАМН України (2002), наказів МОЗ України № 690 від 23.09.2009 р., № 944 від 14.12.2009 р. та положень ВООЗ (World Health Organization), Міжнародної ради медичних наукових товариств та Міжнародного кодексу медичної етики (1983). Протоколи дослідження схвалені Комітетом з питань біоетики та деонтології ДУ «Інститут медичної радіології ім. С.П. Григор’єва НАМН України» (протокол № 1 від 22 січня 2019 р., протокол № 8 від 19 квітня 2019 р.).
Для комплексного аналізу клінічних та інструментальних даних історій хороби створено стандартизовану цифрову інформаційну базу. Статистичну обробку отриманих результатів проведено з використанням прикладної програми для роботи з електронними таблицями Microsoft Office Excel 2013 (Microsoft Corporation, США). Оцінку характеру розподілу величин у кожній групі вибіркової сукупності проводили з використанням W-критерію Шапіро — Вілка (Shapiro-Wilk test). Однорідність дисперсій визначали за критерієм Левена (Levene’s test). Для оцінки значущості виявлених відмінностей досліджуваних показників проводили статистичний аналіз з використанням параметричного t-критерію Стьюдента у випадках нормального розподілу, непараметричний ранговий U-критерій Манна — Уїтні (Mann-Whitney) застосовували за його відсутності. Кількісна оцінка факторів ризику розвитку ППУ проведена з розрахунком значень відносного ризику (risk ratio) та відношення шансів (odds ratio). Відмінності вважали статистично значущими при p < 0,05. Цифрові дані у разі нормального розподілу величин наведені у вигляді M ± m (M ± SE), де M — середнє арифметичне значення, m (SE) — стандартна похибка середнього арифметичного або М (95% ДІ 5–95 %), де 95% ДІ — 95% довірчий інтервал. При ненормальному розподілі отриманих величин дані подано у вигляді Ме [LQ; UQ], де Ме — медіана, [LQ; UQ] — верхня межа нижнього (першого) квартиля (lower quartile — LQ) та нижня межа верхнього (третього) квартиля (upper quartile — UQ) [8].
Результати та обговорення
Проведене дослідження показало, що пацієнтки обох груп були порівнянні за віком та масово-ростовими коефіцієнтами (табл. 1). Гістологічно в обох групах переважали хворі на плоскоклітинний варіант раку шийки матки (90,9 та 91,6 % відповідно) ІІ–ІІІ стадії процесу. Встановлено, що більше половини пацієнток обох груп отримували поєднану ПТ (ДПТ + ВППТ).
Оцінка наявності супутніх захворювань показала, що у пацієнток з ППУ у 72,8 % випадків було уражено 3 та більше систем організму, в той час як серед пацієнток без ППУ у 62,6 % коморбідною патологією уражені менше трьох систем організму (табл. 1).
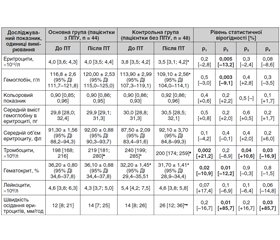
Аналіз гематологічних показників пацієнток показав, що у хворих на РШМ з ППУ після ХПТ (табл. 2) до лікування відзначались нижчі кількості тромбоцитів на 21,2 % (р = 0,002) і лейкоцитів на 17,4 % (р = 0,07), а також нижча швидкість осідання еритроцитів на 16,7 % (р = 0,2) відносно показників пацієнток контрольної групи в аналогічні строки дослідження. Водночас відзначено статистично вірогідно (р = 0,02) нижче на 10,2 % вихідне значення гематокриту у хворих основної групи порівняно з хворими без ППУ. Міжгрупові розбіжності з боку вихідних значень інших гематологічних показників не перевищували 5,0 %.
Згідно з оцінкою значень біохімічних показників (табл. 3), у хворих на РШМ із ППУ виявлено статистично вірогідно (р = 0,03) нижчий на 22,1 % вихідний рівень сечовини (4,3 [3,7; 5,5] ммоль/л). Проте вектор зміни вказаного показника в динаміці ХПТ значно різнився. Так, у пацієнток основної групи він статистично вірогідно (р < 0,001) зріс на 51,2 %, водночас у хворих без ППУ він знизився (р = 0,3) на 7,0 % відносно вихідних значень. Крім того привертає увагу статистично вірогідне (р = 0,01) зниження рівня білірубіну (р = 0,01) у хворих на РШМ без ППУ в динаміці лікування на 16,3 %, тоді як у хворих із ППУ він знизився лише на 3,7 % (р = 0,4).
Привертають увагу й вищі значення вихідних показників АлАТ та АсАТ у хворих на РШМ із ППУ на 6,7 % (р = 0,3) та 5,8 % (р = 0,06) відповідно щодо показників пацієнток контрольної групи.
Характеризуючи показники системи згортання крові (табл. 4) на тлі ХПТ хворих на РШМ встановлено, що у хворих із ППУ відзначено статистично вірогідно (р = 0,01) вищий на 23,4 % активований парціальний тромбопластиновий час (38 [35; 40] с), а також вищий на 11,6 % (р = 0,09) час згортання відносно показників хворих без ППУ в ті самі строки дослідження. Зазначені зміни вказують на дефіцит факторів внутрішнього шляху згортання крові (кінінгену, прекалікреїну, факторів згортання XII, XI, VIII).
Крім того, у хворих із ППУ встановлено нижчий (р = 0,09) на 11,6 % вихідний рівень фібриногену (2,9 [2,2; 3,2] г/л) щодо показників хворих контрольної групи (3,2 [2,7; 4,4] г/л).
Висновки
1. У хворих на РШМ при проведенні цисплатинвмісної хіміопроменевої терапії прогностичними маркерами пізньої променевої токсичності є послаблення окремих ланок судинно-тромбоцитарного гемостазу, на що вказували нижчі вихідні показники кількості тромбоцитів, ШОЕ, АЧТЧ та час згортання.
2. З боку біохімічних показників у хворих на РШМ прогностично-несприятливими щодо розвитку ППУ у хворих після ХПТ є вищі значення печінкових ферментів (АлАТ та АсАТ).
Конфлікт інтересів. Автори рукопису свідомо засвідчують відсутність фактичного або потенційного конфлікту інтересів щодо результатів цієї роботи з фармацевтичними компаніями, виробниками біомедичних пристроїв, іншими організаціями, чиї продукти, послуги, фінансова підтримка можуть бути пов’язані з предметом наданих матеріалів.
Фінансування. Це дослідження є фрагментом планової науково-дослідної роботи ДУ «Інститут медичної радіології ім. С.П. Григор’єва НАМН України» «Визначення факторів прогнозу та індивідуалізація комплексного лікування пізніх променевих ускладнень» (номер державної реєстрації: 0118U001712, шифр теми: НАМН. 03.19, термін виконання: 2019–2021 рр.). Фінансування видатками державного бюджету України.
Інформація про внесок кожного учасника: Гладких Ф.В. — розробка дизайну дослідження, огляд наукової публікації за темою статті, підбір хворих, статистичне опрацювання та узагальнення результатів, оформлення статті; Кулініч Г.В. — концепція дослідження, підбір хворих, наукове редагування тексту рукопису, аналіз результатів.
Етичне твердження. Дослідження виконані згідно з міжнародними етичними нормами та схвалені Комітетом з питань біоетики та деонтології ДУ «Інститут медичної радіології ім. С.П. Григор’єва НАМН України» (протокол № 1 від 22 січня 2019 р., протокол № 8 від 19 квітня 2019 р.). Ретроспективне дослідження не потребує отримання формальної згоди учасників. У цій статті не міститься ніяких досліджень з тваринами, виконаних будь-ким з авторів.

/3-1.jpg)
/4-1.jpg)
/5-1.jpg)
/6-1.jpg)