Журнал «Практическая онкология» Том 2, №3, 2019
Вернуться к номеру
Прогностические маркеры развития лимфомы при первичном синдроме Шегрена
Авторы: Головач И.Ю. (1), Егудина Е.Д. (2)
1 - Клиническая больница «Феофания» Государственного управления делами, г. Киев, Украина
2 - Образовательный центр Клиники современной ревматологии, г. Киев, Украина
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
Первинний синдром Шегрена (ПСШ) — це системне автоімунне захворювання з безліччю клінічних проявів у діапазоні від сухого синдрому до системних екстрагландулярних уражень. Наявність сухого синдрому визначає якість життя пацієнта і може викликати місцеві ураження із залученням слизових оболонок; системні ураження визначають прогноз захворювання. Системними проявами, що призводять до передчасної смертності пацієнтів з ПСШ, є кріоглобулінемічний васкуліт, інтерстиціальні захворювання легенів і лімфопроліферативні захворювання. Поданий огляд літератури присвячений доказовим даним про тісний зв’язок між ПСШ і розвитком лімфом. Надані дані про поширеність лімфом при ПСШ, їх типи і підтипи, описані фактори ризику розвитку лімфом. Ризик розвитку лімфоми при ПСШ у 10–44 рази вище, ніж у здорових людей, що перевищує дані при системному червоному вовчаку і ревматоїдному артриті. Тісний зв’язок між лімфомою і ПСШ наочно ілюструється дуже специфічним типом лімфоми, що виникає в пацієнтів з ПСШ. Це в основному В-клітинні лімфоми (з переважним залученням клітин крайової зони) з первинним екстранодальним ураженням великих слинних залоз, переважно привушних, з провідною роллю асоційованих з кріоглобулінемією маркерів (як клінічних, так і імунологічних). У пацієнтів з ПСШ виявлено велику кількість факторів ризику, що призводять до більш високого ризику розвитку лімфоми. Найсильнішими предикторами розвитку лімфом у пацієнтів з ПСШ є збільшення привушної залози в анамнезі, вираженість лімфаденопатії при діагностиці ПСШ, шкірна пурпура (ускладнена або не ускладнена виразками), кріоглобулінемія, кріоглобулінемічний васкуліт, цитопенія і особливо лейкопенія, фактори комплементу C3/C4 і моноклональні сироваткові імуноглобуліни. Клінічна та епідеміологічна картини ПСШ-асоційованої лімфопроліферації дуже специфічні і включають значну кількість прогностичних маркерів, що вимагає ретельного спостереження за групами високого ризику з оцінкою всіх відомих факторів-предикторів, допомагаючи лікарям поліпшити діагностичний процес при підозрі на лімфопроліферативне захворювання у пацієнтів з ПСШ.
Первичный синдром Шегрена (ПСШ) — это системное аутоиммунное заболевание с множеством клинических проявлений, со спектром от сухого синдрома до системных экстрагландулярных поражений. Наличие сухого синдрома определяет качество жизни пациента и может вызывать местные поражения с вовлечением слизистых оболочек; системные поражения определяют прогноз заболевания. Системными проявлениями, приводящими к преждевременной смертности пациентов с ПСШ, являются криоглобулинемический васкулит, интерстициальное заболевание легких и лимфопролиферативное заболевание. Представленный обзор литературы посвящен доказательным данным о тесной связи между ПСШ и развитием лимфом. Представлены данные о распространенности лимфом при ПСШ, их типах и подтипах, описаны факторы риска развития лимфом. Риск развития лимфомы при ПСШ в 10–44 раза выше, чем у здоровых людей, — больше, чем при системной красной волчанке и ревматоидном артрите. Тесная связь между лимфомой и ПСШ наглядно иллюстрируется очень специфическим типом лимфомы, возникающей у пациентов с ПСШ. Это в основном В-клеточные лимфомы (с преимущественным вовлечением клеток краевой зоны) с первичным экстранодальным поражением крупных слюнных желез, преимущественно околоушных, с ведущей ролью ассоциированных с криоглобулинемией маркеров (как клинических, так и иммунологических). У пациентов с ПСШ выявлено большее количество факторов риска, приводящих к более высокому риску развития лимфомы. Наиболее сильными предикторами развития лимфом у пациентов с ПСШ являются увеличение околоушной железы в анамнезе, выраженность лимфаденопатии при диагностике ПСШ, кожная пурпура (осложненная или не осложненная язвами), криоглобулинемия, криоглобулинемический васкулит, цитопения и особенно лейкопения, факторы комплемента C3/C4 и моноклональные сывороточные иммуноглобулины. Клиническая и эпидемиологическая картина ПСШ-ассоциированной лимфопролиферации очень специфична и включает большое количество прогностических маркеров, что требует тщательного наблюдения за группами высокого риска с оценкой всех известных факторов-предикторов, помогая врачам улучшить диагностический процесс при подозрении на лимфопролиферативное заболевание у пациентов с ПСШ.
Primary Sjogren’s syndrome (PSS) is a systemic autoimmune disease with many clinical manifestations, with a spectrum from dry syndrome to systemic extraglandular lesions. The presence of dry syndrome determines the patient’s quality of life and can cause local lesions involving mucous membranes; systemic lesions determine the prognosis of the disease. Systemic manifestations leading to premature mortality in patients with PSS are cryoglobulinemic vasculitis, interstitial lung disease, and lymphoproliferative disease. This literature review deals with the evidence of the close relationship between PSS and the development of lymphomas. Data on the prevalence of lymphomas in PSS, their types and subtypes are presented, the risk factors for the development of lymphomas, which may increase the risk of their occurrence, are described. The risk of developing lymphoma with PSS is 10–44 times higher than that of healthy people, which is higher than with systemic lupus erythematosus and rheumatoid arthritis. The close relationship between lymphoma and PSS is clearly illustrated by a very specific type of lymphoma that occurs in patients with PSS. These are mainly B-cell lymphomas (with predominant involvement of cells in the marginal zone), with primary extranodal damage to large salivary glands, mainly parotid, with the leading role of markers associated with cryoglobulinemia (both clinical and immunological). In patients with PSS, a greater number of risk factors have been identified, leading to a higher risk of developing lymphoma. The strongest predictors of lymphoma in patients with PSS are an increase in the parotid gland in the past medical history, the severity of lymphadenopathy when diagnosing PSS, cutaneous purpura (complicated by ulcers or not), cryoglobulinemia, cryoglobulinemic vasculitis, cytopenia and, especially, leukopenia, complement factors C3/C4 and serum immunoglobulins. The clinical and epidemiological picture of the PSS-associated lymphoproliferation is very specific and includes a large number of prognostic markers, so careful monitoring of high-risk groups with evaluation of all known predictor factors is needed, which can help doctors improve the diagnostic process for suspected lymphoproliferative disease in patients with PSS.
лімфома; синдром Шегрена; лімфопроліферативне захворювання; прогностичні маркери; кріоглобулінемія; фактори ризику; діагностика
лимфома; синдром Шегрена; лимфопролиферативное заболевание; прогностические маркеры; криоглобулинемия; факторы риска; диагностика
lymphoma; Sjogren’s syndrome; lymphoproliferative diseases; prognostic markers; cryoglobulinemia; risk factors; diagnosis
Введение
Первичный синдром Шегрена (ПСШ) — это системное аутоиммунное заболевание с множеством клинических проявлений, со спектром симптомов от сухого синдрома (ксеростомия, ксерофтальмия) до тяжелых системных экстрагландулярных поражений [1]. И если сухой синдром прежде всего приводит к ухудшению качества жизни и может вызывать местные поражения с вовлечением слизистых оболочек различных органов, то системное поражение определяет прогноз заболевания. У пациентов с ПСШ развивается большое количество системных проявлений как в дебюте заболевания, так и в процессе его прогрессирования [2]. Преждевременная и высокая смертность пациентов с ПСШ обусловлена в первую очередь развитием криоглобулинемического васкулита, интерстициального заболевания легких и лимфопролиферативными заболеваниями [3].
Связь между аутоиммунными заболеваниями и лимфомой отмечается не только при ПСШ (рис. 1). Повышенный риск развития опухолей системы крови обнаружен у пациентов с хроническим воспалением, ассоциированным с аутоиммунными нарушениями в целом, и этот риск дополнительно увеличивается при определенных методах лечения [4]. Хотя пациенты с аутоиммунными заболеваниями составляют только 5 % среди всех пациентов с неходжкинской лимфомой (НХЛ) [5], развитие лимфомы следует рассматривать как серьезную угрозу для пациентов с ПСШ [6] и наиболее серьезное осложнение, которое может развиться у пациента с болезнью/синдромом Шегрена в течение жизни. Следует отметить, что пациенты с ПСШ имеют более высокий риск развития лимфомы, чем лица с другими аутоиммунными заболеваниями: в 7 и 4 раза выше, чем лица с системной красной волчанкой (СКВ) и ревматоидным артритом (РА) соответственно, и в 10 раз выше, чем здоровые лица [7].
Ключевую роль лимфомагенеза при ПСШ играет постоянная стимуляция В-клеток аутоантигенами, аномально экспрессируемыми экзокринными железами и лимфоидной тканью слизистых оболочек (MALT — mucosa-associated lymphoid tissue). Первым событием в этом многоэтапном процессе является хроническая экспрессия поликлональных B-клеток, особенно с активностью ревматоидного фактора (РФ), органами-мишенями, поврежденными аутоиммунным процессом. Следствием поликлональной активации аутоиммунных B-клеток может быть повышенная концентрация проонкогенных факторов, способствующих аномальному удлинению продолжительности жизни B-клеток и высокому риску их злокачественной транс–формации [21].
Настоящий обзор литературы посвящен доказательствам и обсуждению данных о тесной связи между синдромом Шегрена (СШ) и развитием лимфом. За исключением наиболее важных классических статей, обзор сфокусирован на исследованиях, в которых применялись критерии классификации СШ 2002/2016 гг. [22, 23] для определения случаев первичного и ассоциированного СШ.
Современные данные о лимфомах и синдроме Шегрена
Общий уровень риска
Проводя испытания, в которых анализируется риск развития рака, исследователи используют стандартный параметр для сравнения частоты развития злокачественных новообразований в определенной когорте пациентов по отношению к населению в целом — стандартизованный коэффициент заболеваемости (СКЗ) [24]. СКЗ анализирует, является ли число наблюдаемых случаев заболевания раком у этих пациентов из определенного географического региона выше или ниже, чем ожидалось в общей популяции для этого региона. СКЗ определяется путем деления наблюдаемого количества случаев рака при заболевании, которое мы анализируем, на ожидаемое количество случаев, которые могут возникнуть в общей популяции.
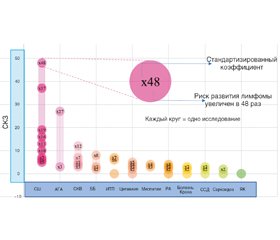
В 1978 году S.S. Kassan с соавт. впервые сообщили о семи пациентах с неходжкинской лимфомой в когорте Национального института здравоохранения из 142 пациентов с сухим синдромом [25]. Впервые авторами был оценен СКЗ для НХЛ при ПСШ — 44,4, а для СШ, ассоциированного с РА, — 42,9. С тех пор более 30 исследований были сосредоточены на анализе риска развития лимфомы у пациентов с ПСШ (табл. 1) [16, 25–56], включая 13 762 больных, из которых у 706 (5,1 %) была диагностирована лимфома. На рис. 2 суммирован СКЗ основных исследований. Отличия связаны с дизайном исследований: хотя клинические испытания показали, что СКЗ колебался в диапазоне от 10,5 [20] до 48,1 [35], с использованием административных баз данных (в подавляющем большинстве случаев применялись коды Международной классификации болезней для выявления случаев СШ) был выявлен более низкий СКЗ — между 1,9 и 9 [57].
Подтипы лимфом
Лимфомы являются основным типом злокачественных новообразований, ассоциированных с СШ, и могут быть классифицированы согласно различным системам. Однако значительные успехи в понимании патогенеза лимфом привели к созданию общепризнанной классификации Всемирной организации здравоохранения. Она разделяет лимфомы на B-клеточные и T/NK-клеточные новообразования, и каждый из этих типов затем делится на ряд специфических подтипов [21]. Клинические проявления лимфом значительно варьируют в зависимости от гистологического типа и вовлечения органов, но часто подразделяются на две основные модели в зависимости от типа течения. Так называемые индолентные лимфомы (MALT-лимфомы, фолликулярные лимфомы, хронические лимфоцитарные лейкозы/малые лимфоцитарные лимфомы и лимфомы маргинальной зоны селезенки (ЛМЗС)) часто встречаются и медленно растут в лимфатических узлах, селезенке, печени или экзокринных железах. Агрессивные лимфомы (диффузные В-крупноклеточные лимфомы, лимфома Беркитта, лимфобластные лейкемии/лимфомы и большинство Т-клеточных лимфом) обычно имеют острый или подострый характер манифестации, быстро прогрессируют и имеют так называемые системные В-симптомы (лихорадка, ночная потливость, потеря веса) [58].
Хотя подавляющее число клеток, инфильтрирующих слюнные железы пациентов с ПСШ, являются Т-клетками [1], большинство лимфом имеют В-клеточное происхождение. Среди 598 СШ-ассоциированных лимфом, включенных в 22 исследования [26, 29, 31–36, 39–41, 44, 49, 50, 53, 55, 56, 59–64], только 11 (2 %) были Т-клеточными лимфомами. Для СШ наиболее часто (более 90 %) характерна ассоциация с тремя подтипами лимфом: MALT-лимфомой, диффузными В-крупноклеточными лимфомами (ДВКЛ) и ЛМЗС [34, 43, 44, 49, 53, 56, 62]. Плазмоклеточная миелома встречается довольно редко, но в недавнем исследовании [65] описан повышенный риск ее развития у пациентов с ПСШ, страдающих моноклональной гаммапатией. Среди не-B-клеточных гематологических форм рака у пациентов с ПСШ может развиться миелоидная неоплазия/лейкоз, болезнь Ходжкина или T/NK-клеточная лимфома. Кроме того, к редким ассоциированным с СШ и малоизученным формам лимфом относят Т-клеточную (CD3þ) крупную гранулярную лимфоцитарную лейкемию [42].
MALT-лимфомы составляют 63 % случаев гематологической неоплазии, зарегистрированных у пациентов с ПСШ [47–49, 53, 56, 59, 60, 63]. Слюнные железы (в основном околоушные) являются наиболее частой локализацией MALT-лимфом при ПСШ, но в патологический процесс также могут быть вовлечены и слизистые оболочки. В подавляющем большинстве случаев у пациентов наблюдается медленно прогрессирующее увеличение околоушной железы, что трудно дифференцировать клинически с доброкачественной гиперплазией: гиперплазия часто является двусторонней, распространяется вверх и вниз, в то время как поражение при лимфоме чаще одностороннее, очаговое и плотное [1]. Локализованная MALT-лимфома часто является мультифокальной и распространяется за пределы вовлеченного органа (желудок, кожа). У 20 % пациентов MALT-лимфома может присутствовать в более чем одном экстранодальном участке, что подчеркивает необходимость комплексного обследования пациентов для постановки диагноза. Пациенты с поражением лимфатических узлов или костного мозга (10–20 %) на момент обращения, но не с множественными участками слизистой оболочки, имеют худший прогноз. Кроме того, есть данные, что MALT-лимфома может трансформироваться в ДВКЛ в ходе заболевания, однако процент ДВКЛ, возникающих из ранее существовавших MALT-лимфом или фолликулярных лимфом, неизвестен.
В нескольких исследованиях оценивался дифференцированный риск для каждого подтипа НХЛ при СШ [9, 10, 16, 27, 35, 42, 53, 54, 57, 59, 60, 66–68]. Сообщалось о более высоком относительном риске (ОР) для трех основных подтипов НХЛ — MALT, ДВКЛ и ЛМЗС при СШ, а для фолликулярной лимфомы [59, 60], лейкемии [16, 53] или других подтипов лимфомы [59, 60] повышенный риск не был продемонстрирован. Результаты противоречивы и для множественной миеломы, причем некоторые исследования продемонстрировали повышенный риск [42], а другие — несущественный [16, 66]. Три исследования [9, 16, 53] подтвердили более высокий риск развития лимфомы Ходжкина у пациентов с ПСШ — в 5–19,4 раза выше, чем в популяции.
Нодальное и экстранодальное вовлечение
Лимфома маргинальной зоны (ЛМЗ) включает три специфические локализации: экстранодальную (MALT-лимфома), селезеночную и нодальную ЛМЗ. Клинические и молекулярные характеристики различны для каждой формы с некоторыми общими фенотипическими и генетическими особенностями. MALT-лимфома является наиболее распространенной формой (70 % всех ЛМЗ), может возникать практически в любом экстранодальном участке и обычно связана с хронической антигенной или инфекционной стимуляцией (вирус гепатита C (ВГС)) в лимфатических узлах или Helicobacter pylori в желудке) или с –аутоиммунным заболеванием (СШ в слюнных железах) с определенными морфологическими признаками (лимфоэпителиальные поражения и фолликулярная колонизация) [69].
Существует тенденция к определенной цитологической экспрессии в органах-мишенях среди различных MALT-лимфом: малые лимфоциты в легких, моноцитарные инфильтраты в слюнных железах и плазмоцитарные клетки в щитовидной железе и коже. Специфические морфологические различия в зависимости от локализации в основном отражают уникальные топографические характеристики вовлеченного органа, влияя на клинические признаки. Тем не менее MALT-лимфомы в различных областях обычно имеют лимитированные клинические проявления и медленно прогрессирующее течение, при которых выживаемость существенно не отличается от здоровых пациентов группы контроля [56].
В 1999 году М. Voulgarelis с соавт. [70] представили первую детальную характеристику СШ-ассоциированных лимфом, используя данные 9 европейских центров: лимфома была исключительно экстранодальной у 36 % больных, как нодальной, так и экстранодальной — у 45 % и исключительно нодальной — у оставшихся 18 %. Лимфомы были классифицированы как низкодифференцированные у 70 % пациентов, а среди тех, у кого отмечалось экстранодальное вовлечение, 69 % локализаций были представлены поражением слюнных желез. Преобладающее вовлечение слюнных желез является этиопатогенетически обусловленной ключевой особенностью лимфомагенеза при СШ, поскольку лимфомы слюнных желез составляют менее 5 % всех лимфом и только 5–10 % всех раковых образований слюнных желез. Более частыми гистологическими подтипами являются MALT-лимфома и ДВКЛ — либо de novo, либо возникающие из предшествующих ЛМЗ. В ретроспективной серии у 180 пациентов с MALT-лимфомами слюнная железа была наиболее распространенной локализацией после слизистой желудка [71]. Как и в случае других MALT-лимфом, имеются свидетельства о корреляции между развитием лимфомы и хронической антигенной стимуляцией, ассоциированной с ПСШ или ВГС-инфекцией [71, 72].
На рис. 3 представлены основные первичные локализации лимфом у 337 пациентов с СШ [11, 17, 26, 29, 30, 32–34, 38, 40, 41, 47, 53, 55, 56, 63, 64, 73, 74]. У 235 пациентов (70 %) развивалась лимфома слюнных желез: околоушные железы были вовлечены в 200 случаях, малые слюнные железы — в 23 и подчелюстные слюнные железы — в остальных 12 случаях. Легкие (7 %), желудок (6 %) и придатки глаза (5 %) поражались гораздо реже. Выраженный тропизм СШ-связанных лимфом к поражению околоушных слюнных желез подтверждается несколькими исследованиями, которые установили, что у пациентов с СШ риск развития В-клеточной лимфомы околоушной железы выше в 22–260 раз, а MALT-лимфомы околоушной железы — в 90–1000 раз по сравнению с населением в целом [10, 57–60].
Прогностические маркеры
Идентификация маркеров, которые могут помочь в принятии диагностических решений, занимает центральное место в персонализированной медицине, особенно в клинических сценариях, потенциально опасных для жизни. Несмотря на то, что угроза развития лимфомы распространяется только на 5 % пациентов с ПСШ, крайне важно выделить маркеры, которые бы помогли врачу определить, у каких пациентов может быть повышенный или пониженный риск развития лимфомы, и, следовательно, проводить регулярный скрининг пациентов высокого риска для раннего выявления лимфом. В данном обзоре нами использован термин «прогностический фактор» в соответствии с определением, предложенным G.M. Clark с соавт. (2008) [75], как характеристика или оценка, связанная с клиническим исходом заболевания в отсутствие терапии или как мера естественного развития болезни. Причинно-следственная связь между прогностическим фактором и конечной точкой исследования (развитие лимфомы) может быть установлена только с помощью исследований с проспективным контролируемым дизайном [76]. Число прогностических факторов, связанных с развитием лимфомы у пациентов с ПСШ, является достаточно большим (табл. 2).
Эпидемиологические маркеры
Несколько исследований, проведенных на небольшой серии пациентов, продемонстрировали ключевое значение возраста на момент постановки диагноза СШ как прогностического маркера. Они показали, что у пациентов с манифестацией заболевания в молодом возрасте отмечается более частое развитие лимфом. Последующие исследования в более крупных когортах не подтвердили возраст на момент постановки диагноза в качестве прогностического маркера развития лимфомы [15, 19, 33, 36, 40].
Эпидемиологической особенностью, более однородно связанной с повышенным риском развития лимфомы, является пол пациента. Лимфома диагностируется раньше и с более высокой частотой (риск выше в 3–28 раз) у мужчин по сравнению с женщинами [9, 39, 53, 55, 61, 77, 78]. Оцененный для всех раковых заболеваний СКЗ был выше у мужчин, чем у женщин (2,29 против 1,87), так же как и СКЗ для основных гематологических групп рака (43 против 36 для множественной миеломы и иммунопролиферативных заболеваний, 59 против 16 для лимфомы Ходжкина и 18 против 5 для НХЛ соответственно) [53].
Клинические маркеры
В нескольких исследованиях были проанализированы клинические проявления ПСШ как потенциальные прогностические маркеры развития лимфомы. Однако данные весьма вариабельны и поэтому сомнительны. Сухой синдром (ксеростомия и ксерофтальмия) не коррелировали с риском развития лимфом [9, 27, 31, 40, 53]. В отличие от этого анализ системной активности поражения органов продемонстрировал значительную корреляцию, особенно для трех специфических показателей шкалы EULAR, оценивающей индекс активности СШ (ESSDAI) [79].
1. Поражение железистых органов: увеличение околоушной железы в анамнезе было отмечено как прогностический маркер развития лимфомы в 11 из 12 исследований (табл. 2), риск у пациентов с этим клиническим проявлением был в 3–15 раз выше по сравнению с лицами без него. Этому есть объяснение, принимая во внимание то, что 2/3 лимфом при ПСШ возникают в околоушных железах (MALT-лимфомы возникают из лимфоидных популяций, которые индуцируются хроническим воспалением в экстранодальных участках), и то, что эти низкодифференцированные лимфомы часто имеют медленно прогрессирующее течение. S.S. Kassan с соавт. (1978) [25] сообщили, что риск развития лимфомы у пациентов с увеличением околоушной железы в анамнезе был значительно выше, чем у лиц без данного поражения (66,7 против 12,5). L. Quartuccio с соавт. (2014) [46] подтвердили это утверждение в своем исследовании и сообщили, что у пациентов с увеличенными околоушными железами повышен риск развития лимфомы.
2. Поражение лимфатических узлов (лимфаденопатия): увеличенные лимфатические узлы в анамнезе были предложены как прогностический маркер развития лимфомы при СШ вместе со спленомегалией (табл. 2). Для MALT-лимфомы характерна длительная ограниченная первичная локализация с момента манифестации заболевания с частым поражением только регионарных лимфатических узлов и селезенки. Тем не менее следует отметить, что диффузное увеличение лимфатических узлов более характерно для не-MALT-лимфом. Только в одном исследовании проанализирована корреляция выраженности поражения различных органов-мишеней (по шкале ESSDAI) с различными подтипами лимфомы при ПСШ. Р. Brito-Zeron с соавт. (2017) [53] сообщили, что выраженность лимфаденопатии при диагностике СШ была связана с высоким риском возникновения всех подтипов гематологической неоплазии, тогда как степень поражения железистой ткани — только с развитием MALT-лимфомы, а выраженность конституциональных, легочных и гематологических поражений — с не-B-клеточным раком. Эти дифференцированные профили высокого риска, которые присутствуют при диагностике ПСШ, могут помочь врачам выделить пациентов высокого риска в отношении развития определенного подтипа гематологического рака.
3. Поражение кожи: системный васкулит (в основном связанный с криоглобулинемией) является одной из основных системных причин смертности у пациентов с ПСШ [80]. Однако клиническое проявление васкулита зависит от расположения и площади вовлечения пораженных сосудов. ESSDAI классифицирует кожную васкулитную активность как умеренную или высокую в соответствии с распространением кожных высыпаний (менее или более 18 % от площади поверхности тела соответственно) и наличием язв (высокая активность) [79]. Было продемонстрировано, что кожная пурпура (осложненная или не осложненная язвами) является ключевым прогностическим маркером развития лимфомы при ПСШ (табл. 2).
Недавно была подтверждена тесная связь между криоглобулинемией и развитием лимфом, причем эта связь была сильнее у пациентов с клиническими проявлениями криоглобулинемического васкулита (КВ) (отношение рисков [ОР] 7,47), чем у больных без КВ (ОР 2,56) [51]. Кроме того, пациенты без криоглобулинемии имели очень низкий риск развития лимфомы (ОР 0,39) по сравнению с больными с КВ [45]. Не все признаки, включенные в критерии КВ, имели одинаковую прогностическую ценность: холод-индуцированная пурпура (как субъективная, так и объективная) и кожные язвы были ассоциированы с лимфомой, тогда как поражение суставов выступало протективным фактором [37]. Эти результаты показывают, что кожные проявления КВ могут оказывать более сильное влияние на прогноз, чем другие симптомы, а применение критериев КВ позволяет дифференцировать криоглобулинемическую и гипергаммаглобулинемическую пурпуру у пациентов с ПСШ [8, 81]. У пациентов с ПСШ криоглобулинемия должна быть отдифференцирована от гипергаммаглобулинемической пурпуры, которая связана с поликлональной В-клеточной гиперактивностью, в то время как КВ представляет собой васкулитный процесс, обусловленный моноклональными антителами, который следует рассматривать как предлимфомное состояние [53].
Некоторые сывороточные маркеры были связаны с повышенным риском развития лимфомы при ПСШ, включая лабораторные особенности, связанные с B-клеточной поликлональной стимуляцией, характерной для заболевания (поликлональная гипергаммаглобулинемия или повышенные уровни уровней b2-микроглобулина и факторов, активирующих В-клетки). Тем не менее цитопения и особенно лейкопения выступают как наиболее чувствительные прогностические лабораторные маркеры [20, 36, 46, 55]. E. Theander с соавт. (2006) [33] впервые сообщили, что у пациентов с ПСШ может присутствовать CD4þT-лимфоцитопения, главным образом ассоциированная с антителами к Ro, и те же авторы сообщили о CD4+ T-лимфоцитопении как о значимом предикторе лимфопролиферативного заболевания. Сообщалось, что лейкопения и лимфопения являются маркерами-предикторами лимфом в девяти дополнительных исследованиях (табл. 2).
1. Аутоантитела. Прогностическая роль Ro-/La-антител является спорной. Одновременно с этим ни одно из исследований не идентифицировало положительные антинуклеарные антитела (ANA) как маркер лимфомы [19, 20, 31, 46]. В 2002 году J.P. Ioannidis с соавт. (2002) [31] сообщили о более высоком риске развития лимфомы у пациентов, имеющих положительные титры Ro- и La-антител, хотя многомерный анализ не подтвердил эту связь. Используя другой дизайн исследования (исследование «случай — контроль»), та же самая группа исследователей в 2016 году сообщила, что Ro-/La-антитела были независимыми предикторами развития НХЛ [51]. Итальянское многоцентровое исследование, включающее 661 пациента [8], также продемонстрировало, что La-антитела были связаны с развитием НХЛ и что пациенты с ПСШ, не имеющие Ro-/-La-антител, имели более низкий риск развития лимфом и более низкий уровень экспансии B-клеток [82]. Напротив, крупные исследования, проведенные в других странах, таких как Швеция [33], Испания [19, 53] и Норвегия [40], не обнаружили статистически значимой ассоциации между положительными специфическими антителами и риском развития лимфом у пациентов с ПСШ.
2. Криоглобулин-ассоциированные маркеры. Именно связанные с криоглобулинами маркеры, включая сывороточные криоглобулины, ревматоидный фактор, факторы комплемента C3/C4 и моноклональные сывороточные иммуноглобулины, должны рассматриваться как наиболее сильные предикторы развития лимфом у пациентов с ПСШ. Эти криоглобулин-ассоциированные маркеры тесно связаны с более высокой активностью системного заболевания.
В исследовании, проведенном в 2018 году P. Brito-Zeron с соавт. [83], сообщалось, что средний балл по шкале ESSDAI составил 17,7 у пациентов с криоглобулинемией, 11,3 — у лиц с низким уровнем С3 и 9,2 — с низким С4 по сравнению с 3,8 у лиц, у которых эти маркеры были негативными. L. Quartuccio с соавт. [84] также сообщили, что клинические и лабораторные показатели ESSDAI были значительно выше у криоглобулин-позитивных пациентов (p < 0,0001 для обоих показателей). Криоглобулинемия в значительной степени связана с признаками по шкале ESSDAI, которые более тесно ассоциированы с развитием лимфом: конституциональными симптомами, лимфаденопатией, вовлечением железистых органов, гематологическими изменениями. Наряду с криоглобулинемией гипокомплементемия является еще одним узловым иммунологическим прогностическим фактором развития лимфом при СШ. Несколько исследований, проведенных в многоцентровых национальных когортах, выявили значительную корреляционную связь между низким уровнем комплемента и системными признаками СШ, тесно связанными с лимфомой: лихорадкой, кожным васкулитом, криоглобулинемией [85]. Гипокомплементемия также ассоциирована с развитием лимфом и смертностью. Большинство исследований указывают на более сильную зависимость развития лимфомы и гипокомплементемии C4 по сравнению с гипокомплементемией C3 (табл. 2).
Гистопатологические паттерны
Ключевым гистопатологическим признаком СШ является очаговый лимфоцитарный сиаладенит (множественные плотные скопления лимфоцитов в периваскулярной или перидуктальной железистой ткани). Требования для правильной гистологической оценки включают адекватное количество информативных долек и определение количества очагов (фокусов). Очаг (фокус) — это агрегация не менее 50 лимфоцитов.
В нескольких исследованиях сообщалось о тяжелом системном фенотипе у пациентов с большим количеством очагов при биопсии слюнных желез, которые коррелировали с более частым увеличением околоушных желез, системным заболеванием, положительными иммунологическими маркерами и риском развития лимфомы [19, 53, 83, 85].
Зародышевые центры (ЗЦ) представляют собой структуры, возникающие в В-клеточных фолликулах вторичных лимфоидных органов в ответ на антигенную стимуляцию, и впервые были обнаружены в большой серии пациентов с ПСШ в 2003 году группой исследователей под руководством S. Salomonsson [86]. У пациентов с ЗЦ при биопсии слюнных желез отмечалось большее количество лимфоцитарных фокусов при гистопатологическом исследовании и более высокая частота увеличения околоушной железы, системное вовлечение, гипергаммаглобулинемия и положительные аутоантитела [20, 53, 74, 85]. О тесной связи между наличием ЗЦ и развитием лимфомы также сообщали E. Theander с соавт. (2006) [38], хотя это не было подтверждено в более поздних работах [20, 74]. Считается, что пациенты с ЗЦ-подобными структурами формируют особый фенотип заболевания, который прогностически отличается от фенотипа без ЗЦ.
Практическая оценка и менеджмент
НХЛ, возникающие у пациентов с основными системными аутоиммунными заболеваниями, рассматриваются как имеющие специфические особенности по сравнению с НХЛ, диагностированными у лиц без аутоиммунных заболеваний [12, 13]. Недавнее китайское исследование подтвердило значительные различия между пациентами с НХЛ, ассоциированной с аутоиммунными заболеваниями, и пациентами без аутоиммунных заболеваний [5]. Для первой когорты была характерна высокая частота экстранодального вовлечения (87 %) и характерные ассоциации между конкретными экстранодальными локализациями лимфомы и аутоиммунными заболеваниями. Хотя выживаемость у пациентов этих групп значительно не различалась, предшествующий анамнез системной терапии глюкокортикоидами (ГК) был связан с худшей выживаемостью (ОР 7,33, р = 0,006) [5].
Клиническая и эпидемиологическая картина СШ-ассоциированной лимфопролиферации очень специфична и включает большое количество прогностических маркеров, характерную гистопатологическую картину, потенциальное влияние предшествующей терапии, что может помочь врачам улучшить диагностический поиск при подозрении на лимфопролиферативное заболевание у пациентов с ПСШ.
Синергетический эффект прогностических маркеров
В недавних исследованиях, посвященных изучению роли прогностических маркеров в развитии СШ-ассоциированных лимфом, предлагается синергетическая модель риска, поскольку чем больше у пациента прогностических факторов, тем выше риск развития лимфомы. S. Fragkioudaki et al. (2016) [51] предложили предиктивный показатель риска развития НХЛ, включающий семь прогностических маркеров, и обнаружили, что у пациентов с не менее чем тремя факторами вероятность развития НХЛ составляет 40 %, а у тех, кто имеет все семь прогностических факторов, — 100 %. W. Zhang с соавт. (2010) [35] сообщили, что риск возникновения злокачественных новообразований был увеличен примерно в 30 раз у пациентов с тремя или более факторами риска, в 3 раза — с одним фактором риска по сравнению с лицами без таковых. S. Retamozo с соавт. (2016) [81] обнаружили, что чем больше клинических и иммунологических криоглобулин-связанных маркеров у пациентов с ПСШ, тем выше риск развития лимфомы (как в одномерном, так и в многомерном анализе). L. Quartuccio с соавт. (2014) [46] использовали четыре независимых биомаркера и сообщили, что чувствительность к диагностике лимфомы при наличии как минимум двух из этих маркеров составила 72 % со специфичностью 79 % и положительными и отрицательными прогностическими значениями 44 и 92 % соответственно.
На рис. 4 перечислены основные прогностические маркеры, сгруппированные по количеству исследований, которые могут быть классифицированы как очень сильные (> 10 исследований, поддерживающих прогностическую связь), сильные (5–10 исследований), слабые (2–5 исследований) и неясные (больше отрицательных, чем положительных данных).
Прогнозирование дифференцированного риска для подтипов лимфомы
Почти все исследования, посвященные изучению прогностических факторов при СШ, связали их с общим риском развития лимфомы. Однако НХЛ включает биологические и клинические гетерогенные подтипы, и в нескольких гематологических исследованиях были выявлены различные профили факторов риска среди подтипов лимфомы. Риск различался статистически значимо среди подтипов НХЛ в отношении данных истории болезни, таких как аутоиммунные заболевания или инфицирование вирусом гепатита С, семейного анамнеза лейкемии и множественной миеломы, злоупотребления алкоголем, курения сигарет и некоторых профессиональных вредностей [87]. Поскольку различные подтипы имеют не только разные клинические проявления, но и разную частоту возникновения, прогноз и терапевтический подход, выявление прогностических факторов для развития различных подтипов В-клеточной лимфомы представляется рациональным. Немногие исследования были сосредоточены на выявлении различных профилей риска, связанных с гистопатологическими вариантами лимфом, у пациентов с ПСШ. Так, в одном исследовании возраст пациентов с ДВКЛ был выше, чем у лиц с B-клеточными лимфомами маргинальной зоны –(В-КЛМЗ), а временной интервал между постановкой диагноза СШ и возникновением лимфомы был наиболее продолжительным для ДВКЛ [34]. В том же исследовании методом многомерного анализа было установлено, что криоглобулинемия, нейтропения, низкий уровень С4, лимфаденопатия и спленомегалия являются независимыми факторами риска для В-КЛМЗ, в то время как только лимфоцитопения была фактором риска для развития не-В-КЛМЗ [34]. Прогностическая роль этих факторов может различаться в зависимости от подтипа гематологического рака. Был обнаружен более высокий риск развития MALT-лимфом у пациентов с более высокой системной активностью, положительным анализом на криоглобулины и низким уровнем C3 при постановке диагноза СШ, в то время как риск не-MALT B-клеточных лимфом не был связан с системной активностью, анемией, моноклональной гаммапатией, криоглобулинемией и низким уровнем С4 при диагностике СШ. При не-B-клеточном гематологическом раке факторами риска были системная активность, цитопения (анемия, тромбоцитопения и лейкопения) и криоглобулинемия [53].
Медикаментозное лечение и риск развития лимфомы при синдроме Шегрена
Важным фактором для оценки лимфомагенеза, связанного с аутоиммунными заболеваниями, является установление потенциальной роли иммуносупрессивных и биологических агентов в развитии лимфомы. Среди биологических методов лечения в подавляющем большинстве случаев используется B-клеточная терапия. Остается открытым вопрос, снижает ли риск лимфомагенеза эффективность анти-В-клеточных препаратов. Эффекты деплеции B-клеток при ПСШ, такие как уменьшение количества экстрагландулярных проявлений или количества ЗЦ в околоушной железе, подтверждают потенциальную роль этих биологических агентов в предотвращении развития лимфом, но необходимы дальнейшие исследования [1]. Прежде чем на этот вопрос можно будет дать окончательный ответ, потребуются длительные периоды наблюдения и использование суррогатных биомаркеров для определения профиля риска развития лимфомы. Что касается потенциального влияния иммуносупрессивной терапии на развитие малигнизации, есть данные о более высоком риске развития гематологического рака у пациентов, которые получали глюкокортикоиды/иммунодепрессанты [33]. Однако следует учесть, что глюкокортикоиды/иммунодепрессанты обычно назначаются пациентам с более высокой степенью активности, а последняя, как было доказано, обладает проонкогенными свойствами.
Лимфома в анамнезе
Лимфома в анамнезе традиционно рассматривалась как критерий исключения для постановки диагноза ПСШ. Однако в 2016 году Американский колледж ревматологии (ACR) и Европейская противоревматическая лига (EULAR) в критериях классификации ПСШ отменили это исключение. В недавнем исследовании изучались различия между пациентами с ПСШ с ранее существовавшей лимфомой на момент постановки диагноза ПСШ и без таковой [88]. Мужской пол, увеличенные лимфатические узлы, MALT-лимфома и лимфома слюнных желез более часто встречались у пациентов с лимфомой в анамнезе. У значительной части пациентов, особенно у мужчин, ПСШ оставался недиагностированным до момента диагностики лимфомы. В повседневной практике нередко диагностика лимфомы является первым ключом к обнаружению ранее недиагностированного СШ. Гематолог или онколог может быть первым врачом, который задал вопрос этим пациентам о предшествующем анамнезе сухого синдрома, в большинстве случаев беспокоившего пациентов в течение длительного времени. Лимфомы околоушных слюнных и слезных желез также были зарегистрированы как первый признак не выявленного ранее СШ [89].
Дифференцированный риск лимфомы в случаях первичного и ассоциированного (вторичного) синдрома Шегрена
За последние 50 лет в научной литературе термин «вторичный СШ» использовался для пациентов с диагностированными другими системными аутоиммунными заболеваниями, а «первичный СШ» — для пациентов без таковых. Эта терминология находится в стадии обсуждения, и стандартизированные руководящие принципы относительно того, когда и почему эти термины следует использовать, отсутствуют. Вторичный СШ в основном диагностируется у пациентов с сопутствующим РА, системной склеродермией и СКВ, но редко устанавливается лицам с другими системными заболеваниями (саркоидоз, системные васкулиты, антифосфолипидный синдром) или с сопутствующими органоспецифическими аутоиммунными заболеваниями (аутоиммунный тиреоидит, первичный билиарный холангит, аутоиммунный гепатит). Кроме того, некоторые авторы использовали термин «вторичный СШ» для пациентов с клиническими признаками сухого синдрома, когда остальные клинические и лабораторные признаки в совокупности не соответствовали критериям СШ. Некоторыми авторами предложено дифференцированное использование этого диагноза в соответствии с ассоциированным заболеванием: вторичный СШ, ассоциированный с СКВ или РА. Тем не менее различия между первичным и ассоциированным (вторичным) СШ отражают только клиническую ситуацию сосуществования или синдром перекреста у пациентов с аутоиммунными заболеваниями. Для практического ведения пациентов нет смысла выделять первичный и вторичный СШ, поскольку ключевая цель менеджмента СШ в обеих группах является одинаковой.
Несколько исследований продемонстрировали потенциальный дифференцированный риск развития лимфомы у пациентов с первичным или ассоциированным СШ [16, 25, 27, 57, 60, 68]. В некоторых описательных исследованиях не было зарегистрировано ни одного случая лимфомы среди лиц с ассоциированным СШ по сравнению с теми, у кого было первичное заболевание [27, 68]; в трех исследованиях сообщалось о более высоком риске лимфомы у пациентов с ПСШ [16, 25, 57], и только в одном исследовании сообщалось о повышенном риске у пациентов с ассоциированным заболеванием по сравнению с ПСШ [60].
Выводы
Недавние исследования подтверждают мнение о том, что чем больше факторов риска развития лимфомы у пациентов с СШ, тем выше риск развития этого онкологического заболевания, но прогнозировать лимфомагенез по этим выявленным факторам риска остается невозможным. При изучении связи между ПСШ и риском развития лимфомы следует учитывать несколько факторов, в том числе то, как было диагностировано заболевание (критерии классификации), среднюю продолжительность заболевания и дополнительные факторы (индекс массы тела, курение, употребление алкоголя, проведение иммуносупрессивной или глюкокортикоидной терапии), что может повлиять на результаты диагностики. С клинической точки зрения обязательным является тщательное наблюдение за группами пациентов высокого риска с тщательной оценкой всех известных факторов риска, включая маркеры, связанные с криоглобулинемией и повышенной активностью заболевания, оцениваемой по шкале ESSDAI. Проводящиеся в настоящее время исследования направлены на понимание механизма лимфомагенеза при СШ и на разработку стратегий вмешательства для предотвращения таких событий. В будущем цель этих исследований может быть направлена на изучение дифференцированных клинических проявлений лимфом, предрасположенности к конкретным подтипам лимфомы, а также изучение того, был ли риск (или даже прогноз) снижен в последние годы из-за раннего диагноза заболевания и назначения соответствующего лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Информация о вкладе каждого участника: Головач И.Ю. — концепция и дизайн работы, обзор литературы по проблеме, коррекция текста; Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати.

/12-1.jpg)
/11-1.jpg)
/12-2.jpg)
/12-3.jpg)
/14-1.jpg)
/17-1.jpg)