Газета «Новости медицины и фармации» №1 (713), 2020
Вернуться к номеру
Огляд міжнародного консенсусу з алергії та ринології: Алергічний риніт (частина ІIІ)
Рубрики: Пульмонология, Оториноларингология
Разделы: Справочник специалиста
Версия для печати
(Початок у випуску «Оториноларингологія. Пульмонологія. Алергологія», № 701, 707, 2019)
IX.B.5. Кромолін
Динатрію кромоглікат є стабілізатором тучних клітин, що запобігає вивільненню гістаміну. Він перешкоджає функціонуванню хлоридних каналів, необхідних для регулювання об’єму клітин, і запобігає припливу позаклітинного кальцію в цитоплазму тучної клітини, запобігаючи тим самим дегрануляції сенсибілізованих клітин. Найкраще його використовувати профілактично для запобігання появі симптомів шляхом переривання фізіологічної реакції на носові алергени.
Динатрію кромоглікат продемонстрував здатність пригнічувати ранню й пізню реакції при астмі. Початкові дослідження були присвячені впливу на вивільнення гістаміну й цитокінів із тучних клітин. Більш пізні дослідження показали протиалергічну активність, не пов’язану з активацією тучних клітин, а пов’язану скоріше з пригніченням макрофагів, еозинофілів, моноцитів і тромбоцитів.
Динатрію кромоглікат може використовуватися у вигляді інгаляцій як профілактичний засіб при лікуванні астми легкого й середнього ступеня тяжкості, як назальний спрей для лікування сезонного алергічного риніту або як офтальмологічний розчин для лікування алергічного або весняного кон’юнктивіту. Також можна приймати його всередину для контролю алергічних реакцій на певні продукти. Він може використовуватись для пацієнтів від 2 років і старших, але має короткий період напіввиведення, що вимагає дозування 3–6 разів на день. Динатрію кромоглікат має чудовий профіль безпеки, хоча необхідність частого дозування може вплинути на його дотримання. Невеликі побічні ефекти включають подразнення або печіння в носі, чхання, носову кровотечу й поганий смак.
Більшість досліджень, які порівнюють динатрію кромоглікат безпосередньо з плацебо, показали, що він ефективний у пацієнтів із сезонним алергічним ринітом. Дослідження ефективності динатрію кромоглікату при багаторічному алергічному риніті були суперечливі. У недавньому рандомізованому конт-
рольованому дослідженні Lejeune і співавт. вивчали роль динатрію кромоглікату в моносенсибілізованих пацієнтів із багаторічним алергічним ринітом і виявили, що він приводив до значного зниження вираженості симптомів закладеності носа, виділень з носа й чхання порівняно з плацебо. Порівняно з інтраназальними кортикостероїдами динатрію кромоглікат виявився менш ефективним.
На сьогодні не було ніяких прямих порівнянь динатрію кромоглікату й інтраназальних антигістамінних препаратів. У кінцевому підсумку роль динатрію кромоглікату в первинному лікуванні алергічного риніту обмежена з огляду на його більш низьку ефективність порівняно з інтраназальними кортикостероїдами, а також потенційні проблеми з дотриманням вимог частого прийому.
Загальний рівень доказовості: A (рівень 1b: 13 досліджень; рівень 2b: 9 досліджень).
Користь: ефективно зменшує чхання, ринорею, закладеність носа.
Шкода: рідкісні місцеві побічні ефекти включають подразнення ротоглотки, чхання, ринорею, головний біль.
Вартість: низька.
Оцінка співвідношення користь/шкода: переважання користі над шкодою. Менш ефективний, ніж інтраназальні кортикостероїди.
Висновки про цінність: корисний для короткочасного профілактичного використання в пацієнтів з відомими ризиками впливу.
Втручання: може використовуватись для лікування алергічного риніту, особливо в пацієнтів, які не переносять інтраназальних кортикостероїдів.
ІХ.B.6. Інтраназальні антихолінергічні препарати
Іпратропію бромід застосовується в першу чергу для зменшення ринореї і ефективний у дорослих і дітей з багаторічним ринітом і застудою. Він має швидкий початок дії і короткий період напіввиведення, що обумовлює потребу в його введенні до 6 разів на добу. Місцеві побічні ефекти включають сухість у носі, подразнення, носову кровотечу й печіння. Системних побічних ефектів при терапевтичному дозуванні не спостерігалося. Однак слід бути обережним, щоб не передозувати препарат, бо це може призвести до високих концентрацій іпратропію в сироватці крові. Усі дослідження показали, що використання іпратропію броміду суттєво контролює ринорею в дітей і дорослих з багаторічним алергічним ринітом. Також було показано, що комбіноване застосування з інтраназальним кортикостероїдом є більш ефективним, ніж будь-яка інша комбінація, що вказує на ефективність застосування іпратропію броміду для пацієнтів зі стійкою ринореєю.
Загальний рівень доказовості: B (рівень 1b: 9 досліджень; рівень 2b: 5 досліджень).
Користь: зменшення ринореї місцевими антихолінергічними препаратами.
Шкода: місцеві побічні ефекти включають подразнення носоглотки, печіння, головний біль, фарингіт, набряк і сухість у носі, закладеність носа й сухість у роті. Слід уникати передозування, що призводить до системних побічних ефектів.
Вартість: від низької до середньої.
Оцінка співвідношення користь/шкода: перевага користі над шкодою в пацієнтів, хворих на багаторічний алергічний риніт із ринореєю.
Висновки про цінність: немає суттєвих переваг для контролю інших симптомів, крім ринореї. Докази для комбінованого застосування з інтраназальними кортикостероїдами обмежені, але обнадійливі для пацієнтів зі стійкою ринореєю.
Втручання: іпратропію бромід спрей назальний може розглядатися як допоміжний препарат щодо інтраназальних кортикостероїдів у пацієнтів з багаторічним алергічним ринітом із неконтрольованою ринореєю.
IX.B.7. Біопрепарати (oмалізумаб)
Біологічні препарати для лікування алергічного риніту (омалізумаб) вивчались окремо й у поєднанні зі специфічною алерген-імунотерапією. Омалізумаб являє собою гуманізоване антитіло, що зв’язується з людським IgE. Жоден біологічний препарат на цей час не схвалений FDA США для лікування АР. Один систематичний огляд і метааналіз РКД продемонстрували зменшення симптомів, зменшення використання рятувальних ліків і покращення якості життя в пацієнтів, які отримували омалізумаб. Але вартість омалізумабу дуже висока, за оцінками експертів, у США це понад 18 000 доларів на рік.
Систематичний огляд виявив п’ять доказових досліджень рівня 1, що вивчали використання омалізумабу при АР. Чотири рандомізовані контрольовані дослідження показали, що монотерапія омалізумабом перевершує плацебо в покращенні симптомів і за показниками якості життя. Перше рандомізоване конт-рольоване дослідження, що оцінювало різні шляхи доставки й діапазони дози, не виявило ефективності проти АР, викликаного амброзією, але і не повідомляло про значні побічні дії, пов’язані з омалізумабом. Друге дослідження, рандомізоване щодо пацієнтів із багаторічним АР, спричиненим пилком берези, які отримували або 300 мг омалізумабу (спочатку назвали rhumAb-E25), або плацебо, що давали 2 або 3 рази протягом сезону залежно від вихідного рівня IgE. Лікування RhemAB-E25 значно знизило показники вираженості носової симптоматики, середню кількість таблеток рятувальних антигістамінних препаратів на добу, питому вагу днів із застосуванням будь-яких препаратів і всі показники якості життя. У третьому дослідженні застосували омалізумаб 50, 150 або 300 мг проти плацебо підшкірно до сезону амброзії з повторенням кожні 3–4 тижні протягом сезону пилку залежно від базового рівня сироваткового IgE пацієнта. При найвищій досліджуваній дозі 300 мг омалізумабу значно знижувались показники вираженості носової симптоматики й специфічні для риніту показники якості життя. Спостерігалася значна асоціація між зниженням IgE й назальними симптомами і вживанням антигістамінних препаратів. Частота побічних явищ суттєво не розрізнялася між групами омалізумабу й
плацебо.
Омалізумаб також вивчався при лікуванні багаторічного АР шляхом підшкірного введення кожні 4 тижні протягом 16 тижнів, він значно знижував середній добовий показник закладеності носа й частоти використання рятувальних ліків і покращував якість життя. Терапія омалізумабом добре переносилася. Аналогічно ефективність і безпека підшкірно введеного омалізумабу була показана при лікуванні сезонного АР, спричиненого пилком японського кедра. Під час лікування омалізумабом знизилися рівень сироваткового IgE і клінічна відповідь на провокацію алергії назальним алергеном у відкритому дослідженні, але лікування омалізумабом не вплинуло на Ig-секретуючі В-клітини й епсилон-мРНК у рідині для промивання носа, що дозволяє припустити, що лікування протягом 6 місяців незначно модулює синтез назального IgE. Також біологічні препарати пригнічували рівень триптази й еозинофільного катіонного білка у виділеннях з носа при сезонній алергії. Омалізумаб показав значно більше покращання, ніж суплатаст-тосилат, селективний інгібітор цитокінів типу T-хелперів, при лікуванні сезонного АР, індукованого пилком японського кедра.
У чотирьох випробуваннях було вивчено комбінацію омалізумабу з алерген-імунотерапією, щоб визначити, чи може комбінована терапія забезпечити кращу ефективність і зменшити побічні явища порівняно з алерген-імунотерапією. У дітей і підлітків, які страждають від сезонного АР на пилок берези чи трави, комбінована терапія значно знижує навантаження симптомів порівняно з алерген-імунотерапією незалежно від алергену. Монотерапія анти-IgE значно зменшила використання рятувальних ліків і зменшила кількість днів, коли реєструвались симптоми. Комбіноване лікування алерген-імунотерапією та aнти-IgE показало кращу ефективність щодо вираженості симптомів порівняно з монотерапією анти-IgE. Тому комбінована терапія може бути корисною для лікування АР, особливо для полісенсибілізованих пацієнтів. Пацієнти, які отримували омалізумаб і швидку алерген-імунотерапію на амброзію, показали значне покращання показників протягом сезону порівняно з моноалерген-імунотерапією.
Хоча сам омалізумаб несе певний ризик виникнення анафілаксії, додавання омалізумабу привело до знач-ного зниження ризику анафілаксії, спричиненої алерген-імунотерапією. Комбінована терапія також значно знизила тяжкість симптомів у суб’єктів, які страждають від алергії до кліща домашнього пилу, краще, ніж моноалерген-імунотерапія, і покращила контроль астми і якість життя щодо астми й АР. Ці ефекти були обмежені комбінованим періодом лікування.
Немає інших опублікованих досліджень, які б оцінювали інші біологічні препарати (анти-IL-5, анти-IL-4 або ІL-4R) в монотерапії АР. Комбінована терапія анти-ІL-4 із субоптимальною алерген-імунотерапією не давала додаткової користі порівняно з підшкірною імунотерапією при купіруванні реакції з боку шкіри на пізній фазі, викликаної алергеном.
Хоча є стійкі докази того, що монотерапія омалізумабом перевершує плацебо щодо зменшення симптомів і покращання якості життя при АР, переваги над фармакотерапією порівняно невеликі. Омалізумаб має переваги в поєднанні з алерген-імунотерапією і знижує ризик виникнення анафілаксії, пов’язаної з алерген-імунотерапією. Комбінована терапія може бути показана в окремих пацієнтів, полісенсибілізованих і високочутливих.
Загальний рівень доказовості: A (рівень 1a: 1 дослідження; рівень 1b: 5 досліджень).
Користь: постійне зменшення симптомів і рятувальних препаратів, а також покращання якості життя порівняно з плацебо.
Шкода: реакції на місці ін’єкції, можливість анафілактичної реакції.
Вартість: висока. Щорічні витрати на ліки в США перевищують 18 000 доларів США на рік.
Оцінка співвідношення користь/шкода: жоден варіант терапії, оскільки омалізумаб не зареєстрований для лікування АР. Цей огляд обмежився лише оцінкою АР; коморбідна астма не оцінювалася.
Висновки про цінність: монотерапія омалізумабом перевершує плацебо, але ефекти порівняно з фармакотерапією невеликі. Можна оцінити у виняткових випадках високочутливих полісенсибілізованих людей у поєднанні з алерген-імунотерапією.
Втручання: омалізумаб не слід застосовувати як монотерапію при лікуванні АР, але він може розглядатися в комбінованій терапії для високочутливих пацієнтів з поліалергічним ринітом з підвищеним ризиком анафілаксії. Оскільки омалізумаб у даний час не затверджений FDA для лікування AР, у США такий підхід до лікування, швидше за все, не застосовується у звичайній клінічній практиці.
IX.B.8. Назальний сольовий розчин
Назальний сольовий розчин часто використовується при лікуванні АР. Однак термін «назальний сольовий розчин» охоплює широке розмаїття терапевтичних схем. До них можна віднести гіпертонічний фізіологічний розчин, ізотонічний/звичайний фізіологічний розчин, морську воду, буферні або небуферні розчини й об’єми, що варіюються від 300 мкл до 500 мл на введення. Режими зрошення також застосовуються з різною частотою.
У дорослих у 5 дослідженнях було виявлено покращання клінічних результатів із застосуванням різних видів фізіологічного розчину для носа. Ці дослідження варіювали в оцінці показників для сезонного АР порівняно з багаторічним АР, а також типу й обсягу фізіологічного розчину. Дослідження Garavello та
співавт. і Rogkakou та співавт. встановило, що додавання гіпертонічного фізіологічного розчину значно покращило носові симптоми і якість життя порівняно з невикористанням фізіологічного розчину. Ural та співавт. порівняли ефективність гіпертонічного й ізотонічного фізіологічного зрошення, виявивши покращений час мукоциліарного кліренсу при застосуванні ізотонічного розчину. Вони дійшли висновку, що при багаторічному АР реологічні властивості слизу найбільше посилюються ізотонічним фізіологічним розчином, тим самим покращується мукоциліарний кліренс. Chusakul та співавт. також визначили, що буферний ізотонічний фізіологічний розчин із легкою лужністю має найбільший вплив на зниження показників назальних симптомів і більшість пацієнтів віддали йому перевагу. Нарешті, Cordray та співавт. виявили, що сольовий спрей Мертвого моря суттєво покращив бал згідно з опитувальником якості життя при ринокон’юнктивіті порівняно з ізотонічним фізіологічним розчином. Cordray
і його колеги припустили, що магній у сольовому розчині Мертвого моря може мати протизапальні властивості, у результаті чого покращуються результати АР.
У педіатричній популяції всі дослідження, що оцінювали або сезонний АР, або багаторічний АР, виявили покращення назальних симптомів або показників якості життя при включенні назального фізіологічного розчину. Обидва дослідження Garavello та співавт. показали значне покращання після додавання зрошення гіпертонічним фізіологічним розчином тричі на добу порівняно з відсутністю зрошень. Marchisio і Satchabudha та співавт. встановили, що гіпертонічні сольові зрошення призводять до більшого покращення показників назальних симптомів у дітей порівняно з ізотонічним фізіологічним розчином. Нарешті, Li і Chen та співавт. виявили адитивний ефект у використанні назального сольового спрея як доповнення до назального стероїдного спрея порівняно з будь-якою терапією.
Систематичний огляд Hermelingmeier та співавт. включав 10 досліджень, з яких 7 були рандомізованими контрольованими, що оцінювали як дорослих, так і педіатричних пацієнтів. Кілька цих досліджень також включені вище. Цей огляд виявив, що майже всі дослідження показали покращання назальних симптомів від 3,1 до 70,5 % при додаванні назального фізіологічного розчину. Крім того, вони виявили зменшення споживання ліків на 24,2–100 %, а також покращення рівня якості життя на 29,8–37,5 %. У цьому огляді також припускається, що ізотонічний фізіологічний розчин був більш ефективним, ніж гіпертонічний фізіологічний розчин. Можливо, дивно, що вони виявили, що назальні сольові спреї приводять до покращання симптомів порівняно з фізіологічним зрошенням. У цілому вони дійшли висновку, що назальний фізіологічний розчин є настільки ж ефективним, як і інші часто застосовувані фармакологічні методи лікування (наприклад, назальні антигістамінні препарати, пероральні антигістамінні засоби тощо) для лікування як сезонного АР, так і багаторічного АР.
У цілому є вагомі докази на підтвердження використання назального фізіологічного розчину як допоміжного лікування для ГРВІ та багаторічного АР. Виявляється, у дорослих буферизований ізотонічний спрей може забезпечити максимальну користь. Однак у дітей гіпертонічний розчин може бути більш ефективним.
Гіпотонічний фізіологічний розчин не вивчався в лікуванні АР. Додавання легкої лужності (рН 7,2–7,4) до розчину може додатково покращити переносимість. Хоча показано, що назальний фізіологічний розчин сприяє покращенню симптомів і результатів анкетування щодо якості життя при самостійному застосуванні, його часто застосовують як доповнення до інших методів лікування, включаючи назальні стероїди, антигістамінні спреї або пероральні антигістамінні препарати. Як у дорослих, так і в дітей назальний фізіологічний розчин дає адитивний ефект при застосуванні в поєднанні з іншими стандартними методами лікування АР. Крім того, сольовий розчин для носа має відносно низьку вартість і чудовий профіль безпеки. Хоча несприятливі ефекти рідкісні, вони можуть включати місцеве подразнення, біль у вухах, кровотечі з носа, головний біль, печіння носа, дренаж носа й забруднення пляшки.
Загальний рівень доказовості: A (рівень 1a: 1 дослідження; рівень 1b: 11 досліджень). Дослідження нижчого рівня в цьому огляді не враховувалися.
Користь: зниження показників назальних симптомів, покращений мукоциліарний кліренс, добре переноситься з відмінним профілем безпеки.
Шкода: інтраназальне подразнення, головні болі, біль у вусі.
Вартість: мінімальна.
Оцінка співвідношення користь/шкода: перевага користі над шкодою.
Висновки про цінність: назальний сольовий розчин слід використовувати як доповнення до інших фармакологічних методів лікування АР. Ізотонічні розчини можуть бути кориснішими для дорослих, тоді як гіпертонічні можуть бути ефективнішими в дітей.
Рівень політики: сильна рекомендація.
Втручання: сольовий фізіологічний розчин наполегливо рекомендується в рамках стратегії лікування АР.
IX.B.9. Пробіотики
Взаємозв’язок між мікробіомом і розвитком атопії складний і не повністю зрозумілий. Попередні дані спостережних досліджень свідчать про те, що мікробне заселення, особливо в грудному віці, формує мікро-біоми кишечника й дихальних шляхів і впливає на подальше імунологічне зміщення Th2 або Th1. З огляду на зв’язок між флорою кишки й атопією маніпулювання мікробіомом через введення пробіотиків теоретично може привести до клінічного покращання при алергічному захворюванні. Пробіотики чинили імуномодулюючу дію на атопічну хворобу за допомогою лімфоїдної тканини, пов’язаної з кишечником. Стимуляція дендритних клітин індукує реакції Th1 через IL-12
та IFN-γ, регуляцію клітин Treg через IL-10 і TGF-β, а також пригнічення Th2-шляхів за рахунок зниження регуляції IL-4, sIgE, IgG1 та IgA.
Оптимальні терміни прийому пробіотиків для лікування атопії невідомі. Метааналіз 17 подвійних сліпих рандомізованих контрольованих досліджень показав, що пробіотики під час вагітності й у ранньому віці були пов’язані зі зменшенням захворюваності на екзему, але не на астму чи риносинусит у ранньому дитячому віці. Багато подвійних сліпих рандомізованих контрольованих досліджень і рандомізованих кросовер-досліджень вивчали вплив пробіотиків на АР у дітей старшого віку й дорослих. Метааналізи цих досліджень були опубліковані у 2015 та 2016 роках із позитивними результатами. Побічні явища при призначенні пробіотиків були рідкісними і незначними, включно з діареєю, болем у животі й метеоризмом.
Guvenc та співавт. провели систематичний огляд і метааналіз 22 подвійних сліпих рандомізованих контрольованих досліджень, що включали 2242 пацієнтів віком 2–65 років із багаторічним або сезонним АР. Пацієнти отримували щоденно пробіотик або плацебо протягом 4 тижнів до 12 місяців як засіб, допоміжний щодо стандартної терапії алергії. Основні результати включали загальні показники назальних/очних симптомів і показники опитувальника якості життя. Вторинні результати включали конкретні показники назальних симптомів та імунологічні параметри. Сімнадцять випробувань продемонстрували клінічну користь пробіотиків. Аналіз підгруп продемонстрував покращання клінічних показників при багаторічному або сезонному АР. Співвідношення Th1/Th2 було покращено (SMD –0,78, p = 0,045) у групі пробіотиків, без різниці в кількості tIgE, sIgE або еозинофілів.
Zajac та співавт. опублікували систематичний огляд і метааналіз 21 подвійного сліпого рандомізованого контрольованого дослідження і двох рандомізованих кросовер-досліджень, що включали 1919 дорослих і педіатричних пацієнтів із багаторічним або сезонним АР, які отримували пробіотик від 3 тижнів до 12 місяців порівняно з плацебо. Метааналіз продемонстрував покращання глобального показника й оцінки носових симптомів за даними стандартного опитувальника якості життя при ринокон’юнктивіті.
Переважання даних з метааналізів і подвійних сліпих рандомізованих контрольованих досліджень говорить про сприятливий ефект щодо пробіотиків при лікуванні багаторічного або сезонного АР як у дорослих, так і в дітей, але інтерпретація обмежена неоднорідністю віку й діагностикою, втручаннями й результатами, включеними в дослідження. Пробіотики в різних дозах постачалися через молоко, йогурт, порошок або капсули і включали низку різноманітних штамів: у 19 дослідженнях використовувались види лактобактерій, у 6 дослідженнях — біфідобактерії, по 1 дослідженню — кожен з наступних штамів: Tetragenococcus halophilus, Escherichia coli та Bacillus clausii.
Загальний рівень доказів: A (рівень 1a: 2 дослідження; рівень 1b: 26 досліджень).
Користь: покращання назальних/очних симптомів або якості життя в більшості досліджень. Можливе покращання імунологічних показників (співвідношення Th1/Th2).
Шкода: низька.
Оцінка співвідношення користь/шкода: баланс користі й шкоди.
Висновки про цінність: мінімальна шкода, пов’язана з пробіотиками, але неоднорідність під час досліджень ускладнює кількісну оцінку величини користі. Варіації в організмі й дозування протягом випробувань перешкоджають конкретній рекомендації щодо лікування.
Рівень політики: варіант.
Втручання: розгляньте допоміжне застосування пробіотиків для пацієнтів із симптоматичним багаторічним або сезонним АР.
ІХ.В.10. Комбінована терапія
ІХ.В.10.а. Пероральний антигістамінний препарат і пероральний деконгестант
Пероральні антигістамінні препарати функціонують як оборотні конкурентні антагоністи гістамінового рецептора H1 і перешкоджають зв’язуванню гістаміну з його рецепторами. Пероральні деконгестанти, такі як псевдоефедрин і фенілефрин, є альфа-адренергічними стимулюючими препаратами, які зв’язуються з до- і посткапілярними судинами, що призводить до звуження судин слизової оболонки носа. Непов’язані біологічні цілі механізмів дії цих препаратів були показані в рандомізованому дослідженні, це призводить до синергічного покращання симптомів АР.
Комбінація перорального антигістамінного препарату з пероральним деконгестаном виявилася більш ефективною, ніж плацебо, у боротьбі з чханням, свербінням у носі й зменшенні закладеності носа в пацієнтів з АР. Дослідження Kaiser та співавт. виявили, що при прийомі один раз на день або двічі на день лоратадин і псевдоефедрин постійно перевершували плацебо, зменшуючи загальний показник назальних симптомів, із значно більшим ризиком виникнення безсоння й сухості у роті, пов’язаним із обома препаратами, порівняно з плацебо. Крім того, у 2006 році Nathan та співавт. повідомили, що комбінація цетиризину й псевдоефедрину зменшила загальну вираженість симптоматики АР, показники тяжкості астми й покращила показники якості життя для астми порівняно з плацебо. Однак вони не виявили суттєвих змін при тестуванні легеневої функції в пацієнтів, які отримували цетиризин і псевдоефедрин або плацебо, і вони виявили схожі темпи припинення й побічні явища в обох групах лікування.
Також показано, що комбінація пероральних антигістамінних і пероральних деконгестантів є більш ефективною в боротьбі з симптомами АР порівняно з інтраназальним кортикостероїдом або порівняно з монотерапією або пероральними антигістамінними препаратами, або пероральними деконгестантами. Zieglmayer та співавт. виявили, що комбінація цетиризину з псевдоефедрином із пролонгованим вивільненням значно перевершує назальний спрей будесоніду щодо покращання закладеності носа після впливу кліща домашнього пилу, що вимірюється за допомогою передньої риноманометрії і візуалізації носа. Показано, що поєднання пероральних антигістамінних препаратів другого покоління й псевдоефедрину знижує показники симптомів у пацієнтів із сезонним АР більше, ніж один препарат. Додатково встановлено, що тип антигістамінного препарату другого покоління й графік дозування ліків, мабуть, не мають істотного впливу на ефективність.
Пероральні деконгестанти корисні для полегшення симптомів закладеності носа завдяки їх здатності викликати вазоконстрикцію капілярів всередині слизової носа; однак їх механізм дії також може спричинити несприятливі системні наслідки, такі як гіпертонія і затримка сечі. Пероральні деконгестанти також були пов’язані зі збільшенням частоти специфічних вроджених вад розвитку, включно з пілоричним стенозом і дефектами ендокарда при використанні вагітними жінками. Крім того, деконгестанти не рекомендуються дітям віком до 4 років через високий ризик виникнення несприятливих подій, пов’язаних із застосуванням ліків у цій віковій групі. Слід дотримуватися обережності при застосуванні цих препаратів, особливо в дітей до 4 років і пацієнтів, які вагітні або мають наявний серцево-судинний стан, гіпертонію або доброякісну гіпертрофію передміхурової залози. Пероральні антигістамінні препарати добре переносяться зі сприятливим співвідношенням ризику/користі. Однак слід бути обережним, оскільки антигістамінні препарати мають серцеві побічні ефекти, змінюють метаболізм інших лікарських засобів і пов’язані з більшою частотою побічних явищ і взаємодією лікарських засобів у літніх людей.
Імовірно, через цей значний ризик виникнення побічних явищ і схильність до взаємодії з іншими лікарськими засобами рекомендації ARIA 2010 не рекомендували рутинне лікування АР комбінацією деконгестанту для перорального прийому й пероральним антигістамінним препаратом. Документ ARIA 2010 року передбачав, що пероральні деконгестанти слід додавати тільки пацієнтам, які не лікуються самими лише антигістамінними препаратами. Крім того, вони запропонували обмежити використання пероральних деконгестантів насамперед як рятувальних препаратів у періоди значних загострень симптомів.
У цілому, незважаючи на наявні докази, що підтверджують ефективність комбінації пероральних антигістамінних препаратів і пероральних деконгестантів для покращання симптомів АР, усе ж слід дотримуватися обережності при призначенні цього лікування, особливо пацієнтам із серцево-судинною або урологічною коморбідністю.
Загальний рівень доказовості: A (рівень 1b: 21 дослідження).
Користь: може покращитись контроль закладеності носа за допомогою застосування комбінації пероральних антигістамінних препаратів і пероральних деконгестантів.
Шкода: пероральні деконгестанти можуть спричинити значні несприятливі наслідки, особливо в пацієнтів із гіпертонічною хворобою, серцево-судинними захворюваннями або доброякісною гіпертрофією простати. Крім того, ці ліки не слід застосовувати дітям до 4 років або вагітним пацієнткам. Слід зважити на можливі переваги перед призначенням препарату.
Вартість: низька.
Оцінка співвідношення користь/шкода: шкода, ймовірно, переважає користь при рутинній основі.
Висновки про цінність: комбінована терапія пер-оральними антигістамінними препаратами й пероральними деконгестантами може бути корисною для полегшення загострення АР, особливо носових симптомів, при дії тригерів. Слід бути обережними щодо тривалого використання, враховуючи можливість значних побічних ефектів.
Рівень політики: варіант, особливо при загостреннях із закладеністю носа.
Втручання: комбінована терапія пероральним антигістамінним засобом і пероральним деконгестантом може забезпечити ефективне зменшення симптомів закладеності носа в пацієнтів з АР, проте тривале застосування не рекомендують з огляду на значний профіль побічних ефектів пероральних деконгестантів.
ІХ.В.10.b. Пероральний антигістамінний препарат та інтраназальний кортикостероїд
Комбінація перорального антигістамінного препарату й інтраназального КС часто використовується в клінічній практиці для лікування АР. Як уже було сказано раніше, пероральні антигістамінні препарати функціонують як оборотний конкурентний антагоніст рецептора Н1 гістаміну і тим самим запобігають зв’язуванню гістаміну, який присутній у циркуляції. Нові засоби другого покоління, такі як фексофенадин і цетиризин, мають менше заспокійливих ефектів, меншу кількість побічних ефектів і забезпечують добрий контроль чхання, ринореї і свербежу в носі, але менше впливають на закладеність носа. Крім того, неодноразово підтверджувалось, що інтраназальні КС, такі як флутиказон або беклометазон, є ефективним варіантом лікування АР, пропонуючи добрий профіль безпеки й низьке системне поглинання.
Кілька рандомізованих контрольованих досліджень вивчали ефективність комбінованої терапії, у якій використовувався як пероральний антигістамінний засіб, так і інтраназальний КС, і не показали додаткової користі від комбінованої терапії. У 2000 р. Wilson
та співавт. продемонстрували, що пероральний цетиризин та інтраназальний мометазон були ефективними щодо покращання пікової швидкості носового потоку, а також щодо назальних симптомів і загальних добових симптомів після 4 тижнів використання. Однак комбінація не була значно кращою, ніж цетиризин і плацебо або цетиризин і монтелукаст. У подвійному сліпому перехресному дослідженні Barnes та співавт. порівняли комбінацію флутиказону й левоцетиризину проти флутиказону й плацебо й виявили в більшості пацієнтів, що переваги додаткового перорального антигістамінного препарату для ефективного режиму назальної стероїдної терапії не суттєві. Крім того, Ratner та співавт. встановили, що монотерапія флутиказоном порівняно з комбінацією флутиказон плюс лоратадин мала порівнянну ефективність майже за всіма симптомами, які оцінювали лікар і пацієнт. Нарешті, Di Lorenzo
та співавт. продемонстрували подібні результати в пацієнтів із сезонним АР, зазначивши, що комбінована терапія не дає значного покращання щоденних показників назальних симптомів або зменшення маркерів запалення у змиві з носа.
На відміну від цього проведене в 2008 році дослідження Pinar та співавт. порівняло монотерапію спреєм монометазону із застосуванням комбінації мометазон + дезлоратадин і виявило, що ця група комбінованої терапії значно покращила показники назальних симптомів наприкінці другого тижня дослідження й показник якості життя протягом усього дослідження. Нещодавній систематичний огляд і метааналіз Feng та співавт. підсумували ефективність комбінованої терапії пероральним антигістамінним препаратом та інтраназальним КС порівняно з будь-якою терапією. Дослідники дійшли висновку, що комбінація продемонструвала значне покращання показників симптомів при АР порівняно з пероральним антигістамінним препаратом, але вона не дає значної додаткової користі порівняно з монотерапією з ефективним інтраназальним КС. Обмеження щодо цих даних включають той факт, що дослідження не контролювали відхилення конкретних пероральних антигістамінних препаратів або застосованих інтраназальних КС і що дослідження переважно оцінювали пацієнтів із сезонним АР, виключаючи пацієнтів із багаторічним АР. Крім того, висновки цього метааналізу підкріплені оновленими інструкціями ARIA 2010 року, які також не рекомендують додавати пероральний антигістамінний препарат до ефективного інгаляційного кортикостероїду, на відміну від попередніх рекомендацій. Слід також зазначити, що до несприятливих ефектів пероральних антигістамінних препаратів і комбінованої терапії з інтраназальними КС відносять сонливість і сухість у роті (від пероральних антигістамінних препаратів), а також епістаксис і подразнення носа (від застосування інтраназального КС).
Загальний рівень доказовості: В (рівень 1b: 5 досліджень).
Користь: зменшення закладеності носа за допомогою комбінації пероральних антигістамінних препаратів та інтраназальних КС порівняно з пероральними антигістамінними препаратами.
Шкода: побічні ефекти включають седативні властивості антигістамінних препаратів, хоча вони значно знижуються порівняно з новими засобами другого покоління. Побічні ефекти місцевих інтраназальних КС включають сухість у носі й епістаксис, печіння в носі, і при тривалому застосуванні можливе пригнічення росту в педіатричній популяції.
Вартість: низька.
Оцінка співвідношення користь/шкода: шкода, ймовірно, перевершує користь від додавання перорального антигістамінного препарату, якщо не лікувати інші симптоми, крім симптомів носа.
Висновки про цінність: комбінована терапія пер-оральним антигістамінним препаратом та інтраназальним кортикостероїдом може бути корисною при лікуванні симптомів закладеності носа.
Рівень політики: варіант.
Втручання: комбінована терапія інтраназальним КС і пероральним антигістамінним препаратом не покращує симптоми закладеності носа більше, ніж при застосуванні монотерапії інтраназальним КС, а також має ризики негативних наслідків системного впливу антигістамінних препаратів.
ІХ.В.10.c. Пероральний антигістамінний препарат і антагоніст лейкотрієнових рецепторів
Комбінована терапія антагоністами лейкотрієнових рецепторів і пероральними антигістамінними препаратами при лікуванні АР була вивчена в рамках одного систематичного огляду й декількох рандомізованих контрольованих досліджень. Комбінована терапія, як правило, покращувала симптоми й показники якості життя порівняно з плацебо в кількох дослідженнях. Ефективність комбінованої терапії порівняно з монотерапією або антагоністами лейкотрієнових рецепторів, або пероральним антигістамінним засобом є меншою. У систематичному огляді комбінованої терапії Wilson та співавт. відмітили покращення симптомів порівняно з будь-яким препаратом у монотерапії, але відмінностей у стандартизованих показниках якості життя не було. У дослідженні Cingi та співавт. показано, що комбінована терапія монтелукастом і фексофенадином переважає за зменшенням симптомів, що вимірюються риноманометрією, порівняно з монотерапією фексофенадином або фексофенадином у поєднанні з плацебо. Однак декілька інших рандомізованих контрольованих досліджень не виявили різниці в зменшенні симптомів між комбінованою терапією та пероральною антигістамінною монотерапією.
Кілька досліджень також вивчали відносну ефективність комбінованої терапії антагоністами лейкотрієнових рецепторів і пероральними антигістамінними препаратами порівняно з інтраназальними КС. Комбінована терапія, як правило, менш ефективна, ніж монотерапія інтраназальними КС, хоча деякі дослідження не виявили статистично значущої різниці. Систематичний огляд Wilson та співавт. не виявив різниці в зменшенні симптомів між комбінованою терапією антагоністами лейкотрієнових рецепторів і пероральними антигістамінними препаратами й монотерапією інтраназальними КС. На противагу цьому три рандомізовані контрольовані дослідження показали, що інтраназальні КС призводять до покращання симптомів носа порівняно з лікуванням комбінацією на додаток до зниження кількості еозинофілів слизової оболонки носа.
Існують суперечливі докази щодо того, чи є комбінована терапія більш ефективною, ніж пероральна антигістамінна терапія, і, мабуть, є відносно послідовні докази того, що монотерапія інтраназальними КС є ефективнішою щодо зменшення назальних симптомів, ніж комбінована терапія антагоністами лейкотрієнових рецепторів і пероральними антигістамінними препаратами. Тому комбінована терапія може бути варіантом для пацієнтів, симптоми яких не повністю контролюються пероральною антигістамінною монотерапією і які не переносять інтраназальні КС. Це може бути особливо корисно для підгрупи цих пацієнтів, які одночасно мають астму. Монтелукаст може бути ефективним при одночасному зменшенні симптомів АР і покращенні контролю астми.
Взаємодія лікарських засобів і безпека є важливим фактором при використанні комбінованої терапії. Зафіксовані побічні явища для монтелукасту й лоратадину в поєднанні були подібними до таких при монотерапії монтелукастом і лоратадином і плацебо. Найпоширенішими побічними діями були головний біль (4,5 %), швидка стомлюваність (1,2 %) і фаринголарингеальний біль (1,2 %). У період моніторингу не спостерігалося жодних змін життєвих ознак, електрокардіограми або даних фізикальних обстежень. Комбінацію антагоністів лейкотрієнових рецепторів і пероральних антигістамінних препаратів можна застосовувати з мінімальними побічними діями і з частотою, подібною до такої в будь-якого засобу при монотерапії.
Загальний рівень доказовості: A (рівень 1a: 1 дослідження; рівень 1b: 11 досліджень; рівень 2b: 1 дослідження).
Користь: суперечливі докази того, що комбінація антагоністів лейкотрієнових рецепторів і перорального антигістамінного препарату переважає за зменшенням симптомів і покращанням якості життя будь-який препарат при монотерапії. Комбінація цих препаратів поступається за ефективністю щодо зменшення симптомів інтраназальним КС.
Шкода: немає значних побічних ефектів, пов’язаних з безпекою, у результаті застосування цієї комбінованої терапії.
Вартість: загалом монтелукаст був дорожчим, ніж генеричний лоратадин або цетиризин.
Оцінка співвідношення користь/шкода: баланс користі й шкоди.
Висновки про цінність: комбінована терапія антагоністом лейкотрієнових рецепторів і пероральним антигістамінним препаратом не призводить до стабільного покращання симптомів АР порівняно з будь-яким препаратом. Повідомляється про небажані побічні явища, пов’язані з безпекою, комбінованої терапії. Додавання антагоністу лейкотрієнових рецепторів може відігравати роль у лікуванні коморбідної астми.
Рівень політики: варіант.
Втручання: комбінована терапія антагоністами лейкотрієнових рецепторів і пероральних антигістамінних препаратів є варіантом лікування АР, особливо в пацієнтів із коморбідною астмою або тих, хто не переносить інтраназальні КС і симптоми недостатньо контролюються при пероральній антигістамінній монотерапії.
ІХ.В.10.d. Інтраназальний кортикостероїд та інтраназальний антигістамінний засіб
Застосування комбінованого інтраназального антигістамінного й кортикостероїдного спрея для АР добре вивчено. У даний час у Північній Америці доступний один актуальний препарат для інтраназального застосування у вигляді комбінації азеластину гідрохлориду й флутиказону пропіонату (AzeFlu). Цей агент також позначається в літературі як MP-AzeFlu або MP29-02 і продається в США під торговою назвою Dymista. Проведено систематичний огляд англомовної літератури для пошуку клінічних випробувань комбінації інтраназального КС та інтраназального антигістамінного препарату для лікування АР. Усього 10 рандомізованих контрольованих досліджень (9 подвійних сліпих, 1 несліпе) оцінювали комбіновану терапію проти плацебо або активного контролю. Додаткові 2 обсерваційні дослідження в допустимому діапазоні дат пошуку для цього документа повідомили про результати AzeFlu як єдиної групи лікування.
Вихідні дані були переважно показниками симптомів, про які повідомляли пацієнти, або оцінками стандартного опитувальника якості життя пацієнтів із АР. Найпоширенішим показником результатів була загальний показник назальних симптомів (TNSS) (9 досліджень), що реєструє ступінь тяжкості нежитю, чхання, свербежу й закладеності носа. Інші результати результатів включали загальний показник очних симптомів (TOSS) (4 дослідження), візуальну аналогову шкалу (VAS) (3 дослідження), опитувальник якості життя при ринокон’юнктивіті (RQLQ) (2 дослідження), педіатричний RQLQ (1 дослідження) і бал порога/дискримінації/ідентифікації (TDI) (1 дослідження).
Мінімальний вік осіб у більшості включених досліджень становив 12 років і старше. Тривалість дослідження становила 14 днів активного лікування в більшості досліджень, крім 1 дослідження тривалістю 3 місяці й 1 дослідження тривалістю 52 тижні. Кількість суб’єктів у кожному дослідженні становила від 47 до 3398. Комбінована терапія препаратом AzeFlu порівнювалася з плацебо в 6 дослідженнях, при цьому первинні результати демонстрували перевагу над плацебо в усіх дослідженнях. У 6 дослідженнях AzeFlu порівнювали з активним лікуванням монотерапією флутиказону пропіонатом, і всі вони показали перевагу комбінованої терапії. Аналогічно інтраназальний AzeFlu порівнювали з активним лікуванням монотерапією азеластином гідрохлоридом у 4 дослідженнях, усі вони показали перевагу комбінованої терапії. В 1 дослідженні AzeFlu безпосередньо порівнювали з комбінованою терапією з інтраназальним олопатадином і флутиказоном, без суттєвої різниці щодо полегшення симптомів між групами лікування. В одному дослідженні було виявлено перевагу експериментальної комбінації солюбілізованого азеластину й будесоніду порівняно з препаратом азеластину й будесоніду типу суспензії або плацебо.
Два дослідження оцінювали дітей віком від 6 до 12 років. Як і в дорослих, AzeFlu показав перевагу над плацебо в покращенні симптомів і якості життя дітей. У кількох дослідженнях, що повідомили про час до початку, було встановлено, що AzeFlu має більш швидкий ефект порівняно з інтраназальними КС.
Про серйозні побічні ефекти не повідомлялося в жодному дослідженні. Інтраназальна антигістамінна й кортикостероїдна комбінована терапія, як правило, добре переноситься, при цьому найчастіше повідомляється про такий побічний ефект, як неприємний смак. Інші повідомлення про побічні ефекти включали сонливість, головний біль, епістаксис і дискомфорт у носі, усі вони виникали менше ніж у 5 % випадків у кожному дослідженні. В одному дослідженні, що порівнювало комбіновану терапію флутиказону пропіонатом з азеластином або олопатадином, повідомлялося про більше подій, пов’язаних із лікуванням групи азеластину (16/68), ніж групи олопатадину (7/67).
Загальний рівень доказовості: A (рівень 1b: 9 досліджень; рівень 2b: 1 дослідження; рівень 2c: 2 дослідження).
Користь: швидка дія, більш ефективно для купірування багатьох симптомів, ніж використання інтраназального КС або інтраназального антигістамінного засобу.
Шкода: непереносимість препарату, особливо через смак.
Вартість: помірне фінансове навантаження. Середня оптова ціна 202 долари США за 23-грамову пляшку.
Оцінка співвідношення користь/шкода: перевага користі над шкодою. Комбінована терапія з інтраназальним антигістамінним препаратом та інтраназальним КС стабільно ефективніша, ніж плацебо. Низький ризик несерйозних побічних ефектів.
Висновки про цінність: незважаючи на докази рівня 1, які демонструють, що комбінована спрей-терапія (інтраназальний КС плюс інтраназальний антигістамін) є більш ефективною, ніж монотерапія і плацебо, збільшені фінансові витрати й потреба в рецепті обмежують значення комбінованої терапії як звичайного лікування АР першої лінії.
Рівень політики: суворі рекомендації щодо лікування АР, коли за допомогою монотерапії не вдається конт-ролювати симптоми.
Втручання: комбінована терапія «інтраназальний КС та інтраназальний антигістамінний препарат» може використовуватися як терапія другого ряду при лікуванні АР, коли початкова монотерапія або інтраназальним КС, або антигістамінним препаратом не забезпечує належного контролю.
IX.D. Імунотерапія алергенами (ІТА)
Крім уникнення алергенів і численних варіантів фармакотерапії в лікуванні АР часто розглядається ІТА. ІТА передбачає планове введення екстрактів алергену в ефективних дозах з метою встановлення стійкої імунологічної зміни. Ефективність ІТА часто вимірюється за усуненням алергічної симптоматики й зменшенням прийому протиалергічних препаратів. У наступному розділі розглянуто специфіку одиниць і стандартизації екстрактів алергенів, ад’ювантів і модифікацій екстрактів алергенів, підшкірної і сублінгвальної імунотерапії (ПШІТ, СЛІТ), а також менш традиційні види імунотерапії.
IX.D.1. Одиниці, активність і стандартизація екстрактів алергенів
Історично склалося так, що проби на алергію виконували за допомогою введення пилкових зерен безпосередньо на кон’юнктиву, але, оскільки діагностичними та імунотерапевтичними методами лікування стали шкірні проби і ПШІТ, виникла необхідність в ін’єкційних формах екстрактів алергенів. Інгаляційні алергенні частинки містять складну гетерогенну суміш алергенних і неалергенних білків і макромолекул. Екстракти алергенів створюються шляхом збору сировини від певного виду рослини, пліснявих грибків або тварин, а потім використовують розчин для вилучення екстракту білків із сировини.
Існує кілька джерел дисперсії для екстрактів алергенів. Сировина відзначається біологічною різноманітністю, і білки можуть відрізнятися за антигенністю і складом; крім того, відносна кількість алергенних білків може змінюватися. Домішки у вихідних матеріалах, такі як пліснява, що росте на пилкових гранулах, або бактерії, присутні на котячій шерсті, також можуть бути імуногенними, навіть якщо вони нежиттєздатні. Варіації також виникають при зборі й переробці сировини. Існує варіабельність у процесі вилучення різних виробників, що використовують різні методи, включаючи фільтрацію, екстракцію, стерилізацію і консервацію. Лише дуже невелика частка екстрагованих білків є алергенними. Зважаючи на те, що білковий склад екстрактів алергенів невідомий, виробництво й маркування екстрактів алергенів, які є безпечними й ефективними, становить складне завдання.
Одиниці та активність. Екстракти алергенів маркуються асортиментом одиниць, що містять непряму вказівку на вміст алергену в екстракті. Більшість екстрактів алергенів маркуються одиницями, які не передають інформацію про біологічний склад або активність. Існує кілька типів одиниць, які можна об’єднати в нестандартизовані, стандартизовані або пропрієтарні. Різниця між стандартизованими й нестандартизованими екстрактами обговорюється далі в цьому розділі.
Активність алергену може мати різні значення. Іноді активність стосується алергенності білків первинного матеріалу або біологічної активності. Наприклад, пилок трави, як правило, більш сильний, ніж пилок дерев. Типова людина з алергією на пилок трави має більш виражену клінічну реакцію на пилок трави, ніж людина-алергік на таку ж кількість пилку дерев. Однак міра активності екстракту алергену також може стосуватися сили або концентрації, виміряних в одиницях.
Нестандартизовані екстракти алергенів. Більшість екстрактів алергенів, наявних у США, є нестандартизованими. Екстракти алергенів підлягають регулюванню Центром оцінювання та досліджень біологічного матеріалу при Управлінні з контролю якості харчових продуктів і лікарських препаратів (FDA) США. Екстракти алергенів необхідні для переліку біологічної сировини, одиниці активності й терміну придатності.
Маса/об’єм — це перша найпоширеніша нестандартизована одиниця, що є відношенням кількості сухої сировини у грамах до розчинника екстракту у мілілітрах. Зазвичай маса/об’єм дорівнює 1/20, що означає, що на 1 грам сировини (наприклад, пилку) припадає 20 мл розчинника екстракту. Це не дає прямої інформації ані про кількість алергенних білків в екстракті алергену, ані про його біологічну активність. Однак це означає, що була використана відтворювана методологія.
Одиниці білкового азоту (ОБА) — це друга найпоширеніша нестандартизована одиниця, що зараз використовується в США. ОБА заснована на аналізі осаджуваного білкового азоту фосфорно-вольфрамовою кислотою, що корелює із загальною кількістю білка. Хоча більша частина білка неалергенна, загальний білок є ще одним методом кількісного визначення вмісту екстракту алергену.
У Європі багато виробників застосовують власні одиниці й внутрішній контроль якості, що повинен використовувати затверджений аналіз. Цей контроль якості на базі європейського виробника відомий як «Корпоративний стандартний препарат». Однак Європейське медичне агентство розробляє стандартизовану структуру, засновану на гомології білка, а не на сировинних зразках. ЄС також розробляє додаткові стандарти алергенів із ВООЗ, починаючи з Bet v 1 і Phl p 5a.
Стандартизовані екстракти алергенів. У США стандартизовані екстракти алергенів перевіряються виробником, щоб вони були в межах діапазону референсних значень (70–140 %) порівняно зі стандартом, наданим Центром оцінювання та досліджень біологічного матеріалу (уряду США). Урядовий стандарт посилається на реакційну здатність людей-алергіків, що створює рівень біологічної активності.
Центр оцінювання та досліджень біологічного матеріалу створює стандартний екстракт шляхом випробування його на відомих людях-алергіках. Вони використовують серійні внутрішньошкірні триразові титрування й вимірюють активність залежно від того, скільки розведень потрібно для отримання яскравої алергічної реакції на шкірі певного розміру. Розмір визначається шляхом вимірювання найбільшого діаметра й додавання довжини лінії, перпендикулярної до лінії найбільшого діаметра. Ортогональні суми наносяться на графік для кожного розведення, і відображається найкраща емпірична крива. Концентрація, яка відповідає ортогональній сумі яскравої алергічної реакції на шкірі, що становить 50 мм (ID50EAL), визначає одиниці, перераховані або в алергенних одиницях (АО), або в біологічних алергенних одиницях (БАО). АО використовується для пилових кліщів. Середнє значення ID50EAL 14 3-кратних розведень визначається як 100 000 БАО/мл, а 12 3-кратних розведень — визначається як 10 000 БАО/мл.
Стандарти алергенів FDA порівнюються з екстрактами алергенів, що виготовляються виробниками. Процес розрізняється для екстрактів, у яких реактивність основного алергену співвідноситься із загальною реактивністю алергену (котяча шерсть і амброзія), і екстрактів, які не мають основного алергену, який би мав подібну сильну кореляцію. Основний алерген визначається як специфічний білковий епітоп (антигенна детермінанта), на який реагує понад 50 % осіб, які мають алергічну реакцію на цей вид. Якщо є основ-ний алерген, що сильно корелює з клінічною реактивністю даної популяції, виробник може порівняти цей екстракт зі стандартним екстрактом за допомогою електрофорезу в гелі, що має моноклональні антитіла IgG до основного білка алергену. Якщо немає жодного алергену, який добре корелює з реактивністю популяції, отриманий екстракт і стандарт порівнюються за допомогою конкурентного твердофазного ІФА з використанням змішаного сироваткового IgE від відомих пацієнтів-алергіків. Екстракт виробника повинен перебувати в межах діапазону референсних значень (70–140 %) FDA. Кількість основного алергену іноді перераховується в мкг/мл, одиницях Fel d 1 (котяча шерсть) або одиницях антигену Е (амброзія). Стандартизовані інгаляторні алергени в США включають котячу шерсть, Dermatophagoides pteronyssinus, Dermatophagoides farinae, амброзію і кілька видів трави.
Для деяких екстрактів алергенів у Європі використовують скандинавський метод, коли 10 000 біологічно стандартизованих одиниць/мл порівнюють зі шкірною реакцією, що викликається 10 мг/мл гістаміну.
Підбиваючи підсумки, слід зазначити, що не було встановлено міжнародного консенсусу щодо алергенних одиниць або стандартизації екстрактів алергенів. Хоча стандартизація та аналіз прозорості активності збільшують виробничі витрати, загальноприйнято, що більш висока стандартизація та узгодженість між виробниками дасть більше користі. Варіювання екстрактів алергенів між виробниками може перешкоджати медичним установам змінювати постачальників, зменшуючи вплив конкуренції на ціну. Безліч одиниць екстрактів алергенів і різноманітність також ускладнюють інтерпретацію і застосування опублікованих досліджень між США, ЄС та іншими країнами. ВООЗ визнала стандартизацію алергенів проблемою, і ЄС профінансував проєкт, відомий як CREATE, «Розробка сертифікованих стандартних зразків для алергенних продуктів і перевірка методів кількісного визначення».
IX.D.2. Модифіковані екстракти алергенів
Мета ІТА — пригнітити основний запальний діатез і викликати стан клінічної толерантності до відповідного алергену. Тим самим послаблюється, якщо не повністю блокується, процес запалення, який є головною клінічною ознакою АР. Традиційна ІТА з різними немодифікованими екстрактами є успішною, але має низку обмежень. Імунотерапія може призвести до побічних реакцій, які рідко можуть бути небезпечними для життя. Крім ризиків, екстракти алергенів пов’язані зі значними виробничими витратами з обмеженням доступності й консистенції між партіями. Існують різні варіанти природних екстрактів фармацевтичної продукції за кількістю, активністю та імуногенністю окремих молекул алергенів, які неможливо контролювати в процесі виробництва.
Нові досягнення ІТА були зосереджені на перегляді алергічного діатезу з точки зору регуляції Т- і В-клітин, у плані відновлення балансу між підтипами клітин Тх2 і Тх1 і встановлення імунної толерантності до Т-клітин. Використанням рекомбінантних похідних алергенів, синтетичних пептидів, алергоїдів і ад’ювантів намагалися забезпечити безпечніші, більш послідовні, легко доступні й ефективні алергени порівняно з наявними в продажу натуральними екстрактами (табл. IX.D.2-1).
Лабораторне виробництво алергенів дозволяє модифікувати екстракти й структури епітопів, що має на меті підвищення імуногенності зі зменшенням при цьому ризику виникнення побічних реакцій. Клінічні дослідження повідомляють про результати ІТА із застосуванням рекомбінантних молекул, штучно синтезованих пептидів і модифікацій алергенів за допомогою алергоїдів з молекулами ад’ювантів або шляхом денатурації білків.
Рекомбінантні алергени. Рекомбінантні алергени отримують шляхом клонування нативних білків-алергенів із застосуванням технології рекомбінантної ДНК. Алергенний білок підлягає зворотному транскрибуванню з метою отримання додаткової молекули ДНК, що потім може бути перенесена в бактерії, які виробляють копії інкорпорованої ДНК. Ця методика дозволяє конт-ролювати виробництво високоефективного продукту зі стійкою структурою. Проведено дослідження імунотерапії з використанням рекомбінантних алергенів пилку берези й пилку трави тимофіївки. ІТА рекомбінантним алергеном пилку берези продемонструвала еквівалентні клінічні результати, подібні до використання екстракту нативної берези, і значно полегшувала симптоми порівняно з плацебо. ІТА рекомбінантним алергеном пилку тимофіївки показала кращі результати порівняно з плацебо і добрий профіль безпеки. Нещодавно після появи трав’яної вакцини з інтегрованим рекомбінантним білком-переносником було повідомлено про позитивні результати використання вакцини на основі В-клітинного епітопу для імунотерапії алергії на пилок трави.
Сукупний рівень обґрунтованості для пилку берези: B (рівень 1b: 3 дослідження; рівень 2b: 1 дослідження).
Сукупний рівень обґрунтованості для пилку трави тимофіївки: B (рівень 1b: 3 дослідження).
Ці дослідження рекомбінантних алергенів для пилку берези й трави тимофіївки демонструють безпеку та ефективність.
Пептидні конструкції. Синтетичні пептиди для імунотерапії являють собою лінійні фрагменти амінокислот, що відповідають Т-клітинним епітопам. Ці фрагменти не мають вторинної і третинної структури, що активує рецептори IgE, але можуть індукувати імунологічну толерантність, орієнтуючись на специфічні до алергену Т-клітини. Передумовою синтетичних пептидів є те, що відсутність активації IgE нівелює ризик опосередкованої IgE побічної реакції, зберігаючи імуногенність, що призводить до десенсибілізації. Є дані про випробування ІТА на синтетичних пептидах алергенів котячої шерсті та пилку берези й амброзії. Загалом дослідження показали різнорідні результати синтетичних пептидів з деякими молекулами пептидів, що призводять до збільшення побічних реакцій уповільненого типу. Нещодавно завершене масштабне багатоцентрове польове дослідження (clinicaltrials.gov NCT01620762) з пептидом котячої шерсті не увінчалося успіхом; однак на момент написання даного матеріалу триває дослідження пептидів КДП. Новітні пептидні конструкції, що досліджуються нині, включають пептиди, які перекриваються й відтворюють усю послідовність природного алергену в спробі покрити всі Т-клітинні епітопи й природні пептидні фрагменти, що покривають широку панель епітопів.
Сукупний рівень обґрунтованості для котячої шерсті: B (рівень 1b: 5 досліджень).
Сукупний рівень обґрунтованості для пилку берези: невизначений, заснований лише на 1 дослідженні рівня 1b.
Сукупний рівень обґрунтованості для пилку амброзії: B (рівень 1b: 1 дослідження; рівень 2b: 1 дослідження).
Алергоїди й полімеризовані алергени. Алергоїди — це хімічно модифіковані алергени, що були розроблені для покращання протоколів імунотерапії за рахунок прискореного дозування й зменшення побічних ефектів. Початкові спроби розробки алергоїду шляхом часткового денатурації алергенної частини формаліном призвели до зниження алергенності, проте спостерігалося одночасне зниження імуногенності алергоїдів, визначене продукуванням антитіл IgG. Дослідження із застосуванням зв’язаної з глутаральдегідом полімеризації трав’яних алергенів та алергенів амброзії продемонстрували ефективність і переносимість. Однак критерії стандартизації та фактори продукції негативно вплинули на схвалення щодо їх використання з боку регуляторного органу США. Повідомлялося про клінічні дослідження алергоїдів, що використовують алергени пилку амброзії і трави та КДП. Щодо цих алергоїдів є проспективні ранні результати. Крім того, в останніх роботах було зосереджено увагу на депігментованих алергоїдних конструкціях, що зараз використовуються в Європі.
Сукупний рівень обґрунтованості для амброзії: B (рівень 1b: 1 дослідження; рівень 2b: 1 дослідження).
Сукупний рівень обґрунтованості для пилку трави: B (рівень 1b: 7 досліджень).
Сукупний рівень обґрунтованості для КДП: невизначений, заснований лише на 1 дослідженні рівня 2b.
Алергоїдні або полімеризовані алергенні продукти були дозволені в Європі, але жоден не отримав схвалення FDA США.
Ад’ювантні конструкції. З метою покращання протоколів десенсибілізації було виконано додавання молекул (ад’ювантів) до нативного алергену. Першим ад’ювантом, який був прийнятий у ІТА, були квасці. Ранні дослідження з екстрактами, осадженими квасцями, продемонстрували посилену імунологічну відповідь. Однак квасці викликали початкову імунну відповідь на IgE, що становило перешкоду для терапевтичного застосування. Повідомлялося про клінічні дослідження ад’ювантів, що використовують алергени пилку амброзії і трави та КДП.
Creticos повідомив про попереднє дослідження клінічної ефективності використання бактеріальної ДНК (олігонуклеотиду CpG, синтетично отриманого з Mycobacterium bovis) для регулювання імуностимулюючої реакції на алерген через відповідний ліганд (ліганд TLR) на конкретний клас регуляторних дендритних клітин. У дворічному подвійному сліпому плацебо-контрольованому дослідженні агоніст TLR-9 вводили пацієнтам, які страждали від алергії на амброзію, попередньо імунізованим за допомогою режиму 6 ін’єкцій, які вводили до початку сезону цвітіння амброзії. Протягом обох сезонів цвітіння амброзії спостерігалася аналогічна величина ефекту порівняно з плацебо, що вказувало на те, що вакцина дає значну довгострокову ефективність (клінічну й імунну толерантність) протягом 2 сезонів цвітіння амброзії. Подальші масштабні багатоцентрові дослідження не змогли задовольнити вимоги регуляторного органу США, і цей конкретний продукт не отримав свого подальшого розвитку. Однак галузь ад’ювантних підходів до імунізації просувається вперед.
Ад’ювант TLR-4 нині також перебуває в клінічній розробці. Ця конструкція складається з монофосфорилу ліпіду А, отриманого з детоксифікованого ліпополісахариду грамнегативної бактерії (Salmonella minnesota, яка індукує ад’ювант TLR-4), і виробляється з пилковими алергоїдами, що поглинаються мікрокристалічним тирозином. Ця сполука знижує опосередковану IgE алергенність, але зберігає імуногенність. Велике дослідження трав’яних рослин показало значне покращання показників симптомів і медикаментів порівняно з плацебо. Аналіз підгруп показав більшу користь у пацієнтів із більш вираженими симптомами. Скорочене випробування амброзії показало клінічний ефект у первинній кінцевій точці порівняно з плацебо.
Ці дослідження модифікованих ад’ювантами екстрактів демонструють потенціал для удосконалення протоколів імунотерапії; проте ще залишається кілька проблемних моментів. Для того щоб продемонструвати короткочасне й довгострокове покращання як ефективності, так і безпеки щодо звичайних екстрактів алергенів, кожен з модифікованих екстрактів вимагає надійних даних про клінічні результати.
Сукупний рівень обґрунтованості для амброзії: B (рівень 1b: 3 дослідження).
Сукупний рівень обґрунтованості для пилку трави: B (рівень 1b: 2 дослідження).
Сукупний рівень обґрунтованості для КДП: невизначений, заснований лише на 1 дослідженні рівня 2b.
Підсумовуючи вищесказане, слід зазначити, що нині широкий спектр імунотерапевтичних препаратів перебуває в клінічній розробці з метою підвищення безпеки й досягнення імунної толерантності за умов тривалої терапевтичної ефективності. Це нове покоління вакцин включає рекомбінантні алергени, пептидні конструкції, алергоїди/полімеризовані алергени й ад’ювантні конструкції, кожна з яких повинна пройти сувору клінічну оцінку, щоб продемонструвати прийнятні безпечні й значущі клінічні результати, які відповідають нормативним рекомендаціям для схвалення. Деякі досліджувані препарати виявляють покращання порівняно з плацебо, і результати аналогічні нативним алергенам. Дослідження агоніста TLR-9 показало ефективність упродовж 2 років після припинення прийому препарату. Однак деякі молекули пептидів демонстрували посилення алергічних реакцій уповільненого типу, а також змішані клінічні результати залежно від препарату. Алергоїди, ад’юванти й пептиди також показали свою ефективність у багаторічних клінічних дослідженнях. Відсутні достатні докази для надання рекомендацій, оскільки вони засновані на малій кількості досліджень для кожного препарату й відсутності довгострокових результатів — жодне дослідження не вивчало їх результатів протягом більше ніж 2-річного періоду.
IX.D.3. Підшкірна імунотерапія (ПШІТ)
ІТА являє собою лікування опосередкованої IgE чутливості до алергенів оточуючого середовища. ПШІТ передбачає введення наростаючих доз екстракту відповідного алергену з подальшим повторним введенням максимальної або підтримуючої дози протягом 3–5 років з метою зменшення симптомів впливу цього алергену. ПШІТ застосовується на практиці вже понад століття, використовуються водні екстракти природних алергенів. Доведено, що ПШІТ є ефективною при АР, алергічній астмі й чутливості до отрути перетинчастокрилих комах, а також є корисною для відібраних пацієнтів з АД. Наряду з тим, що метааналізи роблять висновок про ефективність ІТА, це позитивне судження про ефективність (і безпеку) повинно обмежуватися лише продуктами, які були випробувані в клінічних дослідженнях. Неправильно робити загальне припущення про те, що «ІТА є ефективною», оскільки це може призвести до клінічного використання продуктів, які не були вивчені належним чином. Однак, як це нині практикується, ПШІТ має недоліки у вигляді не тільки тривалого періоду лікування й необхідності багаторазового відвідування медичних закладів, але й постійно існуючого ризику розвитку системних реакцій. Зараз є спроби подолати ці обмеження, модифікуючи нативні алергени або використовуючи рекомбінантну технологію для отримання екстрактів, яким властиво менше реагувати на sIgE, що дозволяє використовувати більш високі дозування з більшою безпекою і коротшими терапевтичними курсами.
Відбір пацієнтів. Для пацієнтів з АР існує три терапевтичні варіанти: уникнення, фармакотерапія та імунотерапія. Докази, що підтримують уникнення, переглядаються в розділі IX.A цього документа. Фармакотерапія обговорюється в розділі IX.B. Для розгляду ІТА існує дві основні причини. Одна полягає в тому, що додавання ІТА до фармакотерапії, ймовірно, буде призводити до більш вираженого зниження симптомів (навіть після короткого курсу ІТА). Друга стосується неспроможності фармакотерапії змінити основний імунологічний процес. Пацієнти можуть вибирати ІТА значною мірою для отримання тривалої користі, запобігання прогресуванню АР до розвитку бронхіальної астми або запобігання новим сенсибілізаціям.
Протипоказання до ІТА. У погоджувальному документі EAACI за 2015 рік було зазначено протипоказання щодо запровадження ПШІТ для АР. Абсолютними протипоказаннями були погано контрольована або неконтрольована астма, активні автоімунні порушення й злоякісні новоутворення. Відносними протипоказаннями були частково контрольована астма, автоімунні захворювання в стадії ремісії, серцево-судинні захворювання й застосування бета-адренергічних засобів. З іншого боку, «Практичні рекомендації з імунотерапії при алергії» (3-тя редакція) не виявили суттєвих доказів того, що імунотерапія є шкідливою для пацієнтів з автоімунними захворюваннями. Практичні рекомендації також відносять вагітність до протипоказань щодо початку ПШІТ. Однак її можна продовжувати, якщо пацієнт перебуває на підтримуючих дозах.
Екстракти. У США більшість екстрактів пилку, лупи, комах і грибів доступні або в буферному сольовому розчині з фенолом, або в 50% розчині гліцерину. Виняток становлять ті екстракти, стандартизовані FDA США, які містять лише 50% розчин гліцерину. Є одна лінія екстрактів, осаджених квасцями, що складаються виключно з пилкових екстрактів. З іншого боку, у Європі зазвичай використовуються екстракти, осаджені квасцями, і все частіше використовуються алергоїдні екстракти, що складаються з природних алергенів, частково денатурованих сумішшю з альдегідом. (Для отримання додаткової інформації з цієї теми див. розділ IX.D.1 «Одиниці, активність та стандартизація екстрактів алергенів» і розділ IX.D.2 «Модифіковані екстракти алергенів».)
Дозування. Було неодноразово підтверджено, що корисні результати ПШІТ залежать від введення достатньої підтримуючої дози кожного екстракту під час кожної підтримуючої ін’єкції. Зниження ефективної підтримуючої дози на 90–95 % спричиняє часткову або повну втрату ефективності. Результати багатьох подвійних сліпих плацебо-контрольованих досліджень були використані для формулювання рекомендацій щодо дозування, адаптованих на підставі «Практичних рекомендацій з імунотерапії при алергії» (3-тя редакція).
Моносенсибілізація порівняно з полісенсибілізацією. У більшості великих досліджень АР 80–85 % учасників сенсибілізовані до більше ніж одного неспорідненого алергену. Аналіз деяких із цих досліджень показав, що субсенсибілізовані пацієнти реагують на (сублінгвальну) ІТА так само, як особи, які мають чутливість лише до введеного алергену. Не має імунологічного обґрунтування, чому це має відрізнятися від підшкірної ІТА, але це специфічне питання є важливою незадоволеною потребою, яку слід вирішити в майбутніх випробуваннях.
ІТ одним алергеном порівняно з ІТ декількома алергенами. Поширеною практикою серед американських алергологів є включення у лікування декількох екстрактів алергенів, до яких чутливий даний пацієнт. Нещодавно проведене опитування 670 пацієнтів у 6 клініках виявило в середньому 18 екстрактів алергенів при їх лікуванні. З іншого боку, європейські рекомендації пропонують проводити терапію одним, найбільш подразнюючим алергеном, який визначений клінічно, або, якщо потрібно призначати більше від одного екстракту, їх слід вводити на окремі ділянки з інтервалом принаймні 30 хвилин між введеннями. Наукове підґрунтя підходу американських алергологів до використання кількох алергенових сумішей для ПШІТ можна знайти в 4 подвійних сліпих плацебо-контрольованих дослідженнях, серед яких 2 охоплювало пацієнтів з АР, 1 — дітей з бронхіальною астмою й 1 — пацієнтів як із ринітом, так і з астмою; усі вони демонстрували значне покращання стану пацієнтів, які отримували суміші декількох неспоріднених екстрактів алергенів. Однак у недавньому огляді було зроблено висновок, що імунотерапія декількома екстрактами алергенів у пацієнтів із полісенсибілізацією незалежно від сублінгвального чи підшкірного введення потребує додаткових підтверджуючих доказів з добре розроблених, добре функціонуючих подвійних сліпих плацебо-контрольованих клінічних досліджень для підтвердження її ефективності на практиці.
Змішування. Якщо для ПШІТ потрібно використовувати суміші з декількома алергенами, слід врахувати кілька міркувань на додачу до того, щоб кожен екстракт у суміші був у концентрації, яка забезпечить ефективну дозу при введенні підтримуючої ін’єкції. Це такі міркування: 1) уникати змішування екстрактів із сильною протеолітичною активністю з екстрактами, алергени яких сприйнятливі до цієї активності; 2) звертати увагу на алергенну перехресну реактивність; 3) використовувати консерванти, що відповідають цим алергенам.
Усі екстракти грибів і деякі екстракти комах (крім американських екстрактів КДП) мають сильну протеолітичну активність, до якої сприйнятливі багато алергенів пилку, кліща й лупи тварин. Екстракти грибів і тарганів не слід змішувати, але екстракти грибів можна комбінувати.
Пилок рослин містить деякі алергени, схожі на алергени неспоріднених рослин (паналергени), але здебільшого основні алергени є унікальними. Коли на панелі тестування є відповідні алергени, з метою відмежування перехресної реактивності, обумовленої паналергенами, від такої, що обумовлена декількома спорідненими основними алергенами, може бути дуже корисним використання молекулярної діагностики або компонентного алерготестування (КАТ). У разі, якщо пацієнт чутливий до основних алергенів ботанічно споріднених рослин, існує два підходи, які можна застосовувати. Один із підходів полягає в тому, щоб включати лише найважливіший місцевий член спорідненої групи (наприклад, амброзії або північних пасовищних трав); інший підхід полягає у використанні сумішей екстрактів споріднених алергенів, але проводити терапію слід таким чином, ніби вони є одним алергеном.
Розчинники. Розчинники, що містять 50% гліцерин, відмінно підтримують екстрактивну активність і використовуються в США зазвичай для екстрактів з високою активністю протеази. Недолік використання екстрактів з високим вмістом гліцерину полягає в тому, що вони викликають біль при введенні. Екстракт на фенол-фізіологічному розчині, що містить 0,3 % людського сироваткового альбуміну, добре переноситься і за відсутності високої протеолітичної активності є відмінним розчинником, який можна регулярно використовувати для введення розведень для початку ПШІТ у США.
Режими. З метою безпеки ПШІТ починають при розведенні кінцевої дози й накопичують зазвичай щотижневими ін’єкціями в зростаючих кількостях і концентраціях протягом тижнів або навіть місяців. Після досягнення підтримуючих доз інтервал між ін’єкціями можна збільшувати, але зазвичай не більше від 4 тижнів для водних екстрактів, що використовуються в США, і не більше від 4–6 тижнів для депо-екстрактів, які використовуються в Європі.
Місце проведення ПШІТ. ПШІТ в алергічній практиці в США пов’язана зі швидкістю виражених системних реакцій 0,1 %. З цієї причини в «Практичних рекомендаціях з імунотерапії при алергії» (3-тя редакція) зазначено, що ін’єкції слід робити лише в медичному закладі, який забезпечує швидку діагностику й лікування анафілаксії, і після ін’єкції пацієнти повинні залишатися під спостереженням протягом не менше ніж 30 хвилин. Це відповідає європейській перспективі. У США є компанія, що пропагує практику проведення ПШІТ у домашніх умовах. Її протокол вимагає введення відносно низьких доз ПШІТ декілька разів на тиждень, що призводить до накопичувальної дози, яка наближається до рекомендованих у практичних рекомендаціях. Однак є дані, які дозволяють припустити, що ефективність цього підходу з низькими дозами визначає саме величину індивідуальної дози, а не введену кумулятивну кількість, і для підтвердження ефективності цього підходу не було запропоновано жодних сліпих досліджень.
Прискорене проведення ПШІТ. Щоб скоротити тривалість нарощення доз, іноді застосовують кластерне дозування. Під час кожного візиту в непослідовні дні роблять дві або три ін’єкції з 30-хвилинним інтервалом між ними. Якщо відвідування проводяться двічі на тиждень, підтримуючої дози можна досягти через 4 тижні або навіть після більш короткого періоду, залежно від введеного препарату й графіка, якого дотримувались. Ретроспективний аналіз частоти системних реакцій у масштабній мультидисциплінарній клініці та подвійне сліпе рандомізоване дослідження не показали збільшення швидкості системних реакцій у пацієнтів при порівнянні кластерного режиму зі звичайними схемами лікування. Інше (відкрите) дослідження також підтримує ці висновки.
Інтенсивні режими ІТ включають введення великої кількості ін’єкцій на день протягом декількох днів поспіль, як правило, з досягненням підтримуючої дози протягом одного-трьох днів. Навіть при застосуванні премедикації спостерігається підвищена швидкість системних реакцій порівняно зі звичайними режимами дозування.
Механізм дії. Узагалі імунологічна відповідь на ПШІТ включає два послідовні етапи. Перший — це формування генерації регуляторних Т-клітин, які секретують ІЛ-10 і ТФР-β, що призводить до переходу від IgE до формування антитіл IgG4 [1653, 1654]. При продовженні ІТА реакція Т-рег знижується і домінує імунне відхилення від відповідей Тх2 до Тх1.
Модифікація хвороби. Перевага ПШІТ над фармакотерапією полягає в тому, що вона змінює основну імунологічну відповідь на таку, що спостерігається в людей, які не мають алергії. Результати цієї зміни в основній імунній відповіді при ПШІТ можна клінічно побачити в зменшенні кількості нових реакцій сенсибілізації, запобіганні прогресуванню розвитку АР до бронхіальної астми й стійкому ефекті після адекватного курсу терапії.
У дітей, підлітків і молодих людей, які чутливі лише до введеного алергену, розвиток нових реакцій сенсибілізації зменшується не лише під час ІТА, але й протягом кількох років після завершення курсу ІТА. Подібний захисний ефект не був продемонстрований у пацієнтів, які мали полісенсибілізацію на початку ІТА.
Також було доведено, що ПШІТ запобігає прогресуванню розвитку АР до бронхіальної астми. У дослідженні 205 дітей, які були чутливі до алергенів трави, берези або обох цих алергенів і які не мали ознак бронхіальної астми протягом спостережного року, одна група дітей протягом 3 років отримувала лікування у вигляді ПШІТ алергенами тимофіївки та/або берези, а інша — стандартну фармакотерапію; результати терапії спостерігали протягом додаткових 7 років після завершення ПШІТ у відкритому дослідженні. Наприкінці ПШІТ ризик розвитку астми був вірогідно нижчим і зберігався на низькому рівні протягом 7 років спостереження. Для спостереження за хворими на АР при відсутності бронхіальної астми, які отримували або не отримували ІТА у 2006 році, використовувалася база даних Німецького національного медичного страхування. Під час п’ятирічного спостереження в тих пацієнтів, які отримували ІТА (90 % у вигляді ПШІТ), шанси на розвиток бронхіальної астми були вірогідно нижчими.
Тривалість лікування й стійкість ефекту від лікування. Щодо стійкості ефекту було проведено подвійне сліпе рандомізоване дослідження на пацієнтах з АР, які протягом 3 або 4 років отримували ПШІТ екстрактом трави тимофіївки. Пацієнти були рандомізовані у 2 терапевтичні групи, одна з яких продовжувала прийом ПШІТ, а друга отримувала плацебо; терапія тривала 3 роки. Між групами пацієнтів, які отримували й не отримували ін’єкції екстракту тимофіївки, протягом 3 сезонів цвітіння трави не було виявлено відмінностей у симптомах і бальній оцінці проведеної терапії. В іншому дослідженні вивчалося припинення ПШІТ у 108 чутливих до алергенів трави пацієнтів, які добре відреагували на лікування, після 3 або 4 років ПШІТ. За пацієнтами спостерігали до 4 сезонів цвітіння трави на предмет розвитку в них рецидиву. Приблизно в 30 % пацієнтів рецидиви виникали на третій сезон цвітіння трави, а згодом рецидиви виникали також ще в деяких пацієнтів.
ПШІТ екстрактом алергенів трави тривалістю 3–4 роки викликала ремісії, що зберігалися в більшості пацієнтів принаймні 3 роки. Існує лише кілька досліджень, що розглядають більш тривалий або коротший термін лікування. Дослідження, яке порівнювало 3- і 5-річну ПШІТ екстрактом КДП, виявило значне покращання через 3 роки, але додало клінічне покращання риніту через 5 років ПШІТ.
Безпека. Комітетом з імунотерапії Американської академії алергічних захворювань, бронхіальної астми та імунології (ААААІ) була отримана ретроспективна інформація про виникнення летальних реакцій на ПШІТ шляхом періодичних опитувань його членів у період з 1985 по 2001 рік і проведення он-лайн опитування на веб-сайті з 2008 року. Попередні ретроспективні дослідження показали, що летальна реакція спостерігається на кожні 2–2,5 мільйона випадків введення ін’єкцій. Он-лайн опитування виявило інформацію про 2 летальні реакції на 28,9 мільйона випадків введення ін’єкцій; вважалося, що цей показник покращився за рахунок більш ретельного моніторингу пацієнтів із бронхіальною астмою. Частота виникнення системних реакцій залишається стійкою: у 1,9 % пацієнтів розвивається системна реакція легкого ступеня, але 0,08 % пацієнтів відчувають реакції 3-го ступеня і 0,02 % пацієнтів відчувають реакції 4-го ступеня. Виникнення й розмір місцевих реакцій не прогнозують виникнення системної реакції з наступною ін’єкцією.
Економічна ефективність. ПШІТ можна проводити протягом 3–5 років із подальшим полегшенням симптоматики протягом наступних років після її відміни. З іншого боку, фармакотерапію потрібно продовжувати нескінченно, оскільки вона не має активності, що модифікує захворювання. Через цю різницю початкова вища вартість ПШІТ може бути компенсована тривалою ефективністю після її припинення. Це закладено в розрахунки аналізу прийняття рішень, який запропонував, що в пацієнтів із САР, які потребують прийняття назальних стероїдів 6 місяців на рік, віком до 41 року вартість терапії буде меншою в довгостроковій перспективі, якщо вони перейдуть на ПШІТ. Якщо в пацієнта є багаторічна потреба в назальних стероїдах і йому менше за 60 років, найбільш економічно ефективним підходом є ПШІТ. Інший аналіз економічної ефективності показав, що ПШІТ при САР може бути більш ефективною і менш дорогою, ніж фармакотерапія, із соціологічної точки зору, коли враховуються витрати на втрату працездатності. У ретроспективному дослідженні американської федеральної системи медичної допомоги незаможним Medicaid, що надавала лікувальну допомогу дорослим і дітям, у яких нещодавно діагностували АР, проводилося порівняння витрат на медичне обслуговування серед тих, кому проводилася і не проводилася ІТА. Було виявлено, що в пацієнтів, які отримували ІТА, економія витрат на медичне обслуговування протягом 18 місяців подальшого періоду спостереження становила 30 і 42 % відповідно.
Сукупний рівень обґрунтованості для ПШІТ при лікуванні АР: A (рівень 1a: перераховано 3 останні дослідження; рівень 1b: перераховано 5 останніх досліджень). Слід відзначити великий обсяг літератури, у якій підтримують ПШІТ як метод лікування АР.
Користь: покращання симптомів і зменшення потреби в препаратах для екстреної терапії. Знижена ймовірність прогресування АР до бронхіальної астми. Стійкій ефект протягом років після закінчення 3–5-річної ПШІТ.
Ризик: незручність багаторазового відвідування медичного закладу для отримання ін’єкцій. Можливий розвиток системних реакцій, включно з анафілаксією.
Вартість: вартість підготовки екстракту алергену для лікування. Вартість відвідування медичних закладів для отримання ін’єкцій.
Оцінка користь/ризик: користь переважає над ризиком у пацієнтів, які не можуть отримати адекватного полегшення при симптоматичному лікуванні і симптоми яких тривають понад кілька тижнів.
Ціннісні судження: пацієнти, які можуть отримати адекватне полегшення симптомів за допомогою медикаментозних препаратів, повинні вирішити, чи компенсуються короткочасне збільшення вартості й незручності у прийомі ПШІТ довготривалою стійкою клінічною ефективністю й позбавленням від необхідності постійної фармакотерапії. Фармакоекономічні дослідження дозволяють припустити, що в довгостроковій перспективі ПШІТ є економічно ефективною порівняно із симптоматичною терапією.
Директивний рівень: ПШІТ наполегливо рекомендується пацієнтам, які не можуть отримати адекватного полегшення за допомогою симптоматичної терапії.
Упровадження в практику: ПШІТ слід рекомендувати пацієнтам з АР, які не можуть отримати адекватного полегшення від симптоматичних препаратів протягом тривалих періодів щорічно, а також тим, хто отримає користь від її вторинних ефектів, які модифікують перебіг захворювання (профілактика бронхіальної астми й нової сенсибілізації), зокрема дітям і підліткам.
IX.D.4. Сублінгвальна імунотерапія (СЛІТ)
СЛІТ являє собою альтернативний варіант застосування ПШІТ, який вперше був упроваджений у практику Noon та співавт. понад століття тому. Перше подвійне сліпе плацебо-контрольоване дослідження з використанням СЛІТ було проведено до 1986 року Scadding та співавт. у Лондоні, Великобританія. Після цього до початку нового тисячоліття було проведено лише кілька невеликих досліджень, коли нарешті кілька «масштабних досліджень» продемонстрували клінічну ефективність і безпеку СЛІТ. Відтоді повідомлялося про велику кількість якісних досліджень СЛІТ. Як результат, фактичні докази щодо СЛІТ виявляються як мінімум такими ж переконливими, як і для ПШІТ. Літературні дані про застосування СЛІТ при АР/ринокон’юнктивіті є широкими, за останнє десятиліття було опубліковано кілька змістовних метааналізів і систематичних оглядів, було прийнято рішення проаналізувати насамперед результати цих оглядів і доповнити їх висновками великих рандомізованих досліджень.
Ефективність у дорослих. Більшість систематичних оглядів і метааналізів показують низьку й помірну ефективність СЛІТ порівняно з плацебо (СВ = 0,30–0,50), і це наближається до високої ефективності при більш тривалому лікуванні (СВ = 0,70 при терапії протягом більше ніж 12 місяців). Потрібно враховувати, що всі пацієнти, як ті, які отримають СЛІТ, так і ті, які отримають плацебо, мають відкритий доступ до препаратів екстреної терапії і що СЛІТ є ефективною поряд з усуненням симптомів за допомогою препаратів екстреної терапії.
Ефективність у дітей. Голландські експерти проаналізували систематичні огляди СЛІТ у дітей і дійшли висновку, що слід покращити їх методологічну вірогідність. Зокрема, вони ставили під сумнів неоднорідність включених досліджень і ризик системної похибки. Roder та співавт. також визначили, що немає достатньої кількості доказів для підтвердження корисності СЛІТ у дітей. Ці недоліки були усунені в останніх дослідженнях. Є вагомі докази того, що таблетки для СЛІТ з алергенами трав’яного пилку усувають симптоми АР у дітей. Докази щодо СЛІТ водними розчинами алергенів є помірними. Докази щодо СЛІТ алергенами КДП мають середню й низьку якість.
Ефективність СЛІТ порівняно з фармакотерапією. При ЦАР СЛІТ таблетованими алергенами КДП є більш ефективною, ніж будь-яка монофармакотерапія, включно з антигістамінними препаратами, антилейкотрієнами й інтраназальними кортикостероїдами (ІНКС). При САР СЛІТ таблетованими алергенами пилку трав та амброзії є майже такою ж ефективною, як і ІНКС, і більш ефективною, ніж інші види фармакотерапії. Ці дані вже були підтверджені для СЛІТ таблетованими алергенами пилку трави за допомогою попереднього метааналізу; у цій публікації окремий аналіз СЛІТ таблетованими алергенами пилку 5 видів трав показав її перевагу над усіма методами фармакотерапії.
Ефективність СЛІТ порівняно з ПШІТ. Кілька дослідників намагалися порівняти ефективність СЛІТ з ефективністю ПШІТ. Більшість метааналізів ґрунтується на непрямих порівняннях, оскільки існує лише дуже мало прямих порівняльних рандомізованих досліджень, у яких безпосередньо порівнюються між собою ці два методи терапії. Отже, докази того, що ПШІТ є більш ефективною, ніж СЛІТ, є слабкими. У дітей ПШІТ також, імовірніше за все, є більш ефективною, ніж СЛІТ, але, знову ж таки, якість доказів є низькою.
Безпека. Повідомлялося про рідкісні системні й серйозні побічні ефекти при СЛІТ, але в цілому метааналізи виявили, що СЛІТ є більш безпечною, ніж ПШІТ. У повному наборі даних систематичних оглядів було 7 згадок про використання адреналіну в групі пацієнтів, які приймали СЛІТ, і один випадок еозинофільного езофагіту в групі пацієнтів, які приймали СЛІТ таблетованими алергенами пилку трави. У дослідженнях, які проводилися за межами США, не було даних про введення адреналіну. Огляд, проведений Calderon та співавт. у 2012 році, оцінив, що частота розвитку анафілаксії при СЛІТ становить 1 на 100 мільйонів доз, або 1 на 526 000 років лікування. СЛІТ таблетованими алергенами пилку трави також є безпечною для пацієнтів з АР як з наявністю, так і з відсутністю легких астматичних симптомів. Виявилося, що своєчасний початок СЛІТ у сезон є безпечним. Незважаючи на те, що були 2 серйозні побічні ефекти, пов’язані з початком СЛІТ, жоден випадок не потребував введення адреналіну. У США FDA вимагає, щоб пацієнтам, які приймають таблетовані препарати, обов’язково призначали автоінжектор для введення адреналіну, а перша доза СЛІТ надавалася в кабінеті лікаря. Продовження ІТА під час вагітності не збільшувало випадків несприятливих наслідків під час пологів і не змінювало ризик розвитку атопічного захворювання в нащадків. Щодо безпеки початку СЛІТ у вагітних жінок не можна зробити жодного висновку через відсутність подібних випадків терапії.
Профілактичні ефекти. Відсутні систематичні огляди, які б конкретно стосувались профілактичних ефектів СЛІТ, що потрапляють у допустимий діапазон даних Міжнародного консенсусу з питань алергології і ринології (МКАР) у частині АР. Профілактичний ефект СЛІТ щодо розвитку бронхіальної астми було вивчено у відкритому РКД Marogna та співавт., у якому брали участь 216 дітей, які отримували СЛІТ протягом 3 років. Персистуюча бронхіальна астма легкого ступеня виявлялася рідше в пацієнтів, які отримували СЛІТ, ніж у пацієнтів, які отримували монофармакотерапію. У подвійному сліпому РКД, у якому брали участь 812 дітей із ринокон’юнктивітом, спричиненим пилком трави, після 3 років терапії таблетованими алергенами пилку трави згідно зі стандартом якості (СЯ) у 2-річному періоді подальшого спостереження в дітей у терапевтичній групі спостерігався менший ризик розвитку астми порівняно з групою, яка отримувала плацебо (відношення шансів [ВШ]: 0,71; р < 0,05). Незважаючи на те, що ці дані є цікавими, загальна кількість доказів щодо профілактики астми в дослідженнях СЛІТ нині є низькою, хоча щодо зменшення симптомів астми й скорочення фармакотерапії — високою.
У природній динаміці респіраторної алергії часто відбувається розвиток нових реакцій сенсибілізації на алергени. Часто обговорюється превентивний вплив ІТА на початок нових реакцій сенсибілізації. Однак наявні нині дані про СЛІТ для профілактики нової чутливості до алергенів також є обмеженими. Вищезгадане дослідження Marogna та співавт. вказувало, що частота нових реакцій сенсибілізації була низькою: 3,1 % пацієнтів, які отримували СЛІТ, і 34,8 % пацієнтів із конт-
рольних груп; ВШ для розвитку нових реакцій сенсибілізації в контрольних групах становило 16,85. В іншому проспективному дослідженні Marogna та співавт. оцінювався довгостроковий ефект СЛІТ, отриманий протягом 3, 4 або 5 років у 78 пацієнтів, які отримували СЛІТ, порівняно з 12 пацієнтами з контрольних груп. Протягом 15-річного періоду подальшого спостереження в усіх пацієнтів контрольної групи розвивалася нова реакція чутливості до алергенів, у той час як у групі, яка отримувала СЛІТ, вона мала місце лише у 25 % пацієнтів (у 21 % — після лікування протягом 3 років, у 12 % — після лікування протягом 4 років, в 11 % — після лікування протягом 5 років).
Додаткові дані з подвійних сліпих плацебо-конт-рольованих досліджень. Нижче наведено декілька найважливіших останніх досліджень із даними, що додають інформацію до вже поданих систематичних оглядів.
— СЛІТ високими дозами водних розчинів алергенів пилку дерев була ефективною щодо зниження бальної оцінки симптомів у дітей у високоякісному подвійному сліпому плацебо-контрольованому дослідженні.
— У подвійних сліпих плацебо-контрольованих дослідженнях СЛІТ алергенами пилку амброзії знижувала комбіновану бальну оцінку симптомів при її призначенні у вигляді крапель і у вигляді таблеток, особливо у високих дозах.
— У невеликому подвійному сліпому плацебо-контрольованому дослідженні середньої і високої якості СЛІТ АР (і астми) алергенами пилку альтернарії показала свою ефективність у значному зниженні комбінованої бальної оцінки симптомів АР.
— Що стосується СЛІТ таблетованими алергенами КДП, то ефект дози для зниження бальної оцінки симптомів АР показаний у трьох подвійних сліпих плацебо-контрольованих дослідженнях. Одне дослідження показало статистично значущу різницю й зниження бальної оцінки симптомів на 29 % лише в пацієнтів із захворюваннями середнього й тяжкого ступеня.
— Помірні докази ефективності СЛІТ подвійними алергенами пилку трави + КДП після 12-місячной терапії і протягом 1 року після її завершення.
— СЛІТ мультиалергенами була випробувана в одноцентровому подвійному сліпому плацебо-конт-рольованому дослідженні з трьома терапевтичними групами: одна приймала монотерапію алергенами пилку тимофіївки, друга — алергенами пилку тимофіївки з 9 іншими пилковими алергенами, а третя — плацебо. Лише група, що приймала монотерапію алергенами пилку тимофіївки, продемонструвала статистично значуще покращання симптоматики при проведенні назального провокаційного тесту, підборі доз при проведенні шкірної ін’єкційної проби (ШІП), зниження sIgE і збільшення IgG4. Через дуже короткий сезон цвітіння різниці в бальній оцінці симптомів між групами не було. СЛІТ з мультиалергенами потрібує проведення додаткових досліджень.
Сукупний рівень обґрунтованості й рекомендації
Сукупний рівень обґрунтованості: A (рівень 1a: 10 досліджень; рівень 1b: 3 дослідження; рівень 2a: 11 досліджень; рівень 3a: 1 дослідження).
Користь: СЛІТ покращувала бальну оцінку симптомів у пацієнтів, навіть у якості додаткового метода до екстреної терапії. СЛІТ зменшувала використання фармакотерапії. Ефект СЛІТ триває принаймні 2 роки після трирічного курсу терапії високими дозами. Користь, як правило, більша, ніж при монофармакотерапії; однак її ефективність, можливо, дещо менша, ніж у ПШІТ. Незважаючи на те, що недавнє високоякісне пряме порівняльне дослідження не виявило статистично значущої різниці в ефективності між ПШІТ і СЛІТ, цей доказ не наведений у даному документі, оскільки його дата публікації знаходиться поза періодом огляду цього рукопису.
Ризик: мінімальний. Дуже часті, але локальні побічні ефекти легкого ступеня тяжкості. Дуже рідкісні системні побічні ефекти. СЛІТ, імовірно, є безпечнішою, ніж ПШІТ.
Вартість: проміжна. СЛІТ стає економічно ефективною порівняно з фармакотерапією після кількох років прийому. Дані про вартість СЛІТ порівняно з ПШІТ є мінливими.
Оцінка користь/ризик: перевага порівняно з лікуванням плацебо невелика, але відчутна, а також викликає покращення на додаток до фармакотерапії. Тривалий ефект не менше від 2 років після завершення лікування. Шкода при СЛІТ є мінімальною, ризик при ПШІТ є більшим.
Ціннісні судження: СЛІТ покращувала симптоми в пацієнтів і мала низький ризик розвитку побічних ефектів.
Директивний рівень:
— використання СЛІТ: таблетовані алергени пилку трави й амброзії і КДП, а також водний розчин алергенів пилку дерев — наполеглива рекомендація;
— СЛІТ алергенами пилку альтернарії — рекомендація;
— СЛІТ алергенами епітелію — можливий спосіб терапії;
— СЛІТ подвійними алергенами в пацієнтів з алергією на 2 речовини — рекомендація.
Упровадження в практику: пацієнтам (дорослим та дітям) із САР і/або ЦАР, які бажають полегшити симптоматику й зменшити використання фармакотерапії, ми рекомендуємо призначати СЛІТ таблетованими алергенами у високих дозах або водний розчин алергенів. СЛІТ можна безпечно продовжувати у вагітних пацієнток.
IX.D.5. Черезшкірна або нашкірна імунотерапія
Черезшкірна або нашкірна імунотерапія являє собою неінвазивну форму ІТА, що полягає в застосуванні алергенів на шкірі. Епідерміс багатий на клітини, що презентують антиген (КПА), хоча він менше васкуляризований, що потенційно знижує ризик розвитку системної реакції. Для покращання доставки антигенів через роговий шар до імунних клітин епідермісу й дерми використовували різні методи: скарифікацію (або дряпання) шкіри, зскрібок липкою стрічкою, панелі мікроголок і накопичення поту шляхом нанесення пластиру. Нещодавно була досліджена нашкірна імунотерапія на мишачій моделі з використанням наночастинок, що містять алерген, який кодує ДНК. Протоколи введення алергенів через шкіру датуються ще 1926 роком, коли 29 пацієнтів із сінною лихоманкою отримували внутрішньошкірне введення екстракту пилку; усі отримували користь після лише 3 доз і не мали значних побічних ефектів.
В одноцентровому плацебо-контрольованому подвійному сліпому дослідженні 37 дорослих пацієнтів із позитивною ШІП і назальним провокаційним тестом на пилок трави були рандомізовані у дві терапевтичні групи: одна отримувала пластири з алергеном (n = 21), а друга — пластири з плацебо (n = 16). Лікування розпочиналося за місяць до сезону цвітіння 2006 року. Зі шкіри робили 6 зскрібків липкою стрічкою і щотижня застосовували пластири протягом 12 тижнів, їх знімали через 48 годин. Пацієнтів оцінювали до, на початку та після сезону цвітіння 2006 року, а також до (n = 26) і після (n = 30) сезону цвітіння 2007 року. Первинною кінцевою точкою був назальний провокаційний тест із трав’яним екстрактом; вторинні кінцеві точки включали анкетування щодо риніту, використання ліків і побічні ефекти. У пацієнтів, які отримували імунотерапію трав’яним екстрактом, бальна оцінка назального провокаційного тесту значно знижувалася в 1-й (p < 0,001) і 2-й рік (p = 0,003). У пацієнтів, які отримували плацебо, показники знижувалися після 1-го року (р = 0,03), але ефект зменшувався на 2-й рік (р = 0,53). Однак покращення бальної оцінки назального провокаційного тесту не було суттєвим у терапевтичній групі порівняно з групою, яка отримувала плацебо. У пацієнтів із терапевтичної групи спостерігалося покращання бальної оцінки суб’єктивної симптоматики після сезону цвітіння як 2006 року (p = 0,02), так і 2007 року (p = 0,005). Екзема на місці застосування була значно більшою в терапевтичній групі, але серйозних побічних ефектів не спостерігалося.
В другому одноцентровому подвійному сліпому РКД 15 дітей отримували черезшкірну імунотерапію трав’яними алергенами, а 15 дітей отримували плацебо. Липкий пластир розміщували щотижня з лютого по квітень 2008 року й видаляли через 24 години. Статистично значущих відмінностей у ШІП між групами до і після лікування не було. В обох групах симптоматика посилювалася, але в терапевтичній групі були менш виражені симптоми ринореї, закладеності носа, задишки й сльозотечі. У терапевтичній групі спостерігалося значне зменшення вживання антигістамінних препаратів (р = 0,019). Системних або місцевих реакцій не було.
У третьому одноцентровому подвійному сліпому плацебо-контрольованому дослідженні, опублікованому тими ж авторами, брали участь 132 дорослих пацієнти з алергічним ринокон’юнктивітом на пилок трави. Пацієнти розподілялися на 4 групи для отримання плацебо або трав’яного екстракту в низькій, середній і високій дозах відповідно (n = 33 у кожній групі). Щотижня протягом 6 тижнів, починаючи з одного місяця до початку сезону цвітіння 2008 року, застосовувались пластири з наступним їх видаленням через 8 годин. На початку дослідження й після сезонів цвітіння 2008 і 2009 років проводили ШІП і кон’юнктивальні провокаційні тести (КПТ). В аналіз ефективності було включено 93 з 132 пацієнтів. Первинною кінцевою точкою була бальна оцінка суб’єктивної симптоматики ринокон’юнктивіту з використанням візуальної аналогової шкали (ВАШ). Через 5 місяців після нанесення першого пластиру всі терапевтичні групи та група, яка приймала плацебо, продемонстрували покращення симптоматики. Через рік покращення було лише в терапевтичній групі, яка застосовувала пластир трав’яного екстракту у високій дозі, порівняно з конт-рольною групою (р = 0,017); полегшення симптоматики було більше ніж на 30 % (у сезон цвітіння 2008 року) і на 24 % (у сезон цвітіння 2009 року) порівняно з плацебо. Не було відмінностей у застосуванні препаратів для екстреної терапії, ШІП або КПТ. Місцеві реакції частіше мали місце при використанні більш високих доз і зменшувалися з подальшим застосуванням. Системні реакції, що призводять до припинення лікування, відбувалися в 11 пацієнтів (8,3 %) протягом 45 хвилин після застосування пластиру; реакції були більш м’якими (1–2-го ступеня) і не потребували лікування адреналіном.
Четверте одноцентрове подвійне сліпе плацебо-контрольоване дослідження, опубліковане тими ж авторами, охоплювало 98 дорослих пацієнтів з алергічним ринокон’юнктивітом на пилок трави; 48 пацієнтів отримували алергени пилку трави і 50 пацієнтів отримували плацебо. Лікування полягало в щотижневому накладанні пластирів протягом 8 годин, 6 пластирів на курс. Після лікування у 2009 році медіана симптоматики риніту покращувалася на 48 % у терапевтичній групі порівняно з 10 % у групі, яка приймала плацебо (p = 0,003); через рік цей показник становив 40 і 18 % відповідно (р = 0,43). Через рік комбінована бальна оцінка симптомів та оцінка медикаментозної терапії не змінювалися. Оцінки КПТ покращувалися після першого року в терапевтичній групі, але подібного покращення не спостерігалось у групі, що приймала плацебо. У перший рік у терапевтичній групі підвищувався рівень алерген-специфічного IgG4, тоді як у групі, яка приймала плацебо, рівень алерген-специфічного IgE знижувався; на другий рік різниці в обох оцінках порівняно з базовими не було. Мали місце 8 випадків розвитку системних реакцій, які призвели до виключення пацієнтів з дослідження. Автори дійшли висновку, що ця стратегія лікування може відігравати потенційну роль у лікуванні алергії, опосередкованої IgE, але для подальшого дослідження потрібні оптимальні схеми, які врівноважують ефективність і безпеку.
Сукупний рівень обґрунтованості: B (рівень 1b: 4 дослідження).
Користь: черезшкірна імунотерапія приводила до обмеженого й варіабельного покращання симптоматики, використання медикаментів і провокаційних тестів з алергенами в пацієнтів з АР або кон’юнктивітом.
Ризик: черезшкірна імунотерапія спричиняла розвиток системних і місцевих реакцій. Системні реакції спостерігалися в 14,6 % пацієнтів, які отримували черезшкірну імунотерапію алергенами трав’яного пилку.
Вартість: невідома.
Оцінка співвідношення користь/ризик: дані щодо користі від лікування є обмеженими й суперечливими, тоді як існує певний ступінь побоювання щодо розвитку побічних ефектів. 3 з 4 досліджень на цю тему були опубліковані тими ж дослідниками у 2009–2015 роках.
Ціннісні судження: черезшкірну імунотерапію можна запропонувати як потенційну альтернативу ПШІТ і СЛІТ, але необхідно провести подальші дослідження.
Директивний рівень: не рекомендується.
Упровадження в практику: хоча черезшкірна імунотерапія потенційно може мати майбутнє клінічне застосування при лікуванні АР, на цьому етапі є обмежені дослідження, які демонструють варіабельну й обмежену ефективність і значну кількість побічних реакцій. З огляду на вищесказане й наявність альтернативних методів лікування черезшкірна імунотерапія нині не рекомендується.
IX.D.6. Інтралімфатична імунотерапія
Інтралімфатична імунотерапія (ІЛІТ) являє собою новий метод ІТА: алерген вводиться безпосередньо в лімфатичні вузли. Основними перевагами цього способу застосування алергенів є помітно скорочена тривалість лікування (як витраченого часу, так і кількості відвідувань медичного закладу) і значно менша кількість алергену, необхідного для досягнення результатів. Ця менша доза алергену також приводить до зниження ризику розвитку побічних ефектів, пов’язаних із введенням алергенів.
Клінічні дослідження проілюстрували, що полегшення симптоматики АР можна досягти лише за допомогою трьох доз введеного алергену з інтервалом дозування в один місяць. Це контрастує з підшкірним застосуванням, коли протягом 5 років може знадобитися до 70 доз. ІЛIT передбачає введення алергену безпосередньо в пахові лімфатичні вузли під контролем УЗД.
У 5 клінічних дослідженнях, опублікованих до цього часу, порівнювали ІЛІТ з плацебо. У 2008 році Senti та співавт. порівнювали ІЛIT з ПШІТ, а не з плацебо. У всіх дослідженнях як вакцину застосовували адсорбований гідроксидом алюмінію антиген. У більшості досліджень як антиген використовувались доступні на ринку екстракти пилку трави або пилку берези. В одному дослідженні використовувався рекомбінантний алерген котячої лупи, адгезований до транслокаційної послідовності й до частини інваріантного ланцюга людини, що генерує вакцину модульного антигенного транспортеру, або MAT.
Загальний протокол введення включав три ін’єкції з 1000 стандартизованих одиниць якості (СОЯ) алергену, адсорбованого гідроксидом алюмінію, з інтервалами в 4 тижні. Варіації цього протоколу включали менший інтервал дози в одному дослідженні й відсутність перерахунку кількості алергену на СОЯ у дослідженні із застосуванням рекомбінантного алергену котячої лупи.
Із 6 опублікованих до цього часу досліджень 5 продемонстрували клінічну ефективність і безпеку. Загалом 127 пацієнтів прийняли препарат активної терапії і 45 пацієнтів прийняли плацебо. Witten та співавт. при застосуванні ІЛIT продемонстрували наявність імунологічних змін, але не полегшення симптоматики. Слід зазначити, що інтервал дози в цьому дослідженні був коротшим, ніж у дослідженнях, які продемонстрували клінічну ефективність, при цьому алерген вводили з 2-тижневими інтервалами замість 4-тижневих.
Найбільша різниця між випробуваннями на сього-дні полягає в підборі клінічних кінцевих показників та оцінці клінічних результатів. Усі дослідження використовували суб’єктивні оцінки щодо визначення клінічних кінцевих точок, які найчастіше проводилися у формі симптоматичного опитувальника.
Враховуючи скорочення тривалості лікування, дозу алергенів, фінансове навантаження відносно ПШІТ і низький ризик розвитку побічних ефектів, слід зазначити, що ІЛIT є новим перспективним видом терапії АР. Перш ніж інтегрувати ІЛIT у клінічну практику, потрібно чітко розробити фармакоекономічну оцінку ІЛIT порівняно з ПШІТ і провести більш масштабні РКД, а також подальші дослідження для вивчення впливу терапевтичного протоколу на результати.
Сукупний рівень обґрунтованості: B (рівень 1b: 5 досліджень; рівень 2b: 1 дослідження; рівень 4: 1 дослідження).
Користь: скорочений період лікування, менша кількість ін’єкцій, менша доза введеного алергену, менший ризик виникнення побічних ефектів.
Ризик: ризик виникнення анафілаксії.
Вартість: ІЛІТ може бути пов’язана зі зменшенням витрат відносно ПШІТ (скорочення часу, зменшення фінансового навантаження на пацієнтів та медичних працівників). Застосування вимагає навчання персоналу.
Оцінка співвідношення користь/ризик: баланс користі і шкоди для ІЛІТ відносно ПШІТ.
Ціннісні судження: ІЛІТ виявляється ефективним методом лікування АР. Попередні дані свідчать про те, що відносно ПШІТ навантаження на пацієнта і систему охорони здоров’я є нижчим.
Директивний рівень: альтернативний метод лікування, що потребує додаткових досліджень.
Упровадження в практику: хоча дане дослідження є проспективним, потрібно провести подальші дослідження, перш ніж ІЛIT можна було би запровадити в звичайну клінічну практику.
IX.D.7. Альтернативні форми імунотерапії
Пероральна, назальна й інгаляційна (внутрішньобронхіальна) ІТА є альтернативними варіантами лікування АР — вони насамперед мають історичне значення. Хоча альтернативні форми ІТА оцінювали, намагаючись уникнути локального дискомфорту й використання ресурсів, пов’язаних із ПШІТ, упровадження СЛІТ значною мірою замінило ці методи.
Неін’єкційні альтернативні форми імунотерапії передбачають місцеве всмоктування екстрактів алергену шляхом перорального/шлунково-кишкового, назального або інгаляційного введення. У цьому документі окремо розглядаються СЛІТ, а також внутрішньолімфатична й нашкірна форми ІТА. Подвійні сліпі плацебо-контрольовані дослідження оцінювали пероральну/шлунково-кишкову імунотерапію для лікування сенсибілізації до пилку берези, котячої шерсті й пилку амброзії; при цьому значного полегшення назальних симптомів, покращення провокаційних тестів чи зменшення прийому фармакотерапевтичних препаратів не спостерігалося. Крім того, пероральне/шлунково-кишкове введення алергенів вимагає високих концентрації екстрактів, до 200 разів більших, ніж при ПШІТ, і пов’язане з розвитком несприятливих шлунково-кишкових побічних ефектів. Однак ефективність пероральної/шлунково-кишкової імунотерапії була продемонстрована для лікування гіперчутливості до харчових продуктів, де цей підхід залишається дослідженим.
Оральна імунотерапія шляхом дії на слизову оболонку ротової порожнини (ОІТСОРП) являє собою альтернативну форму ІТА, що чітко відрізняється від СЛІТ і пероральної/шлунково-кишкової стратегії. ОІТСОРП використовує носій у вигляді зубної пасти на основі гліцерину для введення антигену у вестибулярну й щічну слизову оболонку ротової порожнини для досягнення ним клітин Лангерганса з високою щільністю, які переробляють алерген. Теоретичними перевагами цієї форми ІТА є індукція імунної толерантності меншими концентраціями алергену, зниження місцевих побічних ефектів і більш висока прихильність пацієнта до режиму прийому алергену порівняно з СЛІТ. Нещодавно завершене пілотне дослідження, у якому ОІТСОРП порівнювалася зі СЛІТ, виявило клінічно значущі покращання показників ЯЖ, пов’язаних із основним захворюванням, зі значним підвищенням рівня специфічного IgG4 протягом перших 6 місяців лікування. Про побічні ефекти не повідомлялося, і між оцінками результатів в обох терапевтичних групах не було статистично значущих відмінностей. Для визначення ролі ОІТСОРП у лікуванні АР необхідне провести додаткове дослідження.
Було встановлено, що ефективним підходом для лікування сенсибілізації до пилку й КДП є місцева назальна імунотерапія. Однак висока частота виникнення місцевих побічних реакцій обмежує дотримання пацієнтами режиму терапії: в одному попередньому дослідженні було виявлено, що 43,9 % пролікованих дітей відмовилися від цього варіанту протягом першого року терапії. Високоякісні дослідження інгаляційної/внутрішньобронхіальної імунотерапії при лікування АР ще не завершені, при цьому сучасні дослідження обмежуються лікуванням алергічної астми. У світлі цих висновків з огляду на дотримання пацієнтами режиму терапії і її обмежену ефективність пероральні/шлунково-кишкові, назальні й інгаляційні форми імунотерапії мають обмежену корисність у сучасному лікуванні АР, у той час як ОІТСОРП являє собою нову альтернативу ПШІТ і СЛІТ.
IX.D.8. Комбінована терапія омалізумабом і підшкірна імунотерапія
Щодо комбінованої терапії біологічним препаратом омалізумабом та ІТА, слід зазначити, що окремі її компоненти спрямовані на різні механізми раннього алергічного каскаду. ІТА десенсибілізує реакцію організму на специфічний антиген, не впливаючи на баланс Тх1/Тх2 та індукцію толерантності Т-клітин. Омалізумаб невибірково діє на гуморальний ефектор алергічного запалення з використанням гуманізованого моноклонального антитіла, що блокує вільний IgE. Незважаючи на те, що обидва способи незалежно продемонстрували ефективність як варіанти лікування ЦАР, необхідно розробити вдосконалені стратегії, особливо в пацієнтів із полісенсибілізацією.
Описано дві переваги комбінованої терапії: зменшення частоти системних алергічних реакцій, пов’язаних з ІТА, і покращання контролю симптомів АР. Анафілаксія викликає постійне занепокоєння з приводу ІТА, а частота повідомлених системних реакцій згідно з протоколами інтенсивної імунотерапії сягає 65 %. Отже, попередня терапія омалізумабом була оцінена як стратегія підвищення толерантності до ІТА, яка продемонструвала позитивні результати. У 2 мультицентрових рандомізованих плацебо-контрольованих дослідженнях оцінювали частоту системних алергічних реакцій, спричинених ІТА після попереднього лікування омалізумабом. Massanari та співавт. проводили оцінку 248 пацієнтів із персистуючою астмою середнього ступеня тяжкості, одна з груп отримувала попередню терапію омалізумабом, а друга — плацебо перед кластерною ІТА, прискореного графіку нарощування доз ІТА. У групі, яка приймала омалізумаб, повідомлялося про значно нижчу частоту розвитку системних і респіраторних реакцій з більшою ймовірністю досягти підтримуючої терапії порівняно з групою, яка не прий-мала профілактичної терапії цим біологічним препаратом. Casale та співавт. проводили оцінку 123 дорослих пацієнтів з АР на пилок амброзії, які отримували омалізумаб перед одноденною інтенсивною ІТА, і виявили в 5 разів менший ризик виникнення системних алергічних реакцій при попередньому лікуванні омалізумабом (ВШ: 0,17). Подальші результати включали значне покращення щоденних бальних оцінок симптоматики серед пацієнтів, які отримували комбіновану терапію (тривала терапія омалізумабом + ІТА), порівняно з групою пацієнтів, які отримували лише ІТА. Додаткове дослідження ІТА для лікування гіперчутливості до харчових продуктів або отрути комах також продемонструвало покращення профілю безпеки при попередній терапії омалізумабом.
Ефективність комбінованої терапії для лікування АР була додатково оцінена декількома ітераційними аналізами одного РКД. Kuehr та співавт. проводили оцінку 221 підлітка (віком 6–17 років) з АР середнього й тяжкого ступеня і сенсибілізацією до пилку берези й трави. За допомогою рандомізованого контрольованого дизайну ефективність комбінованої терапії оцінювали протягом послідовних періодів цвітіння берези й трави й порівнювали ефективність ІТА у вигляді монотерапії з ІТА у комбінації з омалізумабом. Значущі висновки включали перевагу комбінованих методів терапії порівняно з ІТА у вигляді монотерапії, які проявлялися у зниженні вираженості симптомів на 48 % (сума середньої добової бальної оцінки тяжкості симптомів + середнє щоденне використання препаратів для екстреної терапії) протягом усього сезону цвітіння й зниженні середнього використання препаратів для екстреної терапії на 80 %. У 2 додаткових дослідженнях повідомляється про унікальні результати, отримані в цьому дослідженні. Rolinck-Werninghaus та співавт. провели аналіз досліджуваних пацієнтів у підгрупах, одна з яких отримувала специфічну ІТА у вигляді монотерапії, а друга — ІТА в комбінації з омалізумабом, під час сезону цвітіння відповідних трав. Результати включали зменшення бальної оцінки симптомів і використання препаратів для екстреної терапії в пацієнтів, які отримували комбіновану терапію порівняно з монотерапією. Kopp та співавт. проводили оцінку підгрупи з 92 дітей і виявили зменшення вивільнення лейкотрієнів (LTC4, LTD4 і LTE4) серед пацієнтів, які отримували комбіновану терапію після антигенної стимуляції зібраних клітин крові in vitro. Неспоріднене дослідження Klunker та співавт. дає додаткові докази ефективності комбінованої терапії з демонстрацією інгібування алерген-специфічного зв’язування IgE in vitro протягом 42 тижнів після припинення комбінованої терапії (порівняно з 30-тижневою монотерапією омалізумабом).
Хоча попереднє дослідження оцінило вартість омалізумабу (1 253 EUR/пацієнт/місяць) і терапії ІТА
(425 EUR/пацієнт/рік), оцінка економічних результатів і підсумковий вплив на продуктивність не була завершена для пацієнтів, які проходили комбіновану терапію. Нарешті, прийом омалізумабу асоціювався з анафілактичними реакціями, які мали місце в 0,09–0,2 % пацієнтів, у зв’язку з чим було рекомендовано спостерігати за пацієнтами протягом 30 хвилин після введення препарату.
Сукупний рівень обґрунтованості: B (рівень 1b: 4 дослідження, плюс 2 додаткові ітераційні аналізи первинного дослідження).
Користь: покращений профіль безпеки прискорених кластерних протоколів і протоколів інтенсивної ІТА, покращення бальної оцінки симптомів і зменшення використання препаратів для екстреної терапії серед ретельно відібраної популяції.
Ризик: фінансові витрати й ризик виникнення анафілактичних реакцій.
Вартість: від помірної до високої.
Оцінка користь/ризик: схильність до більшої користі порівняно зі шкодою.
Ціннісні судження: згідно з результатами кластерних протоколів і протоколів інтенсивної імунотерапії, комбінована терапія підвищує профіль безпеки ІТА та зменшує розвиток системних реакцій. Необхідно враховувати пов’язані з цим витрати на лікування і ймовірність виникнення системних реакцій, а також звернути більшу увагу на попередню терапію омалізумабом перед застосуванням протоколів ІТА, що мають більш високий ризик. Незважаючи на те, що два високоякісні РКД продемонстрували краще усунення симптоматики при використанні комбінованої терапії порівняно з використанням монотерапії ІТА або омалізумабом, не всі пацієнти потребуватимуть такого підходу. Швидше за все, до ведення пацієнта з оцінкою альтернативних причин стійких симптомів, таких як невстановлена чутливість до алергенів, потрібен індивідуальний підхід. Існуючі дані не підтверджують використання комбінованої терапії для всіх пацієнтів, які не отримують користі від ІТА.
Директивний рівень: варіант, що заснований на поточних доказах. Однак важливо зазначити, що омалізумаб на сьогодні не схвалений FDA США для лікуван-ня АР.
Упровадження в практику: омалізумаб може бути запропонований для премедикації перед індукцією кластерних протоколів і протоколів інтенсивної ІТА. Комбінована терапія являє собою альтернативний варіант для ретельно підібраного пацієнта зі стійкою симптоматикою АР після проведеної ІТА. Щодо тактики ведення пацієнтів необхідно враховувати індивідуальний підхід. Крім того, оскільки омалізумаб нині не затверджений FDA для лікування АР, у США в звичайній клінічній практиці такий підхід до лікування, швидше за все, не застосовується.

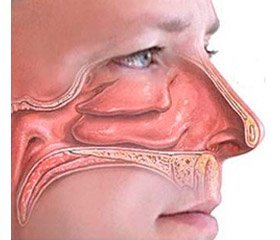
/38-1.jpg)