Журнал «Медицина неотложных состояний» Том 16, №1, 2020
Вернуться к номеру
Скринінг і діагностика сепсису при тяжких опіках
Авторы: Сорокіна О.Ю.(1), Коваль М.Г.(2)
(1) — ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
(2) — КЗ «Одеський обласний клінічний медичний центр», м. Одеса, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
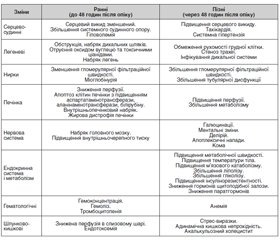
На сьогодні багато зусиль докладається для розробки більш точної діагностики, профілактики та своєчасного виявлення сепсису у хворих різних вікових груп. Незважаючи на сучасні досягнення в профілактиці і лікуванні, сепсис залишається основною причиною смертності тяжкої опікової травми. Загроза розвитку сепсису в опікових хворих залишається до тих пір, поки рани не будуть повністю закриті. Мета огляду: розглянути сучасні дані літератури щодо скринінгу та ранньої діагностики сепсису у хворих з опіками. У статті проведено аналіз літератури з використанням PubMed, Scopus, GoogleScholar і висвітлені актуальні проблеми діагностики опікового сепсису, що виникає у хворих різних вікових груп. На третьому міжнародному консенсусі «Сепсис-3» у 2016 році сепсис був визначений як загрозлива для життя органна дисфункція, яка викликає порушення реакції організму пацієнта на інфекцію. У статті розглянуті відмінності патофізіологічних змін у ранню та пізню фази перебігу опікової хвороби, коли проявляється органна недостатність. Визначено, що при проведенні стратифікації сепсису для дорослих і дітей визначаються критерії високого, помірного та низького ризику на підставі анамнезу, змін з боку дихальної та серцево-судинної систем, шкіри, циркуляції та гідратації пацієнта. Хоча критерії розвитку опікового сепсису відповідають загальноприйнятим, проте слід враховувати розвиток системної запальної відповіді з перших днів тяжкої опікової хвороби, що відрізняє опіковий сепсис від сепсису в загальній популяції інтенсивної терапії і ускладнює діагностику і лікування. У статті розглянуті питання інформативності біохімічних маркерів, зокрема динаміки прокальцитоніну, С-реактивного білка, пресепсину. Зроблено висновок, що у хворих з термічною травмою до моменту закриття опікових ран мають місце синдром системної запальної відповіді, гіперметаболізму-гіперкатаболізму та можливі прояви органної недостатності. Тому багато наукових робот спрямовані на пошук та розробку точного алгоритму діагностики опікового сепсису. Розвиток генетичних методів дослідження опікового сепсису — один з перспективних напрямків в прогнозуванні та запобіганні тяжким ускладненням, що дозволить своєчасно спрогнозувати та корегувати розвиток сепсису.
На сегодняшний день много усилий прикладывается для разработки более точной диагностики, профилактики и своевременного выявления сепсиса у больных разных возрастных групп. Несмотря на современные достижения в профилактике и лечении, сепсис остается основной причиной смертности при тяжелой ожоговой травме. Угроза развития сепсиса у ожоговых больных остается до тех пор, пока раны не будут полностью закрыты. Цель обзора: рассмотреть современные данные литературы по проведению скрининга и ранней диагностики сепсиса у больных с ожогами. В статье проведен анализ литературы с использованием PubMed, Scopus, GoogleScholar и освещены актуальные проблемы профилактики и диагностики ожогового сепсиса, возникающего у больных разных возрастных групп. На третьем международном консенсусе «Сепсис-3» в 2016 году сепсис был определен как угрожающая жизни органная дисфункция, вызывающая нарушения реакции организма пациента на инфекцию. В статье представлены различия патофизиологических изменений в раннюю и позднюю фазы течения ожоговой болезни, когда развивается органная недостаточность. Определено, что при проведении стратификации сепсиса для взрослых и детей определяются критерии высокого, умеренного и низкого риска на основании анамнеза, изменений со стороны дыхательной и сердечно-сосудистой систем, кожи, циркуляции и гидратации пациента. Хотя критерии развития ожогового сепсиса соответствуют общепринятым, однако следует учитывать развитие системного воспалительного ответа с первых дней тяжелой ожоговой болезни, что отличает ожоговый сепсис от сепсиса в общей популяции интенсивной терапии и усложняет диагностику и лечение. В статье рассмотрены вопросы информативности биохимических маркеров, в частности динамики прокальцитонина, С-реактивного белка, пресепсина. Сделан вывод, что у больных с термической травмой до момента закрытия ожоговых ран имеют место синдром системного воспалительного ответа, гиперметаболизма-гиперкатаболизма и возможны проявления органной недостаточности. Поэтому многие научные работы направлены на поиск и разработку точного алгоритма диагностики ожогового сепсиса. Развитие генетических методов диагностики ожогового сепсиса — одно из перспективных направлений в прогнозировании и предупреждении тяжелых осложнений, что позволит своевременно спрогнозировать и корректировать развитие сепсиса.
A large amount of effort is being applied to develop a more accurate diagnosis, prevention and timely detection of sepsis in patients of different age groups. Despite current advances in prevention and treatment, sepsis remains the leading cause of death for severe burn injury. The threat of developing sepsis in burn patients remains until the wounds are completely closed. The study aimed to review the current literature on screening and early diagnosis of sepsis in burn patients. This article analyzes the literature using PubMed, Scopus, GoogleScholar and highlights the current problems of the prevention and diagnosis of burn sepsis that occurs in patients of different age groups. At the third international consensus (Sepsis-3) in 2016, sepsis was defined as a life-threatening organ dysfunction, causing a disturbance in the patient’s response to infection. The article presents the differences of pathophysiological changes in the wound and late phase of burn disease, when manifestations of organ failure develop. The criteria for high, moderate and low risk based on anamnesis, changes in respiratory and cardiovascular systems, skin, circulation and hydration of the patient were determined during the stratification of sepsis for adults and children. Although the criteria for the development of burn sepsis are consistent with generally accepted, however, the development of a systemic inflammatory response from the first days of severe burn disease should be taken into account, which distinguishes burn sepsis from sepsis in the general intensive care population and complicates the diagnosis and treatment. The article deals with the expediency of biochemical markers, in particular the dynamics of procalcitonin, C-reactive protein, and presepsin. It is concluded that patients with thermal trauma until the moment of the closure of burn wounds have a systemic inflammatory response syndrome, hypermetabolism-hypercatabolism and possible manifestations of organ failure. Therefore, many scientific papers are aimed at finding and developing an accurate algorithm for the diagnosis of burn sepsis. The development of genetic methods for the study of burn sepsis is one of the promising directions in the prediction and prevention of serious complications, which will allow timely prognosis and correction of the development of sepsis.
опіки; скринінг і діагностика сепсису; огляд
ожоги; скрининг и диагностика сепсиса; обзор
burns; screening and diagnosis of sepsis; review
Вступ
Висновки
1. Дубров С.А., Сорокина Е.Ю. Новые шаги в определении понятий «сепсиса» и «септического шока». Изменения в диагностике и терапии сепсиса и септического шока. Экстренная медицина. 2017. 4(6). 535-545.
2. Singer M., Deutschman C.S., Seymour C.W., Shankar-Hari M., Annane D., Bauer M., Bellomo R., Bernard G.R., Chiche J.D., Coopersmith C.M., Hotchkiss R.S., Levy M.M., Marshall J.C., Martin G.S., Opal S.M., Rubenfeld G.D., van der Poll T., Vincent J.L., Angus D.C. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016. 315(8). 801-810. doi: 10.1001/jama.2016.0287.
3. Heming N., Lamothe L., Ambrosi X., Annane D. Emerging drugs for the treatment of sepsis. Expert Opinion on Emerging Drugs. 2016. 21(1). 27-37.
4. http://apps. who.int/classi cations/icd10/browse/2016/en.
5. Vincent Jean-Louis, Greg S. Martin, Mitchell M. Levy. qSOFA does not replace SIRS in the definition of sepsis. Critical care. 2016. 20(1). 210. https://doi.org/10.1186/s13054-016-1389-z.
6. Sepsis: recognition, diagnosis and early management/NICE guidelines [NG51] Published date: July 2016. https://www.nice.org.uk/guidance.
7. Козинець Г.П., Сорокіна О.Ю., Слєсаренко С.В., Філіп Ж.В. Сучасне визначення сепсису та септичного шоку у хворих з глибокими поширеними опіками. Хірургія України. 2017. 1(61). 109-117.
8. Greenhalgh David G. Sepsis in the burn patient: a different problem than sepsis in the general population. Burns & trauma. 2017. 5(1). 23. https://doi.org/10.1186/s41038-017-0089-5.
9. Sorokina O.Yu., Filip Zh.V., Buryak T.O., Shepitko K.V. Perioperative medicine — a new field of severe burn injury treatment. World of Medicine and Biology. 2018. 4(66). 108-112. DOI: 10.26724/2079-8334-2018-4-66-108-112.
10. Samraj Ravi S., Basilia Zingarelli, Hector R. Wong. Role of biomarkers in sepsis care. Shock (Augusta, Ga.). 2013. 40(5). 358. doi: 10.1097/SHK.0b013e3182a66bd6.
11. Land Walter G. The role of damage-associated molecular patterns (DAMPs) in human diseases: part II: DAMPs as diagnostics, prognostics and therapeutics in clinical medicine. Sultan Qaboos University Medical Journal. 2015. 15(2). e157. PMID: 26052447.
12. Iwasaki A., Medzhitov R. Regulation of adaptive immunity by the innate immune system. Science. 2010. 327(5963). 291-295. DOI: 10.1126/science.1183021.
13. Noreen M., Shah M.A., Mall S.M., Choudhary S., Hussain T., Ahmed I., Jalil S.F., Raza M.I. TLR4 polymorphisms and disease susceptibility. Inflammation Research. 2012. 61(3). 177-88. https://doi.org/10.1007/s00011-011-0427-1.
14. Arancibia S.A., Beltrán C.J., Aguirre I.M., Silva P., Peralta A.L., Malinarich F., Hermoso M.A. Toll-like receptors are key participants in innate immune responses. Biological research. 2007. 40(2). 97-112. http://dx.doi.org/10.4067/S0716-97602007000200001.
15. Słotwiński R., Sarnecka A., Dąbrowska A., Kosałka K., Wachowska E., Bałan B.J., Jankowska M., Korta T., Niewiński G., Kański A., Mikaszewska-Sokolewicz M. Innate immunity gene expression changes in critically ill patients with sepsis and disease-related malnutrition. Central-European journal of immunology. 2015. 40(3). 311. doi: 10.5114/ceji.2015.54593.
16. Mokline A., Garsallah L., Rahmani I., Jerbi K., Oueslati H., Tlaili S., Hammouda R., Gasri B., Messadi A.A. Procalcitonin: a diagnostic and prognostic biomarker of sepsis in burned patients. Annals of burns and fire disasters. 2015. 28(2). 116. PMID: 27252609.
17. Jeschke M.G., Finnerty C.C., Kulp G.A., Kraft R., Herndon D.N. Can we use C-reactive protein levels to predict severe infection or sepsis in severely burned patients? International journal of burns and trauma. 2013. 3(3). 137. PMID: 23875119.
18. Пипа Л.В., Мургіна М.М. Порівняльний аналіз інформативності сучасних біомаркерів сепсису у дітей. Міжнародний журнал педіатрії, акушерства та гінекології. 2017. 11(1). 14-23.
19. Нетюхайло Л.Г., Харченко С.В., Костенко А.Г. Патогенез опікової хвороби. Світ медицини та біології. 2011. 1. 131-135.
20. Bittner E.A., Shank E., Woodson L., Martyn J.A.J. Acute and Perioperative Care of the Burn-injured Patient. Anesthesiology. 2015. 122(2). 448-464. doi: 10.1097/ALN.0000000000000559.
21. Martin L., Derwall M., Al Zoubi S., Zechendorf E., Reuter D.A., Thiemermann C., Schuerholz T. The septic heart: current understanding of molecular mechanisms and clinical implications. Chest. 2019. 155(2). 427-37. https://doi.org/10.1016/j.chest.2018.08.1037.
22. Knowlin L.T., Purcell L., Cairns B.A., Charles, A.G. Burn injury mortality in patients with preexisting and new onset renal disease. The American Journal of Surgery. 2018. 215(6). 1011-1015. https://doi.org/10.1016/j.amjsurg.2018.02.027.
23. Ibrahim A.E., Sarhane K.A., Fagan S.P., Goverman J. Renal dysfunction in burns: a review. Annals of burns and fire disasters. 2013. 26(1). 16. PMID: 23966894.
24. Kimmel L.A., Wilson S., Walker R.G., Singer Y., Cleland H. Acute Kidney Injury: It’s not just the ‘big’burns. Injury. 2018. 49(2). 213-218. https://doi.org/10.1016/j.injury.2017.11.016.
25. Davis A.L., Carcillo J.A., Aneja R.K., Deymann A.J., Lin J.C., Nguyen T.C., Okhuysen-Cawley R.S., Relvas M.S., Rozenfeld R.A., Skippen P.W., Stojadinovic B.J. American College of Critical Care Medicine clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock. Critical care medicine. 2017. 45(6). 1061-93. https://doi.org/10.1097/CCM.0000000000002425.
26. American Burn Association Consensus Conference on Burn Sepsis and Infection Group et al. American Burn Association consensus conference to define sepsis and infection in burns. Journal of burn care & research. 2007. 28(6). 776-790. https://doi.org/10.1097/BCR.0b013e3181599bc9.
27. Noskova O.A., Anganova E.V., Gvak G.V., Savilov E.D. Epidemiological aspects of sepsis. Journal of microbiology epidemiology immunobiology. 2018. 5. 121-126. https://doi.org/10.36233/0372-9311-2018-5-121-126.
28. Upperman Jeffrey S., John C. Bucuvalas, Felicia N. Williams, Bruce A. Cairns, Charles S. Cox Jr, Allan Doctor, Robert F. Tamburro. Specific etiologies associated with the multiple organ dysfunction syndrome in children: Part 2. Pediatric critical care medicine: a journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies. 2017. 18(3). Suppl. 1. S58.
29. Upperman J.S., Bucuvalas J.C., Williams F.N., Cairns B.A., Cox C.S. Jr, Doctor A., Tamburro, R.F. Specific etiologies associated with the multiple organ dysfunction syndrome in children: Part 2. Pediatric critical care medicine: a journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies. 2017. 18(3 Suppl. 1). S58.d oi: 10.1097/PCC.0000000000001051.
30. Manz Markus G., Steffen Boettcher. Emergency granulopoiesis. Nature reviews Immunology. 2014. 14(5). 302-314. https://doi.org/10.1038/nri3660.
31. Lamas Daniela. Chronic critical illness. The New England journal of Medicine. 2014. 175-177. DOI: 10.1056/NEJMms 1310675.
32. Hotchkiss R.S., Monneret G., Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy. Nature Reviews Immunology. 2013. 13(12). 862-74. https://doi.org/10.1038/nri3552.
33. Wong H.R. Genetics and genomics in pediatric septic shock. Critical care medicine. 2012. 40(5). 1618.
34. Reinhart K., Bauer M., Riedemann N.C., Hartog C.S. New approaches to sepsis: molecular diagnostics and biomarkers. Clinical microbiology reviews. 2012. 25(4). 609-34. DOI: 10.1128/CMR.00016-1.
35. Peter A. New approaches to the study of sepsis. EMBO molecular medicine. 2012. 4(12). 1234-1243. https://doi.org/10.1002/emmm.201201375.
36. Xiao W., Mindrinos M.N., Seok J., Cuschieri J., Cuenca A.G., Gao H., Hayden D.L., Hennessy L., Moore E.E., Minei J.P., Bankey P.E. A genomic storm in critically injured humans. Journal of Experimental Medicine. 2011. 208(13). 2581-90. DOI: 10.1084 / jem.2 0111354.
37. Norbury W., Herndon D.N., Tanksley J., Jeschke M.G., Finnerty C.C., Scientific Study Committee of the Surgical Infection Society. Infection in burns. Surgical infections. 2016. 17(2). 250-5. https://doi.org/10.1089/sur.2013.134.
38. Cabral L., Afreixo V., Almeida L., Paiva J.A. The use of procalcitonin (PCT) for diagnosis of sepsis in burn patients: a meta-analysis. PLoS One. 2016. 11(12). e0168475. doi.org/10.1586/eri.10.154.
39. Standage S.W., Wong H.R. Biomarkers for pediatric sepsis and septic shock. Expert review of anti-infective therapy. 2011. 9(1). 71-9. https://doi.org/10.1586/eri.10.154.
40. Lopez O.N., Cambiaso-Daniel J., Branski L.K., Norbury W.B., Herndon D.N. Predicting and managing sepsis in burn patients: current perspectives. Therapeutics and clinical risk management. 2017. 13. 1107. doi: 10.2147/TCRM.S119938.
41. Abraham E. New Definitions for sepsis and septic shock continuing evolution but with much still to be done. JAMA. 2016. 315(8). 757-759. doi: 10.1001/jama.2016.0290.
42. Wong H.R., Salisbury S., Xiao Q., Cvijanovich N.Z., Hall M., Allen G.L., Thomas N.J., Freishtat R.J., Anas N., Meyer K., Checchia P.A. The pediatric sepsis biomarker risk model. Critical care. 2012. 16(5). 174. doi: 10.1186/cc11652.
43. Вельков В.В. Использование биомаркера пресепсин для ранней и высокоспецифичной диагностики сепсиса. Журнал им. проф. Б.М. Костюченко. 2015. 2. 54-82.
44. Ozdemir A.A., Elgormus Y. Diagnostic value of presepsin in detection of early-onset neonatal sepsis. American journal of perinatology. 2017. 34(06). 550-6. DOI: 10.1055/s-0036-1593851.
45. Булава Г.В. Иммунологические аспекты сепсиса. Неотложная медицинская помощь. 2013. 2. 47-56.
46. Ingram N. Procalcitonin: does it have a role in the diagnosis, management and prognosis of patients with sepsis? Journal of the Intensive Care Society. 2013. 14(3). 226-30. https://doi.org/10.1177/175114371301400310.
47. Gupta R., Singh V., Patrikar S., Hazra N., Mathai S.S. Is Procalcitonin Useful in Early Diagnosis of Serious Bacterial Infections in Children? J. Nepal. Paediatr. Soc. 2013. 33(2). 106-109. https://doi.org/10.3126/jnps.v33i2.7988.
48. Garcia I.J., Gargallo M.B., Torné E.E., Lasaosa F.J., Viñas A.T., Tolosa C.V., Rico A.P. Procalcitonin: a useful biomarker to discriminate infection after cardiopulmonary bypass in children. Pediatric Critical Care Medicine. 2012. 13(4). 441-5. doi: 10.1097/PCC.0b013e31823890de.
49. Zou Q., Wen W., Zhang X.C. Presepsin as a novel sepsis biomarker. World journal of emergency medicine. 2014. 5(1). 16. doi: 10.5847/wjem.j.issn.1920-8642.2014.01.002.
50. Колоскова К.О., Безруков Л.О., Колюбакіна Л.В., Власова О.В. Діагностична цінність гострофазових показників інфекційно-запального процесу у діагностиці раннього неонатального сепсису. Міжнародній журнал педіатрії, акушерства та гінекології. 2016. 9(3). 58-64.
51. HAVE EC, LIFE FY. Diagnosing and managing sepsis in children. Practitioner. 2018. 262(1811). 21-5.
52. Hartman M.E., Linde-Zwirble W.T., Angus D.C., Watson R.S. Trends in the epidemiology of pediatric severe sepsis. Pediatric Critical Care Medicine. 2013. 14(7). 686-93. doi: 10.1097/PCC.0b013e3182917fad.
53. Balamuth F., Weiss S.L., Neuman M.I., Scott H., Brady P.W., Paul R., Farris R.W., McClead R., Hayes K., Gaieski D., Hall M. Pediatric severe sepsis in US children’s hospitals. Pediatric critical care medicine: a journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies. 2014. 15(9). 798. doi: 10.1097/PCC.0000000000000225.
54. Seymour C.W., Liu V.X., Iwashyna T.J., Brunkhorst F.M., Rea T.D., Scherag A., Rubenfeld G., Kahn J.M., Shankar-Hari M., Singer M., Deutschman C.S. Assessment of clinical criteria for sepsis: for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016. 315(8). 762-74. doi: 10.1001/jama.2015.14123.
55. Махмудов О.С., Пулатова Р.З. Опыт внедрения современных методов диагностики и лечения сепсиса у детей раннего возраста. Педиатрия. 2012. 3(4). 88-91.
56. King E.G., Bauzá G.J., Mella J.R., Remick D.G. Pathophysiologic mechanisms in septic shock. Laboratory investigation. 2014. 94(1). 4.
57. Mossie A. Pathophysiology of sepsis. World Journal of Medicine and Medical Science. 2013. 1(8). 159-168. https://doi.org/10.1038/labinvest.2013.110.
58. Faix I.D. Biomarkers of sepsis. Crit. Rev. Clin. Lab. Scl. 2013. 50(1). 23-36.
59. Гузенко Б.В. Алгоритм діагностики опікового бактеріального сепсису. Запорожский медицинский журнал. 2013. 5. 19-22.
60. Delongui F., Carvalho Grion C.M., Ehara Watanabe M.A., Kaminami Morimoto H., Bonametti A.M., Maeda Oda J.M., Kallaur A.P., Matsuo T., Vissoci Reiche E.M. Association of tumor necrosis factor β genetic polymorphism and sepsis susceptibility. Experimental and Therapeutic Medicine. 2011. 2(2). 349-56. https://doi.org/10.3892/etm.2011.213.
61. Surbatovic M., Veljovic M., Jevdjic J., Popovic N., Djordjevic D., Radakovic S. Immunoinflammatory response in critically ill patients: severe sepsis and/or trauma. Mediators of inflammation. 2013. 2013. http://dx.doi.org/10.1155/2013/362793.
62. Brøchner A.C., Toft P. Pathophysiology of the systemic inflammatory response after major accidental trauma. Scandinavian journal of trauma, resuscitation and emergency medicine. 2009. 17(1). 43. https://doi.org/10.1186/1757-7241-17-43.
63. Gentile L.F., Cuenca A.G., Efron P.A., Ang D., McKinley B.A., Moldawer L.L., Moore F.A. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. The journal of trauma and acute care surgery. 2012. 72(6). 1491. doi: 10.1097/TA.0b013e318256e000.
64. Namath Allen, Andrew J. Patterson. Genetic polymorphisms in sepsis. Critical Care Nursing Clinics. 2011. 23(1). 181-202. DOI: https://doi.org/10.1016/j.ccell.2010.12.011.
65. Wang H., Wei Y., Zeng Y., Qin Y., Xiong B., Qin G., Li J., Hu D., Qiu X., Sooranna S.R., Pinhu L. The association of polymorphisms of TLR4 and CD14 genes with susceptibility to sepsis in a Chinese population. BMC medical genetics. 2014. 15(1). 123. https://doi.org/10.1186/s12881-014-0123-4.
66. Kumpf O., Schumann R.R. Genetic variation in innate immunity pathways and their potential contribution to the SIRS/CARS debate: evidence from human studies and animal models. Journal of innate immunity. 2010. 2(5). 381-94. https://doi.org/10.1159/000314269.
67. Wischmeyer P.E. Malnutrition in the acutely ill patient: is it more than just protein and energy? South African Journal of Clinical Nutrition. 2011. 24(3). S1-7. http://dx.doi.org/10.1080/16070658.2011.11734372.
68. Hughes S.M., Amadi B., Mwiya M., Nkamba H., Tomkins A., Goldblatt D. Dendritic cell anergy results from endotoxemia in severe malnutrition. The Journal of Immunology. 2009. 183(4). 2818-26. DOI: https://doi.org/10.4049/jimmunol.0803518.
69. Cabrera-Perez J., Condotta S.A., Badovinac V.P., Griffith T.S. Impact of sepsis on CD4 T cell immunity. Journal of leukocyte biology. 2014. 96(5). 767-77. https://doi.org/10.1189/jlb.5MR0114-067R.

/33.jpg)
/35.jpg)
/36.jpg)