Резюме
Актуальність. Протеїндефіцитна мальнутриція — одне з поширених порушень нутритивного статусу, що впливає на клінічний стан, перебіг та прогноз захворювань у дітей. Метою цього дослідження було вивчити поширеність зниження рівня транстиретину (TTR), динаміку співвідношення «TTR/С-реактивний протеїн», тривалість госпіталізації у відділенні інтенсивної терапії та рівень 28-денної летальності в дітей із гострою гіпоксемічною дихальною недостатністю. Матеріали та методи. Із травня 2018 р. по травень 2019 р. нами проведено проспективне когортне одноцентрове дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії Львівської обласної дитячої клінічної лікарні «ОХМАТДИТ») серед пацієнтів віком 3–12 років. Рівень транстиретину та С-реактивного протеїну сироватки крові оцінювали в 1-шу (d1), 3-тю (d3), 5-ту (d5), 7-му та 9-ту добу (d7 та d9). До дослідження були включені 19 пацієнтів. Ретроспективно всіх пацієнтів було розподілено на такі підгрупи: 1-ша підгрупа — діти з рівнем TTR понад 150 мг/л (відсутня мальнутриція), 2-га — рівень TTR сироватки крові 120–150 мг/л (легка мальнутриція), 3-тя — рівень TTR 80–100 мг/л (помірна мальнутриція), 4-та — рівень TTR менше 80 мг/л (тяжка мальнутриція). Результати. Установлено, що зниження рівня транстиретину нижче 150 мг/л було виявлено в 10 з 19 включених у дослідження пацієнтів (52,6 %) на етапі дослідження d1, у 7 пацієнтів із 15 (46,7 %) — на етапі дослідження d3, у 6 пацієнтів із 10 (60 %) — на етапі дослідження d5 та в 3 пацієнтів із 4 (75 %) і 1 пацієнта з 4 (25 %) — на етапах дослідження d7 та d9 відповідно. У пацієнтів 1-ї підгрупи виявлено прогресивне зростання співвідношення транстиретину та С-реактивного протеїну впродовж дослідження з 2,83 на етапі дослідження d1 до 13 та 31 на етапах дослідження d5 та d9 відповідно (p = 0,12 та p = 0,06 порівняно з етапом дослідження d1). У пацієнтів 4-ї підгрупи дане співвідношення впродовж дослідження становило 0,53 на етапі дослідження d1, на етапах дослідження d5 та d9 — 0,25 та 0,33 (p = 0,72 та p = 0,56 порівняно з етапом дослідження d1). Частка 28-денної летальності серед пацієнтів 1-ї підгрупи становила 11,1 %. Усі пацієнти з 2-ї та 3-ї підгруп вижили. У 4-й підгрупі пацієнтів рівень летальності становив 42,9 % (p = 0,18 порівняно з 1-ю підгрупою пацієнтів). Тривалість госпіталізації серед пацієнтів 1-ї підгрупи становила 14,8 доби (12,5–19,7 доби); серед пацієнтів 4-ї підгрупи — 23,2 доби (19,1–29,5 доби) (p = 0,11). Висновки. Гострі порушення нутритивного статусу були верифіковані в 52,6 % пацієнтів із гіпоксемічною дихальною недостатністю при надходженні на лікування. У пацієнтів із тяжким нутритивним дефіцитом співвідношення транстиретину та С-реактивного протеїну було зниженим упродовж усього дослідження. Рівень 28-денної летальності в пацієнтів без гострих нутритивних порушень становив 11,1 %, у пацієнтів із гострим тяжким нутритивним дефіцитом — 42,9 % (p = 0,18).
Актуальность. Протеиндефицитная мальнутриция — одно из самых распространенных нарушений нутритивного статуса, которое влияет на клиническое состояние, течение и прогноз заболеваний у детей. Целью данного исследования было изучить распространенность снижения уровня транстиретина (TTR), динамику соотношения «TTR/С-реактивный протеин», продолжительность госпитализации в отделении интенсивной терапии и уровень 28-дневной летальности у детей с острой гипоксемической дыхательной недостаточностью. Материалы и методы. С мая 2018 г. по май 2019 г. нами проведено проспективное когортное одноцентровое исследование на клинической базе кафедры анестезиологии и интенсивной терапии Львовского национального медицинского университета имени Данила Галицкого (отделение анестезиологии с койками интенсивной терапии Львовской областной детской клинической больницы «ОХМАТДЕТ») среди пациентов в возрасте 3–12 лет. Уровень транстиретина и С-реактивного протеина сыворотки крови оценивали в 1-е (d1), 3-и (d3), 5-е (d5), 7-е и 9-е сутки (d7 и d9). В исследование были включены 19 пациентов. Ретроспективно все пациенты были разделены на следующие подгруппы: 1-я подгруппа — дети с уровнем TTR более 150 мг/л (мальнутриция отсутствует), 2-я — уровень TTR сыворотки крови 120–150 мг/л (легкая мальнутриция), 3-я — уровень TTR 80–100 мг/л (умеренная мальнутриция), 4-я — уровень TTR менее 80 мг/л (тяжелая мальнутриция). Результаты. Установлено, что снижение уровня транстиретина ниже 150 мг/л было обнаружено у 10 из 19 включенных в исследование пациентов (52,6 %) на этапе исследования d1; у 7 пациентов из 15 (46,7 %) — на этапе исследования d3; у 6 пациентов из 10 (60 %) — на этапе исследования d5 и у 3 пациентов из 4 (75 %) и 1 пациента из 4 (25 %) — на этапах исследования d7 и d9 соответственно. У пациентов 1-й подгруппы в течение исследования обнаружен прогрессивный рост соотношения «транстиретин/С-реактивный протеин» с 2,83 на этапе исследования d1 до 13 и 31 на этапах исследования d5 и d9 соответственно (p = 0,12 и p = 0,06 по сравнению с этапом исследования d1). У пациентов 4-й подгруппы данное соотношение в течение исследования составило 0,53 на этапе исследования d1, на этапах исследования d5 и d9 — 0,25 и 0,33 соответственно (p = 0,72 и p = 0,56 по сравнению с этапом исследования d1). Доля 28-дневной летальности среди пациентов 1-й подгруппы составила 11,1 %. Все пациенты из 2-й и 3-й подгрупп выжили. В 4-й подгруппе уровень летальности составил 42,9 % (p = 0,18 по сравнению с 1-й подгруппой пациентов). Продолжительность госпитализации среди пациентов 1-й подгруппы составила 14,8 суток (12,5–19,7 суток), среди пациентов 4-й подгруппы — 23,2 суток (19,1–29,5 суток) (p = 0,11). Выводы. Острые нарушения нутритивного статуса были верифицированы у 52,6 % пациентов с гипоксемической дыхательной недостаточностью при поступлении на лечение. У пациентов с тяжелым нутритивным дефицитом соотношение транстиретина и С-реактивного протеина было пониженным в течение всего исследования. Уровень 28-дневной летальности у пациентов без острых нутритивных нарушений составил 11,1 %, у пациентов с острым тяжелым нутритивным дефицитом — 42,9 % (p = 0,18).
Background. Protein-deficient malnutrition is one of the common disorders of nutritional status that affects the clinical condition, course and prognosis of diseases in children. The purpose of this study was to investigate the prevalence of transthyretin levels decreasing, the dynamics of the transthyretin/C-reactive protein ratio, duration of staying at the pediatric intensive care unit, and 28-day mortality rate in children with acute hypoxemic respiratory failure. Materials and methods. We complete the prospective single-centre cohort study (May 2018 — May 2019) at the Department of Anesthesiology and Intensive Care, Danylo Halytsky Lviv National Medical University; Department of Anesthesiology and Intensive Care, Lviv Regional Children Hospital OCHMATDYT. We included the patients aged from 3 to 12 years old with acute respiratory failure on invasive mechanical ventilation. Serum transthyretin (TTR) level was evaluated on the day 1 (d1), day 3 (d3), 5 (d5), 7 (d7) and 9 (d9). We included 19 patients in study results analysis. Patients were divided into the following subgroups: 1st subgroup — children with transthyretin levels over 150 mg/l (no malnutrition); 2nd subgroup — serum TTR level 120–150 mg/l (mild malnutrition); 3rd subgroup — TTR level 80–100 mg/l (moderate malnutrition); 4th subgroup — TTR level under 80 mg/l (severe malnutrition). Results. The transthyretin level below 150 mg/l was determined in 10 out of 19 patients included in the study results analysis (52.6 %) on d1; in 7 patients out of 15 (46.7 %) on d3; in 6 patients out of 10 (60 %) on d5, in 3 patients out of 4 (75 %) and in one patient out of 4 (25 %) on d7 and d9, respectively. Our investigation reveals the increased ratio of transthyretin to C-reactive protein in the 1st subgroup of patients from 2.83 on d1 to 13 and 31 on d5 and d9, respectively (p = 0.12 and p = 0.06 in comparison with d1). In patients of the 4th subgroup this ratio was 0.53 at d1; and 0.25 at d5 and 0.33 at d9 (p = 0.72 and p = 0.56 in comparison with d1). The 28-day mortality rate in patients of the 1st subgroup was 11.1 %, in the 4th subgroup — 42.9 % (p = 0.18 compared to the 1st subgroup of patients). All patients of the 2nd and 3rd subgroups survived. The duration of staying at pediatric intensive care unit for the 1st subgroup of patients was 14.8 days [12.5; 19.7]; for the 4th subgroup of patients — 23.2 days [19.1; 29.5] (p = 0.11). Conclusions. Our study reveals the presence of acute nutritive disorders in 52.6 % of patients with hypoxemic respiratory failure at admission. The transthyretin/C-reactive protein ratio diminished during the study period in patients with severe malnutrition. The 28-day mortality rate in patients without acute nutritional disorders was 11.1 %, in patients with acute severe malnutrition — 42.9 % (p = 0.18).
Вступ
Протеїндефіцитна мальнутриція — одне з поширених порушень нутритивного статусу, що впливає на клінічний стан, перебіг та прогноз захворювань у дітей [1, 3, 7, 8, 11]. Пацієнти з нутритивним дефіцитом довше перебувають у відділенні інтенсивної терапії (ВІТ) та на штучній вентиляції легень (ШВЛ), відлучення від ШВЛ у них є довготривалим та може супроводжуватися повторними епізодами інфекцій нижніх дихальних шляхів [1, 2, 6].
Оцінити нутритивний статус можна лабораторними й інструментальними методами. До лабораторних методів належить вимірювання рівня білків плазми крові (табл. 1). Проте за рівнем загального білка складно оцінити гостру нутритивну недостатність, оскільки період напіврозпаду альбуміну становить близько 20 днів. Для оцінки гострих порушень нутритивного статусу використовують вимірювання рівня трансферину та транстиретину сироватки крові, які мають період напіврозпаду 3 та 1 день відповідно.
/89.jpg)
Визначення рівня транстиретину є ключовим кроком оцінювання гострих порушень нутритивного статусу. Проте залишається нез’ясованим, коли використовувати та як інтерпретувати рівень транстиретину та його динаміку [7, 8, 10, 13], особливо серед пацієнтів із синдромом загальної відповіді організму на запалення (SIRS — systemic inflammatory responsive syndrome). Також варто згадати, що до сьогодні рівень транстиретину не включений у міжнародні керівництва з нутритивної терапії (ESPEN/ASPEN), проте даний показник вже включений до національних керівництв Польші, Італії, Великобританії та Франції з поданням його меж для встановлення легкої/середнього ступеня/тяжкої мальнутриції [11].
Базуючись на припущенні, що гострі порушення нутритивного статусу пацієнта, зокрема зміна пулу вісцерального білка транстиретину та співвідношення «транстиретин/С-реактивний протеїн» є поширеними та недостатньо діагностованими серед пацієнтів із гострою гіпоксемічною дихальною недостатністю, метою даного дослідження було вивчити поширеність зниження рівня транстиретину, динаміку співвідношення «транстиретин/С-реактивний протеїн», а також тривалість госпіталізації у відділенні інтенсивної терапії та рівень 28-денної летальності залежно від рівня транстиретину сироватки крові серед таких пацієнтів.
Матеріали та методи
Із травня 2018 р. по травень 2019 р. нами проведено проспективне когортне одноцентрове дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії Львівської обласної дитячої клінічної лікарні «ОХМАТДИТ») серед пацієнтів віком від 3 до 12 років. Протокол висновку біоетичної комісії Львівського національного медичного університету імені Данила Галицького № 1 від 30.01.2018 року. Клінічні дані, що публікуються в даній статті, є частиною результатів клінічного дослідження «Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study»; ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652.
Критеріями включення в дослідження були: вік 3–12 років, клінічні та лабораторні ознаки гострої гіпоксемічної дихальної недостатності, що потребувала проведення інвазивної конвекційної ШВЛ (через інтубаційну трубку). Критеріями виключення з дослідження були: відмова законних представників пацієнта брати участь у дослідженні, повторне надходження пацієнта у ВІТ (пацієнти могли бути включені в дослідження лише один раз), термінальний стан пацієнта при надходженні, що впродовж однієї доби закінчився летально. Рівень транстиретину сироватки крові оцінювали в 1-шу (d1), 3-тю (d3), 5-ту (d5), 7-му та 9-ту добу (d7 та d9).
Статистично обробку результатів дослідження проводили за допомогою MS Exсel 2017 з розрахунком середнього значення, стандартного відхилення, медіани (IQR — interquartile range).
Включення пацієнтів у дослідження (рис. 1) відбувалося так: упродовж часу дослідження у відділення було прийнято 22 пацієнти з гострою дихальною недостатністю, у 3 із них рівень транстиретину не визначали. Таким чином, до дослідження були включені 19 пацієнтів досліджуваної групи.
Ретроспективно нами було розподілено всіх пацієнтів досліджуваної групи на такі підгрупи: 1-ша підгрупа — діти з рівнем транстиретину (TTR) понад 150 мг/л (відсутня мальнутриція); 2-га — рівень TTR сироватки крові 120–150 мг/л (легка мальнутриція); 3-тя — рівень TTR 80–100 мг/л (помірна мальнутриція); 4-та підгрупа — рівень TTR менше 80 мг/л (тяжка мальнутриція).
Результати
Основними причинами гострої дихальної недостатності в дітей, включених у дослідження, були: пневмонія — у 14 пацієнтів (73,7 %), перитоніт та пневмонія — у 3 (15,8 %), бронхолегенева дисплазія та пневмонія — у 2 (10,5 % відповідно) (табл. 2). Середній вік пацієнтів досліджуваної групи становив 62,2 ± 13,5 міс. До дослідження увійшли 11 хлопчиків та 8 дівчаток. Індекс маси тіла пацієнтів становив 14,5 ± 1,9 кг/м2.
Ми проаналізували динаміку рівня транстиретину та встановили, що на етапі дослідження d1 відмічено 9 пацієнтів 1-ї підгрупи (TTR понад 150 мг/л), не виявлено пацієнтів 2-ї підгрупи (TTR = 120–150 мг/л) та були 3 та 7 пацієнтів у 3-й (TTR = 80–100 мг/л) та 4-й (TTR менше 80 мг/л) підгрупах відповідно (рис. 2).
/89_2.jpg)
На етапі дослідження d3 із 1-ї підгрупи один пацієнт перейшов у 2-гу підгрупу та двоє — в 4-ту, три пацієнти з 4-ї підгрупи перемістилися в 1-шу підгрупу. На етапі дослідження d5 один пацієнт із 4-ї підгрупи перемістився в 1-шу підгрупу, проте вже на етапі d7 знову потрапив у 4-ту підгрупу, двоє пацієнтів із 1-ї підгрупи перемістилися в 3-тю підгрупу, та вже на етапі дослідження d7 ці ж пацієнти перемістилися в 4-ту підгрупу. На етапі дослідження d9 залишалися пацієнти в 1-й підгрупі (n = 3) та в 4-й підгрупі (n = 1). Зважаючи на отриману нами динаміку руху пацієнтів упродовж дослідження за підгрупами залежно від рівня транстиретину, варто відзначити, що коливання кількості пацієнтів відбувалися переважно між 1-ю та 4-ю та між 1-ю та 3-ю підгрупами пацієнтів.
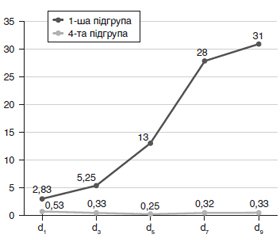
Нами було вивчено динаміку співвідношення «транстиретин/С-реактивний протеїн» у включених у дослідження пацієнтів 1-ї та 4-ї підгруп (рис. 3) та встановлено, що дане співвідношення становило в 1-й підгрупі пацієнтів на етапі дослідження d1 2,83 ± 0,11; на етапах дослідження d3, d5, d7 та d9 поступово зростало до 5,25 ± 0,42, 13,0 ± 1,1, 28,0 ± 1,3 та 31,0 ± 0,9 відповідно. Рівень летальності в 1-й підгрупі пацієнтів становив 11,1 %, серед пацієнтів 4-ї підгрупи — 42,9 % (p = 0,18). Середня тривалість госпіталізації у ВАІТ серед пацієнтів 1-ї підгрупи була 14,8 доби (12,5–19,7 доби); тривалість ШВЛ становила 8,3 доби (7,9–11,1 доби).
/90.jpg)
Ми проаналізували динаміку співвідношення «транстиретин/С-реактивний протеїн» у померлих пацієнтів 4-ї підгрупи (n = 3) та встановили, що впродовж всіх етапів дослідження воно не перевищувало 0,5. Виявлено значні обернені кореляційні зв’язки між співвідношенням «транстиретин/С-реактивний протеїн» та тривалістю перебування у ВІТ (r = –0,76; p = 0,09) та між співвідношенням «транстиретин/С-реактивний протеїн» та тривалістю ШВЛ (r = –0,62; p = 0,18).
Рівень летальності в 1-й підгрупі пацієнтів становив 11,1 %, серед пацієнтів 4-ї підгрупи — 42,9 % (p = 0,18). Тривалість госпіталізації у ВАІТ серед пацієнтів 1-ї підгрупи була 14,8 доби (12,5–19,7 доби), тривалість ШВЛ становила 8,3 доби (7,9–11,1 доби). Тривалість госпіталізації у ВАІТ серед пацієнтів 4-ї підгрупи була 23,2 доби (19,1–29,5 доби), тривалість ШВЛ становила 17,6 доби (15,1–21,1 доби).
Обговорення
Це проспективне одноцентрове дослідження серед 19 пацієнтів віком 3–12 років із гострою гіпоксемічною дихальною недостатністю було розпочато, щоб вивчити поширеність зниження рівня транстиретину, динаміку співвідношення «транстиретин/С-реактивний протеїн» упродовж лікування пацієнтів у ВІТ, а також тривалість госпіталізації пацієнтів та рівень 28-денної летальності. Установлено, що зниження рівня транстиретину нижче 150 мг/дл було виявлено в 10 з 19 включених у дослідження пацієнтів (52,6 %) на етапі дослідження d1, у 7 пацієнтів із 15 (46,7 %) на етапі дослідження d3, у 6 пацієнтів із 10 (60 %) на етапі дослідження d5 та в 3 пацієнтів із 4 (75 %) і 1 пацієнта з 4 (25 %) на етапах дослідження d7 та d9 відповідно.
У пацієнтів 1-ї підгрупи (рівень транстиретину при надходженні на лікування понад 150 мг/дл) виявлено прогресивне зростання співвідношення транстиретину та С-реактивного протеїну впродовж дослідження з 2,83 на етапі дослідження d1 до 13 та 31 на етапах дослідження d5 та d9 відповідно (p = 0,12 та p = 0,06 порівняно з етапом дослідження d1). У пацієнтів 4-ї підгрупи (рівень транстиретину при надходженні на лікування становив менше 80 мг/дл) співвідношення транстиретину та С-реактивного протеїну впродовж дослідження практично не змінювалося та становило 0,53 на етапі дослідження d1, на етапах дослідження d5 та d9 — 0,25 та 0,33 (p = 0,72 та p = 0,56 порівняно з етапом дослідження d1).
Найнижчим був рівень 28-денної летальності серед пацієнтів 1-ї підгрупи (рівень TTR при надходженні на лікування понад 150 мг/дл), що становив 11,1 %. Усі пацієнти з 2-ї та 3-ї підгруп вижили. У 4-й підгрупі пацієнтів рівень летальності був вищим порівняно з 1-ю групою та становив 42,9 % (p = 0,18).
У результаті аналізу тривалості госпіталізації у ВАІТ було встановлено, що серед пацієнтів 1-ї підгрупи вона становила 14,8 доби (12,5–19,7 доби), а серед пацієнтів 4-ї підгрупи суттєво зростала та становила 23,2 доби (19,1–29,5 доби) (p = 0,11).
До діагностичних критеріїв нутритивного дефіциту також включено абсолютну кількість лімфоцитів периферичної крові, оскільки лімфопенія є незалежним предиктором летальності в пацієнтів ВІТ. Крім того, ріст та вага є основними антропометричними показниками для нутритивної оцінки в дітей. Вони можуть бути конвертовані у швидкість росту за рік чи розглянені як номограми росту щодо віку або ваги щодо росту. Також використовують вимірювання товщини підшкірної жирової клітковини за товщиною шкірної складки й обвід плеча, ноги чи тулуба. Проте оцінювання складу тіла із застосуванням цих методів може бути причиною методологічних помилок. Золотим стандартом для визначення «сухої» маси тіла та вмісту жиру в організмі вважають рівень загального калію в організмі та загальної води організму, проте ці методи не є загальнодоступними [8].
Відомо, що нутритивний статус пацієнта впливає на короткотривалі та довготривалі результати лікування [4, 8]. Будь-яка інтенсивна терапія потребує індивідуальної адаптації її, незважаючи на стандартизацію та концепцію, що її підтримує [9]. Оцінювання нутритивного статусу дитини дає можливість фахово та цілеспрямовано проводити лікування нутритивного дефіциту. Показаннями до лікування вважають: зміни понад 2 стандартних відхилень від середнього значення для віку на номограмах «ріст щодо віку» та «вага щодо зросту» чи «вага щодо віку»; ріст щодо віку менше ніж 95 % від очікуваного; вага щодо росту менше ніж 90 % або понад 120 % від очікуваної; швидкість росту менше ніж 5 см/рік у дітей старше 2 років [8, 15].
Ще одним параметром оцінювання нутритивного статусу може бути індекс маси тіла. Доведено (для осіб похилого віку), що саркопенія (зменшення м’язової маси) та різні підвиди саркопенічного ожиріння прогресують із віком, а індекс маси тіла не може бути єдиним інструментом для визначення доброго здоров’я та тим більше нутритивного статусу пацієнта [12]. Серед дітей, які пережили критичний стан, мали тяжку інфекцію, сепсис або ж септичний шок, у подальшому при відновленні харчування маса тіла прогресивно збільшується, а деякі з цих пацієнтів мають навіть надмірну масу тіла, проте вони можуть страждати від саркопенії, котра і буде предиктором несприятливого прогнозу для пацієнта при повторному надходженні на лікування [12].
Дослідження стверджують, що при недостатньому надходженні нутрієнтів або за неможливості їх засвоювати персистує продукція ендогенної енергії, що є максимальною лише впродовж перших 3–4 днів. Цей факт повинен враховуватися при інтеграції в план нутритивної терапії стратегії повільного нарощення харчування, оскільки повний об’єм харчування може призвести до перевантаження пацієнта. Золотим стандартом щодо калорійності харчування, беззаперечно, є непряма калориметрія. За її допомогою ми можемо оцінити те, як і коли потрібно змінювати калораж. Проте призначення оптимальної кількості протеїнів є тяжким для практичного вирішення питання, яке все ще не має єдиного рішення [9].
Теоретично з метою оцінювання нутритивного статусу можна використовувати рівень транспортних протеїнів, таких як альбумін та трансферин. Проте транстиретину надають перевагу, оскільки він більш точно допомагає оцінити нещодавній прийом їжі, аніж нутритивний статус загалом. Крім того, транстиретин є добрим маркером того, чи буде в пацієнта з мальнутрицією після початку харчування розвиватися рефідинг-синдром.
Транстиретин — це транспортний протеїн сироватки крові та цереброспінальної рідини, що зв’язує тироксин Т4 та ретинолзв’язуючий протеїн із ретинолом. Саме так він отримав свою назву «транспорт тироксину та ретинолу». Печінка виділяє транстиретин у кров, хоріоїдальне сплетення — в цереброспінальну рідину. Транстиретин був спочатку названий преальбуміном, оскільки він швидше рухається в гелі для електрофорезу. Ген, що відповідає за синтез транстиретину, розміщений у 18-й хромосомі.
Концентрація преальбуміну в сироватці крові менше 10 мг/дл асоційована з мальнутрицією. Основною перевагою преальбуміну порівняно з альбуміном в оцінюванні мальнутриції є його коротший час напіврозпаду (від 2 до 3 днів), що робить даний показник привабливим щодо визначення гострих порушень нутритивного статусу [4]. Крім того, рівень транстиретину не змінюється в пацієнтів із протеїнвтрачаючою ентеропатією. Рівень преальбуміну може зростати при нирковій дисфункції, терапії кортикостероїдами чи дегідратації, а також знижуватися під час фізіологічного стресу, інфекції, дисфункції печінки та гіпергідратації. Рівень преальбуміну є маркером стратифікації пацієнтів щодо ризику ускладнень та результатів лікування. Скринінгове визначення альбуміну повинно проводитися, коли виключено гострий запальний процес (С-реактивний протеїн не перевищує 15 мг/л). Рівень преальбуміну нижче 0,11 г/л асоціюється зі збільшенням рівня летальності та тривалості лікування, а зростання його менше як на 0,04 г/л/тиждень є індикатором неуспішної нутритивної терапії [14].
Транстиретин часто використовують у наукових дослідженнях [4, 5], проте ще рідко — в клінічній практиці багатьох країн, причинами вважаються брак відповідних доказів доцільності його моніторингу, низька специфічність та високе співвідношення «вартість/ефективність» [5, 11].
Якщо про те, що синтез транстиретину сповільнюється при білково-дефіцитних станах, широко відомо [9], то той факт, що він також пригнічується при цитокініндукованих запальних порушеннях, є менш відомим. Фактором ризику мальнутриції вважають і власне запалення, оскільки при цьому процесі синтезується значна кількість прозапальних цитокінів, зокрема TNF-α та IL-6, що призводять до зниження експресії генів, що відповідають за синтез транстиретину [13]. Транстиретин є тим показником, що інтегрує різні централізовані регуляторні механізми, які забезпечують рівновагу між накопиченням та розпадом білка, стаючи кінцевим показником ресурсів безжирової маси тіла [10]. Прийнято виокремлювати так звану «сіру зону» рівня транстиретину від 100 до 200 мг/л, що залежно від того, куди змінюється рівень транстиретину, дозволяє передбачати більш чи менш сприятливий результат лікування. Найкращого прогнозу захворювання можна досягти, якщо всі рішення щодо харчування, лікування та/чи хірургічної тактики призвели до зростання рівня транстиретину (що відображає зростання його синтезу). Деякі пацієнти можуть не мати відповіді на терапію і бути всередині «сірої зони», поєднуючи стабільно тяжкий стан із персистуючим рівнем транстиретину [12].
У випадках вираженого запального процесу в організмі пацієнта прийнято вважати рівень транстиретину не настільки показовим для визначення гострого нутритивного дефіциту [5, 11, 13]. У таких випадках на допомогу повинно прийти визначення співвідношення «транстиретин/С-реактивний протеїн». У нашому дослідженні пацієнти 4-ї підгрупи мали персистуючий низький рівень співвідношення «транстиретин/С-реактивний протеїн», що відображає виражену диспротеїнемію в них із неможливістю відновити позитивний азотистий баланс організму (нарощувати синтез транстиретину) на фоні постійно високого рівня показників запалення. Тому визначення даного співвідношення в пацієнтів зі стабільно тяжким станом повинне бути серійним, і такі пацієнти повинні лікуватися так інтенсивно й індивідуалізовано [9], аби досягти належного зростання рівня транстиретину, що забезпечить найкращий результат лікування.
Висновки
Гострі порушення нутритивного статусу були верифіковані в 52,6 % пацієнтів із гіпоксемічною дихальною недостатністю при надходженні на лікування. У пацієнтів із тяжким нутритивним дефіцитом співвідношення транстиретину до С-реактивного протеїну було зниженим упродовж усього дослідження. Рівень 28-денної летальності в пацієнтів без гострих нутритивних порушень становив 11,1 %, у пацієнтів із гострим тяжким нутритивним дефіцитом — 42,9 % (p = 0,18).
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Wenji Wang, Yu Pan, Xiao Tang, Guihua Hao, Yingxin Xie, Shuai Ma, et al. Serum prealbumin and its changes over time are associated with mortality in acute kidney injury. Sci. Rep. 2017. 7. 41493. DOI: 10.1038/srep41493.
2. Schepens T., Dianti J. Diaphragm protection: what should we target? Curr. Opin. Crit. Care. 2019. 25:000-000. DOI: 10.1097/MCC.0000000000000683.
3. Tsegaye B., Mekasha A., Genet S. Serum Transthyretin Level as a Plausible Marker for Diagnosis of Child Acute Malnutrition. Biochemistry Research International. 2017. Article ID 9196538. 6 p. https://doi.org/10.1155/2017/9196538.
4. Bharadwaj S., Ginoya S., Tandon P., Gohel T.D., Guirguis J., Vallabh H. et al. Malnutrition: laboratory markers vs nutritional assessment. Gastroenterology Report. 2016. 4(4). Р. 272-280. doi: 10.1093/gastro/gow013.
5. Keller U. Nutritional Laboratory Markers in Malnutrition. J. Clin. Med. 2019. 8(6). 775. https://doi.org/10.3390/jcm8060775.
6. Verhulst S., Haan J., Toussaint M. Influence of Body Mass Index and Prealbumin Levels on Lung Function in Patients with Spinal Muscular Atrophy: A Pilot Study. J. Clin. Neuromuscul. Dis. 2019. 20(3). Р. 137-138. doi: 10.1097/CND.0000000000000225.
7. Chourdakis M., Hecht C., Gerasimidis K., Joosten F.M.K., Karagiozoglou-Lampoudi T., Koetse A.H., Ksiazyk J., Lazea C., Shamir R., Szajewska H., Kolezko B., Hulst M.J. Malnutrition risk in hospitalized children: use of 3 screening tools in a large European population. The American Journal of Clinical Nutrition. 2016. 103(5). Р. 1301-1310. https://doi.org/10.3945/ajcn.115.110700.
8. Moti J.K. Sensitive measures of nutritional status in children in hospital and in the field. International Journal of Cancer. 1999. 78(S11). https://doi.org/10.1002/(SICI)1097-0215(1998)78:11+<2::AID-IJC3>3.0.CO;2-I.
9. Mette M.B., Claude P. Feeding should be individualized in the critically ill patients. Current Opinion in Critical Care. 2019. 25(4). Р. 307-313. doi: 10.1097/MCC.0000000000000625.
10. Delliere S., Cynober L. Is transthyretin a good marker of nutritional status? Clin. Nutr. 2017. 36(2). Р. 364-370. doi: 10.1016/j.clnu.2016.06.004.
11. Dellière S., Neveux N., De Bandt J.-P., Cynober L. Transthyretin for the routine assessment of malnutrition: A clinical dilemma highlighted by an international survey of experts in the field. Clin. Nutr. 2018. 37(6 Pt A). Р. 2226-2229. doi: 10.1016/j.clnu.2018.09.021. Epub 2018, Sep 25.
12. Ingenbleek Y. Transthyretin as A Biomarker of Sarcopenia in Elderly Subjects. Nutrients. 2019. 11(4). Р. 895. doi: 10.3390/nu11040895.
13. Keller U. Nutritional Laboratory Markers in Malnutrition. J. Clin. Med. 2019. 8(6). Р. 775. Published 2019, May 31. doi:10.3390/jcm8060775.
14. Becker P., Carney L.N., Corkins M.R., Monczka J., Smith E., Smith S.E., Spear B.A., White J.V. Academy of Nutrition and Dietetics; American Society for Parenteral and Enteral Nutrition. Consensus statement of the Academy of Nutrition and Dietetics/American Society for Parenteral and Enteral Nutrition: indicators recommended for the identification and documentation of pediatric malnutrition (undernutrition). Nutr. Clin. Pract. 2015 Feb. 30(1). Р. 147-61. doi: 10.1177/0884533614557642. Epub 2014, Nov 24.
15. Spiekerman A. Nutritional assessment (protein Nutriture). Anal. Chem. 1995. 67. Р. 429-436. doi: 10.1021/ac00108a026.
/89_3.jpg)
/89_2.jpg)
/90.jpg)

/89.jpg)
/88.jpg)