Международный неврологический журнал Том 16, №1, 2020
Вернуться к номеру
Терморегуляторные эффекты производных трийодтиронина: in vivo исследование и обзор потенциальных нейропротекторных свойств
Авторы: Филимонов Д.А.(1), Трубникова Н.Н.(1), Белоцерковская М.А.(1), Федорова А.А.(1), Ересько А.Б.(2), Марусиченко В.В.(1)
(1) — ГУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака», г. Киев, Украина
(2) — ГУ «Институт физико-органической химии и углехимии им. Л.М. Литвиненко», г. Киев, Украина
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
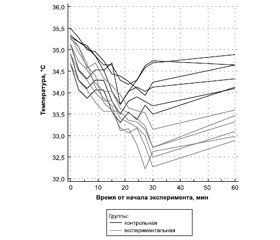
Актуальність. Згідно з результатами численних клініко-експериментальних досліджень, транзиторна гіпотермія є перспективним способом нейропротекції при ішемічному інсульті. Проте сучасні засоби індукції гіпотермії (як фізичні, так і фармакологічні) мають численні васкулярні, метаболічні та ендокринні побічні ефекти. Останнім часом все більше уваги приділяють новітнім індукторам гіпотермії, до яких належать похідні тиреоїдних гормонів. Мета дослідження: дослідити вплив синтетичного аналога тиронаміну Т(0)AM на змінення ректальної температури у білих лабораторних щурів із застосуванням інгаляційного наркозу. Матеріали та методи. Дослідження було проведене на 12 білих безпородних лабораторних щурах, поділених на експериментальну та конт-рольну групи. Щурам контрольної групи вводили інтраперітонеально 2 мл води для ін’єкцій, щурам експериментальної групи — синтетичний аналог Т(0)АМ в концентрації 50 мг/кг, розчинений в 2 мл води для ін’єкцій. У тварин обох груп під галотановим інгаляційним наркозом вимірювали ректальну температуру впродовж 30 хвилин з інтервалом в 3 хвилини. Також одноразово вимірювали температуру через 60 хвилин після введення препарату у щурів, які прокинулись. Статистичну обробку даних проводили з використанням програм Microsoft Office Excel 2007 и MedCalc 14.1. Для порівняння відмінностей між групами застосували t-тест для незалежних вибірок і тест ANOVA. Для порівняння температурних даних до та після введення синтетичного аналога тиронаміну застосували W-критерій Вілкоксона. Результати. Під час експериментального дослідження нами описаний кріогенний вплив синтетичного аналога T(0)AM. Показано, що інтраперитонеальне введення 50 мг/кг препарату лабораторним щурам спричиняє швидке оборотне зниження температури тіла в середньому на 2,5 °С (95% довірчий інтервал 2,2–2,8 °С). Продемонстровано незалежний від іншого індуктора гіпотермії (галотану) вплив синтетичного аналога тиронаміну. В огляді літератури з акцентом на нейропротекцію зроблена спроба ідентифікувати механізми гіпотермічної дії тиронаміну та обґрунтувати вибір напрямків для подальших клініко-експериментальних досліджень. Висновки. Дані, що отримані в результаті експерименту, підтверджують вплив синтетичного аналога тиронаміну Т(0)AM на процеси термогенезу, при цьому гіпотермічний ефект не пов`язаний з впливом інгаляційного наркозу. Патерн зниження температури тіла з одночасним введенням синтетичного аналога тиронаміну свідчить про інший, ніж у галотану, механізм дії.
Актуальность. Согласно результатам многочисленных клинико-экспериментальных исследований, транзиторная гипотермия представляет собой перспективный способ нейропротекции при ишемическом инсульте. Однако существующие способы индукции гипотермии (как физические, так и фармакологические) обладают значительным количеством нежелательных васкулярных, метаболических и эндокринных побочных эффектов. В течение последних лет все больше внимания уделяется новым индукторам гипотермии, одними из которых являются производные тиреоидных гормонов. Цель исследования: изучить воздействие синтетического аналога тиронамина Т(0)AM на изменение ректальной температуры у белых лабораторных крыс с применением ингаляционного наркоза. Материалы и методы. Исследование было выполнено на 12 белых беспородных лабораторных крысах, разделенных на экспериментальную и контрольную группы. Крысам контрольной группы вводили интраперитонеально 2 мл воды для инъекций, крысам экспериментальной группы — синтетический аналог Т(0)АМ в концентрации 50 мг/кг, растворенный в 2 мл воды для инъекций. У животных всех групп под галотановым ингаляционным наркозом измеряли ректальную температуру в течение 30 минут с интервалом в 3 минуты. Также однократно измеряли температуры через 60 минут после введения препарата у проснувшихся крыс. Статистическую обработку полученных данных проводили с помощью программ Microsoft Office Excel 2007 и MedCalc 14.1. Для сравнения различий между группами использовали t-тест для независимых выборок и тест ANOVA. Для сравнения температурных данных до и после введения синтетического аналога тиронамина использовали W-критерий Уилкоксона. Результаты. В ходе экспериментального исследования нами описано криогенное действие синтетического аналога дейодированной формы тиронамина T(0)AM. Показано, что внутрибрюшинное введение 50 мг/кг препарата лабораторным крысам приводит к быстрому обратимому снижению температуры тела в среднем на 2,5 °С (95% доверительный интервал 2,2–2,8 °С). Продемонстрировано независимое от другого индуктора гипотермии (галотана) действие синтетического аналога тиронамина. В обзоре литературы с акцентом на нейропротекцию предпринята попытка идентифицировать механизмы гипотермического действия тиронамина и обосновать выбор направлений для дальнейших клинико-экспериментальных исследований. Выводы. Полученные в ходе исследования данные подтверждают влияние синтетического аналога тиронамина Т(0)AM на процессы термогенеза, при этом гипотермические эффекты тиронамина не связаны с действием ингаляционного наркоза. Паттерн снижения температуры тела на фоне введения синтетического аналога тиронамина свидетельствует об отличном от галотана механизме действия.
Background. According to the results of several clinical and experimental studies, transient hypothermia is a promising neuroprotection method for ischemic stroke. However, existing methods for inducing hypothermia (both physical and pharmacological) have a significant amount of undesirable vascular, metabolic and endocrine side-effects. In recent years, more and more attention has been paid to new hypothermia inducers, some of which are derivatives of thyroid hormones. The study aimed to investigate the effect of the synthetic analogue of thyronamine T(0)AM on the change in rectal temperature in white laboratory rats using inhaled anaesthesia. Materials and methods. The study was performed on 12 white out-breed laboratory rats, divided into experimental and control groups. Animals of the control group were injected intraperitoneally with 2 ml of water for injection, animals of the experimental group were injected with a synthetic analogue of T(0)AM at a concentration of 50 mg/kg dissolved in 2 ml of water for injection. Then, in animals of all groups, rectal temperature was measured for 30 minutes under halothane inhaled anaesthesia with an interval of 3 minutes. Also, the temperature was measured once after 60 minutes after administration of the drug in awakened rats. Statistical processing of the obtained data was performed using Microsoft Office Excel 2007 and MedCalc 14.1. To compare differences between the groups, the t-test for independent samples and the ANOVA test were used. The Wilcoxon test was used to compare temperature data before and after administration of the synthetic thyronamine analogue. Results. Cryogenic effect of a synthetic analogue of the thyronamine deiodinated form T(0)AM was described. It was shown that intraperitoneal administration of 50 mg/kg T(0)AM analogue to laboratory rats led to a rapid reversible decrease in body temperature by an average of 2.5 °C (95% CI 2.2–2.8° C). The action of a synthetic analogue of thyronamine, independent of another hypothermia inducer (halothane), has been demonstrated. In a literature review focused on neuroprotection, an attempt was made to identify the mechanisms of hypothermic action of thyronamine and to substantiate the choice of directions for further clinical and experimental studies. Conclusions. The data obtained confirm the influence of the thyronamine T(0)AM synthetic analogue on the processes of thermogenesis, while the observed hypothermic effects of thyronamine could not be explained by the action of inhaled anaesthesia. The pattern of body temperature lowering in the experimental group indicates a different from halothane cryogenic action of thyronamine derivates.
тиронамін; T(0)AM; гіпотермія; експериментальне дослідження; нейропротекція
тиронамин; T(0)AM; гипотермия; экспериментальное исследование; нейропротекция
thyronamine; T(0)AM; hypothermia; experimental research; neuroprotection
Введение
Материалы и методы
Результаты
/92.jpg)
Обсуждение
Выводы
1. Bernard S. Hypothermia after cardiac arrest: expanding the therapeutic scope. Crit. Care Med. 2009. Vol. 37. № 7. Р. 227-33.
2. Hypothermia after Cardiac Arrest Study G. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N. Engl. J. Med. 2002. Vol. 346. № 8. P. 549-556.
3. Зозуля Ю.П. та ін. Сучасні принципи діагностики та лікування хворих із гострими порушеннями мозкового кровообігу. Методичні рекомендації. К., 2005. 66 c.
4. Linares G., Mayer S.A. Hypothermia for the treatment of ische-mic and hemorrhagic stroke. Crit. Care Med. 2009. № 37(7 Suppl.). S243-9. doi: 10.1097/CCM.0b013e3181aa5de1.
5. Зозуля І.С., Мошенська О.П. Гострий період ішемічного інсульту: сучасний погляд на проблему. Укр. мед. часопис. 2009. № 76(4). C. 67-32.
6. Мищенко Т.С. и др. Новые мишени терапевтического воздействия у пациентов с хронической ишемией головного мозга. Международный неврологический журнал. 2011. № 40(2). C. 7-17.
7. Hemmen T.M. et al. Intravenous Thrombolysis Plus Hypothermia for Acute Treatment of Ischemic Stroke (ICTuS-L): Final results. Stroke. 2010. № 41(10). Р. 2265-70. doi: 10.1161/STROKEAHA.110.592295. Epub 2010 Aug 19.
8. Kollmar R. et al. Cooling in intracerebral hemorrhage (CINCH) trial: Protocol of a randomized German-Austrian clinical trial. Int. J. Stroke. 2012. № 7(2). Р. 168-72. doi: 10.1111/j.1747-4949.2011.00707.x.
9. Piironen K. et al. Mild hypothermia after intravenous thrombo-lysis in patients with acute stroke: A randomized controlled trial. Stroke. 2014. № 45(2). Р. 486-91. doi: 10.1161/STROKEAHA.113.003180. Epub 2014 Jan 16.
10. Van Der Worp H.B. et al. Hypothermia in animal models of acute ischaemic stroke: A systematic review and meta-analysis. Brain. 2007. № 130(Pt. 12). Р. 3063-74. Epub 2007 May 3.
11. Wu T.C., Grotta J.C. Hypothermia for acute ischaemic stroke. The Lancet Neurology. 2013. № 12(3). Р. 275-84. doi: 10.1016/S1474-4422(13)70013-9.
12. Bardutzky J., Schwab S. Antiedema therapy in ischemic stroke. Stroke. 2007. Vol. 38. № 11. P. 3084-3094.
13. Kuramatsu J.B. et al. Is Hypothermia Helpful in Severe Subarachnoid Hemorrhage? An Exploratory Study on Macro Vascular Spasm, Delayed Cerebral Infarction and Functional Outcome after Prolonged Hypothermia. Cerebrovasc. Dis. 2015. № 40(5–6). Р. 228-35. doi: 10.1159/000439178. Epub 2015 Oct 21.
14. Piehl S. et al. Thyronamines-past, present, and future. Endocr. Rev. 2011. Vol. 32. № 1. P. 64-80.
15. Chiellini G. et al. Design, Synthesis, and Evaluation of Thyronamine Analogues as Novel Potent Mouse Trace Amine Associated Receptor 1 (m TAAR1) Agonists. J. Med. Chem. 2015. Vol. 58. № 12. P. 5096-5107.
16. Khajavi N. et al. Thyronamine induces TRPM8 channel activation in human conjunctival epithelial cells. Cell. Signal. 2015. Vol. 27. № 2. P. 315-325.
17. Harder L. et al. In vivo Effects of Repeated Thyronamine Administration in Male C57BL/6J Mice. Eur. Thyroid J. 2018. Vol. 7. № 1. P. 3-12.
18. Klieverik L.P. et al. Central effects of thyronamines on glucose metabolism in rats. J. Endocrinol. 2009. № 201(3). Р. 377-86. doi: 10.1677/JOE-09-0043. Epub 2009 Mar 9.
19. Chiellini G. et al. Thyronamines and Analogues — The Route from Rediscovery to Translational Research on Thyronergic Amines. Mol. Cell. Endocrinol. 2017. № 15. Р. 149-155. doi: 10.1016/j.mce.2017.01.002. Epub 2017 Jan 6.
20. Kinne A. et al. Essential molecular determinants for thyroid hormone transport and first structural implications for monocarboxy-late transporter 8. J. Biol. Chem. 2010. Vol. 285. № 36. P. 28054-28063.
21. Scanlan T.S. et al. 3-Iodothyronamine is an endogenous and rapid-acting derivative of thyroid hormone. Nat. Med. 2004. № 10(6). Р. 638-42. Epub 2004 May 16.
22. Venditti P. et al. Effects of the thyroid hormone derivatives 3-iodothyronamine and thyronamine on rat liver oxidative capaci-ty. Mol. Cell. Endocrinol. 2011. № 341(1–2). Р. 55. ff10.1016/j.mce.2011.05.013ff. ffhal-00719874f.
23. Köhrle J. Thyroid Hormones and Derivatives: Endogenous Thyroid Hormones and Their Targets. Methods in molecular biology (Clifton, N.J.). 2018. Vol. 1801. P. 85-104.
24. Doyle K.P. et al. Novel Thyroxine Derivatives, Thyronamine and 3-iodothyronamine, Induce Transient Hypothermia and Marked Neuroprotection Against Stroke Injury. Stroke. 2007. № 38. P. 2569-2576.
25. Zucchi R., Accorroni A., Chiellini G. Update on 3-iodothyronamine and its neurological and metabolic actions. Frontiers in Physio-logy. 2014. № 5. Р. 402. doi: 10.3389/fphys.2014.00402.
26. Sabatini M. et al. 3-iodothyronamine (T1AM) and synthetic thyronamine-like analogs SG-1 and SG-2 induce autophagy in human glioblastoma cells (U-87MG). Eur. Thyroid J. 2016. Vol. 5. P. 120.
27. Braulke L.J. et al. 3-Iodothyronamine: a novel hormone controlling the balance between glucose and lipid utilisation. J. Comp. Physiol. B. 2008. Vol. 178. № 2. P. 167-177.
28. Kinne A. et al. Essential molecular determinants for thyroid hormone transport and first structural implications for monocarboxylate transporter 8. J. Biol. Chem. American Society for Biochemistry and Molecular Biology Inc., 2010. Vol. 285. № 36. P. 28054-28063.
29. Lin H.-Y. et al. Molecular Basis for Certain Neuroprotective Effects of Thyroid Hormone. Front. Mol. Neurosci. Frontiers. 2011. Vol. 4. P. 29.
30. Dratman M.B. On the mechanism of action of thyroxin, an amino acid analog of tyrosine. J. Theor. Biol. 1974. Vol. 46. № 1. P. 255-270.
31. Dicker A. et al. Halothane selectively inhibits nonshivering thermogenesis: Possible implications for thermoregulation during anesthesia of infants. Anesthesiology. 1995. Vol. 82. P. 491-501.
32. Cichero E., Tonelli M. New insights into the structure of the trace amine-associated receptor 2: Homology modelling studies explo-ring the binding mode of 3-iodothyronamine. Chem. Biol. Drug Des. 2017. Vol. 89. № 5. P. 790-796.