Классификация васкулитов с поражением центральной нервной системы
Распространенность аутоиммунных заболеваний и заболеваемость ими за последние 20 лет неуклонно возрастает, их доля в общей популяции населения достигает 8 %. Васкулиты являются обширной группой клинически неоднородных заболеваний с преимущественно аутоиммунным механизмом поражения сосудов, главным образом артерий. В 2012 году на 2-й Международной согласительной конференции была пересмотрена существовавшая на тот момент номенклатура васкулитов [1]. Предложено классифицировать васкулиты по размеру вовлеченных сосудов и типу основного патогенетического механизма их повреждения, изменены названия и определения некоторых васкулитов, добавлены новые важные классы васкулитов. В новой версии Международной классификации болезней (МКБ-11), которая вступит в силу 1 января 2022 г., васкулиты отнесены в блок 4А44 «Васкулиты» (Vasculitis) главы 4 «Заболевания иммунной системы» (Diseases of the immune system) [2].
Поражение центральной нервной системы (ЦНС) при васкулитах связано не только с развитием первичного изолированного васкулита (ангиита) ЦНС, но может быть также единственным проявлением или составляющей частью (облигатной или факультативной) клинической картины системного васкулита либо протекать как вторичный васкулит ЦНС, изолированный или ассоциированный с системным заболеванием соединительной ткани. При этом также существует градация в зависимости от размера вовлеченных сосудов и гистологических изменений. При первичном васкулите ЦНС наиболее часто отмечается гранулематозный ангиит — 56–58 % случаев, лимфоцитарный составляет 20–28 % (чаще у детей), некротизирующий наблюдается у 14–22 % пациентов [3, 4].
Классификация васкулитов ЦНС [1, 4–6]
I. По этиологии:
1. Первичный (идиопатический, изолированный) васкулит (ангиит) ЦНС:
— детский первичный ангиит ЦНС.
2. Вторичный изолированный васкулит ЦНС:
— инфекционный с системными или органоспецифическими проявлениями соответствующей инфекции (преимущественно не васкулита) — туберкулез, сифилис, боррелиоз, токсоплазмоз, цистицеркоз, ВИЧ, грибковая инфекция;
— вирус-индуцированный (без системных клинических проявлений соответствующей инфекции) — HSV, CMV, VZV, EBV, HHV6, гепатиты В, С;
— паранеопластический васкулит;
— лекарственный/токсический васкулит ЦНС (антибиотики, цитостатики, эфедрин, амфетамин, кокаин, героин);
— радиационно-индуцированный васкулит ЦНС;
— васкулит ЦНС, индуцированный другими воспалительными заболеваниями.
3. Вторичный васкулит ЦНС в рамках системного васкулита:
— как изолированное проявление системного васкулита;
— как составляющая часть системного васкулита.
4. Вторичный васкулит ЦНС при системных заболеваниях соединительной ткани.
II. По типу пораженных сосудов:
— васкулит ЦНС с поражением крупных сосудов (ангиографически позитивный);
— васкулит ЦНС с поражением средних сосудов;
— васкулит ЦНС с поражением мелких сосудов (ангиографически негативный).
III. По типу гистологических изменений:
— гранулематозный васкулит ЦНС;
— лимфоцитарный васкулит ЦНС;
— некротизирующий васкулит ЦНС.
По МКБ-11 диагноз «первичный васкулит (ангиит/артериит) ЦНС» может кодироваться по двум главам: глава 4 «Заболевания иммунной системы» (блок 4А44 «Васкулиты», код 4A44.7 Primary angiitis of the central nervous system) и глава 8 «Заболевания нервной системы» (раздел «Цереброваскулярные заболевания», код 8B22.70 Primary cerebral arteritis). В МКБ-10 данный термин отсутствует, возможно кодирование в виде I67.7 «Церебральный артериит, не классифицированный в других рубриках».
В целом васкулиты с поражением ЦНС считаются редкими патологическими состояниями, однако не исключено, что это связано с трудностью их диагностики, а не с реальной распространенностью. Первичный васкулит ЦНС все чаще диагностируется в различных возрастных группах и считается в настоящее время одним из наиболее распространенных воспалительных заболеваний головного мозга в детской популяции. В то же время вторичные васкулиты ЦНС встречаются заметно чаще первичного [7].
Этиология и патогенез васкулитов
В этиологии васкулитов, в том числе с поражением ЦНС, выделяют влияние инфекционных агентов (вирусных и бактериальных), генетических факторов и гиперчувствительности к некоторым лекарственным средствам и компонентам табака. Иммунопатогенетические механизмы связаны с образованием под влиянием этиологических факторов циркулирующих иммунных комплексов, органоспецифических, антиэндотелиальных и антинейтрофильных цитоплазматических (ANCA) антител [8].
Фиксирующиеся на сосудистой стенке циркулирующие иммунные комплексы посредством активации системы комплемента и фагоцитоза, а образовавшиеся антитела — вследствие реакции с ферментами цитоплазмы нейтрофилов и эндотелиальных клеток обусловливают повреждение сосудистой стенки, отек эндотелиальных клеток, гиперплазию и лимфоцитарную инфильтрацию с развитием лимфоцитарного или некротизирующего васкулита. Нарушение клеточного иммунного ответа, развитие гиперчувствительности замедленного типа и миграция эффекторных Т-лимфоцитов в органы-мишени приводит к развитию гранулематозного воспаления, также способствующего некротизирующему васкулиту. Показано, что имеется определенная тропность разных инфекционных агентов к различным участкам сосудистой системы [3].
Повреждение эндотелия приводит к появлению молекул адгезии, которые вызывают прилипание нейтрофилов и лимфоцитов к эндотелию и способствуют проникновению их в ткани. Образующиеся антитела к фосфолипидам перекрестно реагируют с эндотелиальными белками (тромбомодулин и белки С и S), что способствует повышению коагулирующих свойств крови. Продуцирование эндотелием и тромбоцитами провоспалительных цитокинов способствует усилению иммуновоспалительного процесса в сосудистой стенке [9].
Прогрессирующее утолщение стенки артерии в месте воспаления, пролиферация интимы и последующий фиброз являются причиной развития сужения, а затем и окклюзии сосуда. Клиническими последствиями развития васкулитов являются морфологические и функциональные нарушения органов, кровоснабжаемых этими сосудами. Разрушение сосудистой стенки обусловливает развитие кровоизлияний в окружающие ткани. Недавно показана возможность участия нейродегенеративных механизмов в патогенезе первичного васкулита ЦНС [10].
Клинические проявления поражения ЦНС при васкулитах
Подозрение на развитие первичного васкулита ЦНС должно возникать в случае выявления типичных для церебрального васкулита изменений при визуализации сосудистой системы головного мозга у пациента с необъяснимым неврологическим дефицитом, при отсутствии доказательств инфекционных причин клинической симптоматики, напоминающей хронический менингит, и при развитии более чем одного инсульта в различные сроки и в разных сосудистых территориях [6].
Клиническая синдромология васкулитов ЦНС обусловлена развитием различной степени стеноза или окклюзией пораженных артерий головного или спинного мозга и менингеальных оболочек, сегментарной дилатацией сосудов, утолщением и уплотнением сосудистой стенки, формированием аневризм с последующим их разрывом и изменениями свертывающей системы крови.
Синдромы поражения мозговой паренхимы, оболочек и сосудов при васкулитах ЦНС:
— инфаркты в глубоком или подкорковом белом и сером веществе — при вовлечении небольших перфорирующих артерий;
— инфаркты как в коре, так и в белом веществе — при окклюзии более крупных артерий;
— внутримозговая гематома;
— микрокровоизлияния;
— субарахноидальное кровоизлияние;
— гипертрофический пахименингит.
Критериями диагностики первичного васкулита ЦНС принято считать наличие недавно возникших неврологических или психических нарушений, которые невозможно объяснить другой патологией ЦНС или системным процессом, и подтверждающих данных рентгеновской ангиографии и исследования ликвора. Нейровизуализация также необходима в диагностике васкулитов ЦНС, при этом магнитно-резонансная томография (МРТ) и ангиография (МРА) являются более чувствительными для выявления сосудистых изменений по сравнению с компьютерной томографией (КТ), а КТ-ангиография — по сравнению с МРА. Наиболее чувствительный метод — рентгеновская ангиография, в особенности цифровая субтракционная ангиография (digital subtraction angiography, DSA) [11]. В то же время единственным критерием перехода категории диагноза из вероятного в определенный является выявление гистологических признаков васкулита в ЦНС при биопсийном исследовании.
Симптоматика первичного васкулита ЦНС разнообразна и неспецифична — классические или патогномоничные клинические симптомы отсутствуют. Основные клинические проявления представлены подостро возникающими и постепенно прогрессирующими головной болью и синдромом энцефалопатии (табл. 1). Раньше развиваются когнитивные расстройства, нарастающие достаточно быстро (в течение месяцев или даже недель), позже появляются и очаговые симптомы. У большинства пациентов отмечается несколько симптомов/синдромов. Более выраженные когнитивные нарушения, нарушения сознания, судорожный синдром, дискинезии, изменения в ликворе и диффузные накапливающие контраст МРТ-очаги характерны для изолированного васкулита ЦНС с вовлечением мелких сосудов (при меньшей частоте очаговой неврологической симптоматики) [4, 12]. При отсутствии лечения состояние может прогрессирующе ухудшаться вплоть до коматозного.
/148.jpg)
Клинически выделяют несколько форм (подтипов) первичного васкулита ЦНС [9, 13]. Возможны любые комбинации клинических и диагностических проявлений, создающие перекрытие указанных форм. При этом наиболее часто наблюдается геморрагическая форма (около 11–12 % случаев, чаще страдают женщины), связанная с развитием некротизирующего васкулита и хорошо отвечающая на иммуносупрессивное лечение, а наиболее тяжелой является быстро прогрессирующая — с двусторонним множественным поражением сосудов с развитием инфарктов мозга, агрессивным течением, меньшей восприимчивостью к лечению и высоким риском летального исхода. Гораздо реже клиническая манифестация может проявляться поражением спинного мозга с развитием парапареза или тетрапареза. Возможно чередование эпизодов инфаркта и кровоизлияния у одного и того же пациента в разные периоды времени [7, 14, 15].
Клинические формы (подтипы) первичного васкулита ЦНС [9, 13]:
— ангиографически негативная, биопсийно-позитивная;
— амилоид-β-связанный церебральный ангиит (amyloid-β-related cerebral angiitis, ABRA);
— с менингеальным усилением МР-сигнала;
— с вовлечением спинного мозга;
— геморрагическая (с внутричерепным или субарахноидальным кровоизлиянием);
— быстро прогрессирующая.
При амилоид-β-связанном церебральном ангиите выявляется гранулематозный васкулит с отложениями β-амилоида в стенках сосудов. Эти пациенты более старшего возраста, среди них преобладают мужчины. Для этого подтипа характерны более острое начало, наличие когнитивного ухудшения и накапливающие контраст менингеальные очаги на МРТ.
Для изолированного церебрального васкулита с поражением крупных или средних сосудов характерно развитие очагового неврологического дефицита с признаками острой ишемии на МРТ. При этом инфаркты часто бывают множественными, двусторонними, различного размера, охватывающими разные сосудистые территории с вовлечением корковых, подкорковых и лептоменингеальных зон и имеющими разные стадии своего развития [6].
Первичный васкулит ЦНС с поражением мелких сосудов (ангиографический негативный, биопсийно-позитивный подтип) отличается более тяжелой энцефалопатией с когнитивными расстройствами, нарушениями внимания и судорожным синдромом в сочетании с более частыми рецидивами, более выраженными изменениями ликвора и диффузными, накапливающими контраст очагами повреждения на МРТ головного мозга [12].
Некоторые исследователи выделяют также псевдотуморозную (около 15 % случаев) и детскую формы. Псевдотуморозная форма чаще наблюдается у лиц мужского пола (р = 0,04), характеризуется склонностью к эпилептическим припадкам (р = 0,022), накоплением контраста в очагах поражения (р = 0,007), амилоидной ангиопатией (р = 0,046) и связана с развитием гранулематозного васкулита при меньшей вероятности транзиторных ишемических атак (р = 0,023), двусторонних церебральных инфарктов (р = 0,018), ангиографических признаков васкулита (р = 0,045) и головной боли (р = 0,046) [16].
Для первичного васкулита ЦНС детского возраста характерно превалирование эпилептических припадков, которые при ангиографически негативной форме наблюдались в 50–100 % случаев (у взрослых — 7 %), при ангиографически позитивной форме — у 20 % пациентов. Прогрессирующее течение сочеталось с большей частотой головной боли, эпилептических припадков, очагового неврологического дефицита в виде острого гемипареза и диффузного — в виде затруднения концентрации внимания, когнитивной дисфункции, изменений настроения и личности [7, 9].
Повышение температуры тела, снижение массы тела, ночная потливость, миалгии и артралгии могут быть проявлением системного васкулита, при котором возможно вовлечение ЦНС как составляющей части общего процесса, однако развивается оно, как правило, позже. В то же время изолированное поражение ЦНС может выступать в качестве ограниченного проявления системного васкулита, если клинические, лабораторные и патоморфологические данные позволяют отличить его от первичного васкулита ЦНС. При этом системные проявления васкулита не обязательно могут развиться в последующем [1].
Параклинические методы подтверждения диагноза первичного васкулита ЦНС
Исследование сосудов при помощи различных методик ангиографии выявляет распространенные, двусторонние или чередующиеся участки сегментарного сужения, расширения или окклюзии во множестве мозговых артерий без изменения проксимальных сосудов атеросклеротическим процессом или другими причинами. При этом такие изменения обнаруживаются главным образом при поражении крупных сосудов (ангиографически позитивный васкулит ЦНС), что проявляется чаще всего головной болью, краниальными нейропатиями или развитием инсультов с двигательными расстройствами или с другой очаговой симптоматикой. Поражение мелких сосудов не проявляется изменениями при ангиографии (ангиографически негативный васкулит ЦНС) и может быть подтверждено только гистологическим исследованием. Клинически такой вариант чаще может быть представлен судорожным синдромом, синдромом энцефалопатии с глобальным неврологическим дефицитом и с изменением когнитивных функций, поведения и настроения [17].
Чередование участков сужения и расширения сосудов при васкулите ЦНС из-за характерного вида получило образное название «четки», «бисер», в отличие от интракраниального атеросклероза, при котором в точках ветвления артерий хорошо определяются множественные короткие повреждения («крысиные укусы») с постстенотическими расширениями. При васкулите, кроме этого, сужение сосуда является более плавным, длительным и не связано с точками ветвления артерий, а расширение артерий имеет веретенообразную форму; также характерно вовлечение венозных сосудов. В то же время эти признаки не являются специфичными именно для первичного васкулита ЦНС и могут обнаруживаться при вторичных васкулитах ЦНС или при синдроме обратимой церебральной вазоконстрикции. Характерными, но также не специфичными считаются развитие коллатерального кровообращения и замедление времени накопления и вымывания контрастного вещества [11].
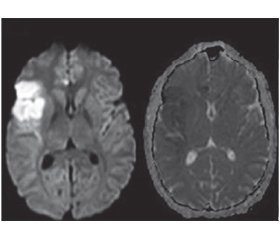
Нейровизуализация обнаруживает множественные радиологические повреждения в различных сосудистых зонах, которые могут быть как ишемическими, так и геморрагическими. В типичных случаях эти очаги являются мультифокальными, двусторонними, с вовлечением корковых и подкорковых структур и глубокого серого и белого вещества (рис. 1). Характерно наличие как новых, так и старых очагов повреждения мозговой ткани. Накопление контрастного вещества наблюдается в паренхиматозных и лептоменингеальных очагах, а также в утолщенной стенке сосудов. Гиперинтенсивность белого вещества часто выявляется при первичном васкулите ЦНС, однако не считается специфичной для его диагностики [6].
/150.jpg)
При первичном васкулите ЦНС у детей радиологические очаги повреждения чаще односторонние, проксимальные, мультифокальные и супратенториальные. Выявляется устойчивая тенденция к центральным поражениям, вовлекающим базальные ганглии или латеральную лентикулостриарную сосудистую территорию. При этом наиболее распространенная МР-ангиографическая находка — вовлечение конечного сегмента внутренней сонной артерии и проксимальных сегментов передней и средней мозговых артерий [15].
В то же время рутинные режимы КТ и МРТ, позитронно-эмиссионной томографии (ПЭТ), однофотонной эмиссионной КТ (ОФЭКТ) имеют низкую чувствительность и специфичность, не позволяя визуализировать стенки сосудов, что привело к внедрению в диагностический процесс при васкулитах ЦНС импульсных последовательностей МРТ и МРА высокого разрешения (3 Т и более, позволяющие обнаружить более дистальные поражения сосудов), в том числе постконтрастных, SWAN-режима и МР-перфузии. Это повысило чувствительность МРТ практически до 100 % (рис. 2, 3). При этом показано, что при атеросклеротическом процессе, как и при диссекции внутричерепных сосудов, утолщение стенки сосуда эксцентрическое и неровное, а при васкулите — гладкое концентрическое, диффузно накапливающее контраст. Накопление контраста при атеросклеротическом поражении коррелирует со степенью нестабильности бляшки. Вместе с тем в настоящее время не определены характерные МРТ-изменения, которые позволяют однозначно подтвердить диагноз первичного васкулита ЦНС с поражением мелких сосудов или исключить его и маскирующие заболевания [6, 18–20].
/151.jpg)
При биопсии мозговой и оболочечной ткани (церебральная и менингеальная биопсия) обнаруживаются явления трансмурального сосудистого воспаления, вовлекающего лептоменингеальные или паренхиматозные сосуды. Выявляются лимфоцитарная воспалительная реакция с различным числом плазматических клеток, гистиоцитов, нейтрофилов и эозинофилов, фибриноидный некроз сосудистой стенки, отложения амилоида в стенках сосудов и участки ишемии. Почти в половине случаев наблюдаются явления гранулематозного васкулита, в четверти — некротизирующего. Гистологическое исследование имеет важное значение для проведения дифференциальной диагностики (в том числе с вторичными васкулитами ЦНС при инфекционных поражениях сосудов или злокачественных заболеваниях), и ее отрицательный результат может привести к альтернативному диагнозу. Выявленные при биопсии характерные для васкулита изменения являются основным критерием перевода диагноза из категории вероятного в категорию определенного [21]. Обычно биопсия проводится в правой (недоминантной) лобной доле с захватом лептоменингеальной ткани. При этом само биопсийное исследование имеет около 1 % риска развития неврологического дефицита [11].
При первичном васкулите ЦНС гематологические исследования неспецифичны, а серологические тесты, специфические для системных инфекций и васкулитов, часто оказываются отрицательными. Возможно повышение титров антиэндотелиальных антител к эндотелию крупных (HUVEC) или мелких (RATEC) сосудов в сыворотке крови [5]. При анализе ликвора диагностически наиболее информативно выявление следующей триады: лимфоцитарный плеоцитоз, повышенный уровень белка, наличие эритроцитов [4, 14].
Дифференциальная диагностика васкулитов с поражением ЦНС
Круг дифференцируемых заболеваний достаточно широк. Вследствие определенной редкости первичного васкулита ЦНС в первую очередь необходимо исключать заболевания с потенциальными мультифокальными церебральными тромбоэмболиями (эндокардит, фибрилляция предсердий, миксома левого предсердия, атеросклероз сонных артерий, антифосфолипидный синдром и другие гиперкоагуляционные состояния), опухоли головного мозга, демиелинизирующие заболевания, васкулопатии другой этиологии.
Состояния, которые необходимо дифференцировать с васкулитами с поражением ЦНС [6–8, 22, 23]
Состояния с изменениями при церебральной ангиографии, подозревающими первичный васкулит ЦНС:
— синдром обратимой церебральной вазоконстрикции;
— мигрень;
— ранний интракраниальный атеросклероз;
— фиброзно-мышечная дисплазия;
— болезнь или синдром мойя-мойя;
— диссекция мелких артерий;
— ангиотропные и внутрисосудистые лимфопролиферативные расстройства;
— радиационная васкулопатия.
Заболевания головного мозга с МРТ-изменениями, подозревающими первичный васкулит ЦНС:
— новообразования головного мозга:
- интраваскулярная лимфома;
- церебральный глиоматоз;
— генетически обусловленные и другие невоспалительные васкулопатии:
- амилоидная ангиопатия;
- болезнь Фабри (X-сцепленная лизосомальная болезнь накопления c врожденным дефицитом α-галактозидазы А (α-galA) — мутация гена GLA D313Y);
- церебральная аутосомная доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией — мутация гена notch 3 (CADАSIL);
- церебральная аутосомно-рецессивная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией — мутация гена HTRA1 (CARASIL);
- аутосомно-доминантная васкулопатия сетчатки с церебральной лейкодистрофией — мутация гена TREX1;
- наследственный синдром «эндотелиопатия — ретинопатия — нефропатия — инсульт» (Hereditary endotheliopathy-retinopathy-nephropathy-stroke syndrome, HERNS);
- семейная васкулопатия — мутация гена COL4A1;
- ретино-кохлео-церебральная васкулопатия (синдром Сусака);
— демиелинизирующие несосудистые аутоиммунные и воспалительные заболевания головного мозга:
- рассеянный склероз;
- острый рассеянный энцефаломиелит;
- оптикомиелит;
- прогрессирующая мультифокальная лейкоэнцефалопатия;
- энцефалит Расмуссена;
— хроническая гипертензия (микроваскулярная церебральная ишемия).
Состояния с мультифокальным церебральным тромбоэмболизмом:
— эндокардит;
— фибрилляция предсердий;
— холестериновый атероэмболизм;
— миксома левого предсердия и другие опухоли сердца.
Другие состояния:
— гипергомоцистеинемия;
— порфирия;
— тромбоцитопеническая пурпура;
— антифосфолипидный синдром;
— кожно-кишечный диссеминированный тромб-ангиит (синдром Кельмейера — Дегоса);
— митохондриальная энцефаломиопатия — синдром MELAS;
— церебральный венозный тромбоз.
Указанием на вторичный характер васкулита могут быть общая слабость, миалгии, артралгии, нейропатии, низкий уровень лейкоцитов и тромбоцитов, повышенная скорость оседания эритроцитов, положительные антинуклеарные антитела ANA, антитела к двуспиральной ДНК (anti-dsDNA), антинейтрофильные цитоплазматические антитела, ревматоидный фактор и низкий уровень комплемента (р < 0,05), а также склонность к рецидивам (р = 0,001). При этом при первичном васкулите ЦНС, в отличие от вторичного, чаще наблюдаются парезы конечностей и вовлечение черепных нервов (р < 0,05) [24].
Наибольшее значение для дифференциальной диагностики первичного васкулита ЦНС установлено для следующих признаков: более тяжелые клинические проявления (р = 0,005), эпилептические приступы (р = 0,004), позитивные данные биопсии (р = 0,004) и стандартной ангиографии (р = 0,005), накопление контраста (р = 0,000) и опухолеподобные очаги на МРТ (р = 0,008), увеличение интратекального IgG (р = 0,020), нормальные результаты дуплексного сканирования мозговых артерий (р = 0,022) и эхокардиографии (р = 0,010) [25].
Учитывая перманентное развитие представлений об иммунопатологических нарушениях, возможны ситуации с возникновением необходимости пересмотра ранее выставленного диагноза. В качестве краткого примера можно привести следующее собственное наблюдение. Больная Д., 55 лет, обратилась в 2016 г. с жалобами на онемение правой руки, периодически — области грудной клетки справа, головные боли в левой лобно-височной области, чаще утром, давящие на глаза, периодические боли в шее.
Головные боли отмечает с 16 лет, связывает с перенесенным острым респираторным заболеванием. В возрасте 22–23 лет — 2 самопроизвольных аборта в сроки 7–8 недель, в 25–27 лет — 2 беременности, завершившиеся нормальными родами. В период с 28 до 34 лет — 3 эпизода онемения правой (дважды) или левой ноги и соответствующей половины туловища до реберной дуги со слабостью в соответствующей ноге и полным самостоятельным восстановлением за 3–4 месяца, за медицинской помощью не обращалась.
В 42 года в связи с участившимися головными болями была обследована: МРТ головного мозга (двусторонние паравентрикулярные очаги, гипер-интенсивные в Т2 и FSEIR, изоинтенсивные в Т1, не противоречащие демиелинизирующему заболеванию), зрительные вызванные потенциалы (увеличение латентности на прехиазмальном уровне слева), осмотр офтальмолога (OU пресбиопия, ангиопатия сетчатки. OD макулодистрофия (вторичная?)), функциональная Rö-графия шейного отдела позвоночника (кифотический угол с центром на уровне С5–С6, дегенеративно-дистрофические изменения межпозвоночных дисков и тел позвонков, ункоартроз С4–С6, гипермобильность сегментов С2–С5 со смещением кпереди на 3 мм при сгибании), осмотр невролога (диагноз «рассеянный склероз). Несмотря на установленный диагноз потенциально тяжелого неврологического заболевания, за лечением и наблюдением по месту жительства к неврологу пациентка не обращалась ввиду функционально нетяжелого состояния.
Через 3 года были выявлены аутоиммунный тиреоидит (АИТ) и фолликулярная аденома правой доли щитовидной железы, по поводу которой пациентка была прооперирована (субтотальная резекция). Для постоянного приема был назначен эутирокс (в дальнейшем сохранялся эутиреоз, уровень антител к тиреоидной пероксидазе снизился с 20-кратного до 8–10-кратного).
Настоящие жалобы стала отмечать около 6 недель назад, связывает с физической нагрузкой. В неврологическом статусе на момент нынешнего обращения — болезненность движений глазных яблок и пальпации тригеминальных точек, повышение глубоких рефлексов с конечностей, S > D, парезов нет, умеренная неустойчивость в усложненной пробе Ромберга, гипалгезия правой руки.
Выполнена МРТ головного мозга (рис. 4): в белом веществе лобных теменных и височных долей выявлены множественные супратенториальные гиперинтенсивные в Т2 и Т2-firm очаги округлой, вытянутой и полигональной формы размерами 3–11 мм с четкими контурами, единичные — с наличием перифокальной инфильтрации, в Т1 отмечается визуализация очаговых изменений в разной стадии трансформации, без масс-эффекта; часть очагов ориентирована перпендикулярно наружным контурам боковых желудочков по типу «пальцев Доусона», накоп-ления контраста не выявлено; субарахноидальные конвекситальные пространства и борозды умеренно расширены в области лобно-теменных долей за счет диффузной биполушарной кортикальной атрофии. Заключение: МР-картина демиелинизирующего заболевания головного мозга (рассеянный склероз), стадия ремиссии.
/153.jpg)
МРТ шейного отдела позвоночника (2004, 2015, 2016): дегенеративно-дистрофические изменения межпозвоночных дисков и тел позвонков, сигналы от структур спинного мозга не изменены, неравномерное сужение просвета V1–V3 сегментов правой позвоночной артерии (ПА), извитость обеих ПА. Триплексное сканирование экстра-/интракраниальных сосудов головного мозга: гипоплазия правой ПА, выраженная извитость хода обеих ПА в позвоночном канале. Обследована ревматологом: системные заболевания исключены.
Таким образом, можно констатировать, что установленный первоначально у пациентки рассеянный склероз не проявлялся функционально тяжелой или прогрессирующей симптоматикой, тем более при отсутствии лечения, и даже выявившийся АИТ не привел к какому-либо отягощению неврологического состояния. Такая ситуация противоречит сведениям об усилении активности демиелинизирующего процесса при рассеянном склерозе в случае сочетания с аутоиммунной патологией щитовидной железы [26, 27]. В то же время на МРТ выявлены паравентрикулярные очаги, а для рассеянного склероза характерно перивентрикулярное их расположение. Не выявлено и накопление контрастного вещества, что при рассеянном склерозе, особенно нелеченом, маловероятно. Исходя из этого, ретроспективно можно предположить, что в данном случае имело место развитие вторичного церебрального васкулита на фоне активно развивавшегося и недиагностированного АИТ, и только после относительного нивелирования этого источника иммунопатологических реакций дальнейшее прогрессирование васкулита приостановилось. Принимая во внимание отсутствие инвалидизирующих симптомов, от более детального обследования пациентка отказалась.
Лечение васкулитов с поражением центральной нервной системы
Лечение собственно первичного васкулита ЦНС не стандартизировано, что связано с недостаточным для проведения проспективных и рандомизированных исследований числом наблюдений, и рекомендации основаны на ретроспективных исследованиях и экспертных заключениях, опирающихся на терапевтические режимы лечения системных васкулитов, адаптированные по принципу патологического соответствия. Учитывая волнообразность течения васкулитов, лечение их является двухэтапным.
Индукционная терапия направлена на ограничение иммунопатологических реакций на этапе их острых проявлений и является достаточно агрессивной и относительно короткой по длительности. Ее цель — достижение ремиссии заболевания, что в среднем возможно через 4–6 месяцев лечения, но может потребоваться и более продолжительный курс терапии. Поддерживающая терапия направлена на пролонгирование ремиссии посредством длительной иммуносупрессии с возможной постепенной ее отменой в последующем. Развитие рецидива заболевания вызывает необходимость повторения этапа индукционной терапии.
Лечение обычно начинают с назначения глюкокортикоидов — метилпреднизолон в виде пульс-терапии по 1 г внутривенно 3–5 дней с последующим пероральным приемом преднизолона или метилпреднизолона по 1 мг/кг (в среднесуточной дозе не более 60 мг/сут) со снижением в дальнейшем до поддерживающей дозы 7,5–10 мг за 3–5 месяцев [28–30]. Возможно также проведение пульс-терапии преднизолоном по следующей схеме: каждые 3 дня внутривенно по 1000, 500, 250 и 125 мг/сут с последующим переходом на пероральный прием [14].
При неэффективности стероидной терапии, быстро прогрессирующем течении, поражении крупных сосудов или в случае подтвержденного гранулематозного васкулита применяют цитостатики, обычно циклофосфамид перорально по 150 мг/сут (2 мг/кг/сут) или внутривенно по 1 г (15 мг/кг) каждые 2–4 недели (750 мг/м2/мес). При этом чаще используют одновременный прием глюкокортикоидов и циклофосфамида. Если воспаление локализовано лишь в мелких кортикальных и лептоменингеальных сосудах, можно ограничиться только пероральным курсом преднизолона.
Через 4–6 месяцев приема циклофосфамида (после достижения ремиссии) в качестве поддерживающей терапии возможно применение других иммунодепрессантов (азатиоприн по 1–2 мг/кг ежедневно, метотрексат по 20–25 мг еженедельно или мофетила микофенолат по 1 г ежедневно) на фоне продолжения приема преднизолона. Учитывая длительность приема глюкокортикоидов и цитостатиков, необходима профилактика остеопороза, язв желудка и пневмоцистной инфекции.
Инновационным направлением в лечении васкулитов является применение химерных моноклональных антител к антигенам В-клеток (генно-инженерная анти-В-клеточная терапия) и к рецепторам фактора некроза опухоли α, имеющих сопоставимую или превышающую эффективность по сравнению с цитостатиками и более безопасных (ритуксимаб, инфликсимаб, этанерцепт). При тяжелом ANCA-ассоциированном системном васкулите, при системной красной волчанке с поражением ЦНС, при рецидивирующем течении васкулита и при непереносимости циклофосфамида (или рефрактерности к нему) применяют ритуксимаб по 375 мг/м2 в неделю в течение 4 недель или по 1000 мг дважды с интервалом в 2 недели [13].
В 2016 г. рядом европейских ревматологических ассоциаций были опубликованы рекомендации по диагностике и лечению ANCA-ассоциированных системных васкулитов, в которых на фоне приема глюкокортикоидов предлагается одновременное применение циклофосфамида или ритуксимаба с предпочтением последнего как препарата первого ряда для индукционной терапии, показавшего преимущества перед циклофосфамидом. Поддерживающая терапия заключается в назначении низких доз глюкокортикоидов в сочетании с приемом азатио-прина, ритуксимаба, метотрексата или мофетила микофенолата [30].
Индукционная терапия с использованием комбинации глюкокортикоидов и циклофосфамида при первичном васкулите ЦНС показала одинаковый эффект по сравнению с монотерапией глюкокортикоидами, однако ассоциировалась с меньшей частотой рецидивов и с более значительным снижением инвалидизации [29, 31]. Из биологических препаратов, помимо ритуксимаба, при первичном васкулите ЦНС применяются инфликсимаб (однократная инфузия 5 мг/кг) и этанерцепт (25 мг 2 раза в неделю в течение 20 месяцев, затем 25 мг/кг еженедельно в течение 8 месяцев). При этом в отношении индукции ремиссии биологические агенты не уступали глюкокортикоидам и иммунодепрессантам [13].
Лечение васкулита продолжают в течение 6–12 месяцев после достижения ремиссии, при ANCA-ассоциированном системном васкулите — не менее 24 месяцев. Мониторинг активности болезни заключается в выполнении МРТ головного мозга через 4–6 недель после начала лечения, затем каждые 3–6 месяцев в течение всего курса лечения на протяжении 1 года или при появлении новой неврологической симптоматики, в дальнейшем — в зависимости от последующего развития заболевания. При развитии клинического ухудшения на фоне стабильной МРТ-картины необходимы повторные ангиография и исследование ликвора [11, 32, 33].
У детей при первичном васкулите ЦНС с поражением мелких сосудов индукционная терапия проводится в течение 6 месяцев в виде семикратной инфузии циклофосфамида (500–750 мг/м2 каждые 4 недели) в сочетании с ежедневным приемом преднизолона (начиная с 2 мг/кг/сут (максимально — не более 60 мг в день) с уменьшением дозы на 10 мг каждые 4 недели, а с дозы 20 мг — на 2,5 мг до отмены). Поддерживающая терапия на фоне уменьшающихся доз преднизолона обычно длится 18 месяцев: предпочтительнее мофетила микофенолат по 800–1200 мг/м2 в день (максимум 2 г в день), реже применяют азатиоприн по 2–3 мг/кг в день (максимум 150 мг в день). При частых рецидивах показан хороший эффект ритуксимаба [34].
При непрогрессирующем течении первичного васкулита ЦНС с поражением крупных сосудов проводится пульс-терапия метилпреднизолоном в течение 5 дней с последующим пероральным приемом преднизолона с уменьшением дозы на протяжении 3 месяцев. В случае прогрессирующего течения индукционная терапия включает сочетанное применение глюкокортикоидов и циклофосфамида в течение 6 месяцев с последующим приемом мофетила микофенолата на протяжении 18 месяцев на этапе поддерживающей терапии [8].
Для лечения вторичных васкулитов ЦНС, особенно ассоциированных с инфекцией, используют также внутривенный иммуноглобулин как в острый период, так и для длительной терапии. Сначала его назначают в дозе 2 г/кг за 2–5 дней, а затем по 1 г/кг однократно каждую неделю [35]. Вторичные васкулиты ЦНС отличаются меньшей чувствительностью к пульс-терапии метилпреднизолоном [24].
Прогноз
Умеренное ухудшение или отсутствие ухудшения по индексу Бартел при первичном васкулите ЦНС отмечается в 67–85 % случаев, рецидивы — у 27–45 % пациентов, летальный исход — в 4–17 % случаев. Прогноз во многом определяется типом пораженных сосудов и гистопатологическим паттерном поражения. Бóльшая частота рецидивов характерна для изолированного васкулита ЦНС с вовлечением мелких сосудов — 54 % случаев, при поражении средних и крупных сосудов рецидив развивался у 24 % пациентов [4, 12, 29, 31, 36]. По другим данным, первичный васкулит с поражением крупных церебральных сосудов имеет более агрессивное течение и худший прогноз по сравнению с вовлечением мелких сосудов [23]. При васкулитах с гранулематозным воспалением выживаемость ухудшают поражение крупных сосудов по сравнению с вовлечением мелких, развитие инфаркта головного мозга по сравнению с его отсутствием или наличие очагового неврологического дефицита по сравнению с головной болью или системными симптомами, нормальная или с незначительными изменениями МРТ по сравнению с накоплением контраста в участках поражения мозга или в оболочках [4].
Поддерживающая терапия глюкокортикоидами или цитостатиками является единственным независимым фактором позитивного эффекта лечения с увеличением в 3 раза количества случаев с клиническим улучшением и с уменьшением в 2 раза числа пациентов с рецидивами [29]. Более высокая безрецидивная выживаемость характерна для первичного васкулита ЦНС, в отличие от вторичного (р < 0,05) [24].
Выводы
Таким образом, возрастающая частота аутоиммунных заболеваний обусловливает необходимость углубления представлений о механизмах, клинических проявлениях, диагностике и методах лечения васкулитов с поражением ЦНС. Постановка диагноза первичного васкулита ЦНС требует прежде всего исключения вторичного характера поражения сосудов головного мозга. В ряде случаев возможны ситуации с возникновением необходимости пересмотра ранее выставленного диагноза.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Jennette J.C., Falk R.J., Bacon P.A. et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013. 65. 1-11. https://doi.org/10.1002/art.37715.
2. ICD-11 for Mortality and Morbidity Statistics (2018). Accessed November 21, 2018. https://icd.who.int/browse11/l-m/en.
3. Hoffman G.S., Calabrese L.H. Vasculitis: determinants of di-sease patterns. Nat. Rev. Rheumatol. 2014. 10. 454-462. https://doi.org/10.1038/nrrheum.2014.89.
4. Salvarani C., Brown R.D., Christianson T.J.H. et al. An update of the Mayo Clinic cohort of patients with adult primary central nervous system vasculitis: description of 163 patients. Medicine. 2015. 94. e738. https://dx.doi.org/10.1097%2FMD.0000000000000738.
5. Тотолян Н.А., Готовчиков А.А., Кодзаева А.Ю. и др. Диагностика изолированного ангиита центральной нервной системы. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013. 2(2). 32-42. https://www.mediasphera.ru/issues/zhurnal-nevrologii-i-psikhiatrii-im-s-s-korsakova-2/2013/2/downloads/ru/031997-72982013226.
6. Hajj-Ali R.A., Calabrese L.H. Diagnosis and classification of central nervous system vasculitis. J. Autoimmun. 2014. 48–49. 149-152. http://dx.doi.org/10.1016/j.jaut.2014.01.007.
7. Twilt M., Benseler S.M. Central nervous system vasculitis in adults and children. Handbook of Clinical Neurology. Elsevier. 2016. 133. 283-300. https://doi.org/10.1016/B978-0-444-63432-0.00016-5.
8. Wan Ch., Su H. A Closer Look at Angiitis of the central nervous system. Neurosciences (Riyadh). 2017. 22(4). 247-254. https://dx.doi.org/10.17712%2Fnsj.2017.4.20170052.
9. Giannini C., Salvarani C., Hunder G., Brown R.D. Primary central nervous system vasculitis: pathology and mechanisms. Acta Neuropathol. 2012. 123. 759-772. https://doi.org/10.1007/s00401-012-0973-9.
10. Ruland T., Wolbert J., Gottschalk M.G. et al. Cerebrospinal Fluid Concentrations of Neuronal Proteins Are Reduced in Primary Angiitis of the Central Nervous System. Front Neurol. 2018. 9. 407-416. https://dx.doi.org/10.3389%2Ffneur.2018.00407.
11. Hajj-Ali R.A., Singhal A.B., Benseler S. et al. Primary angiitis of the CNS. The Lancet Neurology. 2011. 10(6). 561-572. https://doi.org/10.1016/S1474-4422(11)70081-3.
12. De Boysson H., Boulouis G., Aouba A. et al. Adult primary angiitis of the central nervous system: isolated small vessel vasculitis represents distinct disease pattern. Rheumatology (Oxford). 2017. 56. 439-444. https://doi.org/10.1093/rheumatology/kew434.
13. Beuker С., Schmidt A., Strunk D. et al. Primary angiitis of the central nervous system: diagnosis and treatment. Ther. Adv. Neurol. Disord. 2018. 11. 1756286418785071. https://dx.doi.org/10.1177%2F1756286418785071.
14. Kumar P.P., Rajesh A., Kandadai R.M. et al. Primary CNS vasculitis masquerading as glioblastoma: A case report and review. Asian J. Neurosurg. 2017. 12. 69-71. https://dx.doi.org/10.4103%2F1793-5482.145187.
15. Razek A.A.Kh.A., Alvarez H., Bagg S. et al. Imaging Spectrum of CNS Vasculitis. Radio Graphics. 2014. 34 873-894. https://doi.org/10.1148/rg.344135028.
16. Salvarani C., Brown R.D., Christianson T.J.H. et al. Primary central nervous system vasculitis mimicking brain tumor: Comprehensive analysis of 13 cases from a single institutional cohort of 191 cases. J. of Autoimmunity. 2019. 97. 22-28. Available online 24 October 2018. https://doi.org/10.1016/j.jaut.2018.10.001.
17. Nocton J.J. Usual and Unusual Manifestations of systemic and central nervous system vasculitis. Pediatr Clin. N. Am. 2017. 64. 185-204. http://dx.doi.org/10.1016/j.pcl.2016.08.013.
18. De Boysson H., Boulouis G., Parienti J.-J. et al. Concordance of Time-of-Flight MRA and Digital Subtraction Angiography in Adult Primary Central Nervous System Vasculitis. Am. J. Neuroradiol. 2017. 38(10). 1917-1922. https://doi.org/10.3174/ajnr.A5300.
19. Hammad T.A., Hajj-Ali R.A. Primary angiitis of the central nervous system and reversible cerebral vasoconstriction syndrome. Curr. Atheroscler. Rep. 2013. 15(8). 346-354. https://doi.org/10.1007/s11883-013-0346-4.
20. Niu L., Wang L., Yin X. et al. Role of magnetic resonance imaging in the diagnosis of primary central nervous system angiitis. Experimental and Therapeutic Medicine. 2017. 14. 555-560. https://doi.org/10.3892/etm.2017.4572.
21. Chimelli L. The role of biopsies and autopsies in the diagnosis of cognitive impairment, with emphasis on small vessel diseases: A critical appraisal enriched by personal experience. Dement. Neuropsychol. 2017. 11(4). 356-363. https://dx.doi.org/10.1590%2F1980-57642016dn11-040004.
22. Lucke M., Hajj-Ali R.A. Advances in primary angiitis of the central nervous system. Curr. Cardiol. Rep. 2014. 16(10). 533-539. https://doi.org/10.1007/s11886-014-0533-0.
23. Dutra L.A., de Souza A.W.S., Grinberg-Dias G. et al. Central nervous system vasculitis in adults: An update. Autoimmunity Reviews. 2017. 16(2). 123-131. https://doi.org/10.1016/j.autrev.2016.12.001.
24. Vera-Lastra О., Sepúlveda-Delgado J., Cruz-Domínguez M.Р. et al. Primary and secondary central nervous system vasculitis: clinical manifestations, laboratory findings, neuroimaging, and treatment analysis. Clin. Rheumatol. 2015. 34(4). 729-738. https://doi.org/10.1007/s10067-014-2831-8.
25. Becker J., Horn P.A., Keyvani K. et al. Primary central nervous system vasculitis and its mimicking diseases — clinical features, outcome, comorbidities and diagnostic results — A case control study. Clinical Neurology and Neurosurgery. 2017. 156. 48-54. https://doi.org/10.1016/j.clineuro.2017.03.006.
26. Киселева Е.В., Спирин Н.Н. Сочетание рассеянного склероза и аутоиммунной патологии щитовидной железы: особенности течения демиелинизирующего процесса. Практическая медицина. 2017. 1(102). 92-95. https://cyberleninka.ru/article/n/sochetanie-rasseyannogo-skleroza-i-autoimmunnoy-patologii-schitovidnoy-zhelezy-osobennosti-techeniya-demieliniziruyuschego/viewer.
27. Шмонина И.А., Шмонин А.А., Красильникова Е.И., Тотолян Н.А. Аутоиммунные заболевания щитовидной железы у пациентов с рассеянным склерозом: возможные взаимосвязи. Ученые записки СПбГМУ им. И.П. Павлова. 2012. 19(1). 11-16. https://www.elibrary.ru/download/elibrary_22019822_39015939.pdf.
28. Ntatsaki E., Carruthers D., Chakravarty K. et al. BSR and BHPR guideline for the management of adults with ANCA-associated vasculitis. Rheumatology (Oxford). 2014. 53(12). 2306-2309. https://doi.org/10.1093/rheumatology/ket445.
29. Salvarani C., Brown R.D., Christianson T.J.H. et al. Adult primary central nervous system vasculitis treatment and course: ana-lysis of one hundred sixty-three patients. Arthritis & Rheumatology. 2015. 67(6). 1637-1645. https://doi.org/10.1002/art.39068.
30. Yates M., Watts R.A., Bajema I.M. et al. EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann. Rheum. Dis. 2016. 75(9). 1583-1594. https://doi.org/10.1136/annrheumdis-2016-209133.
31. De Boysson H., Parienti J.J., Arquizan C. et al. Maintenance therapy is associated with better long-term outcomes in adult patients with primary angiitis of the central nervous system. Rheumatology (Oxford). 2017. 56(10). 1684-1693. https://doi.org/10.1093/rheumatology/kex047.
32. Salvarani C., Brown R.D., Giannini C., Hunder G.G. Adult Primary Central Nervous System Vasculitis. Systemic Vasculitides: Current Status and Perspectives. 2016. 245-257. https://doi.org/10.1007/978-3-319-40136-2_22.
33. Бекетова Т.В. Международные рекомендации по лечению АНЦА-ассоциированных системных васкулитов. Современная ревматология. 2019. 13(1). 19-25. https://doi.org/10.14412/1996-7012-2019-1-19-25.
34. Deng J., Fang F., Wang X.H. et al. Small vessel-childhood primary angiitis of the central nervous system: a case report and literature review. Zhonghua Er Ke Za Zhi. 2018. 56(2). 142-147. https://doi.org/10.3760/cma.j.issn.0578-1310.2018.02.014.
35. Twilt M., Benseler S.M. Treatment of CNS Vasculitis in Children. Curr. Treat. Options in Rheum. 2015. 1. 365-380. https://doi.org/10.1007/s40674-015-0032-5.
36. Hajj-Ali R.A., Saygin D., Ray E. et al. Long-term outcomes of patients with primary angiitis of the central nervous system. Clin. Exp. Rheumatol. 2019. 37(Suppl. 117(2)). 45-51. https://www.ncbi.nlm.nih.gov/pubmed/30789149.
/148.jpg)

/150.jpg)
/151.jpg)
/153.jpg)