Резюме
Актуальність. Прогресування цукрового діабету 2-го типу (ЦД-2) здебільшого супроводжується розвитком проліферативної діабетичної ретинопатії (ПДР), що є серйозною причиною втрати зору й інвалідності. За умов ЦД-2 зміна складу жирних кислот (ЖК) мембран клітин: адипоцитів, гепатоцитів, клітин скелетних м’язів, еритроцитів — суттєво змінює їх функції — текучість мембрани, проникність іонів, зв’язування та спорідненість рецепторів інсуліну. Мета: вивчення впливу харчових звичок (приготування їжі та вживання олій) на жирнокислотний склад еритроцитарних мембран пацієнтів із ПДР і різною тривалістю ЦД-2 порівняно з рівнем регуляторного шаперону Liver-type Fatty Acid Binding Protein (L-FABP) у сироватці крові. Матеріали та методи. До обстеження було залучено 106 пацієнтів офтальмологічної клініки зі встановленим діагнозом ПДР, яких розподілили на дві групи за тривалістю ЦД-2. У пацієнтів 1-ї групі (n = 46) середній вік (Мe; Q1-Q3) становив 62 (57–66) роки, тривалість ЦД-2 визначалась до 20 років. У пацієнтів 2-ї групи (n = 60) із середнім віком 65 (60–68) років діабет тривав понад 20 років. До групи порівняння (контрольна група (КГ), n = 46) увійшли здорові добровольці. Дослідження ЖК проводили методом газово-рідинної хроматографії в еритроцитарних мембранах, шляхом узяття венозної крові пацієнта та виділення еритроцитів. Вивчення харчових звичок проводили за оцінкою результатів анкетування. Вміст L-FABP визначали в сироватці крові методом ELISA Human L-FABP (Hycult Biotech), розраховували медіану та квартилі (Мe; Q1-Q3). Порівнювали дані за критерієм Краскела — Уолліса у статистичній програмі SPSS 23. Результати. Вивчення спектра основних ЖК у мембранах еритроцитів пацієнтів із ПДР показало підвищення в 1,6 раза (Р < 0,05) вмісту насиченої пальмітинової (С16:0) ЖК, зниження в 1,6 раза (Р < 0,05) вмісту ненасиченої лінолевої (С18:2) і арахідонової (С20:4) ЖК відносно показників групи здорових осіб. Вказані зміни не корелювали з тривалістю ЦД-2. Вміст насиченої стеаринової (С18:0), ненасиченої олеїнової (С18:1) ЖК практично не відрізнявся порівняно з показниками здорових осіб і не змінювався у пацієнтів залежно від тривалості захворювання. Вживання в їжу олій та жирів — прямих джерел зазначених ЖК у пацієнтів відрізняється порівняно з особами контрольної групи. Підвищене в 2 рази вживання соняшникової олії, багатої на лінолеву ЖК, пацієнтами з ПДР супроводжувалося парадоксальним зниженням рівня лінолевої ЖК у складі мембран їх еритроцитів. Підвищене в 2 рази вживання джерела олеїнової ЖК — оливкової олії у пацієнтів КГ та маргарину у пацієнтів 2-ї групи не призводить до зміни вмісту вказаної ЖК у мембранах клітин. Концентрація L-FABP у сироватці крові пацієнтів із ПДР була вище, ніж у групі здорових осіб, і чітко корелювала з тривалістю захворювання на ЦД-2. У пацієнтів з тривалістю ЦД-2 понад 20 років експресія протеїну була практично в 2 рази (Р < 0,05) вищою, ніж у групі здорових осіб. Висновки. Вказані особливості необхідно брати до уваги під час розробки ефективних схем корекції ліпідного метаболізму у хворих на ПДР, а також мати на увазі вплив гіперглікемії на властивості клітинних мембран, що визначаються значною мірою спектром жирних кислот. Стан мембрани клітини визначає міжклітинну взаємодію/кооперацію для внутрішньоклітинних сигналів, а стан мембрани еритроцитів є важливою умовою функціональної спроможності клітин і стану тканинного дихання.
Актуальность. Прогрессирование сахарного диабета 2-го типа (СД-2) в большинстве случаев сопровождается развитием пролиферативной диабетической ретинопатии (ПДР), которая является серьезной причиной потери зрения и инвалидности. В условиях СД-2 изменение состава жирных кислот (ЖК) мембран клеток (адипоцитов, гепатоцитов, клеток скелетных мышц, эритроцитов) существенно меняет их функции (текучесть мембраны, проницаемость ионов, связывание и сродство рецепторов инсулина). Цель: изучение влияния пищевых привычек (приготовления пищи и употребления масел) на жирно-кислотный состав эритроцитарных мембран пациентов с ПДР и разной продолжительностью СД-2 в сопоставлении с уровнем регуляторного шаперона Liver-type Fatty Acid Binding Protein (L-FABP) в сыворотке крови. Материалы и методы. В обследование были включены 106 пациентов офтальмологической клиники с установленным диагнозом ПДР, которые были распределены на две группы по продолжительности СД-2. У пациентов 1-й группы (n = 46) средний возраст (Мe; Q1-Q3) составлял 62 (57–66) года, продолжительность СД-2 — до 20 лет. У пациентов 2-й группы (n = 60) со средним возрастом 65 (60–68) лет диабет длился более 20 лет. Группу сравнения (контрольная группа (КГ), n = 46) составили здоровые добровольцы. Исследование ЖК осуществляли методом газово-жидкостной хроматографии в эритроцитарных мембранах, путем взятия венозной крови пациента и выделения эритроцитов. Изучение пищевых привычек проводили по оценке результатов анкетирования. Содержание L-FABP определяли в сыворотке крови методом ELISA Human L-FABP (Hycult Biotech), рассчитывали медиану и квартили (Мe; Q1-Q3). Сравнивали данные по критерию Краскела — Уоллиса в статистической программе SPSS 23. Результаты. Изучение спектра основных ЖК в мембранах эритроцитов пациентов с ПДР показало повышение в 1,6 раза (Р < 0,05) содержания насыщенной пальмитиновой (С16:0) ЖК, снижение в 1,6 раза (Р < 0,05) содержания ненасыщенной линолевой (С18:2) и арахидоновой (С20:4) ЖК относительно показателей группы здоровых лиц. Указанные изменения не коррелировали с продолжительностью СД-2. Содержание насыщенной стеариновой (С18:0), ненасыщенной олеиновой (С18:1) ЖК практически не отличалось от показателей здоровых лиц и не менялось у пациентов в зависимости от длительности заболевания. Употребление в пищу масел и жиров — прямых источников указанных ЖК у пациентов отличается по сравнению с лицами КГ. Повышенное в 2 раза употребление подсолнечного масла, богатого линолевой ЖК, пациентами с ПДР сопровождалось парадоксальным снижением уровня линолевой ЖК в составе мембран их эритроцитов. Повышенное в 2 раза употребления источников олеиновой ЖК — оливкового масла пациентами КГ и маргарина пациентами 2-й группы не приводило к изменению содержания указанной ЖК в мембранах клеток. Концентрация L-FABP в сыворотке крови пациентов с ПДР была выше, чем в группе здоровых лиц, и четко коррелировала с длительностью заболевания СД-2. У пациентов с длительностью СД-2 более 20 лет экспрессия протеина была практически в 2 раза (Р < 0,05) выше, чем в группе здоровых лиц. Выводы. Указанные особенности необходимо учитывать при разработке эффективных схем коррекции липидного метаболизма у больных ПДР, а также иметь в виду влияние гипергликемии на свойства клеточных мембран, определяющиеся в значительной степени спектром ЖК, поскольку состояние мембраны клетки обеспечивает межклеточное взаимодействие/кооперацию для внутриклеточных сигналов, а состояние мембраны эритроцитов является важным условием функциональной способности клеток и состояния тканевого дыхания.
Background. The progression of type 2 diabetes mellitus (T2D) in most cases is accompanied by the development of proliferative diabetic retinopathy (PDR), which is a serious cause of vision loss and disability. In T2D, there is a change in the composition of fatty acids (FA) of cell membranes: adipocytes, hepatocytes, skeletal muscle cells, and erythrocytes that significantly change their functions — membrane fluidity, ion permeability, binding and affinity of insulin receptors. The purpose is to study the effect of food cooking and oil consumption habits on the fatty acid composition of the erythrocyte membranes of patients with PDR and different duration of T2D, in comparison with the level of regulatory serum liver fatty acid binding protein (L-FABP) chaperone. Materials and methods. The examination included 106 patients of an ophthalmological clinic with an established diagnosis of PDR, who were divided into 2 groups according to the duration of T2D. In patients of group 1 (n = 46), the average age (Me; Q1-Q3) was 62 (57–66) years, the duration of T2D was up to 20 years. In patients of group 2 (n = 60) with an average age of 65 (60–68) years, diabetes lasted more than 20 years. The comparison group (controls, n = 46) consisted of healthy volunteers. The study of FA was carried out using gas-liquid chromatography in erythrocyte membranes by taking venous blood of a patient with isolation of red blood cells. The study of food habits was carried out by evaluating the results of the questionnaire. The content of L-FABP in the blood serum was determined by enzyme-linked immunosorbent essay using Human L-FABP Hycult Biotech kit, the median and quartiles were calculated (Me; Q1-Q3). The data were compared according to the Kruskal-Wallis test in the statistical program SPSS 23. Results. The study of the main FA spectrum in the erythrocyte membranes of patients with PDR showed a 1.6-fold increase (P < 0.05) in the content of saturated palmitic FA (C16:0), a 1.6-fold decrease (P < 0.05) in the content of unsaturated linoleic (C18:2) and arachidonic (C20:4) FA relative to groups of healthy individuals. These changes did not correlate with the duration of T2DM. The content of saturated stearic (C14:0), unsaturated oleic (C18:1) FA practically did not differ in comparison with healthy individuals and did not change in patients with increasing duration of the disease. The consumption of oils and fats — direct sources of these FAs in patients is different compared to those of the control group. A 2-fold increase in the use of sunflower oil rich in linoleic FA by patients with PDR was accompanied by a paradoxical decrease in linoleic FA in the composition of their erythrocyte membranes. A 2-fold increase in the use of the source of oleic FA — olive oil in patients of the control group and margarine in patients of group 2 did not lead to a change in the content of this FA in the cell membranes. The concentration of L-FABP in the blood serum of patients with PDR was higher than in the group of healthy individuals and clearly correlated with the duration of diabetes. In patients with T2DM duration of more than 20 years, protein expression was almost 2 times (P < 0.05) higher than in the group of healthy individuals. Conclusions. These features must be taken into account both for the development of effective schemes for the correction of lipid metabolism in patients with PDR, and evaluating the effect of hyperglycemia on the properties of cell membranes, which are largely determined by the spectrum of FAs. Since the state of the cell membrane provides intercellular interaction/cooperation for intracellular signals, and the state of the erythrocyte membrane is an important condition for the functional ability of cells and the state of tissue respiration.
Вступ
Активно вивчаються механізми регуляції метаболічного обміну у пацієнтів із проліферативною діабетичною ретинопатією (ПДР), оскільки це ускладнення цукрового діабету 2-го типу (ЦД-2) є серйозною причиною втрати зору й інвалідності [1, 2]. Вважається, що тривала циркуляція в плазмі крові вільних жирних кислот (ЖК) є одним із важливих впливів на розвиток інсулінорезистентності (ІР) [3–5]. Водночас механізми, що чітко поясняли би зв’язок харчових надходжень продуктів — джерел ЖК, їх концентрації у вигляді вільних ЖК плазми, вмісту загального холестерину та його фракцій — ліпопротеїдів, до складу яких входять ЖК, рецепторного апарату мембран клітин, що поглинають жири, внутрішньоклітинних регуляторів, які забезпечують використання молекули ЖК або її депонування, залишаються невідомими та продовжують вивчатися.
Один із потенційних механізмів впливу на розвиток діабету — це зміна ЖК-складу мембран клітин: адипоцитів, гепатоцитів, клітин скелетних м’язів, еритроцитів і, відповідно, зміна їх функцій. Вважається, що дієта з високим умістом насичених ЖК погіршує текучість мембрани, проникність іонів, зв’язування та спорідненість рецепторів інсуліну. Однак нез’ясовно, який часовий період необхідний для споживання жирної кислоти, щоб викликати певні зміни вмісту плазми або еритроцитів, що визначить шлях, який веде до ЦД-2 [6]. Склад ЖК можна об’єктивно виміряти в різних тканинах і ліпідних пулах крові, таких як жирова тканина, еритроцити, фосфоліпіди плазми та сироватки крові, ефіри холестерину або фракції тригліцеридів. Але питання про те, який ліпідний басейн найкраще відображає споживання ЖК, залишається невирішеним. Жирова тканина вважається найкращою тканиною для вимірювання ЖК, оскільки саме вона формується при харчування і відображає тривалий час обміну речовин [7]. Однак вимірювання через біопсію жиру мінімізує корисність методу у великих епідеміологічних дослідженнях. На відміну від цього ЖК, виміряні в мембранній фракції еритроцитів, відображають більш короткі часові рамки раціону харчування в порядку 120 діб, але фракція плазми являє ще коротший термін споживання за останні кілька днів [6]. Є дані про невисоку інформативність плазмових маркерів порівняно з оцінкою структурних компонентів через вимірювання мембранних ЖК еритроцитів [8, 9]. Автори також заявляють про те, що екзогенні харчові ЖК сильніше асоціюються з ЖК, виміряними в мембрані еритроцитів, ніж у плазмі [10, 11].
У праці [12] підкреслено, що мембрани еритроцитів є найбільш показовою моделлю, що відображує тривалість циркуляції ЖК внаслідок харчового надходження жирів. Склад ЖК в організмі формується переважно внаслідок дієтичного раціону та ендогенного синтезу, а мембрани еритроцитів не здійснюють синтез та модифікацію ЖК de novo, та, окрім тривалого харчового навантаження, їх мембранний склад ЖК генетично детермінований [12].
Погляди вчених не є одностайними: дехто вважає зв’язок між складом ЖК раціону та розвитком діабету непереконливим, інші повідомляють про відсутність асоціації між споживанням різних ЖК і ризиком виникнення діабету. Є дослідження про зворотний зв’язок між більшим споживанням рослинного жиру та ризиком діабету [6]. Однак є поширене твердження, що насичені ЖК (НЖК) асоціюються з ризиком діабету, при цьому окремі жирні кислоти, такі як НЖК з непарними номерами (С15:0 — пентадеканова кислота; С17:0 — гептадеканова кислота), є обернено асоційованими з ризиком діабету, а парні НЖК (С14:0 — міристинова кислота; С16:0 — пальмітинова кислота) позитивно пов’язані з виникненням захворювання.
Hodge та співавт. провели широке когортне дослідження і протягом 4 років спостерігали за понад 40 тис. пацієнтів, виявивши позитивні асоціації між захворюваністю на діабет і НЖК в дієті. Ліноленова кислота у складі плазмових фосфоліпідів була зворотно, а харчова ліноленова кислота позитивно пов’язана з ризиком діабету [13]. Зменшення вмісту лінолевої ЖК у фосфоліпіді плазми хворих на ЦД-2 порівняно зі здоровими особами свідчить про те, що збільшення споживання лінолевої кислоти може зменшити ризик діабету. Однак проведені спостереження в цьому напрямку не підтверджують корисного впливу дієтичних добавок [6, 13]. Імовірно, на стадії предіабетичного стану виникають якісь відмінності у складі плазми і специфічних регуляторних протеїнів ЖК, що потребують дослідження біомаркерів діабету та ретельного тлумачення результатів [5, 6].
Нові дослідження виводять на арену головних регуляторів накопичення жиру в адипоцитах білок EHD2 (Eps15-homology domain containing protein-2), який регулює стабільність мембрани під час поглинання краплі жиру через ендоцитоз і запобігає утворенню великих каверл із жиром (ендосом). Водночас генетична відсутність експресії EHD2, або зниження його концентрації, сприяє розвитку ожиріння через швидке наповнення клітини жиром. Але цей протеїн тільки починає вивчатися, і досліди проходять на тваринах і культурі клітин [14].
Більш поширеним біомаркером, що зв’язує ЖК в клітині та забезпечує внутрішньоклітинну систему регуляції ліпідного обміну, вважається Liver-type Fatty Acid Binding Protein (L-FABP) [15, 16].
Мета — вивчення впливу харчових звичок (приготування їжі та вживання олій) на жирнокислотний склад еритроцитарних мембран пацієнтів із ПДР і різною тривалістю ЦД-2 порівняно з рівнем регуляторного шаперону L-FABP у сироватці крові.
Матеріали та методи
У дослідження було залучено 106 хворих (106 очей) із ЦД-2, в яких за результатами офтальмологічного обстеження було діагностовано ПДР. Усім хворим були виконані загальноприйняті офтальмологічні обстеження (візометрія, рефрактометрія, статична периметрія Humphrey, тонометрія, біомікроскопія, за необхідності — гоніоскопія, офтальмоскопія лінзою Goldman, оптична когерентна томографія на OCT Triton у режимі macula). Обстеження сітківки проводились фундус-камерою з фотографуванням очного дна у 7 перехресних полях згідно з протоколом Early Treatment Diabetic Retinopathy Study. Флюоресцентну ангіографію виконували за показаннями.
Пацієнтів розподілили на дві групи за тривалістю ЦД-2. У пацієнтів 1-ї групи (n = 46, жінок — 56 %) середній вік (Мe; [Q1-Q3]) становив 62 (57–66) роки, тривалість ЦД-2 визначалася до 20 років. У пацієнтів 2-ї групи (n = 60, жінок — 53 %) із середнім віком 65 (60–68) років діабет тривав понад 20 років. Групу порівняння (контрольна група — КГ) становили добровольці (n = 46, жінок — 56 %), у яких не було порушення вуглеводного обміну (за рівнем глікованого гемоглобіну) та які звернулися з метою профілактичного огляду в лабораторію клінічної лабораторної діагностики НМУ імені О.О. Богомольця, що були порівнянні за віком із пацієнтами з ПДР.
Склад ЖК у мембранах еритроцитів вивчали за допомогою газової хроматографії в лабораторії експериментальних досліджень НДІ ЕКМ НМУ імені О.О. Богомольця. Еритроцити виділяли з венозної крові пацієнтів. У спектрі ЖК ліпідів клітин крові було ідентифіковано 9 найінформативніших ЖК: з них міристинова С14:0, пентодеканова С15:0, пальмітинова С16:0, маргаринова С17:0, стеаринова С18:0, що входять до складу НЖК, а також олеїнова С18:1, лінолева С18:2, ліноленова С18:3, арахідонова С20:4, що становлять групу ненасичених жирних кислот (ННЖК). Лінолева С18:2, ліноленова С18:3, арахідонова С20:4 ЖК входять у склад поліненасичених жирних кислот (ПНЖК) і визначаються як незамінні. Вміст L-FABP визначали у сироватці крові методом ELISA Human L-FABP (Hycult Biotech).
Для вивчення харчових звичок нами була розроблена анкета, на питання якої пропонували відповісти всім досліджуваним особам. Статистичний аналіз даних проводився за допомогою пакета IBM SPSS Statistics 23 та програми MedStat. Перевірку розподілу кількісних показників по всій вибірці даних щодо відповідності закону Гаусса проводили за допомогою одновибіркового критерію Шапіро — Уїлка. Більшість параметрів не відображали нормального розподілу, тому використовували непараметричні критерії, для порівняння даних у таблиці спряженості «k*m» використовували критерій χ2. Дані у групах порівнювали за допомогою рангового однофакторного аналізу за критерієм Краскела — Уолліса, для попарного порівняння використовували критерій Данна або Манна — Уїтні з урахуванням поправки Бонферроні. Відмінності у групах вказували у вигляді Р із зазначенням рівня значущості. Вважали, що дані відрізняються за Р < 0,05. Для опису даних у групах наводили значення медіани (Ме), 25-го (Р25) та 75-го (Р75) процентилей, які визначали в таблицях [QI÷QIII]. Для інтервальної оцінки медіани розраховували 95% довірчий інтервал.
Результати та обговорення
Дослідження ЖК-спектра мембран еритроцитів показало суттєву різницю вмісту ЖК у пацієнтів та осіб КГ. Схожі зміни були описані в роботі [6], де наведено, що у пацієнтів з ДР склад мембран суттєво відрізняється підвищенням насичених ЖК і зменшенням ненасичених: лінолевої, ліноленової та арахідонової. У роботі [17] автори відзначають різнонаправлені коливання вмісту ЖК у групах пацієнтів із різним ступенем ДР, але головною ознакою є зменшення вмісту арахідонової ЖК і загальне підвищення їх насиченості.
Роль так званих мінорних ЖК у складі клітинної мембрани не можна принижувати, вона є значною. До того ж для відтворення міжклітинної кооперації, або реагування у вигляді рецепторної акцепції ліганда, цитокіну, гормону, основну роль відіграють саме мінорні ЖК (пентадеканова, міристинова, ліноленова тощо), які забезпечують властивості рецептора. Але в нашому дослідженні ми акцентуємо увагу на основних (мажорних) ЖК, які представлені у складі мембран в значному об’ємі та, імовірно, їх уміст залежить від екзогенного надходження ЖК у складі харчових жирів.
Так, у складі насичених ЖК ми виявили (рис. 1) вірогідне збільшення в 1,6 раза (Р < 0,05) вміст пальмітинової ЖК у пацієнтів із ПДР порівняно з показником КГ. При цьому підвищення стажу ЦД-2 корелювало зі збільшенням С16:0, але невірогідно. Вміст стеаринової ЖК суттєво не відрізнявся у групах.
У складі ненасичених ЖК виявилося вірогідне зниження в 1,6 раза (Р < 0,05) вмісту лінолевої ЖК у групі пацієнтів порівняно із КГ, що не змінювалося у пацієнтів залежно від тривалості ЦД-2. Також виявлено зменшення арахідонової ЖК в 1-й групі в 3 рази (Р < 0,05), а в 2-й групі в 1,6 раза (Р < 0,05) щодо КГ.
Вивчення харчових звичок досліджуваних осіб проводили за оцінкою результатів анкетування. Для з’ясування об’єму харчових жирів, які використовували досліджувані особи, було надано питання «Який спосіб приготування їжі (наприклад, м’яса) ви використовуєте переважно?» з варіантами відповіді: «жаріння», «відварювання або парування», «запікання в духовці». При цьому респондент за бажанням міг вказувати декілька способів готування їжі. Такий варіант був притаманний в основному особам КГ, де кожний 4-й відповів, що використовує різні варіанти (рис. 2). Пацієнти з ЦД-2 переважно готували їжу шляхом відварювання або парування. Жаріння їжі з використанням жирів та олії вважає за краще приблизно кожний 10-й з опитаних.
Наступним кроком дослідження було з’ясування складу жирів. Питання анкети «Які жири (масла, олії) ви традиційно використовуєте під час приготування їжі?» мало такі варіанти відповідей: «масло вершкове», «маргарин», «оливкову олію», «соняшникову олію», «кукурудзяну олію». За отриманими даними ми виявили (рис. 3), що пацієнти з ПДР найчастіше в 1,6 раза для приготування їжі використовують соняшникову олію. Вживання оливкової олії і вершкового масла було удвічі популярнішим серед осіб КГ. Незначна кількість опитуваних використовувала маргарин або кукурудзяну олію. При цьому пацієнти з тривалим ЦД-2 маргарин уживали вдвічі частіше, ніж здорові особи.
Порівняння змін вмісту ЖК в мембранах еритроцитів пацієнтів з особливостями харчування було проведено авторами на схожій групі пацієнтів із різним ступенем ДР. Автори аналізували склад харчових продуктів, які є визнаними джерелами різних видів ЖК, розраховували коефіцієнт раціональності вживання продуктів та дійшли висновку, що вживання в їжу продуктів — джерел різних типів ЖК не відрізнялося у групах здорових осіб і пацієнтів з різним ступенем ДР і ЦД-2 [5].
/32.jpg)
У нашій роботі ми з’ясували, що харчові звички пацієнтів із ПДР практично не відрізнялися в групах залежно від тривалості ЦД-2, але існують відмінності порівняно з групою здорових осіб. Характерним для пацієнтів із ПДР було відварювання або парування їжі, а як харчові жири переважно використовувалась соняшникова олія. Оливкову олію та вершкове масло пацієнти з ЦД-2 вживають в 2 рази менше, ніж особи КГ. Такий характер харчування вірогідно визначався тим, що людина із ЦД-2 перебувала на відповідній дієті для діабетиків, і, як ми виявили, дотримання рекомендації було особливо якісним у перші роки захворювання.
Надалі ми провели аналіз складу вказаних харчових жирів за даними стандарту [18]. У діаграмі (рис. 4) наводимо лише три основні ЖК, які за об’ємом переважають у продуктах. Згідно з діаграмою, в складі соняшникової олії переважає ненасичена С18:2 лінолева ЖК, а насичена С16:0 пальмітинова ЖК становить незначну частку — до 57 %. Основною ЖК оливкової олії є ненасичена С18:1 олеїнова ЖК, а насичена С16:0 пальмітинова ЖК у складі оливкової олії має більший в 3 рази вміст, ніж у складі соняшникової, що є схожим із вмістом маргарину.
Отже, ми виявили, що у пацієнтів, які використовують переважно соняшникову олію (що багата на С18:2 лінолеву ЖК) для приготування їжі, в складі мембран спостерігається парадоксальне зменшення вмісту С18:2 ЖК. Вміст олеїнової ЖК у мембранах пацієнтів і здорових осіб практично не відрізняється, однак вони вживають в 2 рази більше оливкової олії та маргарину, тобто джерел олеїнової ЖК.
Дослідження зв’язку факторів, які впливають на розвиток ЦД-2, та складу ЖК мембран еритроцитів завжди є популярним. Американськи вчені наводять дані про дослідження через опитування та спостереження протягом 11 років жінок у постменопаузі [19]. Автори провели порівняння низки ознак (вік, раса, освіта, куріння, ступінь фізичної активності, вживання алкоголю) з антропометричними даними (окружність талії, зріст, індекс маси тіла), харчовим глікемічним навантаженням, сімейним анамнезом діабету та дійшли висновку, що не можна чітко визначити вплив якоїсь однієї ЖК, наприклад пальмітинової, на розвиток ЦД-2, але однозначно для хворих на ЦД-2 характерним є перерозподіл ЖК у мембранах еритроцитів відносно здорових осіб [19].
У роботі [5] проводили дослідження із вивчення екзогенних та ендогенних впливів на ліпідний обмін. Автори висловили думку про відсутність прямої залежності між екзогенним впливом у вигляді аліментарного вживання продуктів — джерел ЖК і розвитком діабету та виявили зв’язок експресії внутрішньоклітинного регуляторного протеїну L-FABP із перерозподілом умісту ЖК в мембранах еритроцитів, що дає підставу вважати ендогенні клітинні механізми основою глибокого порушення ліпідного гомеостазу.
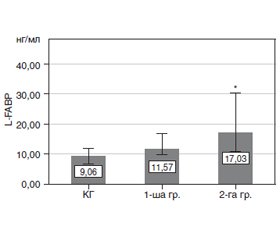
Визначення концентрації L-FABP у досліджуваних осіб (рис. 5) показало, що вміст шаперону підвищується у пацієнтів із ПДР відносно КГ, але не вірогідно. Показник корелює з тривалістю захворювання на ЦД-2 і в 2-й групі вірогідно відрізняється в 1,87 раза (Р = 0,029) від КГ, відмінність між 1-ю та 2-ю групами невірогідна (Р = 0,11).
/33.jpg)
Отже, проведене дослідження показало, що ЖК-склад клітинних мембран у пацієнтів із ПДР має суттєві відмінності відносно здорових осіб, але їх напрям не є неухильним підвищенням насичених ЖК і зниженням ненасичених ЖК. У пацієнтів із ЦД-2 вірогідно підвищується лише вміст насиченої пальмітинової ЖК, знижується вміст ненасиченої лінолевої ЖК, і такий стан не прогресує з часом. Також виявлено, що ступінь вживання прямих джерел вказаних ЖК у пацієнтів відрізняється порівняно з особами КГ. Ефект вживання харчових джерел (наприклад, соняшникова олія, багата на лінолеву ЖК, популярна серед пацієнтів із ЦД-2) практично протилежний тим змінам, які спостерігаються в складі мембрани. Також відмінність у групах ступеня вживання джерела олеїнової ЖК (оливкової олії у пацієнтів КГ та маргарину в пацієнтів 2-ї групи) не призводить до зміни вмісту вказаної ЖК у мембранах клітин.
Схожі результати описані в роботі [12], де автори виявили, що підвищення пальмітолеїнової кислоти значно пов’язане зі зниженою секрецією інсуліну, тоді як лінолева кислота суттєво пов’язана зі збільшенням секреції інсуліну. Водночас у пацієнток із раннім гестаційним діабетом виявлено зниження в мембранах трьох насичених ЖК (міристинової, пальмітинової, стеаринової ЖК), при цьому в основному внаслідок концентрації стеаринової кислоти [20]. Вміст олеїнової ЖК та її цис-компоненту (С18:1 цис-11) було значно підвищено в мембранах еритроцитів групи пацієнток порівняно зі здоровими вагітними.
У роботі [21] показано, що в дітей, хворих на діабет, вагомим маркером розвитку захворювання є більш високий рівень альфа-ліноленової жирної кислоти, ейкозапентаєнової та докозагексаєнової кислот, а також моно- та поліненасичених ЖК. Автори вважають, що ці дані є підґрунтям до зміни харчування при лікуванні дітей, хворих на діабет. Інші дослідники виявили, що розвиток ІР пов’язаний з високим рівнем стеаринової, пальмітолеїнової кислоти, γ-ліноленової кислоти та низьким — лінолевої кислоти в сироватковому ефірі холестерину [22]. Вивчався механізм розвитку ІР через властивості ЖК мембрани [23]. Дослідники довели, що високий уміст пальмітинової кислоти призводить до ІР через зміни рівня фосфорилювання рецептора інсуліну та субстрату рецептора інсуліну-1.
Дослідники єдині в думці про те, що поступове підвищення вмісту насичених ЖК плазми прямо пов’язане з розвитком діабету, а вживання продуктів, що містять харчовий насичений жир, може сприяти розвитку діабету [24]. В експериментальних роботах дослідження молекулярних механізмів націлено на вивчення стану мембранних транспортерів, які з часом формують ІР. В експериментах на тваринах дослідники виявили, що раннє постнатальне перенасичення ЖК призвело до значного зниження рівня субстрату рецептора інсуліну-1 (Irs-1), протеїнкінази В (Akt2) і транспортера глюкози-4 (Glut4) в епідермальному жирі щурів, що призводить до порушення сигнального шляху інсуліну у вісцеральній білій жировій тканині, скелетній мускулатурі та може відігравати головну роль в ІР [25]. Такі відмінності дають підставу вважати основним механізмом регуляції жирно-кислотного стану в організмі ендогенні механізми, що забезпечують розподіл ЖК у клітині. Одним із головних регуляторів внутрішньоклітинного обміну ЖК є протеїн L-FABP, який підвищується у пацієнтів із ЦД-2 та корелює зі стажем захворювання.
Дослідження L-FABP у групі осіб без діабету, але з підвищеними рівнями глюкози крові та холестерину виявили зменшений показник ІМТ, незначне підвищення ПНЖК у мембранах еритроцитів та рівень сироваткового L-FABP в 1,2 раза менший, ніж у відносно здорових осіб (Р > 0,05), і в 2 рази менший, ніж у пацієнтів із ЦД-2 (Р < 0,05). Можна припустити, що за певних умов, при метаболічних зсувах, зменшення експресії L-FABP на тлі підвищення вмісту ПНЖК у клітинах запобігає розвитку ожиріння та діабету [5].
На вказані особливості необхідно зважати при розробці ефективних схем корекції ліпідного метаболізму у хворих на ПДР, а також мати на увазі вплив ЦД-2 на властивості клітинних мембран, які визначаються значною мірою спектром жирних кислот, оскільки стан мембрани клітини визначає міжклітинну взаємодію/кооперацію для забезпечення внутрішньоклітинних сигналів, а стан мембрани еритроцитів є важливою умовою функціональної спроможності клітин і стану тканинного дихання.
Висновки
1. Вивчення спектра основних ЖК у мембранах еритроцитів пацієнтів із ПДР показало вірогідне підвищення в 1,6 раза вмісту насиченої пальмітинової ЖК, зниження в 1,6 раза вмісту ненасиченої лінолевої і арахідонової ЖК відносно показників групи здорових осіб. Вказані зміни не корелювали з тривалістю ЦД-2. Вміст насиченої стеаринової, ненасиченої олеїнової ЖК практично не відрізнявся порівняно з показниками здорових осіб і не змінювався у пацієнтів залежно від тривалості захворювання.
2. Вживання в їжу олій і жирів — прямих джерел вказаних ЖК у пацієнтів відрізняється порівняно з особами КГ. Підвищене в 2 рази вживання пацієнтами з ПДР соняшникової олії, багатої на лінолеву ЖК, супроводжувалося зниженням вмісту лінолевої ЖК у складі мембран еритроцитів. Підвищене в 2 рази вживання джерела олеїнової ЖК — оливкової олії у пацієнтів контрольної групи та маргарину у пацієнтів 2-ї групи не призводило до зміни вмісту вказаної ЖК у мембранах клітин.
3. Концентрація L-FABP у сироватці крові пацієнтів із ПДР була вище, ніж у групі здорових осіб, і чітко корелювала з тривалістю захворювання на ЦД-2. У пацієнтів із тривалістю ЦД-2 понад 20 років експресія протеїну була практично в 2 рази вище, ніж у групі здорових осіб.
Список литературы
1. International diabetes federation annual report 2015. https://www.oedg.at/pdf/1606_IDF_ Atlas_2015_UK.pdf
2. Балашевич Л.И., Измайлов А.С. Диабетическая офтальмопатия. СПб.: Человек, 2012. 396 с.
3. Hammer S.S., Busik J.V. The Role of Dyslipidemia in Diabetic Retinopathy. Vision Res. 2017. Vol. 139. P. 228-236.
4. Boden G., Chen X. and Iqbal N. Acute lowering of plasma fatty acids lowers basal insulin secretion in diabetic and nondiabetic subjects. Diabetes. 1998. Vol. 47(10). P. 1609-1612.
5. Natrus L.V., Gayova L.V., Byhovets M.Yu., Osadchuk Yu.S., Konovalov S.E. The value of regulatory effects on lipid metabolism in during complicated diabetes mellitus. Fiziologichnyi Zhurnal. 2020. Vol. 66(1). P. 25-34.
6. Patel P.S., Sharp S.J., Jansen E., et al. Fatty acids measured in plasma and erythrocyte-membrane phospholipids and derived by food-frequency questionnaire and the risk of new-onset type 2 diabetes: a pilot study in the European Prospective Investigation into Cancer and Nutrition (EPIC)-Norfolk cohort. The American Journal of Clinical Nutrition. 2013. Vol. 98(1). P. 255-258.
7. Hodson L., Skeaff C.M., Fielding B.A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Prog. Lipid Res. 2008. Vol. 47(5). P. 348-380.
8. Bykhovets M. Information value of biochemical markers for evaluation of lipid dysmetabolism secondary to hyperglycaemia in patients with diabetic retinopathy and type 2 diabetes mellitus. East European Scientific Journal (Warsaw, Poland). 2019. Vol. 9(49)/1. P. 19-25.
9. Petrenko O.V., Natrus L.V., Tavartkiladze К. Features of blood cells’ fatty acids content in patients with diabetic retinopathy. Arkhiv Oftal'mologii Ukrainy. 2017. 5. Vol. 3(19). P. 54-60 [in Ukraine].
10. Sun Q., Ma J., Campos H., Hankinson S.E., Hu F.B. Comparison between plasma and erythrocyte fatty acid content as biomarkers of fatty acid intake in US women. Am. J. Clin. Nutr. 2007. Vol. 86(1). P. 74-81.
11. Fuhrman B.J., Barba M., Krogh V., et al. Erythrocyte membrane phospholipid composition as a biomarker of dietary fat. Ann. Nutr. Metab. 2006. Vol. 50(2). P. 95-102.
12. Mahendran Y., Ågren J., Uusitupa M. et al. Association of erythrocyte membrane fatty acids with changes in glycemia and risk of type 2 diabetes. The American Journal of Clinical Nutrition. 2014. Vol. 99(1). P. 79-85.
13. Hodge A.M., English D.R., O'Dea K. et al. Plasma phospholipid and dietary fatty acids as predictors of type 2 diabetes: interpreting the role of linoleic acid. The American Journal of Clinical Nutrition. 2007. Vol. 86(1). P. 189-197.
14. Matthäus C., Lahmann I., Kunz S. et al. EHD2-mediated restriction of caveolar dynamics regulates cellular lipid uptake, 2020 bioRxiv. 511709. doi: https://doi.org/10.1101/511709.
15. Choromańska B., Myśliwiec P., Dadan J., Hady H.R., Chabowski A. The clinical significance of fatty acid binding proteins. Postepy Hig. Med. Dosw. (Online). 2011. Vol. 24(65). Р. 759-63.
16. Atshaves B.P., Martin G.G., Hostetler H.A. et al. Liver Fatty Acid Binding Protein and Obesity. J. Nutr. Biochem. 2010. Vol. 21(11). Р. 1015-1032.
17. Koehrer P. Erythrocyte Phospholipid and Polyunsaturated Fatty Acid Composition in Diabetic Retinopathy. 2014 journal.pone 0106912.
18. Межгосударственный стандарт. Масла растительные и маргариновая продукция. Метод обнаружения фальсификации. Vegetable oils and margarine. Detection of falsification. http://docs.cntd.ru/document/gost-30623-98.
19. Harris W.S., Luo J., Pottala J.V. et al. Red Blood Cell Fatty Acids and Incident Diabetes Mellitus in the Women's Health Initiative Memory Study. PLoS One. 2016. Vol. 11(2).
20. Bukowiecka-Matusiak M., Burzynska-Pedziwiatr I., Sansone A. et al. Lipid profile changes in erythrocyte membranes of women with diagnosed GDM. PLoS One. 2018. Vol. 13(9).
21. Castro-Correia C., Sousa S., Norberto S. et al. The Fatty Acid Profile in Patients with Newly Diagnosed Diabetes: Why it Could be Unsuspected. Int. J. Pediatr. 2017. Vol. 2017. P. 6424186. doi: 10.1155/2017/6424186.
22. Kurotani K., Sato M., Ejima Y. et al. High levels of stearic acid, palmitoleic acid, and dihomo-γ-linolenic acid and low levels of linoleic acid in serum cholesterol ester are associated with high insulin resistance. Nutr. Res. 2012. Vol. 32(9). P. 669-675.
23. Reynoso R., Salgado L.M., Calderón V. High levels of palmitic acid lead to insulin resistance due to changes in the level of phosphorylation of the insulin receptor and insulin receptor substrate-1. Mol. Cell. Biochem. 2003. Vol. 246(1–2). P. 155-162.
24. Wang L., Folsom A.R., Zheng Z.J. Plasma fatty acid composition and incidence of diabetes in middle-aged adults: the Atherosclerosis Risk in Communities (ARIC) Study. Am. J. Clin. Nutr. 2003. Vol. 78(1). P. 91-98.
25. Bei F., Jia J., Jia Y.Q. et al. Long-term effect of early postnatal overnutrition on insulin resistance and serum fatty acid profiles in male rats. Lipids Health Dis. 2015. Vol. 26(14). P. 96.
/33.jpg)

/31.jpg)
/32.jpg)