Проблема зростання кількості опіоїдзалежних пацієнтів після перенесених ними загальних анестезій з використанням стандартних доз наркотичних анальгетиків (фентанілу, суфентанілу, альфентанілу, реміфентанілу), а також проблема формування післяопераційної гіпералгезії, індукованої застосуванням під час операцій опіоїдних анальгетиків короткої дії, призвели до пошуку методик багатокомпонентної загальної анестезії з використанням мінімальних доз наркотичних анальгетиків — так званої мультимодальної малоопіоїдної анестезії (ММА) [1].
Обов’язковими компонентами будь-якої загальної анестезії є відсутність свідомості, амнезія, пригнічення рухових рефлексів, втрата больової чутливості. Звичайно, що всі вищеперераховані ефекти загальної анестезії складно забезпечити одним загальним анестетиком, тому на сьогодні відсутність свідомості забезпечується застосуванням внутрішньовенних (в/в) анестетиків-гіпнотиків — тіопенталу натрію, пропофолу, кетаміну, етомідату, сибазону, оксибутирату натрію, або інгаляційних анестетиків — закису азоту, фторотану, севорану, ксенону. Більшість вищеперерахованих анестетиків викликають ретроградну амнезію, сибазон — антеградну амнезію. Втрата больової чутливості забезпечується застосуванням наркотичних і ненаркотичних анальгетиків, місцевих анестетиків. Пригнічення рухових рефлексів забезпечується застосуванням м’язових релаксантів [2].
У методиках ММА для отримання снодійного/гіпнотичного ефекту найчастіше використовуються такі в/в загальні анестетики, як пропофол, кетамін, та інгаляційний анестетик севофлуран. Цей ефект забезпечується переважно за рахунок пригнічення активності кіркових структур. Більшість загальних анестетиків суттєво послаблюють спонтанну і викликану активність нейронів кори головного мозку. Кожний нейрон кори містить на своїй поверхні від 2 до 10 тисяч синапсів від інших нейронів. Кожний синаптичний контакт складається з пресинаптичного закінчення (це ділянка аксона нейрона, від якого надходить імпульс), синаптичної щілини та постсинаптичної мембрани — ділянки мембрани нейрона кори [3].
В аксонах пресинаптичних нейронів генеруються потенціали дії, які призводять до вивільнення в синаптичну щілину певного медіатора з активацією відповідних рецепторів, розташованих на постсинаптичній мембрані. Потенціал дії і вивільнення нейромедіатора здійснюються за рахунок входження в нейрон іонізованого кальцію по потенціалзалежних каналах кальцію клітинної мембрани. Якщо нейромедіатором, який вивільняється в синаптичну щілину, є глутамінова кислота (глутамат), то після її взаємодії з глутаматними рецепторами клітинної мембрани нейрона кори в ній генерується збуджуючий постсинаптичний потенціал. У разі вивільнення із пресинаптичного закінчення гамма-аміномасляної кислоти (ГАМК) після її взаємодії з ГАМКергічними рецепторами клітинної мембрани нейрона кори в останньому генерується гальмівний постсинаптичний потенціал [4].
Глутамат активує рецептори постсинаптичної мембрани двох класів: іонотропні глутаматні рецептори, що з’єднані з іонними каналами мембрани нейрона кори, і метаботропні глутаматні рецептори, що з’єднані з так званим G-білком [5].
На сьогодні відомі два різновиди іонотропних глутаматних рецепторів: alpha-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid — АМРА-каїнатні та N-метил-D-аспартатні — NMDA-рецептори. Активація цих рецепторів постсинаптичної мембрани призводить до генерації в нейронах кори збуджуючого постсинаптичного потенціалу і деполяризації клітинної мембрани за рахунок входження в клітину іонів натрію і кальцію та виходу із клітини іонів калію.
ГАМК активує іонотропні ГАМК-альфа- і метаботропні ГАМК-бета-рецептори. Після зв’язування ГАМК з ГАМК-альфа-рецепторами постсинаптичної мембрани в мембранах нейронів кори відкриваються мембранні канали хлору, в результаті чого в нейроні накопичується надлишок хлору, розвивається гіперполяризація клітинної мембрани нейрона, і в постсинаптичній мембрані генерується гальмівний струм [4].
Інгаляційні анестетики типу галотан, ізофлуран, енфлуран, севофлуран працюють за рахунок пригнічення потенціалу дії в пресинаптичних нейронах шляхом закриття каналів натрію і відкриття каналів калію, в результаті чого гальмується генерація потенціалу дії і розвивається гіперполяризація мембрани пресинаптичного нейрона. Крім цього, ці анестетики зменшують пресинаптичне вивільнення глутамату й активують ГАМК-альфа-рецептори постсинаптичної мембрани нейронів кори [6].
Кетамін, закис азоту, ксенон, іони магнію інгібують NMDA-рецептори постсинаптичної мембрани нейронів кори [2].
Таким чином, спектр молекулярних ефектів у різних анестетиків відрізняється один від одного, але в основі гіпнотичного ефекту всіх анестетиків лежить тимчасове оборотне порушення внутрішньоклітинного іонного гомеостазу нейронів кори і пресинаптичних нейронів, в результаті чого гальмується генерація потенціалу дії, розвивається тимчасова гіперполяризація їх мембран і нечутливість до пошкоджуючих імпульсів, які надходять із операційного поля, і, таким чином, індукується загальна анестезія.
Аналгетичний компонент у методиках малоопіоїдної анестезії забезпечується в/в застосуванням комбінацій мінімальних доз наркотичного анальгетика-анестетика фентанілу (2 мкг/кг), кетаміну (0,5 мг/кг), дексмедетомідину (агоніста альфа-2-адренорецепторів в дозі 0,3–0,8 мкг/кг/год), нестероїдних протизапальних препаратів (НПЗП) (кеторолаку або кетопрофену), місцевого анестетика лідокаїну, забезпечуючи так звану мультимодальну аналгезію/анестезію.
Основними більпровідними трактами в організмі людини є спіноталамічний і спіноретикулярний, кожен з яких складається з трьох нейронів. Перші нейрони цих трактів локалізуються в спинномозкових гангліях. Ноцицептивні імпульси (в тому числі і больові) йдуть по дендритах та аксонах цих нейронів і прямують в складі заднього корінця в спинний мозок, де в задніх рогах переключаються на другі нейрони. Цитоархітектоніка заднього рогу спинного мозку являє собою вісім прошарків нервових клітин, різних за своєю будовою й функціональним значенням. Процес передачі збудження з першого більсприймаючого нейрона на другий є досить складним. Частина других нейронів, що розташовані в поверхневих прошарках заднього рогу (І–ІІІ прошарки), безпосередньо контактує з аксонами перших нейронів, однак більшість спінальних ней–ронів заднього рогу, що розташовані в більш глибоких прошарках, не мають моносинаптичного входу з периферії, і збудження на них передається через тісно контактуючі тіла нейронів сусідніх прошарків [5]. Структури заднього рогу спинного мозку дають початок основним більпровідним трактам — спіноталамічному та спіноретикулярному. Спіноталамічний тракт в основному утворюється аферентними волокнами клітин V прошарку і меншою мірою — І, ІV і VІ прошарків. Початок спіноретикулярного тракту пов’язують з нейронами VІІ і VІІІ прошарків заднього рогу спинного мозку. Аксони більшості цих нейронів переходять через передню комісуру і приєднуються до системи спіноталамічних трактів. Периферична аферентна інформація надходить до нейронів VІІ і VІІІ прошарків завдяки конвергенції з більш дорзально розташованих клітин задніх рогів спинного мозку. Встановлено, що нейрони VІІ і VІІІ прошарків активуються переважно пошкоджуючими стимулами. Аксони других нейронів больової чутливості проходять через білу спайку одного-двох-трьох сегментів вище, потрапляють в передній і боковий канатики протилежної сторони спинного мозку, формуючи передній і латеральний спіноталамічні тракти. Далі спіноталамічні тракти йдуть в дорзальні відділи стовбура головного мозку і в складі медіальної петлі досягають вентролатеральних ядер таламуса. Тут розташовані треті нейрони больової чутливості. Потім імпульси больової чутливості йдуть по волокнах таламічного пучка та закінчуються в постцентральній звивині тім’яної частки великого мозку (рис. 1) [5, 7].
/17.jpg)
На сьогодні механізм дії наркотичних анальгетиків пояснюють з позиції вчення про ендогенні опіоїдні системи (ЕОС). Встановлено, що в організмі існують 4 незалежні опіоїдні системи: енкефалінова, ендорфінова, динорфінова і система непептидного морфіноподібного фактора [8]. Основними морфофункціональними елементами кожної опіоїдної системи є специфічні опіоїдні рецептори (ОР) і специфічні ендогенні опіоїдні пептиди (ЕОП), які виділяються на закінченнях цих рецепторів або взаємодіють з ними, зумовлюючи певні фізіологічні ефекти, в першу чергу ендогенне знеболювання. В ендорфіновій опіоїдній системі специфічними опіоїдними пептидами є ендорфіни — альфа-, бета-, гамма-ЕНД. В енкефаліновій опіоїдній системі специфічними опіоїдними пептидами є енкефаліни — метіонін-ЕНК, лейцин-ЕНК, метоморфамід. У динорфіновій опіоїдній системі специфічними опіоїдними пептидами є динорфін-А, динорфін-Б, альфа-неоендорфін, бета-неоендорфін, лейморфін. ЕОС локалізуються в структурах центральної і периферичної нервової системи, а також практично в усіх органах — шлунку, кишечнику, печінці, нирках, наднирниках. Лімфоцити, нейтрофільні гранулоцити, тромбоцити також несуть на своїй поверхні ОР.
Зараз родина ЕОП нараховує близько 30 активних сполук, загальною рисою хімічної будови яких є те, що всі вони обов’язково містять в своїй структурі так звану опіоїдну послідовність амінокислот: тирозин — гліцин — фенілаланін — метіонін або лейцин [8]. Цю послідовність амінокислот в молекулі речовини можна ще назвати енкефаліновою, оскільки таку структуру мають найпростіші ЕОП — метіонін-ЕНК і лейцин-ЕНК, що існують в певних структурах як самостійні сполуки. Усі ЕОП мають тою або іншою мірою фармакологічні ефекти морфіну. Усі ЕОП утворюються з одного гормона-попередника — білка аденогіпофіза проопіомеланокортину, з якого також утворюються меланоцитстимулюючий та адренокортикотропний гормони.
Опіоїдні рецептори локалізуються в структурах центральної нервової системи (ЦНС), які відповідають за сприйняття, проведення і модуляцію так званої ноцицептивної, в тому числі і больової імпульсації. Це такі структури, як дендрити й аксони перших нейронів більпровідних трактів, substantia gelatinosis заднього рогу спинного мозку, вентролатеральні ядра таламуса, ретикулярні гігантоклітинне і парагігантоклітинне ядра, вентромедіальні відділи довгастого мозку, сіра речовина, що оточує третій шлуночок, синя пляма, кортикомедіальні відділи мигдалика [9]. Завдяки такому розташуванню опіоїдних рецепторів агоністи ОР здійснюють безпосередній гальмівний вплив на клітинні елементи, які беруть участь в сприйнятті і проведенні ноцицептивної імпульсації. Крім цього, агоністи ОР активують нейрони ядер шва, ретикулярного гігантоклітинного ядра, центральної сірої речовини, які дають початок гальмівним бульбоспінальним шляхам, стимуляція яких призводить до формування стану аналгезії за рахунок модуляції больової аферентації на рівні спинного мозку. Ці шляхи є енкефалінергічними і серотонінергічними [10].
Міжнародний союз фармакологів з метою уніфікації класифікації ОР розподілив опіоїдні рецептори на три основних типи: ОР1 (дельта-ОР), ОР2 (каппа-ОР) і ОР3 (мю-ОР) [11].
За сучасними уявленнями, стимуляція мю-опіоїдних рецепторів викликає розвиток супраспінальної і спінальної аналгезії, респіраторної депресії, брадикардії, ейфорії, міозу, психологічної залежності, інгібіції барорецепторів, артеріальної гіпотензії, гіпотермії, запорів, каталепсії [9]. Стимуляція дельта-рецепторів викликає переважно супраспінальну аналгезію, зменшує фізичну залежність, пригнічення дихання й гальмування діяльності травного тракту, хоча може викликати нудоту, ейфорію або дисфорію. Активація каппа-рецепторів призводить до спінальної аналгезії, седації, дисфорії, міозу, пригнічення апетиту [12].
Аналіз центральної аналгетичної активності агоністів ОР дозволив зробити висновок, що в реалізації цієї якості беруть участь переважно мю-ОР, особливо на супраспінальному рівні. Про це свідчить і висока щільність мю-ОР в ділянці неспецифічних ядер таламуса [9]. Аналгетична дія наркотичних анальгетиків в ділянці задніх рогів спинного мозку може здійснюватись як через мю-ОР, так і через каппа-ОР. Агоністи дельта-ОР потенціюють аналгетичну дію агоністів мю-ОР. Крім цього, у разі розвитку толерантності до морфіну агоністи дельта-ОР зберігають свою аналгетичну активність. Виявилось, що бензодіазепіни здатні активувати дельта-ОР. До агоністів дельта-ОР належать лей-енкефалін і бета-ендорфін. Нарешті, вважається встановленим, що опіоїди можуть зумовлювати аналгезію за рахунок активації ОР, локалізованих поза структурами ЦНС, на всіх нейронах периферичних нервових гангліїв і сплетень і за рахунок активації ОР внутрішніх органів [13].
Залежно від спорідненості до різних типів ОР з наступною їх активацією або пригніченням численна родина природних і синтетичних опіоїдів умовно поділяється на чотири групи [12]. Перша група — агоністи мю- і каппа-ОР, їх ще називають «справжні агоністи ОР». До цієї групи відносяться такі препарати: морфін, фентаніл, альфентаніл, суфентаніл, реміфентаніл, меперидин (петидин, демерол), метадон (долофін), гідроморфон (дилаудид), трамадол, дипідолор, омнопон, промедол, фенаридин, кодеїн, оксикодон, леворфанол, героїн, пропоксифен (дарвон). Друга група — агоністи каппа-ОР і одночасно антагоністи мю-ОР, їх ще називають «агоністи-антагоністи». До цієї групи належать такі препарати: налбуфін (нубаїн), пентазоцин (лексир, фортрал), циклазоцин, налорфін, буторфанол (стадол, морадол) [12]. Третя група — антагоністи мю- і каппа-ОР. Цю групу становлять налоксон і налтрексон. Існує ще одна група опіоїдів — так звані парціальні агоністи мю- і каппа-ОР. До цієї групи відносяться бупренорфін, дезоцин, мептазинол. Ці препарати активують і мю-, і каппа-ОР, однак меншою мірою, ніж справжні агоністи. Характерною особливістю фармакокінетики бупренорфіну є потужне зв’язування з мю-ОР і повільне відщеплення від них. У зв’язку з цим налоксон не завжди повністю знімає ефекти бупренорфіну, наприклад пригнічення дихання.
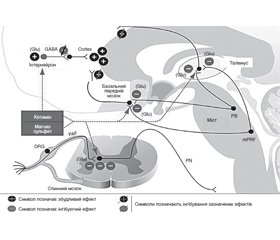
За сучасними уявленнями, аналгетичний та антиноцицептивний ефекти морфіну і морфіноподібних речовин проявляються завдяки взаємодії опіоїдів з ОР ендогенних антиноцицептивних систем спинного і головного мозку. Аналгетичний ефект морфіну та інших справжніх агоністів складається із супраспінальної дії і прямого інгібуючого впливу на ноцицептивні структури спинного мозку — дендрити й аксони чутливих нейронів спинномозкових гангліїв, нейрони І, ІV, V, VІ прошарків заднього рогу [9]. Супраспінальний вплив полягає в посиленні низхідного гальмування з антиноцицептивних структур стовбура головного мозку на нейрони спинного мозку, які пов’язані з ноцицептивною аферентацією. В гальмівному впливі опіоїдів на рівні спинного мозку вирізняють пресинаптичний і післясинаптичний компоненти. Пресинаптичне гальмування здійснюється перш за все блокадою виділення із аксонів перших більсприймаючих нейронів більпровідної речовини Р, а також звільненням ГАМК із ГАМКергічних закінчень. Післясинаптичний компонент гальмування полягає в сповільненні швидкості наростання збуджуючих постсинаптичних потенціалів в нейронах І, ІV, V, VІ прошарків заднього рогу спинного мозку [12]. А це, як відомо, другі нейрони більпровідних трактів (рис. 2) [2].
/18.jpg)
Протягом багатьох років вважали, що аналгетичний ефект НПЗП зумовлений виключно зворотним пригніченням синтезу периферичних простагландинів, в першу чергу PgE2, який відіграє ключову роль у формуванні периферичної сенситизації завдяки блокаді циклооксигенази-1 (ЦОГ-1) [14].
Патофізіологічною основою периферичної сенситизації (первинної гіпералгезії) вважається підвищення чутливості больових рецепторів до дії пошкоджуючих стимулів. Відомо, що тканинна травма супроводжується вивільненням простагландинів симпатичними постгангліонарними нейронами, а також субстанції Р і низки інших алгогенних пептидів (брадикініну, нейрокініну А, кальцитонін-ген-спорідненого пептиду, біогенних амінів), які після взаємодії з відповідними рецепторами більпровідних нервів підвищують чутливість останніх до механічних і термічних стимулів [14]. Брадикінін може чинити як пряму, так і непряму дію на чутливі нервові закінчення. Прямий збуджуючий ефект брадикініну на чутливі нервові закінчення опосередковується бета-адренорецепторами і пов’язаний з активацією мембранної фосфоліпази С. Непряма збуджуюча дія брадикініну зумовлена його впливом на різні тканинні елементи (ендотеліальні клітини, фібробласти, тучні клітини, макрофаги і нейтрофільні гранулоцити) із стимуляцією синтезу в них медіаторів запалення, які взаємодіють з відповідними рецепторами на чутливих нервових закінченнях, активуючи їх мембранну аденілатциклазу з накопиченням в них циклічного аденозинмонофосфату (цАМФ). В свою чергу, цАМФ і фосфоліпаза С стимулюють утворення ферментів, які фосфорилюють білки іонних каналів. В результаті цього змінюється проникність мембран нейронів для іонів таким чином, що підвищується збудливість нервових закінчень і здатність генерувати больові нервові імпульси. Це явище отримало назву «периферична сенситизація» [15].
Патофізіологічною основою центральної сенситизації (вторинної гіпералгезії) вважається підвищена збудливість нейронів задніх рогів спинного мозку (других нейронів більпровідних шляхів) за рахунок активації їх NMDA-рецепторів і розвитку феномену «розширення активності» з розширенням рецепторних полів. Клінічно ділянка вторинної гіпералгезії характеризується підвищенням больової чутливості до інтенсивних механічних стимулів поза зоною пошкодження і може розташовуватися на достатньому віддаленні від місця пошкодження, в тому числі і на протилежному боці тіла [16]. На сьогодні велике значення в механізмах сенситизації ноцицептивних нейронів задніх рогів спинного мозку мають збуджуючі амінокислоти і нейропептиди. За допомогою імуногістохімічних методів дослідження було встановлено, що синаптичні терміналі багатьох тонких високопорогових аферентних волокон містять як нейромедіатор глутамат, аспартат і низку нейропептидів, таких як субстанція Р, нейрокінін А, кальцитонін-ген-родинний пептид та багато інших, що вивільняються з пресинаптичних терміналей під дією ноцицептивних імпульсів [17]. Звільнення глутамату із пресинаптичних терміналей відбувається за будь-якої ноцицептивної дії. Вважається, що реалізація нетривалих фізіологічних больових реакцій у разі звільнення глутамату опосередковується через АМРА-рецептори, в той час як NMDA-рецептори забезпечують тривалу, в тому числі і патологічну гіперактивність ноцицептивних нейронів. Таким чином, індуковане ноцицептивною стимуляцією вивільнення глутамату і нейропептидів із центральних терміналей чутливих волокон С викликає стійкі зміни збудливості ноцицептивних нейронів, посилення їх спонтанної активності, збільшення тривалості після розрядів і розширення рецептивних полів.
Необхідно відмітити, що сенситизація ноцицептивних нейронів, яка виникла в результаті пошкодження тканин, може декілька годин або днів зберігатися після припинення надходження ноцицептивних імпульсів з периферії, іншими словами, якщо вже відбулася гіперактивація ноцицептивних нейронів, то вона не потребує додаткового підживлення імпульсами з місця пошкодження.
Крім сенситизації ноцицептивних нейронів заднього рогу спинного мозку пошкодження тканин викликає також підвищення збудливості і реактивності ноцицептивних нейронів вищерозташованих центрів, включаючи ядра таламуса і соматосенсорну кору великих півкуль головного мозку [17].
Таким чином, периферичне пошкодження запускає цілий каскад патофізіологічних і регуляторних процесів, що охоплюють всю ноцицептивну систему — від тканинних рецепторів до нейронів кори. Тому аналгетичний ефект може бути досягнутий шляхом блокади больової імпульсації на кожному етапі її передачі.
Нестероїдні протизапальні препарати, в першу чергу інгібітори ЦОГ-1, блокують формування больової імпульсації на рівні травмованих тканин за рахунок запобігання продукції PgE2 і запобігання розвитку периферичної і центральної сенситизації.
Певні перспективи підвищення якості інтраопераційної і післяопераційної анестезії пов’язані з використанням препаратів, активних щодо NMDA-рецепторів. Це такі препарати, як кетамін і магнію сульфат [18].
Основні антиноцицептивні ефекти кетаміну зумовлені блокуванням глутаматних NMDA-рецепторів мембран нейронів заднього рогу спинного мозку (другі нейрони ноцицептивних і більпровідних шляхів). Блокування ноцицептивних входів на цьому рівні запобігає надходженню ноцицептивної імпульсації в структури спинного мозку з периферії. Кетамін блокує NMDA-рецептори мембран кіркових нейронів та ноцицептивних нейронів стовбуру мозку, що посилює його антиноцицептивні ефекти та зумовлює снодійний ефект [19].
У низьких дозах кетамін блокує NMDA-рецептори інтернейронів, що супроводжується пригніченням ГАМКергічних структур з розгальмуванням пірамідних нейронів і дифузною збудженістю нейронів кори. На електроенцефалографії (ЕЕГ) це відображається у вигляді гамма-хвиль з амплітудою 25–30 Гц, а клінічно проявляється галюцинаціями. У більш високих дозах кетамін блокує збуджуючі NMDA-рецептори мембран нейронів пірамідних шляхів, нейронів висхідної частини ретикулярної формації, що супроводжується глибокою втратою свідомості, глибокими повільними дельта-хвилями з амплітудою 0,1–4 Гц на ЕЕГ, які чергуються з гамма-коливаннями (рис. 3) [2, 20].
/20.jpg)
Магній вважається неспецифічним блокатором NMDA-рецепторів. У зв’язку з цим в/в інфузія розчину магнію сульфату може бути використана в програмах мультимодальної загальної анестезії для зниження дози інших антиноцицептивних препаратів. Магній також посилює ефекти снодійних препаратів. У разі, коли магній використовується як компонент мультимодальної загальної анестезії, необхідно брати до уваги його гіпотензивний і міорелаксуючий ефекти. Необхідно пам’ятати, що високі дози препаратів магнію можуть викликати порушення атріовентрикулярної (АВ) провідності, AВ-блокаду [21, 22].
Антиноцицептивний ефект дексмедетомідину і клонідину зумовлюється посиленням низхідної бульбоспінальної гальмівної імпульсації на ноцицептивні структури заднього рогу спинного мозку [23]. Відомо, що нейрони ядер шва, ретикулярного гігантоклітинного ядра, центральної сірої речовини дають початок гальмівним бульбоспінальним шляхам, стимуляція яких призводить до формування стану аналгезії за рахунок модуляції больової аферентації на рівні спинного мозку. Таким чином, дексмедетомідин і клонідин активують вищеперераховані структури. Седація і втрата свідомості, викликані дексмедетомідином, зумовлюються норадреналін-опосередкованим гальмуванням преоптичної зони гіпоталамуса і зниженням норадренергічної передачі імпульсації в таламусі. У разі використання дексмедетомідину або клонідину як компонентів ММА необхідно пам’ятати, що механізм дії дексмедетомідину і клонідину полягає в активації альфа-2-адренорецепторів базальних відділів головного мозку і клінічно проявляється брадикардією, артеріальною гіпотензією або гіпертензією (залежно від швидкості введення), міозом, сухістю шкіри і слизових оболонок [24, 25].
Механізм анестетичної дії лідокаїну полягає в запобіганні деполяризації мембрани нейрона, виникненню потенціалу дії та поширеності нервового імпульсу завдяки блокаді натрієвих каналів клітинної мембрани [2]. Цілісність клітини та її метаболізм не змінюються, а проведення електричного імпульсу блокується шляхом унеможливлення проникнення натрію до клітини, що в нормальних умовах викликає потенціал дії і деполяризацію клітинної мембрани. На реполяризацію, яка залежить від переміщення калію всередину клітини, місцевий анестетик не діє. Тому в/в введення лідокаїну, викликаючи блокаду нейропровідності на рівні більсприймаючих і більпровідних нейронів, спричиняє мембраностабілізуючу дію на інші клітини організму, підтримуючи в них потенціал спокою і сприяючи накопиченню внутрішньоклітинної енергії за рахунок внутрішньоклітинного накопичення іонів калію [26].
Внутрішньовенна інфузія місцевого анестетика лідокаїну в програмах ММА використовується для зменшення інтраопераційної ноцицепції. Крім цього, лідокаїн блокує NMDA-рецептори мембран нейронів стовбура мозку і мигдалика. Таким чином, лідокаїн зменшує інтенсивність ноцицептивної імпульсації і посилює седативний ефект [27].
На сьогодні не до кінця відпрацьована стратегія вибору оптимальних комбінацій лікувальних препаратів для забезпечення адекватної ММА. Тому дослідження ефективності/адекватності різних комбінацій лікувальних препаратів для ММА в різних окремих галузях хірургії є актуальними і гостро необхідними.
Використання ММА при проведенні лапароскопічних оперативних втручань на нирках
Використання рутинних доз опіоїдів при проведенні оперативних втручань може мати низку небажаних побічних ефектів, таких як післяопераційна (п/о) гіпералгезія, центральна депресія дихання, парез кишечника, нудота, блювання [28]. У хворих з уже скомпрометованою функцією нирок [29] особливої уваги заслуговує захист ниркових функцій від токсичної дії анестетиків і знеболюючих препаратів під час проведення анестезіологічного забезпечення оперативних втручань на нирках [30, 31].
Пацієнти зі зниженням швидкості клубочкової фільтрації потребують коригування дози анестетиків та анальгетиків або уникнення застосування деяких з них. Пацієнти з патологією нирок схильні до виникнення побічних ефектів, пов’язаних з накопиченням лікувального препарату внаслідок порушення його виведення, з підвищеною чутливістю до лікувальних препаратів, з наявністю супутніх захворювань [29]. Тому такі хворі вимагають застосування комбінації декількох анестетиків/анальгетиків в мінімальних дозах, які діють на різних рівнях більпровідної системи, для інтраопераційної і післяопераційної аналгезії [32].
Лапароскопічна (ЛПС) урологічна хірургія зменшує операційну травму порівняно з відкритою хірургією. Однак лапароскопічна хірургія не позбавляє від специфічного болю при ЛПС-операціях.
Є кілька механізмів розвитку болю, пов’язаного з лапароскопічною хірургією: біль в місці проколу порту, біль внаслідок розтягнення очеревини нагнітанням вуглекислого газу, вісцеральний біль і біль на верхівці плеча і між лопатками. Швидка інсуфляція вуглекислого газу в черевну порожнину може викликати розрив кровоносних судин, травматичне розтягнення нервів і звільнення медіаторів запалення. Післяопераційний залишковий газ викликає біль на верхівці плеча, у спині і біль у верхній частині живота внаслідок подразнення діафрагмального нерва. Тому той факт, що в лапароскопії існують різні механізми виникнення болю, вимагає використання і різних методів усунення болю [33].
Дослідження анестезіологічного забезпечення ЛПС оперативних втручань на нирках обмежені відсутністю якісних рандомізованих контрольованих проспективних досліджень і невеликим числом учасників. Тому дослідження ефективності й безпеки різновидів загальної анестезії під час проведення таких оперативних втручань залишається актуальною проблемою.
У методиці ММА ми використовували такі лікувальні препарати.
Парацетамол — метаболізується в печінці до п’яти неактивних метаболітів. Термінальний період напіввиведення його сульфатних і глюкуронідних метаболітів продовжується у пацієнтів з нирковою недостатністю, таким чином, інтервал дозування парацетамолу повинен бути збільшений до 6–8 годин у пацієнтів з порушеннями функції нирок. В цілому парацетамол вважається одним із найбезпечніших засобів для лікування легкого та середнього ступеня болю у пацієнтів з нирковою патологією, якщо дозування нижче максимальної добової дози (4000 мг) [28, 34].
Кетопрофен — метаболізується в печінці, де приблизно 80 % дози виводиться з сечею у вигляді метаболіту глюкуроніду. Зниження дози рекомендується при нирковій недостатності середнього і тяжкого ступенів і діалізі, тому що він не діалізується [35].
Кетамін — пацієнти зі зниженими функціями нирок не потребують зменшення доз кетаміну [36].
Нефопам — рекомендується з обережністю використовувати при нирковій недостатності середнього і тяжкого ступенів, оскільки при цих станах метаболізм і виведення нефопаму з організму можуть бути порушені [37].
Фентаніл — в основному метаболізується в печінці до неактивних метаболітів. Кліренс фентанілу знижується у пацієнтів з помірною та тяжкою нирковою недостатністю. Фентаніл не діалізується через його фармакокінетичні властивості (висока білково-зв’язуюча здатність, низька розчинність в воді, висока молекулярна маса і великий об’єм розподілу) [12]. Тому використання мінімальних доз опіоїдів є оптимальним рішенням у таких хворих.
Пропофол — швидко розподіляється і швидко виводиться з організму (загальний кліренс становить від 1,5 до 2 л/хв). Виведення пропофолу відбувається шляхом метаболізму, головним чином у печінці, внаслідок чого утворюються неактивні кон’югати пропофолу і відповідний йому хінол, що виводяться з сечею. Тому використання пропофолу рекомендується у пацієнтів з порушеною функцією нирок [38].
Атракуріум — спонтанно метаболізується шляхом елімінації Хоффмана (неферментативний процес, що перебігає при фізіологічних значеннях рН і температури тіла), а також шляхом ефірного гідролізу з участю неспецифічних естераз плазми крові. Елімінація атракуріуму не залежить від функції нирок або печінки. Продуктами розпаду атракріуму є лауданозин та інші метаболіти. Метаболіти не мають міорелаксуючих властивостей, тому хворі з порушеною функцією нирок не потребують зменшення доз цього препарату [39].
Лідокаїн — при нирковій недостатності не відбувається накопичення лідокаїну або його метаболітів, коригування дози не потрібно [40].
Отже, парацетамол, НПЗП, місцеві анестетики можуть розглядатись як альтернатива наркотичним анальгетикам, які мають цілу низку небажаних побічних ефектів, для інтраопераційного та післяопераційного знеболювання [28]. Цих простих анальгетиків може бути достатньо для лікування легкого і помірного післяопераційного болю, а також для зниження потреби в опіоїдах і зменшення пов’язаних з ними побічних ефектів [41–43]. НПЗП є цінними анальгетиками, і від них не слід відмовлятися у пацієнтів з легким і середнім ступенем патологією нирок, оскільки відсутні докази того, що короткострокова терапія призводить до будь-якого прогресування подальшої хронічної ниркової недостатності [44].
Інші ад’юванти, такі як кетамін, нефопам, та внутрішньовенне введення лідокаїну можуть використовуватись для поліпшення періопераційного контролю болю, зменшення дози опіоїдів і запобігання можливості трансформації гострого післяопераційного болю в хронічний біль [29, 45].
Внутрішньовенне введення лідокаїну виявилось ефективним під час проведення лапароскопічних і відкритих процедур [45]. Результати 16 досліджень, в яких лідокаїн отримували 395 пацієнтів, показали як у відкритій, так і в лапароскопічній групах зменшення болю в спокої та з кашлем до 48 годин після операції; зниження споживання опіоїдів на 85 %, ніж в контрольній групі; більш раннє відновлення функції кишечника (перше випорожнення відбулось на 28 годин раніше у пацієнтів, які отримували лідокаїн, порівняно з контрольною групою) і більш коротке перебування в стаціонарі (тривалість перебування знизилась на 1,1 доби). У дослідженні також йдеться про те, що не було відмічено токсичності або клінічно значимих побічних ефектів від в/в введення лідокаїна. Лідокаїн є безпечним, ефективним і економічним, тому вимагає подальшого дослідження як в/в анальгетик [46]. При нирковій недостатності не спостерігається помітного накопичення лідокаїну або його метаболітів; отже, коригування дози не потрібно [47].
Власний досвід використання ММА при проведенні лапароскопічних оперативних втручань на нирках
Для визначення ефективності ММА як методики анестезіологічного забезпечення при проведенні ЛПС оперативних втручань на нирках, ми дослідили ефективність цього різновиду загальної анестезії у 28 пацієнтів, яким були виконані ЛПС-операції на нирках (ЛПС-кістектомія, ЛПС-резекція нирки, ЛПС-пластика мисково-сечовідного сегмента). Середній вік пацієнтів становив 46,60 ± 15,55 року, середня маса тіла — 81,51 ± 13,56 кг. Середня тривалість оперативного втручання — 110,00 ± 34,48 хв, середня тривалість анестезії — 135,00 ± 35,35 хв.
Методика ММА включала використання для премедикації парацетамолу в дозі 1000 мг в/в; для індукції: в/в пропофол 2 мг/кг, фентаніл 1,5–2 мкг/кг, атракуріум 0,6 мг/кг з подальшою інтубацією трахеї. Підтримка анестезії: севофлуран (1,5–2 МАК), кетамін (0,5 мг/кг) та лідокаїн 1 мг/кг болюсно з одночасним налагодженням безперервної в/в інфузії останнього зі швидкістю 1,5 мг/кг/год. Середня доза фентанілу, що була використана впродовж усього часу анестезії, становила 238,0 ± 26,8мкг (1,6 мкг/кг/год). За 30 хв до закінчення операції в/м вводився нефопам 20 мг. Після закінчення операції хворі отримували внутрішньом’язову (в/м) ін’єкцію декскетопрофену в дозі 50 мг для післяопераційного знеболювання.
Для контролю глибини анестезії використовувався BIS-моніторинг, показники якого підтримувалась в межах 36–60 %.
Штучна вентиляція легень здійснювалась повітряно-кисневою сумішшю у режимі нормовентиляції (потік 1 л/хв) FiO2 = 50 %, рівень периферичної сатурації SpO2 становив 98–100 %.
Під час індукції спостерігалось зниження частоти серцевих скорочень (ЧСС) на 24,0 ± 2,7 % щодо вихідних значень. На етапі інтубації трахеї відмічалось збільшення ЧСС щодо попередніх значень на 25,0 ± 2,6 %. Показники середнього артеріального тиску (АТсер.) на етапі індукції зменшувалися на 35,3 ± 3,7 % порівняно з вихідними даними.
Під час підтримки анестезії, після в/в введення субнаркотичних доз кетаміну і вищевказаних доз лідокаїну, ЧСС дорівнювала 64,0 ± 5,3 % уд/хв. Показники АТсер. були на 15,0 ± 4,2 % вищими щодо значень, зареєстрованих на попередньому етапі.
При ЛПС-резекціях нирки з пухлиною, на етапі вилучення пухлини реєструвалось збільшення АТсер. на 13,0 ± 1,5 % та ЧСС на 16,0 ± 1,6 % щодо попередніх значень, у зв’язку з цим додатково вводився фентаніл в дозах 50–100 мкг.
Після закінчення анестезії позитивний вербальний контакт з пацієнтом був зафіксований в середньому через 18,0 ± 2,4 хв. Усі хворі були екстубовані в умовах операційної в середньому через 20,0 ± 4,1 хв після завершення операції.
У післяопераційному періоді жоден пацієнт не потребував знеболювання морфіном (рівень болю визначався за візуально-аналоговою шкалою та не перевищував 4 бали). Для п/о знеболювання використовували в/м введення декскетопрофену 50 мг за вимогою пацієнта, не більше 4 разів на добу. Наступної доби після операції всі хворі активізувалися (сідали в ліжку, ходили).
У результаті проведення даного дослідження було встановлено, що використання ММА з в/в введенням лідокаїну при проведенні лапароскопічних оперативних втручань на нирках має адекватний аналгезуючий ефект, дозволяє відмовитись від використання рутинних доз наркотичних анальгетиків, запобігає розвитку п/о гіпералгезії та зменшує такі побічні прояви наркотичних анальгетиків, як центральна депресія дихання, парез кишечника, нудота та блювання.
Висновки
Протягом багатьох років з моменту відкриття ефірного наркозу в 1846 році всі вважали, що це єдиний препарат для забезпечення анестезії. Але минуло не так багато років, й анестезіологи прийшли до того, що використання збалансованої багатокомпонентної загальної анестезії підвищує ймовірність досягнення адекватної анестезії при мінімізації побічних ефектів. Наявність побічних ефектів наркотичних анальгетиків і недавня епідемія опіоїдів стали рушійною силою з розробки нових збалансованих методик проведення загальної анестезії, що зменшують або виключають використання опіоїдів.
Наведена нами методика ММА включає використання декількох антиноцицептивних агентів для пригнічення ноцицептивних імпульсів — це мінімальні дози опіоїдів, НПЗП, місцеві анестетики, кетамін, магнію сульфат та ненаркотичні анальгетики центральної дії. Кожен препарат націлений на окремий компонент ноцицептивної системи. Наш аналіз нервової системи забезпечує нейрофізіологічний підхід для розуміння ефектів кожного анестетика і для вибору анестезіологічних комбінацій. Ноцицепція, викликана хірургічним втручанням, є основною причиною для проведення загальної анестезії та основним джерелом гемодинамічних і стресових реакцій пацієнта. Якщо ноцицептивний контроль адекватний, реакції на стрес будуть мінімізовані, буде досягнута симпатична стабільність. Відповідно до нашої стратегії, використання опіоїдів не повинно бути виключено, ми намагаємось максимально зменшити їх використання. Замість цього інші препарати використовуються разом з опіоїдами для досягнення антиноцицептивного контролю під час операції і післяопераційного знеболювання. Для досягнення адекватного післяопераційного контролю болю мультимодальне знеболювання має бути продовжено в найближчому післяопераційному періоді.
Що стосується хворих з порушеними функціями нирок, ми прагнемо захистити нирки від подальшого пошкодження, а також уникнути побічних ефектів від накопичення анальгетиків та їх метаболітів. Розуміння фармакокінетики анальгетиків допоможе передбачити їх переносимість у пацієнтів з патологією нирок. Тому такі хворі вимагають застосування комбінації декількох анестетиків/анальгетиків в мінімальних дозах, які діють на різних рівнях більпровідної системи, для інтраопераційної і післяопераційної аналгезії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
/17.jpg) На сьогодні механізм дії наркотичних анальгетиків пояснюють з позиції вчення про ендогенні опіоїдні системи (ЕОС). Встановлено, що в організмі існують 4 незалежні опіоїдні системи: енкефалінова, ендорфінова, динорфінова і система непептидного морфіноподібного фактора [8]. Основними морфофункціональними елементами кожної опіоїдної системи є специфічні опіоїдні рецептори (ОР) і специфічні ендогенні опіоїдні пептиди (ЕОП), які виділяються на закінченнях цих рецепторів або взаємодіють з ними, зумовлюючи певні фізіологічні ефекти, в першу чергу ендогенне знеболювання. В ендорфіновій опіоїдній системі специфічними опіоїдними пептидами є ендорфіни — альфа-, бета-, гамма-ЕНД. В енкефаліновій опіоїдній системі специфічними опіоїдними пептидами є енкефаліни — метіонін-ЕНК, лейцин-ЕНК, метоморфамід. У динорфіновій опіоїдній системі специфічними опіоїдними пептидами є динорфін-А, динорфін-Б, альфа-неоендорфін, бета-неоендорфін, лейморфін. ЕОС локалізуються в структурах центральної і периферичної нервової системи, а також практично в усіх органах — шлунку, кишечнику, печінці, нирках, наднирниках. Лімфоцити, нейтрофільні гранулоцити, тромбоцити також несуть на своїй поверхні ОР.
На сьогодні механізм дії наркотичних анальгетиків пояснюють з позиції вчення про ендогенні опіоїдні системи (ЕОС). Встановлено, що в організмі існують 4 незалежні опіоїдні системи: енкефалінова, ендорфінова, динорфінова і система непептидного морфіноподібного фактора [8]. Основними морфофункціональними елементами кожної опіоїдної системи є специфічні опіоїдні рецептори (ОР) і специфічні ендогенні опіоїдні пептиди (ЕОП), які виділяються на закінченнях цих рецепторів або взаємодіють з ними, зумовлюючи певні фізіологічні ефекти, в першу чергу ендогенне знеболювання. В ендорфіновій опіоїдній системі специфічними опіоїдними пептидами є ендорфіни — альфа-, бета-, гамма-ЕНД. В енкефаліновій опіоїдній системі специфічними опіоїдними пептидами є енкефаліни — метіонін-ЕНК, лейцин-ЕНК, метоморфамід. У динорфіновій опіоїдній системі специфічними опіоїдними пептидами є динорфін-А, динорфін-Б, альфа-неоендорфін, бета-неоендорфін, лейморфін. ЕОС локалізуються в структурах центральної і периферичної нервової системи, а також практично в усіх органах — шлунку, кишечнику, печінці, нирках, наднирниках. Лімфоцити, нейтрофільні гранулоцити, тромбоцити також несуть на своїй поверхні ОР.
/18.jpg)
/20.jpg)