Вступ
Згідно з даними Всесвітньої організації охорони здоров’я (ВООЗ), швидке зростання стійкості мікроорганізмів до антибактеріальних препаратів загрожує підірвати основи охорони здоров’я, закладені протягом останніх 50 років. Як наслідок, ВООЗ визначила антибіотикорезистентність однією з головних загроз людству. Недостатня обізнаність клініцистів щодо правил раціональної антибіотикотерапії призводить до невиправданих призначень антибактеріальних препаратів [1].
Аналіз моніторингу еволюції мікробного пейзажу за період з 2005 по 2015 рік на прикладі чотирьох провідних відділень інтенсивної терапії (ВІТ) загального профілю м. Києва показав, що на сьогодні провідними мікробними патогенами ВІТ є Klebsiella pneumoniaе, Acinetobacter baumannii, Enterococcus faecalis, Pseudomonas aeruginosa [2].
Результати отриманих нами досліджень перекликаються із світовими тенденціями еволюції мікробного пейзажу у ВІТ і формування поліантибіотикорезистентності у провідних мікробних патогенів. Медична спільнота зіткнулася з загрозою невиліковних з причини антибіотикорезистентності інфекцій, особливо зумовлених бактеріями, які продукують карбапенемази, а саме Klebsiella pneumoniaе, Acinetobacter baumannii, Pseudomonas aeruginosa.
Що ж собою являють провідні мікробні патогени ВІТ морфологічно?
Клебсієли — це товсті короткі грамнегативні палички розміром 2–5 × 0,3–1,25 мкм, із закругленими кінцями, нерухомі. Спори не утворюють. У мазках розташовуються попарно або поодиноко, зазвичай оточені капсулою. Добре ростуть на простих живильних середовищах при температурі 35–37 °С. На м’ясо-пептонному агарі утворюють каламутні слизові колонії, а в бульйоні — інтенсивне помутніння. Клебсієли не продукують екзотоксини, а містять ендотоксини. Капсульні бактерії включають три антигени: капсульний (К-антиген), соматичний гладкий (О-антиген), соматичний шорсткий (R-антиген). К- та О-антигени є вуглеводами, R-антиген — протеїном.
Резистентність клебсієл досить висока: при кімнатній температурі вони зберігаються місяцями, при нагріванні до 65 °С гинуть протягом 1 години. Чутливі до дії різних дезінфікуючих речовин: розчину хлораміну, фенолу та ін. Вірулентність клебсієл пов’язана з наявністю у них капсул. Бактерії, що втратили капсулу, стають невірулентними і при попаданні в організм швидко фагоцитуються і знищуються.
Klebsiella pneumoniaе є одним із збудників пневмонії, урогенітальних інфекцій, гнійних абсцесів печінки, селезінки. Цей збудник викликає гнійні і фіброзні плеврити, перикардити, гайморити, ендофтальміти. Klebsiella pneumoniaе — важливий збудник серед нозокоміальних інфекцій. Мікроорганізм є патогененним і для деяких тварин. Деякі штами полірезистентні до антибіотиків, що обумовлено наявністю R-плазмід, іноді виявляється стійкість до карбапенемів за рахунок наявності у Klebsiella pneumoniaе карбапенем-гідролізуючих β-лактамаз. Капсула Klebsiella pneumoniaе обумовлює її патогенність. Для пневмонії, викликаної Klebsiella pneumoniaе, характерним є деструкція легеневої тканини й формування абсцесів.
Acinetobacter baumannii є збудником опортуністичних бактеріальних інфекцій, головним чином нозокоміальних інфекцій. Acinetobacter baumannii — це грамнегативна паличка, в мазках розміщуються парами, короткими ланцюжками або невпорядкованими скупченнями. Джгутиків не має, але завдяки наявності полярних фімбрій на щільних середовищах для цих бактерій характерна «посмикувальна» рухомість. Вони поширені в природі, їх виділяють з води, ґрунту, пастеризованого молока, заморожених продуктів, а також з повітря стаціонарів і змивів з різноманітного медичного обладнання, розчинів і препаратів (у тому числі і препаратів крові). Вони виявлені на шкірних покривах 25 % клінічно здорових людей (особливо медичного персоналу), а також на слизовій носоглотки (більше 7 %). Їх часто виділяють з уражених шкірних покривів, дихальних шляхів, сечовидільного тракту та статевих органів, при кон’юнктивітах, ендокардитах, менінгітах, перитонітах і септицеміях. Ацинетобактерії — це неферментуючі грамнегативні палички. Останнім часом спостерігається збільшення частоти госпітальних інфекцій, викликаних ацинетобактеріями. Опортуністичний патоген Acinetobacter baumannii часто зумовлює високу захворюваність серед людей з ослабленим імунітетом, особливо у тих, хто тривалий час (> 90 днів) перебував у лікарні [3]. Тобто патогенез пов’язаний із порушенням імунітету, оскільки мікроорганізм позбавлений будь-яких факторів патогенності, включаючи ліпополісахариди клітинної стінки. Капсула Acinetobacter baumannii інгібує ефективність фагоцитарних реакцій і полегшує адгезію до епітелію, а здатність до секреції бактеріоцидів полегшує процес колонізації.
Останніми роками даний патоген був позначений як «червоний попереджувальний» людський патоген, що тривожить медичну спільноту. Це значною мірою обумовлено його широким спектром резистентності до антибіотиків. ВООЗ внесла Acinetobacter baumannii до найбільш поширених і серйозних внутрішньолікарняних патогенів [4]. Смертність у разі ацинетобактерної інфекції зазвичай дуже висока і становить 20–60 %. В європейських країнах проводять ретельний контроль присутності штамів Acinetobacter baumannii в лікувально-профілактичних установах через загрозу епідемічного поширення [5]. Найбільш клінічно значущими представниками роду Acinetobacter вважають Acinetobacter baumannii і Acinetobacter lwoffii, на частку Acinetobacter baumannii при цьому припадає понад 90 % інфікувань. Серйозною проблемою є значне підвищення числа бактеріємій, викликаних полірезистентними штамами Acinetobacter baumannii [6]. Однією з найбільш важливих причин такої резистентності є продукція β-лактамаз класу D, що гідролізують карбапенеми: Оха-23, Оха-40 і Оха-58-подібних карбапенемаз, а також метало-β-лактамаз (MBL) груп IMP, VIM і NDM.
Acinetobacter baumannii стала важливим внутрішньолікарняним мікробним патогеном у всьому світі. Бактеріальний менінгіт, зумовлений Acinetobacter baumannii, є частим ускладненням після нейрохірургічних операцій. В його лікуванні може бути ефективним інтратекальне введення колістину [7].
Pseudomonas aeruginosa (синьогнійна паличка) — один з основних збудників гнійно-запальних процесів, особливо в умовах стаціонару. Перший опис ранової інфекції, викликаної синьогнійною паличкою, належить Люку (1862). Перший спалах госпітальної інфекції, викликаної Pseudomonas aeruginosa, зареєстрований в 1897 р.
Pseudomonas aeruginosa поширена повсюдно, істотне значення в циркуляції збудника має вода, в якій він може виживати до 1 року (при 37 °С), у тому числі у багатьох розчинах, що застосовуються в медицині (наприклад, рідина для зберігання контактних лінз). Іноді Pseudomonas aeruginosa входить до складу нормальної мікрофлори людини (шкіра пахвової ділянки, вух, носа; слизова оболонка глотки, шлунково-кишкового тракту). Pseudomonas aeruginosa зумовлює до 15–20 % усіх внутрішньолікарняних інфекцій.
Pseudomonas aeruginosa — це грамнегативні палички, рухливі, мають 1–2 полярних джгутика, в мазку розташовуються поодиноко, попарно, короткими ланцюжками, синтезують крохмалеподібну речовину типу позаклітинного слизу, більш вірулентні штами синтезують підвищену його кількість. Добре росте на простих поживних середовищах, має обмежену потребу в живильних речовинах. Зростає в широкому діапазоні температур (4–42 °С). Виражений хемоорганотроф, строгий аероб, протеолітична активність сильно виражена, сахаролітична — низька. Продукує бактеріоцини — піоцини (білки, що мають бактерицидний ефект на мікроорганізми аналогічного або генетично близького виду). Характерним є пігментоутворення. Найбільш часто зустрічаються: піоціанін (забарвлює середовище, виділення ран в синьо-зелений колір), флуоресцин (флуоресціює при УФ-опроміненні). Деякі штами можуть синтезувати інші пігменти. Високовірулентні штами синтезують піоціанін у великих кількостях. При виділенні культур можуть спостерігатися атипові непігментовані штами. Патогенна дія обумовлена утворенням екзотоксинів і вивільненням ендотоксинів при загибелі клітин. Pseudomonas aeruginosa виробляє такі екзотоксини:
— екзотоксин А — викликає порушення організації матриці білкового синтезу;
— екзоензим S — викликає глибокі патологічні процеси в легенях;
— цитотоксин — викликає нейтропенію та цитоліз інших клітин;
— гемолізини, фосфоліпази.
Серед продуктів життєдіяльності значення мають ентеротоксичний фактор (можливо, відповідальний за розвиток діарейного синдрому), фактор проникності, нейрамінідаза (порушує метаболізм нейрамінової кислоти), протеолітичні ферменти (протеази, колагеназа). Має соматичний О- і джгутиковий Н-антигени, у мукоїдних штамів можна виявити капсульний К-антиген.
Незважаючи на наявність великої кількості факторів вірулентності, синьогнійні інфекції рідко спостерігаються в осіб з нормальною резистентністю та неушкодженими анатомічними бар’єрами. Більшість штамів мають поверхневі ворсинки, що забезпечують адгезію до епітелію. Взаємодія з клітинами реалізується через рецептори, певну роль відіграє вироблений слиз. Прикріплення стимулює дефіцит фібронектину, що спостерігається при муковісцидозі та інших хронічних захворюваннях легень. Типовий позаклітинний паразит, розмноження прямо обумовлено здатністю протистояти дії факторів резистентності. Основну роль у патогенезі уражень відіграють токсини збудника.
Не характерна висока інвазивність, перебіг інфекцій тяжкий, виражений фатальний характер мають септицемії. На частку Pseudomonas aeruginosa серед грамнегативних збудників нозокоміальних інфекцій у ВІТ припадає 18 % усіх виділених штамів (друге місце після кишкової палички). Є одним з основних збудників нозокоміальних пневмоній, уражень сечостатевої системи, викликає 20–25 % гнійних хірургічних інфекцій і первинних грамнегативних бактеріємій. Часто зустрічається у хворих з опіками, захворюваннями сечового міхура. Фактори інфікування: порушення правил стерилізації, зберігання й застосування судинних і сечових катетерів, голок для спінальної пункції, а також різних розчинів, що застосовуються в медицині.
Ентерококи (лат. Enterococcus) — рід грампозитивних коків підкласу лактобактерій. Часто представлені парами (диплококи) або короткими ланцюжками, які складно відрізнити від стрептококів за фізіологічними характеристиками. Два види є основними симбіотичними організмами кишечника людини: E.faecalis (90–95 %) та Enterococcus faecium (5–10 %). Це факультативні анаероби, здатні виживати як у безкисневому середовищі, так і в насиченому киснем [8]. Спори не утворюють, проте стійкі в широкому діапазоні умов. Ростуть при температурі 10–45 °С, рН 4,5–10,0, а також при високих концентраціях хлориду натрію. Викликають типовий гамма-гемоліз кров’яного агарy [9].
Викликають багато клінічно важливих інфекцій, таких як інфекції сечовивідних шляхів, бактеріємія, інфекційний ендокардит, дивертикуліт і менінгіт. Найбільш важливою особливістю роду ентерококів є їх високий рівень ендемічної антибіотикорезистентності. Деякі ентерококи мають внутрішні механізми стійкості до бета-лактамних антибіотиків (пеніцилінів і цефалоспоринів), а також до багатьох аміноглікозидних антибіотиків. В останні два десятиліття з’явилися особливо вірулентні штами ентерококів, які резистентні до ванкоміцину (vancomycin-resistant enterococcus, VRE) і здатні викликати внутрішньолікарняні інфекції.
Результати власних досліджень антибіотикорезистентності
За результатами проведених нами досліджень, досить значна частина штамів провідних мікробних патогенів ВІТ м. Києва має резистентність до декількох груп антибактеріальних препаратів.
За даними багатоцентрового дослідження EPIC II, серед пацієнтів ВІТ, у яких була підтверджена інфекція, 36 % штамів були антибіотикорезистентними [10].
Постійне зростання стійкості до антибактеріальних препаратів (АБП) у всьому світі, поява штамів мікроорганізмів, які мають множинну антібіотикорезистентність (МАБР), таких як Pseudomonas aeruginosa, Acinetobacter baumannii і продукуюча карбапенемази Klebsiella pneumoniae, на фоні нестачі нових АБП призвело до того, що поступово в світі відроджується увага до забутих АБП, таких як фосфоміцин, тобраміцин, гентаміцин, бісептол, які тривалий час не використовувалися з різних причин (наприклад, тобраміцин не використовувався через існування перехресної резистентності до нього, зумовленої широким попереднім застосуванням гентаміцину).
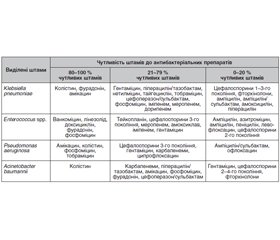
Таким чином, для емпіричного вибору раціональної антибіотикотерапії у разі інфекції, зумовленої Klebsiella pneumoniaе, за нашими дослідженнями, препаратами першого ряду слід вважати коломіцин (колістин), фурадонін (за умови інфекцій сечовидільних шляхів), амікацин; другого ряду — фосфоміцин, гентаміцин, піперацилін/тазобактам, нетилміцин, тайгециклін, тобраміцин, цефоперазон/сульбактам, іміпенем, меропенем, дорипенем; третього ряду — цефалоспорини 1–3-го покоління, фторхінолони, ампіцилін, ампіцилін/сульбактам, амоксицилін, піперацилін.
У разі інфекції, зумовленої Pseudomonas aeruginosa, препаратами першого ряду слід вважати амікацин, коломіцин, фосфоміцин, тобраміцин; другого ряду — цефалоспорини 1–3-го покоління, гентаміцин, карбапенеми, ципрофлоксацин; третього ряду — ампіцилін/сульбактам, офлоксацин.
У випадках інфекції, зумовленої Acinetobacter baumannii, препаратом першого ряду є коломіцин; препаратами другого ряду — фосфоміцин, карбапенеми, піперацилін/тазобактам, амікацин, фурадонін (за умови інфекцій сечовидільних шляхів), цефоперазон/сульбактам; препаратами третього ряду (з вірогідністю позитивного ефекту до 20 %) — гентаміцин, цефалоспорини 2–4-го покоління, фторхінолони.
Результати проведених нами досліджень свідчать, що до фосфоміцину in vitro проявляють чутливість від 21 до 79 % штамів Klebsiella pneumoniae, від 80 до 100 % штамів Pseudomonas aeruginosa, від 21 до 79 % штамів Acinetobacter baumannii і від 80 до 100 % штамів Enterococcus spp. Тому нас зацікавили закордонні публікації стосовно використання для лікування інфекцій, зумовлених вищеперерахованими мультирезистентними збудниками, у хворих, які знаходяться в критичних станах, комбінованої антибіотикотерапії з додаванням фосфоміцину до антибіотика першої низки.
Фосфоміцин, бактерицидний антибіотик 70-х років минулого століття широкого спектра дії, активний in vitro щодо мікроорганізмів з множинною антибіотикорезистентністю, таких як метицилін-резистентний Staphylococcus aureus (MRSA), Enterobacteriaceae і Pseudomonas aeruginosa. Основна перевага фосфоміцину полягає в його механізмі дії, який пов’язаний з пригніченням першого етапу синтезу пептидоглікану клітинної стінки бактерій. Будучи структурним аналогом фосфоенолу пірувату, вступає в конкурентну взаємодію з ферментом N-ацетил-глюкозо-аміно-3-0-енолпірувіл-трансферазою, в результаті чого відбувається специфічне, вибіркове і необоротне інгібування цього ферменту на більш ранній стадії, ніж бета-лактами, тому не формується перехресна резистентність до інших груп антибіотиків.
Інтерес щодо використання фосфоміцину в програмах комбінованої терапії відновився в ХХІ сторіччі, оскільки він залишається активним щодо таких проблемних збудників, як MRSA [11], глікопептид-резистентний ентерокок [12, 13] та ентеробактерії з МАБР [14]. Фосфоміцин активний щодо широкого спектра грампозитивних і грамнегативних бактерій, але проявляє досить обмежену дію щодо анаеробних бактерій, а саме до бактероїдів.
Фосфоміцин вважається антибактеріальним препаратом з привабливими фармакокінетичними властивостями, які зумовлюють його цінність у випадках складних і часто глибоких інфекцій, таких як інфекції центральної нервової системи [15, 16], кісток і суглобів [17], легень [18], м’яких тканин [19], а також сепсису [20, 21]. Вважається, що фосфоміцин потенційно являє собою препарат останньої надії в лікуванні інфекцій, зумовлених грамнегативними мікробними патогенами, які мають множинну антибіотикорезистентність.
У журналі Clinical Microbiology and Infection (2016) був проведений систематизований огляд і метааналіз для узагальнення клінічних даних та особливостей застосування внутрішньовенного фосфоміцину на даний час від моменту його розробки.
Усього було оцінено 128 досліджень внутрішньовенного введення фосфоміцину у 5527 пацієнтів. Фосфоміцин переважно призначався для лікування сепсису/бактеріємії, інфекцій сечовивідних шляхів, дихальних шляхів, кісток і суглобів, а також для лікування бактеріальних інфекцій центральної нервової системи.
Фосфоміцин найчастіше використовували проти стафілококів (1408 ізолятів), переважно Staphylococcus aureus (1062 ізоляти), Escherichia coli (544 ізоляти), Pseudomonas spp. (465 ізолятів), Streptococcus spp. (252 ізоляти) і Klebsiella spp. (218 ізолятів). Особлива увага приділялася патогенам з існуючою раніше стійкістю до різних класів антибіотиків, таких як MRSA або стійких до метициліну Staphylococcus epidermidis, або стійких до карбапенемів грамнегативних мікробних патогенів.
Була показана чудова ефективність внутрішньовенного фосфоміцину проти S.aureus, навіть в монотерапії, підтверджуючи традиційне сприйняття фосфоміцину як антистафілококового препарату. Висока ефективність проти Acinetobacter baumannii відзначалася в поєднанні фосфоміцину з колістином, незважаючи на початкову низьку активність фосфоміцину проти цього збудника. Мікробіологічна ефективність проти Pseudomonas aeruginosa в монотерапії є досить обмеженою, що потребує комбінації з іншими АБП для цього збудника. Фосфоміцин продемонстрував сприятливий профіль безпеки, про серйозні побічні ефекти повідомляється дуже рідко. Основним небажаним явищем була оборотна гіпокаліємія.
Дані дослідження дозволяють зробити висновок, що фосфоміцин має достатню клінічну ефективність порівняно з іншими класами антибіотиків і, більше того, зберігає активність проти антибіотикорезистентних мікроорганізмів [22].
На сьогодні, на думку експертів, найбільшу активність in vitro і найбільшу ефективність in vivo до грамнегативних мультирезистентних мікробних патогенів ВІТ проявляє колістин. Подібну активність, за винятком дії на Pseudomonas aeruginosa, має тигециклін. У разі бактеріємії і вентилятор-асоційованої пневмонії, зумовлених Klebsiella pneumoniae, яка продукує карбапенемазу, рекомендується застосування комбінованої антибіотикотерапії: колістин + фосфоміцин. Фосфоміцин проявляє активність щодо Pseudomonas aeruginosa і Klebsiella pneumoniaе.
Учені з Греції провели дослідження, в якому було досліджено 100 мультиантибіотикорезистентних клінічних ізолятів E.coli, Klebsiella pneumoniае, Pseudomonas aeruginosa. Множинною антибіотикорезистентністю вважалась стійкість принаймні до трьох класів АБП серед тих, які розглядаються як потенційно ефективні проти даних патогенів.
Однак у ВІТ стали висіватися штами Klebsiella pneumoniaе, стійкі до колістину. У зв’язку з цим являють цінність спостереження [24], що продемонстрували ефективність фосфоміцину під час лікування у ВІТ чотирьох хворих, інфікованих колістин-резистентними Klebsiella pneumoniaе (три мікробних ізоляти були висіяні із крові й один — із ендотрахеального аспірату). Усі чотири мікробних ізоляти були чутливими до фосфоміцину in vitro. Усі чотири пацієнти до цього безуспішно лікувались колістином. Внутрішньовенне введення фосфоміцину натрію (Fosmicin) було розпочато у вигляді комбінованої терапії з карбапенемами. Повністю одужали пацієнт з вентилятор-асоційованою пневмонією і два пацієнти з бактеріємією. Причиною смерті єдиного пацієнта, який помер під час курсу терапії, стала суперінфекція — азол-резистентна фунгемія. Ґрунтуючись на доказах клінічного досвіду і доступних дослідженнях, автори дійшли висновку, що внутрішньовенна терапія фосфоміцином може розглядатися як останній варіант лікування мультирезистентних грамнегативних інфекцій, де є документована резистентність до колістину і буквально немає іншого вибору антибіотикотерапії [24].
Іn vitro фосфоміцин виявився активним проти МАБР і панантибіотикорезистентних (ПАБР) Pseudomonas aeruginosa і Klebsiella pneumoniaе, які продукують карбапенемази. Проте in vivo ефективність проти цих патогенів практично невідома. Тому Константінос Понтікіс та співавт. провели дослідження, яке включало 48 пацієнтів одинадцяти ВІТ, які отримували фосфоміцин і мали мікробіологічно підтверджені інфекції, зумовлені МАБР і ПАБР Pseudomonas aeruginosa і Klebsiella pneumoniaе, які іn vitro були чутливими до фосфоміцину. Бактеріємія і вентилятор-асоційована пневмонія були основними інфекціями. Klebsiella pneumoniaе і P.аeruginosa, що продукували карбапенемази, були виділені в 41 і 17 випадках відповідно. Хворі отримували фосфоміцин внутрішньовенно в середній дозі 24 г/добу в середньому протягом 14 днів, переважно в комбінації з колістином або тигецикліном. Клінічний результат на 14-ту добу був успішним у 54,2 % пацієнтів, у той час як невдача — у 33,3 % випадків, невизначений результат — у 6,3 % і суперінфекція — у 6,3 % випадків. Смертність на 28-му добу становила 37,5 %. Бактеріальна ерадикація спостерігалася в 56,3 % випадків. Резистентність до фосфоміцину розвинулaся в трьох випадках. Основним небажаним явищем була оборотна гіпокаліємія. Автори відмічають, що фосфоміцин може бути на озброєнні проти МАБР та ПАБР грамнегативних інфекцій у пацієнтів, які знаходяться в критичному стані, та наголошують про необхідність подальшого дослідження поєднання фосфоміцину з іншими АБП [25].
Висновки
1. На сьогодні провідними мікробними патогенами ВІТ є мультиантибіотикорезистентні мікробні патогени Klebsiella pneumoniaе, Acinetobacter baumannii, Enterococcus faecalis, Pseudomonas aeruginosa.
2. Для емпіричного вибору раціональної антибіотикотерапії у разі інфекції, зумовленої Klebsiella pneumoniaе, за нашими дослідженнями, препаратами першого ряду слід вважати коломіцин (колістин), фурадонін (за умови інфекцій сечовидільних шляхів), амікацин; другого ряду — фосфоміцин, гентаміцин, піперацилін/тазобактам, нетилміцин, тайгециклін, тобраміцин, цефоперазон/сульбактам, іміпенем, меропенем, доріпенем; третього ряду — цефалоспорини 1–3-го покоління, фторхінолони, ампіцилін, ампіцилін/сульбактам, амоксицилін, піперацилін.
3. У разі інфекції, зумовленої Pseudomonas aeruginosa, препаратами першого ряду слід вважати амікацин, коломіцин, фосфоміцин, тобраміцин; другого ряду — цефалоспорини 1–3-го покоління, гентаміцин, карбапенеми, ципрофлоксацин; третього ряду — ампіцилін/сульбактам, офлоксацин.
4. У випадках інфекції, зумовленої Acinetobacter baumannii, препаратом першого ряду є коломіцин; препаратами другого ряду — фосфоміцин, карбапенеми, піперацилін/тазобактам, амікацин, фурадонін (за умови інфекцій сечовидільних шляхів), цефоперазон/сульбактам; препаратами третього ряду (з вірогідністю позитивного ефекту до 20 %) — гентаміцин, цефалоспорини 2–4-го покоління, фторхінолони.
5. Фосфоміцин потенційно є препаратом резерву в комбінованому антибактеріальному лікуванні інфекцій, зумовлених грамнегативними мікробними патогенами, які мають множинну антибіотикорезистентність.
6. Необхідні подальші дослідження ефективності застосування фосфоміцину як компонента комбінованої антибіотикотерапії в поєднанні з іншими антибактеріальними препаратами для визначення оптимальних комбінацій для кожного мультиантибіотикорезистентного мікробного патогена.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/35.jpg)