Международный эндокринологический журнал Том 16, №3, 2020
Вернуться к номеру
Роль дефіциту вітаміну D у генезі вазовагальних синкопе дитячого віку
Авторы: Ковальчук Т.А., Боярчук О.Р.
Тернопільський національний медичний університет імені І.Я. Горбачевського
Міністерства охорони здоров’я України, м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
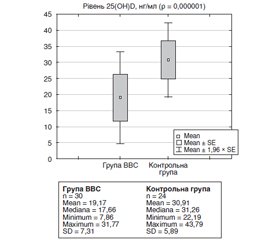
Актуальність. Результати останніх наукових досліджень дають змогу припустити, що вітамін D може чинити опосередковану, а в деяких випадках і пряму дію у патогенезі вазовагальних синкопе у дітей. Мета дослідження: вивчити рівні вітаміну D у сироватці крові дітей із вазовагальними синкопе. Матеріали та методи. Основну групу становили 30 дітей віком 8–17 років із принаймні одним епізодом вазовагального синкопе впродовж останнього місяця. До контрольної групи увійшли 24 практично здорові дитини. 25(ОН)D у сироватці крові визначали методом імуноферментного аналізу з використанням тест-системи Monobind (США). Оцінку вітамін-D-статусу здійснювали відповідно до практичних рекомендацій щодо добавок вітаміну D та лікування дефіциту в Центральній Європі: дефіцит — < 20 нг/мл; субоптимальний рівень (недостатність) — 20–30 нг/мл; оптимальний рівень — 30–50 нг/мл; високий вміст — 50–100 нг/мл; небезпечний рівень — > 100 нг/мл. Результати. Діти обох груп були порівнянні за результатами демографічних та клінічних показників, що дозволило нівелювати вплив статі, віку, дефіциту та надмірної маси тіла, ожиріння, чи артеріальної гіпертензії на рівень 25(ОН)D. Показник 25(ОН)D у групі вазовагального синкопе становив 19,17 ± 1,33 нг/мл та був вірогідно нижчим порівняно зі здоровими дітьми — 30,91 ± 1,20 нг/мл (р = 0,000001). Оптимальний рівень вітаміну D реєстрували лише у 6,7 % хворих із вазовагальним синкопе, тоді як субоптимальний показник та недостатність — у 33,3 та 60,0 %. Показники кальцію, фосфору та лужної фосфатази у сироватці крові обстежених обох груп не відрізнялися (p > 0,05). Висновки. У 93,3 % дітей із вазовагальним синкопе спостерігається вірогідне зниження рівня 25(OH)D у сироватці крові. Поширеність дефіциту вітаміну D становить 60,0 %, субоптимального рівня 25(ОН)D — 33,3 %. Дефіцит і недостатність вітаміну D асоціюються зі збереженням традиційних показників кальцій-фосфорного гомеостазу в межах референтних значень.
Актуальность. Результаты последних научных исследований позволяют предположить, что витамин D может оказывать косвенное, а в некоторых случаях и прямое действие в патогенезе вазовагальных синкопе у детей. Цель исследования: изучить уровни витамина D в сыворотке крови детей с вазовагальными синкопе. Материалы и методы. Основную группу составили 30 детей в возрасте 8–17 лет с как минимум одним эпизодом вазовагального синкопе в течение последнего месяца. В контрольную группу вошли 24 практически здоровых ребенка. 25(ОН)D в сыворотке крови определяли методом иммуноферментного анализа с использованием тест-системы Monobind (США). Оценку витамин-D-статуса осуществляли в соответствии с практическими рекомендациями по добавкам витамина D и лечению дефицита в Центральной Европе: дефицит — < 20 нг/мл; субоптимальный уровень (недостаточность) — 20–30 нг/мл; оптимальный уровень — 30–50 нг/мл; высокое содержание — 50–100 нг/мл; опасный уровень — > 100 нг/мл. Результаты. Дети обеих групп были сопоставимы по результатам демографических и клинических показателей, что позволило нивелировать влияние пола, возраста, дефицита и избыточной массы тела, ожирения или артериальной гипертензии на уровень 25(ОН)D. Показатель 25(ОН)D в группе вазовагальных синкопе составил 19,17 ± 1,33 нг/мл и был достоверно ниже по сравнению со здоровыми детьми — 30,91 ± 1,20 нг/мл (р = 0,000001). Оптимальный уровень витамина D регистрировали только у 6,7 % больных с вазовагальными синкопе, тогда как дефицит и недостаточность витамина D — у 33,3 и 60,0 %. Показатели кальция, фосфора и щелочной фосфатазы в сыворотке крови обследованных обеих групп не отличались (p > 0,05). Выводы. У 93,3 % детей с вазовагальными синкопе наблюдается достоверное снижение уровня 25(OH)D в сыворотке крови. Распространенность дефицита витамина D составляет 60,0 %, субоптимального уровня 25(ОН)D — 33,3 %. Дефицит и недостаточность витамина D ассоциируются с сохранением традиционных показателей кальций-фосфорного гомеостаза в пределах референтных значений.
Background. Recent scientific findings suggest that vitamin D may play a mediated or, in some cases, a direct role in the pathogenesis of vasovagal syncope in children. The purpose of the research was to study the levels of vitamin D in the blood serum of children with vasovagal syncope. Materials and methods. The main group consisted of 30 patients aged 8–17 years with at least one episode of vasovagal syncope during the last month. The control group included 24 apparently healthy children. 25(OH)D in the blood serum was determined by enzyme-linked immunosorbent assay using the Monobind test system (USA). Vitamin D status assessment was performed according to practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe: deficiency — < 20 ng/ml; suboptimal level (insufficiency) — 20–30 ng/ml; optimal concentration — 30–50 ng/ml; high level — 50–100 ng/ml; dangerous concentration — > 100 ng/ml. Results. Children of the two groups were comparable in terms of demographic and clinical parameters. It helped eliminate the effect of gender, underweight and overweight, obesity or hypertension on 25(OH)D serum level. 25(OH)D in the vasovagal syncope group was 19.17 ± 1.33 ng/ml that was significantly lower compared to healthy children — 30.91 ± 1.20 ng/ml (p = 0.000001). Optimal concentration of vitamin D was recorded only in 6.7 % of patients with vasovagal syncope, whereas insufficiency and deficiency — in 33.3 and 60.0 %, respectively. Values of serum calcium, phosphorus, and alkaline phosphatase in children of both groups did not differ (p > 0.05). Conclusions. There is a significant decrease in serum level of 25(OH)D in 93.3 % of children with vasovagal syncope. The prevalence of vitamin D deficiency is 60.0 %, and suboptimal level of 25(OH)D was observed in 33.3 % of cases. Vitamin D deficiency and insufficiency are associated with maintaining traditional indicators of calcium-phosphorus homeostasis within the reference values.
вазовагальні синкопе; вітамін D; діти
вазовагальные синкопе; витамин D; дети
vasovagal syncope; vitamin D; children
Вступ
Матеріали та методи
Результати
/65_2.jpg)
Обговорення
Висновки
- Płudowski P., Karczmarewicz E., Bayer M. et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe — recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynologia Polska. 2013. 64(4). 319-327. doi: 10.5603/EP.2013.0012.
- Butler I.J., Lankford J.E., Hashmi S.S., Numan M.T. Biogenic amine metabolism in juvenile neurocardiogenic syncope with dysautonomia. Ann. Clin. Transl. Neurol. 2014. 1. 251-7. doi: 10.1016/j.jsha.2015.06.006.
- Ghazni M., Donnelly T.O.M., Halpenny L. Tilt Table Test Outcome in the Diagnosis and Prevalence of Syncope in Patients with Vitamin D and Vitamin B12 Deficiency. Age and Ageing. 2017. 46(3). 13-59. https://doi.org/10.1093/ageing/afx144.60
- Arici B., Maeder M., Schuetz P. et al. Potential Role of Biomarkers in the Management of Syncope. International Journal of Clinical Medicine. 2012. 3. doi: 10.4236/ijcm.2012.37A131.
- Wadhwania R. Is Vitamin D Deficiency Implicated in Autonomic Dysfunction? J. Pediatr. Neurosci. 2017. 12(2). 119-123. doi: 10.4103/jpn.JPN_1_17.
- DeLuca G.C., Kimball S.M., Kolasinski J. et al. The role of vitamin D in nervous system health and disease. Neuropathol. Appl. Neurobiol. 2013. 39. 458-484. doi: 10.1111/nan.12020.
- Santillan G.E., Vazquez G., Boland R. Activation of a beta-adrenergic-sensitive signal transduction pathway by the secosteroid hormone 1,25-(OH)2-vitamin D3 in chick heart. J. Mol. Cell. Cardiol. 1999. 31. 1095-104. doi:10.1006/jmcc.1999.0942.
- Ashangari C., Suleman A. Vitamin D Deficiency Study in Postural Orthostatic Tachycardia Syndrome. Circulation: Cardiovascular Quality and Outcomes. 2015. 8. 121.
- Chaudhari S.A., Sacerdote A., Bahtiyar G. 1-α hydroxylation defect in postural orthostatic tachycardia syndrome: Remission with calcitriol supplementation. BMJ Case Rep. 2012. doi: 10.1136/bcr.02.2012.5730.
- Matter M., El-Sherbiny E., Elmougy A. et al. Myocardial function in Saudi adolescents with Vitamin D deficiency: Tissue Doppler imaging study. J. Saudi Heart Assoc. 2016. 28. 22-30. doi: 10.1016/j.jsha.2015.06.006.
- Kovalchuk T.A., Boyarchuk O.R. Vitamin D status in patients with nontraumatic transient loss of consciousness (literature review). Bolʹ, sustavy, pozvonočnik. 2019. 9(3). 178-183. DOI: 10.22141/2224-1507.9.3.2019.178642.
- Brignole M., Moya A., Lange F.J. et al. ESC Guidelines for the diagnosis and management of syncope. European Heart Journal. 2018. 39(21). 1883-1948.
- Pludowski P., Holick M.F., Grant W.B., Konstantynowicz J., Mascarenhas M.R., Haq A. et al. Vitamin D supplementation guidelines. J. Steroid Biochem. Mol. Biol. 2018. 175. 125-135. doi: 10.1016/j.jsbmb.2017.01.021.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi region (pilot project). Problems of radiation medicine and radiobiology. 2018. 23. 442-451. doi: 10.33145/2304-8336-2018-23-442-451.
- Usalp S., Kemal H., Yüksek Ü. et al. Is there any link between vitamin D deficiency and vasovagal syncope? J. Arrhythmia. 2020. 36. 371-376. https://doi. org/10.1002/joa3.12309.
- Pankiv V.I., Yuzvenko T.Yu., Pashkovska N.V., Pankiv I.V. Effect of vitamin D on insulin resistance and anthropometric parameters in patients with type 2 diabetes mellitus. Clinical Endocrinology and Endocrine Surgery. 2019. 1. 53-58. http://nbuv.gov.ua/UJRN/kee_2019_1_8.
- Сорокман Т.В., Попелюк Н.А. Вітамін D як незалежний фактор розвитку ожиріння в підлітків. Міжнародний ендокринологічний журнал. 2018. 14(5). 449-453.
- Xu W.R., Jin H.F., Du J.B. Vitamin D and Cardiovascular Risk in Children. Chin. Med. J. 2017. 130(23). 2857-2862. doi: 10.4103/0366-6999.215500.
- Pilz S., Zittermann A., Trummer C., Theiler-Schwetz V., Lerchbaum E., Keppel M.H. et al. Vitamin D testing and treatment: a narrative review of current evidence. Endocr. Connect. 2019. 8(2). R27-R43. doi: 10.1530/EC-18-0432.

/65.jpg)
/66.jpg)