Газета «Новости медицины и фармации» №8 (726), 2020
Вернуться к номеру
О ПАТОГЕНЕЗЕ КОАГУЛОПАТИИ ПРИ COVID-19
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Статья о патогенезе COVID-19-коагулопатии, опубликованная в журнале «The Lancet» 30 июня, называется «Коагулопатией при COVID-19 дирижирует эндотелий».
Представляем вам ее перевод.
Недавние исследования показали, что у пациентов с тяжелым течением COVID-19 зачастую происходит активация системы коагуляции [1, 2]. Более того, по данным аутопсий, отмечаются распространенные микротромбы, диссеминированные в сосудистой системе легких, что предполагает важную роль васкулопатии в патогенезе COVID-19 [3]. Эти посмертные исследования также выявили масштабное повреждение клеток эндотелия с признаками апоптоза и утрату плотных контактов. В совокупности эти данные позволяют предполагать, что клетки эндотелия играют ключевую роль в управлении этой необычной легочной внутрисосудистой коагулопатией, связанной с инфекцией SARS-CoV-2 [4].
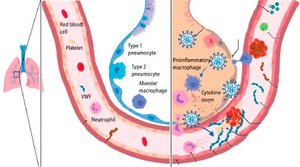
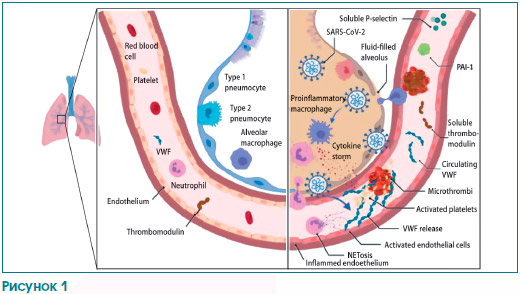
В журнале «The Lancet Haematology» George Goshua и соавторы высказали новые предположения о механизмах COVID-19-ассоциированной коагулопатии (рис. 1) [5].
Как и авторы предыдущих исследований, они показали, что активация коагуляции у госпитализированных пациентов с COVID-19 встречается очень часто. Кроме того, они сообщили, что у этих пациентов повышена концентрация фактора фон Виллебранда (фВБ), растущая вместе с тяжестью заболевания (среднее значение антигена фВБ — 565 % (СО 199) у 48 пациентов, поступивших в отделение реанимации и интенсивной терапии (ОРИТ), по сравнению с 278 % (СО 133) у 20 пациентов не из ОРИТ, p < 0,0001). Это наблюдение является очень интересным, поскольку in vivo биосинтез фВБ ограничивается только клетками эндотелия и мегакариоцитами [6].
Будучи синтезированным в эндотелии, фВБ либо выбрасывается в плазму, либо накапливается во внутриклеточных органеллах, известных как тельца Вайбеля — Паладе. После активации эндотелия накопленный фВБ секретируется и может привязывать тромбоциты и лейкоциты к сосудистой стенке (рис. 1) [6].
Высокие плазменные концентрации фВБ, связанные с тяжелым COVID-19, таким образом, наводят на мысль о фульминантной активации клеток эндотелия. Согласно этой модели, Goshua и соавт. также сообщили, что плазменные концентрации Р-селектина (который может выбрасываться из активированных тромбоцитов или из телец Вайбеля — Паладе) также значимо повышены у реанимационных пациентов с COVID-19 (15,9 нг/мл (4,8) у 40 реанимационных больных по сравнению с 11,2 нг/мл (3,1) у 10 нереанимационных пациентов, р = 0,0014) [5].
Есть несколько научных доказательств, что высокие концентрации фВБ, наблюдаемые Goshua и соавт., играют роль в патогенезе васкулопатии, связанной с COVID-19 (рис. 1).
Во-первых, фВБ способен связываться с рецепторами тромбоцитов, модулируя таким образом их адгезию и агрегацию [6].
Во-вторых, патологические ультрабольшие мультимеры фВБ ответственны за развитие тромботической микроангиопатии, что является отличительным признаком тромботической тромбоцитопенической пурпуры.
В-третьих, ультрабольшие мульти–меры фВБ также играют роль в патогенезе –микрососудистой окклюзии у детей с церебральной малярией [7].
Важно отметить, что тромботические микроангиопатии, связанные с тромботической тромбоцитопенической пурпурой и церебральной малярией, имеют несколько черт, схожих с тяжелым COVID-19.
Наконец, фВБ играет роль в регуляции ангиогенеза [8].
Более того, ангиопоэтин-2, другой белок, содержащийся в тельцах Вайбеля — Паладе, также играет важную роль в этой ситуации [8]. Эти наблюдения интересны, поскольку сообщалось, что у пациентов с фатальным COVID-19 отмечался интенсивный легочный интуссуцептивный ангиогенез [3].
Нормальные кровеносные сосуды выстланы монослоем эндотелия, который играет ключевую роль в предотвращении образования патологических тромбов. В частности, большое число рецепторов, экспрессируемых на клетках эндотелия, работает для обеспечения антикоагулянтных путей. Тромбомодулин, трансмембранный рецептор, постоянно экспрессирующийся на поверхности клеток эндотелия, обладает важной анти–коагулянтной и антифибринолитической активностью (рис. 1). Связывание тромбомодулина переключает тромбин на предпочтительную активацию антикоагулянтного протеина С и антифибринолитического тромбин-активируемого ингибитора фибринолиза [9].
Goshua и соавт. писали о плазменных концентрациях растворимого тромбомодулина. Значимой разницы между реанимационной и нереанимационной группами пациентов не отмечалось. Однако концентрация коррелировала с клиническим исходом, внутригоспитальной летальностью, значимо более низкой среди пациентов с меньшей концентрацией растворенного тромбомодулина (< 3,26 нг/мл) по сравнению с лицами с высоким уровнем растворенного тромбомодулина (> 3,26 нг/мл) в когорте в целом (р = 0,0087) и среди реанимационных пациентов (р = 0,031).
В предыдущих исследованиях было показано, что провоспалительные цитокины, внеклеточные гистоны и нейтрофильные протеазы могут провоцировать выброс тромбомодулина из эндотелия (рис. 1) [9].
Сниженная экспрессия тромбомодулина на поверхности эндотелиоцитов приведет к нарушению образования активированного протеина С, еще больше способствуя прокоагулянтному и провоспалительному локальному окружению в сосудах легких. Примечательно, что большинство реанимационных пациентов, описанных Goshua и соавт., лечили тоцилизумабом до того, как исследовали биомаркеры функции эндотелия, что могло снизить разницу величин эндо–телиальных маркеров в плазме крови между реанимационной и нереанимационной группами [5].
Тем не менее эти данные показывают, что эндотелиопатия является ключевым фактором в патогенезе COVID-19-васкулопатии.
Необходимы дальнейшие исследования, чтобы определить различные механизмы, посредством которых инфекция SARS-CoV-2 вызывает столь значительные эффекты в клетках эндотелия, в частности в легочном микрососудистом русле. Учитывая диффузную природу коронавирусной пневмонии, большой объем полости альвеолы и близость с легочными микрососудами, местное воспаление и нарушение регуляции образования провоспалительных цитокинов, несом–ненно, имеют очень важное значение (рис. 1) [4].
Однако другие механизмы могут включать активацию комплемента, активацию и выброс внеклеточных ловушек нейтрофилов и значительную гипоксию. Кроме того, клетки эндотелия экспрессируют рецептор АСЕ2, который обеспечивает проникновение вируса внутрь клеток. По данным электронной микроскопии, вирусные частицы SARS-CoV-2 были обнаружены в эндотелии [10].
Независимо от механизмов активации клеток эндотелия и ассоциированной легочной внутрисосудистой коагулопатии при COVID-19 было бы интересно выяснить, может ли иммуносупрессивная терапия, включая кортикостероиды и тоцилизумаб, улучшить функцию эндотелия в сторону реверса местного иммунотромбоза и улучшения выживаемости, пишут авторы.
Список литературы
находится в редакции
https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(20)30215-5/fulltext