Журнал «Медицина неотложных состояний» Том 16, №5, 2020
Вернуться к номеру
Прогнозирование исхода тяжелой черепно-мозговой травмы
Авторы: Черний Т.В.(1), Андронова И.А.(2), Черний В.И.(1), Городник Г.А.(2), Назаренко К.В.(2)
(1) — ГУ «Научно-практический центр профилактической и клинической медицины» ГУД, г. Киев, Украина
(2) — Донецкий национальный медицинский университет МЗ Украины, г. Лиман, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
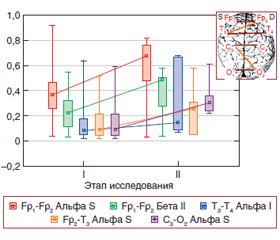
Актуальність. Актуальною проблемою інтенсивної терапії є своєчасне прогнозування результату в пацієнтів із тяжкою черепно-мозковою травмою (ТЧМТ). Мета дослідження: у пацієнтів із ТЧМТ, що знаходяться в коматозному стані, виявити прогностично значущі електроенцефалографічні предиктори прогнозу перебігу коматозного стану: вихід із коми, розвиток вегетативного стану, формування смерті мозку. Матеріали та методи. Відкрите проспективне дослідження за типом «випадок-контроль». У дослідженні брали участь 89 пацієнтів із діагнозом: ТЧМТ, ускладнена комою I–II cт. За результатами лікування 89 хворих були розділені на три підгрупи. Першу підгрупу становили 69 пацієнтів, що вийшли з коми. Друга підгрупа включала 7 досліджуваних хворих, у яких було зафіксовано перехід ТЧМТ у вегетативний стан. До третьої увійшли 13 пацієнтів із летальним результатом ТЧМТ, причому у 6 з них було діагностовано формування смерті мозку. В динаміці терапії проводили аналіз рівня свідомості за шкалою коми Глазго, даних комп’ютерної томографії (Philips Brilliance CT), кількісної електроенцефалографії (кЕЕГ). Результати. Прогностично значущими ЕЕГ-предикторами виходу з коматозного стану є відновлення міжпівкульних когерентних зв’язків в альфа-діапазоні ЕЕГ у відведеннях Fp1-Fp2, T3-T4, C3-О2, Fp2-T3 і підвищення спряженості в діапазоні високочастотної бета-2-активності у відведеннях Fp1-Fp2. Прогностично значущим ЕЕГ-предиктором розвитку вегетативного стану є падіння спряженості когерентних зв’язків в парах центральних відведень (С3-С4) у всіх діапазонах, крім дельта-діапазону. Розвиток вегетативного стану пов’язаний із міжпівкульним роз’єднанням і зниженням рівня взаємодії між ретикулярною формацією верхньостовбурового рівня і системою неспецифічної регуляції ЦНС на діенцефальному рівні. Різке падіння показників когерентності в лобно-скроневих ділянках кори Fp1-T4, Fp2-T3 — показник розриву прямих і обернених когерентних зв’язків, перша ознака розпаду нервової системи. Висновки. Застосування кількісної ЕЕГ дозволяє виявити прогностично значущі ЕЕГ-предиктори прогнозу перебігу коматозного стану: вихід із коми, розвиток вегетативного стану, формування смерті мозку.
Актуальность. Актуальной проблемой интенсивной терапии является своевременное прогнозирование исхода у пациентов с тяжелой черепно-мозговой травмой (ТЧМТ). Цель исследования: у пациентов с ТЧМТ, находящихся в коматозном состоянии, выявить прогностически значимые электроэнцефалографические предикторы прогноза течения коматозного состояния: выход из комы, развитие вегетативного состояния, формирование смерти мозга. Материалы и методы. Открытое проспективное исследование по типу «случай-контроль». В исследовании принимали участие 89 пациентов с диагнозом: ТЧМТ, осложненная комой I–II cт. По результатам лечения 89 больных были разделены на три подгруппы. Первую подгруппу составили 69 пациентов, вышедшие из комы. Вторая включала 7 исследуемых больных, у которых был зафиксирован исход ТЧМТ в вегетативное состояние. В третью подгруппу вошли 13 пациентов с летальным исходом ТЧМТ, причем у 6 из них было диагностировано формирование смерти мозга. В динамике терапии проводили анализ уровня сознания по шкале комы Глазго, данных компьютерной томографии (Philips Brilliance CT), количественной электроэнцефалографии (кЭЭГ). Результаты. Прогностически значимыми ЭЭГ-предикторами выхода из коматозного состояния являются восстановление межполушарных когерентных связей в альфа-диапазоне ЭЭГ в отведениях Fp1-Fp2, T3-T4, C3-О2, Fp2-T3 и повышение сопряженности в диапазоне высокочастотной бета-2-активности в отведениях Fp1-Fp2. Прогностически значимым ЭЭГ-предиктором развития вегетативного состояния является падение сопряженности когерентных связей в парах центральных отведений (С3-С4) во всех диапазонах, кроме дельта-диапазона. Развитие вегетативного состояния связано с межполушарным разобщением и снижением уровня взаимодействия между ретикулярной формацией верхнестволового уровня и системой неспецифической регуляции ЦНС на диэнцефальном уровне. Резкое падение показателей когерентности в лобно-височных областях коры Fp1-T4, Fp2-T3 — показатель разрыва прямых и обратных когерентных связей, первый признак распада нервной системы. Выводы. Применение количественной ЭЭГ позволяет выявить прогностически значимые ЭЭГ-предикторы прогноза течения коматозного состояния: выход из комы, развитие вегетативного состояния, формирование смерти мозга.
Background. An urgent problem of intensive care is the timely prediction of an outcome in patients with severe traumatic brain injury (STBI). The purpose of the study: in patients with a coma due to STBI, to identify prognostically significant electroencephalographic (EEG) predictors of the course of a coma: emerge from a coma, development of a vegetative state, and formation of the brain death. Materials and methods. An open-label, prospective case-control study involved 89 patients with a diagnosis of STBI complicated by coma stage I–II. According to the results of treatment, 89 patients were divided into three subgroups. The first subgroup consisted of 69 people emerged from a coma. The second one consisted of 7 patients in whom STBI resulted in a vegetative state. The third subgroup included 13 individuals with fatal outcome of STBI; moreover, 6 of them were diagnosed with brain death formation. In the dynamics of therapy, an analysis of the level of consciousness was carried out according to the Glasgow coma scale, computed tomography data (Philips Brilliance CT), and quantitative EEG. Results. Prognostically significant EEG predictors for emerging from a coma are the restoration of interhemispheric coherence in the EEG alpha band in Fp1-Fp2, T3-T4, C3-02, Fp2-T3 leads and an increase in connectivity in the high-frequency beta 2-activity range in Fp1-Fp2 leads. Prognostically significant EEG predictors of the development of a vegetative state are decreased coherence in the pairs of central leads (С3-С4) in all ranges except the delta band. The development of a vegetative state is associated with interhemispheric dissociation and a decrease in the level of interactions between the reticular formation of the upper stem level and the system of non-specific regulation of the central nervous system at the diencephalic level. A sharp decrease in the coherence indicators in the Fp1-T4, Fp2-T3 frontotemporal areas of the cortex is an indicator of the breaking of direct and inverse coherence, the first signs of a breakdown of the nervous system. Conclusions. The use of quantitative EEG allows one to identify prognostically significant EEG predictors of the course of a coma: emerge from a coma, development of a vegetative state, and the formation of brain death.
тяжка черепно-мозкова травма; вегетативний стан; смерть мозку; ЕЕГ-предиктори прогнозу перебігу коматозного стану
тяжелая черепно-мозговая травма; вегетативное состояние; смерть мозга; ЭЭГ-предикторы прогноза течения коматозного состояния
severe traumatic brain injury; autonomic state; brain death; EEG predictors of the course of a coma
Введение
Материалы и методы
Результаты и обсуждение
Выводы
- Кондратьева Е.А., Яковенко И.В. Вегетативное состояние: этиология, патогенез, диагностика и лечение. М.: Медицина, 2014. 361 с.
- Легостаева Л.А., Мочалова Е.Г., Супонева Н.А. и др. Сложности клинической диагностики хронических нарушений сознания и рекомендации по клинико-инструментальной оценке пациентов после их выхода из комы. Анестезиология и реаниматология. 2017. 62 (6). С. 449-456. DOI: http://dx.doi.org/ 10.18821/0201-7563-2017-62-6-449-456.
- Медведев С.В., Коротков А.Д., Катаева Г.В. и др. Вегетативное состояние (длительная кома) как проявление устойчивого патологического состояния. Физиология человека. 2010. 1. С. 138-141.
- Легостаева Л.А. Диагностика хронических нарушений сознания: клинико-нейрофизиологическое и нейровизуализационное исследование: Автореф. дис… канд. мед. наук. Москва, 2018. 31 с.
- Adams J.H., Graham D.I., Jennett B. The neuropathology of the vegetative state after an acute brain insult. Brain. 2000. 123. Р. 1327-1338.
- Болдырева Г.Н. Атипичные формы церебральной альфа-активности при поражении регуляторных структур мозга человека. Физиология человека. 2018. 44 (3). С. 14-26.
- Vegetative State and Minimally Conscious State: A Review of the Therapeutic Interventions. Review Stereotact. Funct. Neurosurg. 2010. 88. С. 199-207. DOI: 10.1159/000314354.
- Беленичев И.Ф. и др. Нейропротекция и нейропластичность. К.: Логос, 2015. 512 с.
- Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStat. Д.: Папакица Е.К., 2016. 214 с.
- Черний В.И., Андронова И.А., Городник Г.А. и др. Исследование ЭЭГ-предикторов у больных с острой церебральной недостаточностью, осложненной вегетативным состоянием на фоне нейрометаболической терапии. Медицина неотложных состояний. 2016. 7 (78). С. 33-45.
- Крыжановский Г.Н. Патологические интеграции в центральной нервной системе. Мозг. Теоретические и клинические аспекты. М.: Медицина, 2003. С. 52-67.
- Туровский Я.А. Вейвлет-анализ электроэнцефалограммы: электрофизиологические феномены и их интерпретация. Вестник ВОЛГГМУ. 2011. Выпуск 3 (39). С. 97-99.
- Короновский А.А. и др. Диагностика и анализ осцилляторной нейросетевой активности головного мозга с использованием непрерывного вейвлетного преобразования. Изв. вузов. Прикладная и нелинейная динамика. 2011. Т. 19. № 1. C. 86-108.
- Кононюк А.Е. Системология. Общая теория систем. В 4-х кн. Кн 1. К.: Освіта України, 2014. 564 с.

/94.jpg)
/95.jpg)
/96.jpg)
/97.jpg)
/98.jpg)