Журнал «Медицина неотложных состояний» Том 16, №5, 2020
Вернуться к номеру
Застосування багатокомпонентного гіперосмолярного первинного об’єму заповнення оксигенатора при операціях на серці в умовах штучного кровообігу
Авторы: Черній В.І., Собанська Л.О.
Державна наукова установа «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
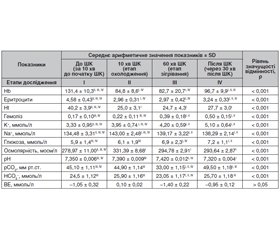
Актуальність. Штучний кровообіг (ШК) справляє істотний вплив на організм пацієнтів. Першим потенційним фактором, здатним негативно впливати на функції органів і тканин під час перфузії, є первинний об’єм заповнення (ПОЗ) оксигенатора. Навіть при сучасному розвитку перфузіологічного забезпечення немає єдиного протоколу щодо того, які розчини і в якому співвідношенні необхідно використовувати в програмі первинного заповнення оксигенатора. Тому питання пошуку розчинів для заповнення контура оксигенатора дуже важливе для уникнення факторів, що спричиняють ускладнення після ШК. Матеріали та методи. На базі хірургічного центру ДНУ «Науково-практичний центр профілактичної та клінічної медицини» ДУС був застосований багатокомпонентний гіперосмолярний ПОЗ у 90 пацієнтів під час кардіохірургічних операцій в умовах штучного кровообігу. Чоловіків було 69 (76,6 %), жінок — 21 (23,4 %), вік пацієнтів — від 37 до 81 року, у середньому 65,0 ± 2,5 року. Вага пацієнтів — від 55 до 115 кг, у середньому 86,40 ± 5,85 кг. За функціональним класом (ФК) за NYHA пацієнти розподілилися таким чином: II ФК — 79 (87,7 %), III ФК — 11 (12,3 %). У 73 пацієнтів операції виконані на фібриляції шлуночків (група 1), у 17 пацієнтів операції виконані з використанням кардіоплегічного розчину кустодіол (група 2). При виборі розчинів для ПОЗ оксигенатора використовували комплексний підхід. Базовим розчином був препарат волютенз, основою якого є 4% модифікований желатин, іншими гіперосмолярними розчинами первинного об’єму заповнення оксигенатора були реосорбiлакт і маніт 15%, для корекції порушень кислотно-лужного балансу застосовували розчин сода-буфер 4,2%. Для внутрішньовенної інфузії під час операції використовували Рінгера малат ізотонічний, який як носій резервної лужності містить ацетат і малат. Сумарний об’єм розчинів у перфузаті становив 1600–1200 мл. Сумарна осмолярність розчинів у перфузаті — 817,4 мосмоль у 1600 мл, що становило 510,9 мосмоль/л. Результати. Відзначений позитивний результат при використанні багатокомпонентного гіперосмолярного ПОЗ. Вивчення газотранспортної функції крові відображає поточні метаболічні потреби організму. При оцінці кисневотранспортної функції системи кровообігу було виявлено, що на передперфузійному етапі (за 10 хв до початку ШК) відзначався нормальний рівень доставки кисню — 571,70 ± 30,35 мл/(хв • м2) (р < 0,001), але рівень його споживання був дещо знижений — 74,20 ± 6,32 мл/(хв • м2) (p < 0,001) за рахунок вазодилатаційного ефекту севофлюрану й зменшення загального периферичного опору, зниження інтенсивності загального метаболізму через анестезію і спонтанне охолодження пацієнтів на операційному столі. На 10-й хвилині штучного кровообігу індекс доставки кисню (IDO2) знизився до 336,5 ± 24,03 мл/(хв • м2), це пов’язано зі зменшенням вмісту кисню в артеріальній крові, що відбувається через зниження гемоглобіну до 84,8 ± 8,6 г/л унаслідок гемодилюції. Індекс споживання кисню (IVO2) на цьому етапі досягав 23,85 ± 3,79 мл/(хв • м2) за рахунок зниження метаболізму при температурі тіла хворого 32,6 ± 0,4 °С. Після виконання основного етапу операції і зігрівання пацієнта IDO2 був 348,60 ± 18,02 мл/(хв • м2), IVO2 збільшився до 101,90 ± 13,04 мл/(хв • м2) при температурі 36,8 ± 0,2 °С. Через 30 хв після ШК кровообігу показник гемоглобіну становив 96,7 ± 9,9 г/л, IDO2 — 478,70 ± 29,12 мл/(хв • м2), що відповідає рівню нормальних показників. Індекс екстракції кисню в нашому дослідженні відповідав етапам операції, температурному статусу і наприкінці операції — фізіологічній нормі. При використанні багатокомпонентного гіперосмолярного первинного об’єму заповнення оксигенатора середній перфузійний тиск становить 68,4 ± 5,7 мм рт.ст., не спостерігається різкого коливання тиску. Відносний гідробаланс після ШК для операцій, виконаних на фібриляції серця, і для операції, виконаних на кустодіолі, становив +2,7 ± 1,1 мл/кг і +5,1 ± 2,4 мл/кг відповідно, що свідчить про відсутність волемічного навантаження після ШК. Висновки. Використання багатокомпонентного гіперосмолярного ПОЗ, спрямоване на запобігання набряку тканин з початком штучного кровообігу, синдрому капілярного витоку, сприяє більш фізіологічній корекції електролітів і кислотно-лужного стану, дозволяє знизити обсяг волемічного навантаження в періопераційному періоді на тлі стабільних показників центральної гемодинаміки.
Актуальность. Искусственное кровообращение (ИК) оказывает существенное влияние на организм пациентов. Первым потенциальным фактором, способным негативно влиять на функции органов и тканей при перфузии, является первичный объем заполнения (ПОЗ) оксигенатора. Даже при современном развитии перфузиологического обеспечения нет единого протокола относительно того, какие растворы и в каком соотношении необходимо использовать в программе первичного заполнения оксигенатора. Поэтому вопрос поиска растворов для заполнения контура оксигенатора очень важен во избежание факторов, вызывающих осложнения после ИК. Материалы и методы. На базе хирургического центра ГНУ «Научно-практический центр профилактической и клинической медицины» ГУД был использован многокомпонентный гиперосмолярный ПОЗ у 90 пациентов во время кардиохирургических операций в условиях искусственного кровообращения. Мужчин было 69 (76,6 %), женщин — 21 (23,4 %) в возрасте от 37 до 81 года, в среднем 65,0 ± 2,5 года. Вес пациентов составил от 55 до 115 кг, в среднем 86,40 ± 5,85 кг. По функциональному классу (ФК) по NYHA пациенты распределились таким образом: II ФК — 79 (87,7 %), III ФК — 11 (12,3 %). У 73 пациентов операции выполнены на фибрилляции желудочков (группа 1), у 17 пациентов операции выполнены с использованием кардиоплегического раствора кустодиол (группа 2). При выборе растворов для ПОЗ оксигенатора использовали комплексный подход. Базовым раствором был препарат волютенз, основой которого является 4% модифицированный желатин, другими базовыми гиперосмолярными растворами были реосорбилакт и маннит 15%, для коррекции нарушений кислотно-щелочного состояния применяли раствор сода-буфер 4,2%. Для внутривенной инфузии по ходу операции использовали Рингера малат изотонический, который в качестве носителя резервной щелочности содержит ацетат и малат. Суммарный объем растворов в перфузате составил 1600–1200 мл. Суммарная осмолярность растворов в перфузате — 817,4 мосмоль в 1600 мл, что составило 510,9 мосмоль/л. Результаты. Отмечен положительный результат при использовании многокомпонентного гиперосмолярного ПОЗ. Изучение газотранспортной функции крови отражает текущие метаболические потребности организма. При оценке кислородно-транспортной функции системы кровообращения было выявлено, что на предперфузионном этапе (за 10 мин до начала ИК) отмечался нормальный уровень доставки кислорода 571,70 ± 30,35 мл/(мин • м2) (р < 0,001), но уровень его потребления был несколько снижен — 74,20 ± 6,32 мл/(мин • м2) (p < 0,001) за счет вазодилатационного эффекта севофлюрана и уменьшения общего периферического сопротивления, снижения интенсивности общего метаболизма за счет анестезии и спонтанного охлаждения пациентов на операционном столе. На 10-й минуте искусственного кровообращения индекс доставки кислорода (IDO2) снизился до 336,50 ± 24,03 мл/(мин • м2), это связано с уменьшением содержания кислорода в артериальной крови, которое происходит из-за снижения гемоглобина до 84,8 ± 8,6 г/л в результате гемодилюции. Индекс потребления кислорода (IVO2) на этом этапе достиг 23,85 ± 3,79 мл/(мин • м2) за счет снижения метаболизма при температуре тела больного 32,6 ± 0,4 °С. После выполнения основного этапа операции и согревания пациента IDO2 был 348,60 ± 18,02 мл/(мин • м2), IVO2 увеличился до 101,90 ± 13,04 мл /(мин • м2) при температуре 36,8 ± 0,2 °С. Через 30 минут после ИК гемоглобин был 96,7 ± 9,9 г/л, DO2 — 478,70 ± 29,12 мл/(мин • м2), что соответствует уровню нормальных показателей. Индекс экстракции кислорода в нашем исследовании соответствовал этапам операции, температурному статусу и в конце операции — физиологической норме. При использовании многокомпонентного гиперосмолярного первоначального объема заполнения оксигенатора среднее перфузионное давление составляет 68,4 ± 5,7 мм рт.ст., не наблюдается его резкого колебания. Относительный гидробаланс после ИК для операций, выполненных на фибрилляции сердца, и операций, выполненных на кустодиоле, составил +2,7 ± 1,1 мл/кг и +5,1 ± 2,4 мл/кг соответственно, что свидетельствует об отсутствии волемической нагрузки после ИК. Выводы. Использование многокомпонентного гиперосмолярного ПОЗ направлено на предупреждение отека тканей с началом искусственного кровообращения, синдрома капиллярной утечки, способствует более физиологичной коррекции электролитов и кислотно-щелочного состояния, позволяет снизить объем волемической нагрузки в периоперационном периоде на фоне стабильных показателей центральной гемодинамики.
Background. Cardiopulmonary bypass (CPB) has a significant effect on the patient’s body. The first potential factor that can negatively affect the functions of organs and tissues during perfusion is the CPB prime of the oxygenator. Even with the modern development of perfusion support, there is no single protocol regarding which solutions and in what proportion should be used in priming program. Therefore, the question of the search for composition of prime solutions is very important in order to avoid factors causing complications after CPB. Materials and methods. At the premises of the surgical center at State Scientific Institution “Scientific and Practical Center of Preventive and Clinical Medicine” of the Agency of State Affairs, the multicomponent hyperosmolar CPB prime was used in 90 patients during cardiac surgeries. There were 69 men (76.6 %) and 21 women (23.4 %) aged 37 to 81 years, on average 65.0 ± 2.5 years. The weight of patients ranged from 55 to 115 kg, an average of 86.40 ± 5.85 kg. According to the New York Heart Association functional classification, patients were divided as follows: II functional class — 79 (87.7 %) people, III functional class — 11 (12.3 %). In 73 patients, the operations were performed for ventricular fibrillation (group 1), in 17 individuals, the surgeries were carried out using a cardioplegic solution custodiol (group 2). When choosing solutions for CPB prime, an integrated method was used. The basic solution was volutenz, the basis of which is 4% modified gelatin, other hyperosmolar priming volume solutions were rheosorbilact and 15% mannit, a 4.2% soda-buffer solution was used to correct acid-base imbalance. For intravenous infusion during the operation, Ringer’s isotonic malate was used, which contains acetate and malate as a carrier of reserve alkalinity. The total volume of solutions in the perfusate was 1600–1200 ml. The total osmolarity of the solutions in the perfusate was 817.4 mosmol in 1600 ml, which amounted to 510.9 mosmol/l. Results. A positive result was noted when using CPB prime. The study of the gas transport function of the blood reflects the current metabolic needs of the body. When assessing the oxygen transport function of the circulatory system, it was found that at the preperfusion stage (10 minutes before the start of CPB), the level of oxygen delivery was normal — 571.70 ± 30.35 ml/(min • m2) (p < 0.001), but the level of its consumption was slightly reduced — 74.20 ± 6.32 ml/(min • m2) (p < 0.001), due to the vasodilation effect of sevoflurane and a decrease in total peripheral resistance, in the intensity of the general metabolism due to anesthesia and spontaneous cooling of patients on the operating table. After 10 minutes of cardiopulmonary bypass, DO2 decreased to 336.50 ± 24.03 ml/(min • m2), this is caused by a reduced oxygen content in arterial blood, which occurs due to a decrease in hemoglobin to 84.8 ± 8.6 g/l as a result of hemodilution. Oxygen consumption VO2 at this stage reached 23.85 ± 3.79 ml/(min • m2) due to a reduced metabolism at a patient’s body temperature of 32.6 ± 0.4 °C. After the main stage of the operation and warming the patient, DO2 was 348.60 ± 18.02 ml/(min • m2), VO2 increased to 101.90 ± 13.04 ml/(min • m2) at body temperature of 36.8 ± 0.2 °C. Thirty minutes after CPB, hemoglobin level was 96.7 ± 9.9 g/l, DO2 — 478.70 ± 29.12 ml/(min • m2), which corresponded to the normal level. The oxygen extraction index in our study was in line with stages of the surgery, the temperature status and the physiological norm at the end of the operation. When using a multicomponent hyperosmolar priming solution, the average perfusion pressure was 68.4 ± 5.7 mmHg, and its sharp fluctuation was not observed. The relative fluid balance after CPB in operations performed for atrial fibrillation and in surgeries performed with the use of custodiol was +2.7 ± 1.1 ml/kg and +5.1 ± 2.4 ml/kg, respectively, which indicates the absence of a volemic load after CPB. Conclusions. The use of CPB prime is aimed at preventing tissue edema with the onset of cardiopulmonary bypass, capillary leak syndrome, contributes to a more physiological correction of electrolytes and acid-base balance, and allows us to reduce of a volemic load in the perioperative period against the background of stable indicators of central hemodynamics.
штучний кровообіг; багатокомпонентний гіперосмолярний первинний об’єм заповнення; оксигенатор; доставка кисню; споживання кисню
искусственное кровообращение; многокомпонентный гиперосмолярный первичный объем заполнения; оксигенатор; доставка кислорода; потребление кислорода
cardiopulmonary bypass; multicomponent hyperosmolar CPB prime; oxygenator; oxygen delivery; oxygen consumption
Вступ
Матеріали та методи
/124.jpg)
/124_2.jpg)
Результати та обговорення
Висновки
- Синельников Ю.С., Ломиворотов В.В. Физиологические параметры искусственного кровообращения с точки зрения доказательной медицины. Часть І. Вестник анестезиологии и реаниматологии. 2016. Т. 13. № 2. С. 57-69. URL: https://doi.org/10.21292/2078-5658-2016-13-3-29-42.
- Sponholz C., Schelenz C., Reinhart K., Schirmer U., Stehr S.N. Catecholamine and volume therapy for cardiac surgery in Germany — results from a postal survey. PLoS One. 2014. 9(8). e103996. doi: 10.1371/journal.pone.0103996.
- Jacob M., Fellahi J.L., Chappell D., Kurz A. The impact of hydroxyethyl starches in cardiac surgery: a meta-analysis. Crit. Care. 2014. Vol. 18(6). P. 656. doi: 10.1186 / s13054-014-0656-0.
- Hans G.A., Ledoux D., Roediger L., Hubert M.B., Koch J.N., Senard M. The effect of intraoperative 6% balanced hydroxyethyl starch (130/0.4) during cardiac surgery on transfusion requirements. J. Cardiothorac. Vasc. Anesth. 2015. Vol. 29(2). P. 328-32. DOI: 10.1053/j.jvca.2014.06.002.
- Pfortmueller C., Funk G.C., Potura E., Reiterer C., Luf F., Kabon B., Druml W., Fleischmann E., Lindner G. Acetate-buffered crystalloid infusate versus infusion of 0.9% saline and hemodynamic stability in patients undergoing renal transplantation: prospective, randomized, controlled trial. Wien Klin. Wochenschr. 2017. Vol. 129 (17–18). P. 598-604. URL: https://doi.org/10.1007/s00508-017-1180-4.
- Pfortmueller C.A., Funk G.C., Reiterer C., Schrott A., Zotti O., Kabon B., Fleischmann E., Lindner G. Normal saline versus a balanced crystalloid for goal-directed perioperative fluid therapy in major abdominal surgery: a double-blind randomised controlled study. Br. J. Anaesth. 2018. Vol. 120(2). P. 274-83. doi: 10.1016/j.bja.2017.11.088.
- Pfortmueller C.A., Faeh L., Müller M., Eberle B., Jenni H., Zante B., Prazak J., Englberger L., Takalaand J., Jakob S.M. Fluid management in patients under going cardiac surgery: effects of an acetate versus lactate-buffered balanced infusion solutionon hemodynamic stability (HEMACETAT). Critical Care. 2019. Vol. 23. P. 159. URL: https://doi.org/10.1186/s13054-019-2423-8.
- Brauer S.D., Applegate R.L. II, Jameson J.J. et al. Association of plasmadilution with cardiopulmonary bypass-associated bleeding and morbidity. J. Cardiothorac. Vasc. Anesth. 2013. Vol. 27. P. 845-852. doi: 10.1053/j.jvca.2013.01.011.
- Murphy G.S., Hessel E.A. II, Groom R.C. Optimal perfusion during cardiopulmonary bypass: an evidence-based approach. Anesth. Analg. 2009. Vol. 108. P. 1394-1417. doi: 10.1213/ane.0b013e3181875e2e.
- Habib R.H., Zacharias A., Schwann T.A. et al. Role of hemodilution alanemia and transfusion during cardiopulmonary bypass in renal injury after coronary revascularization: implications on operative outcomes. Crit. Care Med. 2005. Vol. 33. P. 1749-1756. DOI: 10.1097/01.ccm.0000171531.06133.b0.
- Liskaser F.J. et al. The role of pump prime in the etiology and pathogenesis of cardiopulmonary bypass-associated acidosis. Anaesthesiology. 2000. Vol. 93. Р. 1170-1173. DOI: 10,1097/00000542-200011000-00006.
- Ranucci M., Biagioli B., Scolletta S. et al. Lowest hematocrit on cardiopulmonary bypass impairs the outcome in coronary surgery. Tex. Heart. Inst. J. 2006. Vol. 33. P. 300-305. PMID: 17041685. PMCID: PMC1592281
- Wright B.D., Hopkins A. Changes in colloid osmotic pressure as a function of anesthesia and surgery in the presence and absence of isotonic fluid administration in dogs. Vet. Anaesth. Analg. 2008. Vol. 35. № 4. P. 282-288. doi: 10.1111/j.1467-2995.2007.00388.x.
- Батюк А.М. Клинико-лабораторные аспекты применения перфузата с различной осмолярностью при операциях реваскуляризации миокарда в условиях искусственного кровообращения: дис... канд. мед. наук: 14.00.37. Новосибирск, 2009. 116 с. ил.
- Соловьева И.Н. Эфферентная гемокоррекция в хирургии сердца и аорты: дис... д-ра мед. наук: 14.01.21. Москва, 2018. 132 с.
- Фоминский Е.В. Использование раствора 7,2% NaCl/6% гидроксиэтилированного крахмала 200/0,5 при операциях реваскуляризации миокарда в условиях искусственного кровообращения: дис... канд. мед. наук: 14.01.20. Новосибирск, 2013. 147 с.
- Шмырев В.А. Острая норволемическая гемодилюция при кардиохирургических вмешательствах в условиях искусственного кровообращения: дис... канд. мед. наук: 14.00.37. Новосибирск, 2009. 114 с.
- Heming N., Moine P., Coscas R., Annane D. Perioperative fluid management for major elective surgery. January 2020. Vоl. 107. Issue 2. P. e56-e62. URL: https://doi.org/10.1002/bjs.11457.
- Figge J.J. Integration of acid-base and electrolyte disorders. N. Engl. J. Med. 2015. Vol. 372. P. 390. [Pub. Med.]. doi: 10.1056/NEJMc1414731.
- Хартиг В. Современная инфузионная терапия. Парентеральное питание. 4-е изд., перераб. Москва: Медицина, 1982. 494 с. URL: https://www.twirpx.com/file/555173.
- Корнилов И.А., Пономарев Д.Н., Шмырев В.А., Скопец А.А., Синельников Ю.С., Ломиворотов В.В. Физиологические параметры искусственного кровообращения с точки зрения доказательной медицины. Часть 2. Вестник анестезиологии и реаниматологии. 2016. Т. 13. № 3. С. 26-42. DOI 10.21292/2078-5658-2016-13-3-29-42.

/124_3.jpg)
/125.jpg)
/126.jpg)