Мигрень — одно из 8 хронических медицинских состояний, поражающих более 10 % людей в популяции, и самое частое неврологическое заболевание человека [1]. В настоящее время мигрень рассматривается уже не просто как головная боль, а как болезнь мозга — комплексное неврологическое расстройство с множественной клинической манифестацией. Несмотря на то, что мигрень считается доброкачественным неврологическим расстройством, наблюдаются хотя и редкие, но тяжелые осложнения мигрени. Согласно Международной классификации головной боли 3-го пересмотра 2018 года, к осложнениям мигрени относятся:
— мигренозный статус;
— персистирующая аура без инфаркта;
— мигренозный инфаркт;
— припадок, вызванный мигренозной аурой.
Ассоциация мигрени с инсультом на сегодняшний день является несомненной. Некоторые исследования демонстрируют увеличение риска инсульта у людей, имеющих мигрень в анамнезе, другие это не подтверждают [2–4]. Связь мигрени с инсультом рассматривается в двух направлениях: 1) развитие инсульта (ишемического инфаркта мозга) вследствие различных причин у людей, страдающих мигренью, и 2) развитие ишемического инфаркта во время типичной мигренозной атаки с аурой. Именно последний вариант соответствует критериям мигренозного инфаркта и относится к осложнениям мигрени. Диагноз мигренозного инфаркта основывается на критериях Международной классификации головной боли [5], к которым относятся следующие:
— развивается во время мигренозной атаки, соответствующей всем диагностическим критериям;
— развивается у пациентов с мигренью с аурой, когда один или более симптомов типичной ауры сохраняется свыше 1 часа;
— нейровизуализационное исследование выявляет ишемический инфаркт в зоне, соответствующей этим симптомам;
— другие причины инфаркта мозга должны быть исключены.
Мигренозный инфаркт — редкое осложнение мигрени. Стойкий неврологический дефицит, ассоциированный с мигренозной атакой, был описан еще в XIX веке. Шарко в 1890 году впервые употребил термин «осложненная мигрень». Частота мигренозного инсульта, по современным данным, составляет 3,36 на 100 000 человеко-лет [6]. Данные метаанализов показывают, что риск инсульта выше у пациентов с мигренью с аурой — 2,16 (95% доверительный интервал (ДИ) 1,53–3,03), и отсутствие риска при мигрени без ауры [7]. Также показано, что мигренозный инфаркт чаще развивается у молодых женщин < 45 лет в бассейне задней циркуляции. Часто у таких пациентов наблюдается пролонгированная аура [8]. На увеличение риска мигренозного инсульта оказывает влияние высокая частота атак, у некоторых пациентов также отмечено ухудшение течения мигрени незадолго до развития мигренозного инсульта [9, 10].
Несмотря на то, что, согласно диагностическим критериям, мигренозный инфаркт развивается у пациентов с мигренью с аурой, в литературе описано немало случаев развития инсульта на фоне мигренозной атаки без ауры и у пациентов, у которых никогда не было симптомов ауры [11, 12]. K. Gupta и соавт. описали случай развития ишемического инфаркта у 21-летней женщины на фоне интенсивного мигренозного приступа без ауры с развитием правосторонней гемиплегии и ишемического инфаркта в области внутренней капсулы и базальных ганглиев слева. При этом другие возможные причины инсульта были исключены после тщательного обследования [13].
Патогенетические механизмы мигрень-ассоциированного инфаркта мозга остаются недостаточно выясненными. Среди возможных причин рассматриваются распространяющаяся кортикальная депрессия, артериальный вазоспазм, биохимические и гемодинамические изменения, генетические нарушения. Распространяющаяся кортикальная депрессия является нейрофизиологической основой мигренозной ауры. Она представляет собой сильную волну деполяризации, которая медленно распространяется (около 3 мм/мин) через мозговую кору, что сопровождается короткой гиперперфузией, следующей за периодом в 1–2 часа редукции мозгового кровотока, которого, однако, недостаточно, чтобы вызвать ишемию [14]. Но распространяющаяся кортикальная депрессия ассоциируется также с высвобождением возбуждающих аминокислот, в том числе глутамата, который, как известно, вовлечен в ишемическое нейрональное повреждение [15]. Кроме того, распространяющаяся кортикальная депрессия ведет к метаболическим и гемодинамическим изменениям, высвобождению медиаторов воспаления, вазоактивных пептидов и молекул адгезии, которые предрасполагают к внутрисосудистому тромбообразованию [16].
Другим возможным механизмом может быть вазоспазм во время мигренозной атаки. Ряд авторов диагностировали вазоспазм у пациентов с мигренозным инсультом с помощью магнитно-резонансной ангиографии или транскраниальной допплерографии [17–20]. Одним из предполагаемых механизмов вазоспазма может быть выраженная симпатическая активация во время продолжительной сильной боли, результатом чего является артериальная вазоконстрикция и активация коагуляционного каскада, а артерии задней циркуляции особенно чувствительны к симпатической стимуляции [21]. Некоторые авторы развитие вазоспазма связывают с длительным использованием препаратов алкалоидов спорыньи и триптанов, что может объясняться вазоконстрикторными механизмами их действия [22, 23].
Ряд генетических синдромов, характеризующихся развитием мигрени и инсульта, подтверждают связь с генетическими факторами. Речь идет о редких метаболических заболеваниях, таких как аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией (CADASIL) и митохондриальная миопатия, энцефалопатия с лактатацидозом и инсультоподобными эпизодами (MELAS) [24, 25].
Мигренозный инсульт — достаточно редкое осложнение мигрени. По литературным данным, на его долю приходится от 0,5 до 1,5 % всех ишемических инсультов [26]. Системный поиск позволил идентифицировать 33 статьи с описанием в целом 119 пациентов (41 мужчины и 78 женщин) [19]. Зрительная аура наблюдалась у 49,6 % пациентов, сенситивная — у 15,1 %, неспецифическая — у 30,3 %, отсутствие ауры — только у 4,2 %. Очаг инфаркта в бассейне задней циркуляции визуализировался у 77,3 % пациентов, в бассейне передней циркуляции (на территории средней мозговой артерии) — у 22,7 %.
Случаи из практики
Мы наблюдали пациентов, у которых типичный мигренозный инсульт развился во время приступа мигрени без ауры.
Клинический случай 1
Пациент О., 32 лет, работает менеджером в мебельном салоне, заболел 13.04.2020 г., когда днем появилась пульсирующая головная боль в затылочной области, боль нарастала в течение нескольких часов, присоединились выраженная фото- и фонофобия, тошнота. Спустя несколько часов боль достигла интенсивности 9–10 баллов по ВАШ, и пациент отметил выпадение левой половины поля зрения. Машиной скорой помощи пациент доставлен в нейрохирургической отделение Городской клинической больницы № 7 г. Харькова с подозрением на разрыв артериовенозной мальформации. При поступлении: жалобы на выпадение левой половины поля зрения, пульсирующую головную боль в задней части головы. Из анамнеза известно, что приступообразные пульсирующие головные боли появились в подростковом возрасте, могли провоцироваться физическим или эмоциональным стрессом. Приступы наблюдались в среднем с частой 1–2 раза в месяц. Интенсивность приступов бывает различной, чаще наблюдаются приступы легкой и средней интенсивности, которые купируются сном или приемом цитрамона (комбинация парацетамола, кофеина и ацетилсалициловой кислоты). Раз в несколько лет развиваются приступы высокой интенсивности, когда очень сильная головная боль продолжается более суток и не купируется обычными препаратами. Во время одного из таких приступов и развилась очаговая неврологическая симптоматика в виде выпадения левой половины поля зрения. Из анамнеза жизни известно, что пациент не страдает артериальной гипертонией, сахарным диабетом, заболеваниями сердца, не курит, не употребляет алкоголь, не имел черепно-мозговых травм, также отрицает какие-либо другие заболевания. Семейного анамнеза по мигрени и инсульту нет. Также известно, что пациент склонен употреблять большое количество шоколада. Женат.
Соматический статус: сознание ясное, нормостенического телосложения, кожные покровы чистые, лимфоузлы не пальпируются. Над легкими при аус-культации везикулярное дыхание. Пульс ритмичный, 65 ударов в минуту, артериальное давление — 110/70 мм рт.ст. Живот мягкий, безболезненный. Неврологический статус: зрачки нормальных размеров, зрачковые реакции живые, движения глазных яблок в полном объеме, при исследовании полей зрения контрольным способом — левосторонняя гемианопсия. Лицо симметрично, язык по средней линии. Двигательных, чувствительных, координаторных нарушений нет. Менингеальных знаков нет.
Дополнительные обследования: результаты клинических анализов крови и мочи, сахар крови, биохимические анализы печеночных тестов, уровень креатинина, коагуляционные тесты — без отклонений от нормы. Общий холестерин — 3,86 ммоль/л, триглицериды — 0,39 ммоль/л; общий белок — 74 г/л; комплекс тестов на антифосфолипидный синдром: фосфолипиды, антитела IgG — 1,51 Ед/мл, IgM — 1,11 Ед/мл, антитела к β2-гликопротеину I, IgG — < 1,4 Ед/мл, антитела к β2-гликопротеину I, IgМ — 0,5 Ед/мл, волчаночный антикоагулянт — 35,6 с, индекс LA-AUTO — 1,0988 (риск отсутствует).
МРТ головного мозга (Phillips Intera 1.5 T) в режимах Т1, Т2, T2 hemo, flair, DWI: в кортико-субкортикальных парасагиттальных отделах затылочной доли правой гемисферы головного мозга (структура клина) визуализируется участок размером 37 × 24 × 28 мм, производящий повышенный МР-сигнал в flair, Т2 ВИ, резко повышенный в DWI с ограничением диффузии и слегка изогипоинтенсивный в Т1 ВИ. Заключение: ишемический инфаркт в правой затылочной доле головного мозга (рис. 1).
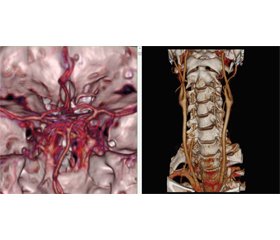
КТ-ангиография сосудов головы и шеи. Сосуды плечеголовного ствола, подключичные, сонные, позвоночные артерии контрастированы хорошо, признаков сужения их просвета не обнаружено. Виллизиев круг не замкнут, правая задняя соединительная артерия не визуализируется, левая задняя соединительная, передняя соединительная, передние, средние и задние мозговые артерии визуализируются хорошо. Данных в пользу аневризмы, артериовенозной мальформации, стеноза сосудов головы и шеи не выявлено (рис. 2).
Ультразвуковое исследование сердца. Аорта не расширена, стенки тонкие, амплитуда сокращений средняя, полости сердца не расширены, клапанный аппарат — движение створок митрального клапана разнонаправленное, смыкание полное, потока регургитации не выявлено. Зон акинезии, асинергии миокарда не выявлено. Жидкости в полости перикарда не выявлено.
Ультразвуковая допплерография магистральных сосудов шеи. Ход артерий ровный. Признаков стенозирования просвета сосудов не выявлено. Направление потоков типичное. Кровоток достаточный. Нефизиологической турбулентности потоков не выявлено. Толщина комплекса интима-медиа общих сонных артерий — 0,5 мм. Функциональные пробы с запрокидыванием и поворотом головы в стороны отрицательные с обеих сторон. Ps 92/мин.
Рентгенография шейного отдела позвоночника. Начальные признаки спондилоартроза и унковертебрального артроза. Аномалия Киммерле.
Клинический диагноз. Ишемический инсульт в бассейне правой задней мозговой артерии с левосторонней гемианопсией. Осложненная мигрень без ауры с частыми приступами, мигренозный инфаркт.
Проведено лечение: декскетопрофен, реосорбилакт, магнезия, раствор NaCl 0,9%, аспирин.
Пациент выписан на 10-й день в удовлетворительном состоянии. Головная боль не беспокоит, сохраняется неврологический дефицит в виде левосторонней гемианопсии. Рекомендации: прием аспирина 75 мг, топирамат для превентивного лечения мигрени.
Клинический случай 2
Пациентка К., 36 лет, домохозяйка. Доставлена машиной скорой помощи 26.06.2016 г. в медико-диагностический центр «ЛОРИТОМ» с жалобами на головную боль, слабость и онемение в правых конечностях. Из анамнеза известно, что около 20 лет страдает приступами головных болей в одной половине головы пульсирующего характера, приступы сопровождаются фото- и фонофобией, тошнотой. Связь головной боли с менструальным циклом отрицает, таблетированные противозачаточные таблетки не принимает. В последние годы приступы стали частыми — 1–2 раза в неделю, купируются комплексными таблетками анальгетиков и суматриптаном. Артериальной гипертонией, сахарным диабетом и другими заболеваниями не страдает. 26.06.2016 г. вечером на фоне головной боли во время домашней работы появилась слабость в правых конечностях. При поступлении в соматическом статусе: сознание ясное. Нормостенического телосложения. Кожные покровы бледные, чистые. Пульс 76 ударов в минуту, ритмичный, АД — 110/70 мм рт.ст. Живот мягкий, безболезненный. Неврологический статус: менингеальных знаков нет. Зрачки нормальных размеров, зрачковые реакции живые, движения глазных яблок в полном объеме, поля зрения не ограничены, слегка опущен правый угол рта, язык отклоняется вправо, глотание, фонация, речь не нарушены. Сила в правых конечностях снижена до 3 баллов, сухожильные рефлексы выше справа. Гемигипестезия всех видов чувствительности в правой половине тела. Атаксия в правых конечностях при выполнении координаторных проб.
Лабораторные обследования: клинические анализы крови и мочи, сахар крови, биохимические анализы печеночных тестов, уровень креатинина, коагуляционные тесты без отклонений от нормы. Общий холестерин — 5,52 ммоль/л, ХС ЛПНП — 2,81 ммоль/л, ХС ЛПВП — 2,29 ммоль/л; триглицериды — 0,39 ммоль/л; С-реактивный белок — 0,27 мг/л; гомоцистеин — 9,59 мкмоль/л; ревматоидный фактор — 5,4 МЕ/мл (в пределах нормы).
ЭКГ — норма. Эхокардиоскопия — магистральные сосуды, камеры и клапаны сердца без патологических изменений. Сократительная функция сердца не снижена, фракция выброса — 65 %. Щитовидная железа без патологических изменений. Суточное мониторирование ЭКГ и АД зарегистрировало синусовый ритм со среднесуточной ЧСС 79 в минуту. Ишемических изменений сегмента S-Т не обнаружено. Максимальное АД — 122/86 мм рт.ст.
МРТ головного мозга. Ишемический инфаркт в левом таламусе с небольшой геморрагической трансформацией.
При КТ-ангиографии сосудов головного мозга 01.07.2016 г. выявлен стеноз сегмента Р2 левой задней мозговой артерии. При повторном ангиографическом обследовании 12.01.2018 г. данных в пользу стенозов, интракраниального атеросклеротического поражения, аневризм, артериовенозной мальформации не выявлено. Вероятно, наличие сужения сегмента позвоночной артерии Р2 (от которого отходит в том числе бугорно-коленчатая артерия, симптомы поражения которой соответствуют клинической картине ишемического инсульта у данной пациентки) при первичном обследовании возможно расценивать как локальный вазоспазм.
УЗДГ магистральных сосудов шеи. Магистральные сосуды шеи проходимы, без признаков окклюзии. Кровоток по ходу общих сонных артерий магистральный, область бифуркации без особенностей, справа локально утолщение комплекса интима-медиа до 0,9 мм. Ускорение линейной скорости кровотока по правой позвоночной артерии. Функциональные пробы отрицательные.
Пациентка продолжает наблюдаться у невропатолога. После курса лечения топираматом 100 мг в сутки для предупреждения мигрени приступы стали гораздо реже, в настоящее время развиваются 1 раз в 2–3 месяца. Сохраняется резидуальный неврологический дефицит в виде легкого пареза в правой руке со снижением силы до 4 баллов, выраженная гемиатаксия с насильственными хореоатетоидными движениями и преимущественно динамическим «порхающим» тремором.
Обсуждение
Оба описанных пациента — люди молодого возраста, длительно страдающие частыми приступами мигрени; инфаркт мозга развился в бассейне задней циркуляции (на территории задней мозговой артерии). Тщательное обследование позволило исключить наличие кардиоваскулярных факторов риска и других причин ишемического инсульта. Особенностью описанных нами случаев является то, что у обоих пациентов инсульт со стойкой неврологической симптоматикой развился во время типичной мигренозной атаки без ауры, и тщательный опрос пациентов не выявил наличия приступов мигрени с аурой в анамнезе. У обоих пациентов сохранялся резидуальный неврологический дефицит. В целом, по литературным данным, функциональный исход после мигренозного инсульта благоприятный, за исключением одного случая фатального исхода. Ретроспективное исследование показало полное восстановление у 47,9 % и уменьшение неврологического дефицита в 18,5 % случаев, хотя дефект поля зрения сохранялся при тяжелых инфарктах в затылочной доле [27].
Помимо ишемического инфаркта, в ряде исследований отмечена связь мигрени с другими нейровизуализационными изменениями мозга, такими как гиперинтенсивность белого вещества и мелкие «немые» инфаркты. Описаны локализации очагов в белом веществе в лобной и теменной долях, лимбической системе [28–30]. Отмечена связь этих изменений с продолжительностью течения и тяжестью мигренозных атак [31, 32]. Изменения в белом веществе связывают также с редукцией мозгового кровотока при мигренозной ауре, однако связи риска инсульта с приемом триптанов не было обнаружено [33]. Наличие таких нейровизуализационных изменений может быть полезным маркером увеличения риска инсульта и подтверждает гипотезу о том, что мигрень является прогрессирующим заболеванием [34, 35].
Выводы
Диагноз «мигренозный инсульт» является трудным диагнозом для клинициста, так как требует исключения многих патологических состояний, которые потенциально могут быть причиной инсульта, особенно у молодых пациентов: различные гиперкоагуляционные состояния, дефект овального окна, аутоиммунные состояния, расслоение артерий и др. Взаимосвязь мигрени, головной боли и инсульта является сложной. Мигрень — очень частое заболевание, и пациент, страдающий мигренью, может иметь и другие причины развития инсульта. Головная боль может быть и следствием инсульта, и простым совпадением с инсультом, но диагноз мигренозного инсульта может быть установлен только когда у пациента с мигренью в анамнезе инфаркт мозга развивается во время типичной мигренозной атаки. Важной задачей является выявление факторов, увеличивающих риск мигренозного инсульта. Одним из таких факторов может быть высокая частота и интенсивность атак. Важно отметить, что купирование атак с применением триптанов и препаратов эрготамина у таких пациентов не рекомендовано. Также молодым женщинам следует избегать приема гормональных контрацептивов. Будущие исследования покажут, будет ли эффективный контроль частоты приступов способствовать снижению риска мигренозного инсульта.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов и финансовой заинтересованности при подготовке статьи.
Список литературы
1. Global Burden of Disease Study 2013 Collaborators. Global, regional, and national incidence, prevalence, and years lived with di-sability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015. 386. 743-800.
2. Etminan M., Takkouche B., Isorna F.C., Samii A. Risk of ischaemic stroke in people with migraine: systematic review and meta-analysis of observational studies. BMJ. 2005. 330. 363.
3. Lee M.J., Lee C., Chung C.S. The migraine-stroke connection. J. Stroke. 2016. 18. 146-156.
4. Peng K.P., Chen Y.T., Fuh J.L. et al. Migraine and incidence of ischemic stroke: a nationwide population-based study. Cephalalgia. 2017. 37. 327-335.
5. The International Classification of Headache. 3rd edition. Cephalalgia. 2018. 38(1). 1-211.
6. Zhang Y., Parikh A., Qian S. Migraine and stroke. Stroke Vasc. Neurol. 2017. 2(3). 160-167. doi: 10.1136/svn-2017-000077.
7. Schürks M., Rist P.M., Bigal M.E. et al. Migraine and cardiovascular disease: systematic review and metaanalysis. BMJ. 2009 Oct 27. 339. b3914.
8. Kurth T., Chabriat H., Bousser M.G. Migraine and stroke: a complex association with clinical implications. Lancet Neurol. 2012. 11. 92-100.
9. Morozova O.G., Yaroshevskiy O.A. Migraine and Cerebral stroke: Comorbidity and the Need for Preventive Therapy. Liku Ukraine. 2011. 9(155). 72-79.
10. Sacco S., Kurth T. Migraine and the risk for stroke and cardiovascular disease. Curr. Cardiol. Rep. 2014. 16. 524.
11. Rothrock J., North J., Madden K., Lyden P., Fleck P., Dittrich H. Migraine and migrainous stroke: Risk factors and prognosis. Neurology. 1993. 43(12). 2473-2476. doi: 10.1212/WNL.43.12.2473. ISSN 0028-3878. PMID 8255442.
12. Milhaud D., Bogousslavsky J., van Melle G., Liot P. Ischemic stroke and active migraine. Neurology. 2001. 57. 1805-1811.
13. Gupta K., Rohatgi A., Handa Sh. Case Report: Migrainous Infarct without Aura. Case Rep. Neurol. 2017. 9. 241-251.
14. Ayata C., Lauritzen M. Spreading Depression, Spreading Depolarizations, and the Cerebral Vasculature. Physiol. Rev. 2015. 95. 953-993.
15. Dreier J.P., Reiffurth C., Woitzik J. et al. How spreading depolarization can be the pathophysiological correlate of both migraine aura and stroke. Acta Neurochir. 2015. 120 Suppl. 137-140. doi: 10.1159/000481281.
16. Spalice A., Del Balzo F., Papetti L. et al. Stroke and migraine is there a possible comorbidity? Ital. J. Pediatr. 2016. 42. 41. doi: 10.1186/ s13052-016-0253-8.
17. Sanin L.C., Mathew N.T. Severe diffuse intracranial vasospasm as a cause of extensive migrainous cerebral infarction. Cephalalgia Int. J. Headache. 1993. 13(4). 289-292. doi: 10.1046/j.1468-2982.1993.1304289.x
18. Tsai C.F., Chen C.C., Wang S.C. et al. Reversible vasospasm in migrainous infarction: a transcranial Doppler follow-up study. J. Ultrasound Med. 2010. 29(3). 481-484. doi: 10.7863/jum.2010.29.3.481.
19. Vinciguerra L., Cantone M., Lanza G. et al. Migrainous Infarction and Cerebral Vasospasm: Case Report. and Literature Review. Journal of Pain Research. 2019. 12. 2941-2950.
20. Viola S., Viola P., Buongarzone M.P. et al. Microvascular vasospasm of cerebral cortex in prolonged aura migraine. Neurol. Sci. 2018. 39 (Suppl. 1). 95-96. doi: 10.1007/s10072-018-3288-3.
21. Mawet J., Kurth T., Ayata C. Migraine and stroke: in search of shared mechanisms. Cephalalgia Int. J. Headache. 2015. 35(2). 165-181. doi: 10.1177/0333102414550106.
22. Meschia J.F., Malkoff M.D., Biller J. Reversible segmental cerebral arterial vasospasm and cerebral infarction: possible association with excessive use of sumatriptan and Midrin. Arch. Neurol. 1998. 55(5). 712-714. doi: 10.1001/archneur.55.5.712.
23. Laurell K., Lundstrцm E. Migrainous infarction: aspects on risk factors and therapy. Curr. Pain Headache Rep. 2012. 16. 255-260.
24. Yevtushenko S.K., Yevtushenko I.S., Savchenko Ye.A., Ivanova M.F. Migraine and Lacunar Strokes as Basic Manifestation of Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarctions and Leukoencephalopathy (CADASIL-syndrome). International Neurological Journal. 2011. 8(46). 40.
25. Malik R., Winsvold B., Auffenberg E. et al. The migraine-stroke connection: a genetic perspective. Cephalalgia. 2016. 36. 658-668.
26. Plato B.M. Rare complications of migraine with aura. Headache. 2016. 56(8). 1373-1379. doi: 10.1111/head.12879.
27. Serrano F., Arauz A., Uribe R., Becerra L.C., Mantilla K., Zermeño F. Long-term follow-up of patients with migrainous infarction. Clin. Neurol. Neurosurg. 2018. 165. 7-9. doi: 10.1016/j.clineuro.2017.12.008.
28. Campagna G., Vickers A., Ponce C.M.P. et al. Homonymous hemianopsia as the presenting sign of migrainous infarction. Can. J. Ophthalmol. 2018. 53(6). e229-232. doi: 10.1016/j.jcjo.2018.01.007.
29. Bashir A., Lipton R.B., Ashina S. et al. Migraine and structural changes in the brain: a systematic review and meta-analysis. Neurology. 2013. 81. 1260-1268.
30. Gaist D., Garde E., Blaabjerg M. et al. Migraine with aura and risk of silent brain infarcts and white matter hyperintensities: an MRI study. Brain. 2016. 139. 2015-2023.
31. Monteith T., Gardener H., Rundek T. et al. Migraine, white matter hyperintensities, and subclinical brain infarction in a diverse community: the northern Manhattan study. Stroke. 2014. 45. 1830-1832.
32. Morais R., Sobral F., Cunha G. et al. Advanced MRI study of migrainous infarction presenting as cortical laminar necrosis — Case report and literature review. Clin. Neurol. Neurosurg. 2018. 167. 82-85. doi: 10.1016/j.clineuro.2018.02.016.
33. Roberto G., Raschi E., Piccinni C. et al. Adverse cardiovascular events associated with triptans and ergotamines for treatment of migraine: systematic review of observational studies. Cephalalgia. 2015. 35. 118-131.
34. Sadokha K.A., Kistsen V.V., Evstigneev V.V. Migraine: some age, gender and pathogenetic aspects, the problem of comorbidity (a review of literature and clinical observation). International Neurological Journal. 2017. 3(89). 118-124. doi: 10.22141/2224-0713.3.89.2017.104251.
35. Renard D., Nerrant E., Freitag C. Early recurrence of migrainous infarction. Acta Neurol. Belg. 2015. 115(4). 675-676. doi: 10.1007/s13760-015-0444-x.
/88.jpg)

/89.jpg)