Вступ
Останнє десятиріччя характеризується стрімким збільшенням випадків отруєнь, асоційованих із метадоном (метадону гідрохлорид — МГ), як в Україні, так і в Києві. Проблема гострих отруєнь насамперед нелегальним, або «вуличним», метадоном вийшла за межі наркологічної або психіатричної практики та стала справжнім випробуванням для відділень інтенсивної терапії, що спеціалізуються на лікуванні отруєнь. Перші наші публікації з цієї проблеми з’явилися 7 років тому [1, 2], але на той час тяжкі отруєння МГ не мали масового характеру, а привернули нашу увагу у зв’язку з появою смертельно небезпечного ускладнення — синдрому тривалої компресії м’яких тканин, що спостерігався переважно при алкогольному отруєнні тяжкого ступеня.
Поглиблене дослідження випадків отруєнь МГ надало можливість з’ясувати, що тяжкий стан постраждалих обумовлений не лише вживанням МГ, а й одночасним прийомом інших психоактивних речовин [3]. Найбільш несподіваною речовиною в даному аспекті виявився етанол, або етиловий алкоголь, різні концентрації якого виявлялися при хіміко-аналітичних дослідженнях крові і сечі постраждалих від отруєння МГ. Факт вживання наркотичної речовини разом з алкоголем був несподіваним. Більше ніж 30-річний досвід роботи токсикологічного центру Київської міської клінічної лікарні швидкої медичної допомоги був пов’язаний із лікуванням пацієнтів із моно- або комбінованими отруєннями наркотичними і психотропними речовинам, але раніше ін’єкційні наркомани не вживали наркотики одночасно з алкоголем, однак для ситуації з МГ виявилося інакше.
Поєднання токсичних ефектів різних психоактивних речовин, вживаних одночасно з МГ, спричиняло розвиток різноманітних токсичних синдромів, що супроводжувалися нетиповою для опіоїдних отруєнь симптоматикою. Клініко-лабораторні показники свідчили про наявність гострих уражень нервової, дихальної серцево-судинної систем, а також демонстрували ознаки гострої ниркової та іноді печінкової недостатності. Непоодинокими були випадки виявлення хронічних захворювань, спричинених тривалим вживанням наркотичних речовин [4, 5]. Таким чином, отруєння, що пов’язані з МГ, становлять групу різноманітних патологічних станів, у якій класичний опіоїдний синдром зустрічається в невеликому відсотку випадків.
Різноманітність порушень гомеостазу при тяжких отруєннях МГ обумовила необхідність визначення типових біомаркерів токсичного процесу, що можуть слугувати орієнтиром для оцінки тяжкості отруєння, контролю ефективності лікування, зокрема застосування методів штучної детоксикації організму. У попередній публікації ми приділили увагу дослідженню гематологічних індексів токсичності (за методикою Кальф-Каліфа Я.) при комбінованих отруєннях МГ й етанолом, ускладнених гострою нирковою недостатністю [6]. Дана робота присвячена дослідженню клініко-лабораторних показників крові пацієнтів з отруєннями МГ, що можуть слугувати критеріями оцінки тяжкості отруєння та включення до плану лікування методів штучної детоксикації (гемодіалізу (ГД), ультрафільтрації (УФ), плазмаферезу (ПФ), озонування крові).
Мета дослідження: на підставі оцінки параметрів токсичного процесу при гострому отруєнні МГ обґрунтувати підходи до застосування методів штучної детоксикації організму (гемодіалізу, ультрафільтрації, плазмаферезу та озонування крові).
Матеріали та методи
Дана робота виконана на базі Київської міської клінічної лікарні швидкої медичної допомоги при співпраці з ДП «Науковий центр превентивної токсикології, харчової та хімічної безпеки імені академіка Л.І. Медведя Міністерства охорони здоров’я України» в рамках фрагмента НДР (номер держ. реєстрації 0112U001133) на тему «Встановити причинно-наслідкові зв’язки при формуванні сучасних побутових токсикозів та обґрунтувати модифікацію технологій штучної детоксикації організму при отруєннях хімічними речовинами та їх мікстами», термін виконання — 2018–2020 рр. Досліджувалися випадки гострих отруєнь психоактивними речовинами (МКХ Т40.0–Т40.3.), асоційовані з МГ. Проведено ретроспективну оцінку карт стаціонарних хворих (форма № 003/0) із гострим отруєнням МГ, залучені матеріали медичного архіву Київської міської клінічної лікарні швидкої медичної допомоги за період 2005–2019 рр. Використовувалися методи дослідження: клінічні, біохімічні, функціональні, хіміко-аналітичні, статистичні.
Характеристика контингенту дослідження і формування груп дослідження. За весь період спостереження загальна чисельність гострих отруєнь психотропними речовинами, що включали моно- або комбіновані отруєння МГ, становила понад 1320 випадків. Нами було відібрано і статистично оброблено клініко-лабораторні показники 186 випадків отруєнь у дорослих віком 21–43 роки, чоловіків було 161 (86,6 %), жінок — 25 (14,4 %). Усі випадки кодувалися за МКХ-10, а саме Т40.0–Т40.3. Пацієнти були доставлені до Київської міської клінічної лікарні швидкої медичної допомоги бригадами екстреної медичної допомоги за ургентними показаннями з діагнозом «наркотичне отруєння», «отруєння метадоном». У всіх випадках за даними хіміко-аналітичного дослідження крові і сечі виявлено МГ (100 %), бензодіазепіни — у 70 випадках (37,6 %), фенотіазини — у 33 (17,7 %), барбітурати — у 14 (7,53 %), етанол (МГ + етанол) — у 126 (67,8 %).
Оцінка ступеня тяжкості отруєння була проведена за шкалою Перссона (Poisoning Severity Score — PSS; Persson H.E., 1998) [8] шляхом оцінки функціональних і лабораторних показників таких органів та систем: шлунково-кишкового тракту, нервової системи, дихальної системи, серцево-судинної системи, метаболічних показників (кислотно-лужний стан й електролітний стан, рівень глюкози), печінки (АСАТ, АЛАТ), нирок (протеїнурії, сечовини, креатиніну, діурезу), крові (гемолізу, метгемоглобінемії), м’язів (КФК крові), шкіри (наявність подразнення, опіку, компресії), органів зору (подразнення слизових, деструкція), наявності локальних уражень (біль, подразнення, набряк, некроз). Залежно від тяжкості стану пацієнти були розподілені на три групи (табл. 1):
— І група (n = 21) включала випадки отруєнь МГ середнього ступеня тяжкості, за шкалою бальної оцінки тяжкості отруєння PSS — 0 < 2 бали;
— ІІ група (n = 79) включала випадки отруєнь МГ тяжкого ступеня, за шкалою бальної оцінки тяжкості отруєння PSS — 2–3 бали;
— ІІІ група (n = 86) включала випадки отруєнь МГ вкрай тяжкого ступеня, за шкалою бальної оцінки тяжкості отруєння PSS — 3–4 бали.
Протягом всього періоду лікування визначали клініко-лабораторні показники за стандартними методиками, що затверджені наказами МОЗ України та клінічними протоколами [7]. Забір крові для проведення лабораторних досліджень здійснювали при надходженні хворого у відділення інтенсивної терапії та в динаміці лікування через 24, 48 та 72 години. УЗД органів черевної порожнини, комп’ютерну томографію голови та рентгенологічні дослідження органів грудної клітки в прямій проєкції виконували однократно усім хворим у перші 6 годин перебування пацієнтів у лікарні.
Методи лікування та медичне обладнання. Усі пацієнти отримували стандартне лікування відповідно до тяжкості стану отруєння, що оцінювався за PSS, та клінічного протоколу МОЗ України «Отруєння опіоїдами».
Застосовано вено-венозний гемодіаліз й ультрафільтрацію (Continuous veno-venous hemodialysis) у 87 пацієнтів із синдромом гострого пошкодження нирок, обумовленим преренальними (гіповолемія, низький серцевий викид, зниження тонусу ниркових судин) і ренальними (гостре токсичне ураження паренхіми нирок) чинниками. Гемодіаліз проводився на приладі компанії B. Braun Dialog iQ®, використовувалися діалізатори Diacap (LOPS-15/18), швидкість — 200–250 мл/хв, тривалість процедури — не менше 6 годин, ультрафільтрація — 2000–3000 мл за один сеанс.
Процедура плазмаферезу здійснювалася за допомогою апаратів: «Гемофенікс» з мембранним стерильним плазмофільтром ПФМ-800 і комплектом магістралей «Фенікс-АМП»; «Гемонетикс» із магістраллю та колбою для центрифуги. Перед початком процедури проводилося в/в введення кристалоїдів у дозі 10–15 мл/кг маси тіла. Гепарин вводили в дозі 5000 Од в/в пацієнту до початку процедури, ще 10 000 Од вводили в стерильний контур апарату. Ексфузія плазми становила 5–10 мл/кг маси тіла пацієнта, за одну процедуру в середньому виділялося 600–800 мл плазми. Критеріями для розрахунку об’єму ексфузії були: маса тіла, об’єм циркулюючої плазми, рівень альбуміну крові. Плазмаферез застосовувався з урахуванням методичних рекомендацій МОЗ України «Метод мембранного плазмаферезу в комплексному лікуванні невідкладних станів в наркології» (2009 р.).
Озонування крові здійснювалося за допомогою апарата Bozon-Н з урахуванням методики, схваленої МОЗ України («Методики озонотерапії», 2001 р.). Використаний медичний генератор озону родини Bozon (виробник НВП «Еконіка», Одеса, Україна). Прилад зареєстрований як медична техніка в МОЗ України та відповідає вимогам міжнародних стандартів EN61010-1:2001, EN55022:2006, EN61000-3-2:2006, EN61000-6-1:007; має вітчизняний сертифікат якості і виробляється серійно. Виробництво атестовано за системою якості виробництва медичної техніки ДСТУ ISO 13485:2005. Установка забезпечена цілим набором додаткових пристосувань для конкретних процедур, при виконанні яких відбувається інгаляційний вплив озону на медичний персонал.
Для збору та подальшої обробки результатів досліджень була побудована база даних у форматі Microsoft Excel 2007, яка включала показники епідеміологічних досліджень, клініко-лабораторного, функціонального і клінічного дослідження для кожного випадку отруєння. Було використано програмне забезпечення Statistica for Windows 10 (StatSoft Іnc., CША). Показники в групах дослідження порівнювали за допомогою t-критерію Стьюдента для незалежних вибірок; відмінності вважали статистично значущими при р ≤ 0,05.
Результати
Усі пацієнти були доставлені до відділення інтенсивної терапії та екстракорпоральної детоксикації токсикологічного центру бригадами екстреної медичної допомоги. Показаннями до госпіталізації у відділення були: кома, нестабільні показники артеріального тиску, ознаки дихальної недостатності, ознаки синдрому тривалої компресії м’яких тканин, анурія. Окремим пацієнтам під час госпіталізації проводилась допоміжна вентиляція легень за допомогою мішка Амбу через повітровід або ларингеальну маску. Після підключення пацієнтів до систем життєзабезпечення здійснювався відбір крові і сечі для проведення клінічних і хіміко-аналітичних досліджень. За результатами досліджень пацієнти були розподілені на групи. Характеристика показників у групах пацієнтів із гострими отруєннями МГ наведена в табл. 1.
У пацієнтів I групи спостерігався класичний опіоїдний синдром, що проявлявся відсутністю свідомості, пригніченням дихання і помірним зниженням артеріального тиску. У крові і сечі пацієнтів виявлені МГ та етанол. Дана група пацієнтів не потребувала реанімаційних заходів, однак необхідним був інтенсивний моніторинг життєвих показників. Пацієнти не мали ознак пошкодження м’яких тканин. За шкалою Перссона група мала найменші показники (1,34 ± 0,61 бала). У пацієнтів II групи також спостерігалися опіоїдний синдром, однак загальний стан був значно тяжчим (2,51 ± 0,44 бала) порівняно з I групою, низькі показники артеріального тиску (90,65 ± 31,43 мм рт.ст.); були наявні зони тривалої компресії м’яких тканин, що не перевищували 5 % поверхні тіла. Дана група пацієнтів потребувала застосування реанімаційних заходів. Третя група пацієнтів демонструвала критичний симптомокомплекс, що характеризувався глибокою комою, арефлексією, атонією м’язів, апное і низьким артеріальним тиском (85,74 ± 25,81 мм рт.ст.). Характерними були гіпотермія, наявність масивних зон компресії м’яких тканин, більших за 5 % площі тіла. Характерними були зміни в біохімічних показниках крові. Дана група пацієнтів потребувала застосування реанімаційних заходів.
/63.jpg)
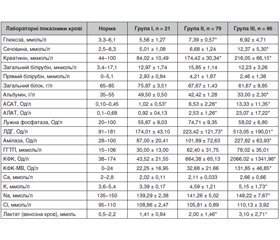
Дослідження біохімічних показників крові пацієнтів з отруєнням МГ тяжкого ступеня виявило характерні відмінності в окремих показниках, що дозволило в подальшому розцінювати їх як важливі маркери токсичного процесу або біомаркери ефекту. Дані про лабораторні показники крові, що характеризують біохімічні показники, систему гемостазу і клінічні показники крові пацієнтів у групах дослідження, наведені в табл. 2–4.
/64.jpg)
Характеризуючи біохімічні показники й електролітний склад крові пацієнтів із гострим отруєнням метадоном у групах дослідження, слід зазаначити, що в I групі (n = 21) не було відмічено суттевих відхилень біохімічних показників крові і показників системи гемостазу від норми, однак спостерігалися помірні ознаки гемоконцентрації. У II групі (n = 79) відмічалися зміни в показниках креатиніну, АСАТ і АЛАТ, ЛДГ, лактату; підвищення рівнів протромбіну за Квіком і тромбінового часу; ознаки гемоконцентрації, помірного гранулоцитозу, лімфо- і моноцитозу. У пацієнтів III групи (n = 86) відмічені вірогідні зміни щодо норми в показниках сечовини, креатиніну, альбуміну, АСАТ, АЛАТ, ЛДГ, амілази крові, КФК (із міокардіальною фракцією), лактату, калію і натрію плазми крові; відмічалася значна гемоконцентрація, гіперкоагуляція, здебільшого — гранулоцитоз, лімфо- і моноцитоз.
Біохімічний моніторинг крові пацієнтів є важливою частиною інтенсивного лікування. У пацієнтів усіх груп спостерігалися ознаки тканинної гіпоксії і недостатність функції киснево-транспортної системи у вигляді зниження коефіцієнта утилізації О2, споживання О2, наявності артеріовенозної різниці і підвищення рівня лактату в плазмі крові (табл. 2).
У пацієнтів всіх груп використовувалися однакові підходи до діагностики і лікування. До плану інтенсивної терапії і детоксикації включали:
— корекцію порушень функції дихальної та серцево-судинної систем;
— запобігання всмоктуванню токсикантів із шлунково-кишкового тракту шляхом ентеросорбції та лікувальної діареї;
— посилення механізмів природної детоксикації, запобігання виникненню та розвитку ускладнень;
— корекцію показників гомеостазу;
— органопротекторну терапію;
— відновлювальну терапію і реабілітацію.
У пацієнтів I групи оксигенація киснем здійснювалася через носові катетери або ларингеальну маску, для внутрішньовенного введення розчинів проводилася катетеризація вен. В окремих випадках застосовувалася штучна вентиляція легень з оксигенацією. У пацієнтів II та III груп здійснювалися катетеризація центральних вен (v. jugulars, v. subclavia), інтубація трахеї, проводилася штучна вентиляція легень у режимі примусової вентиляції і помірної гіпервентиляції. Гостра дихальна недостатність розвивається внаслідок пригнічення МГ дихального центру з одночасним порушенням водно-електролітного та кислотно-лужного балансу.
Відновлення функції дихання — першочергове завдання при проведенні реанімаційних заходів при отруєнні МГ. Слід враховувати, що для всіх груп пацієнтів підтримка дихання шляхом неінвазивної або інвазивної вентиляції здійснювалася не менше 12–24 годин. Критеріями припинення штучної вентиляції легень вважали: наявність свідомості і доступність продуктивного контакту (не менше 10–12 балів за шкалою Глазго); відновлення тонусу м’язів і кашльового рефлексу; рівень РаО2 70 мм рт.ст. та вище, SpО2 — 96 % або вище при FiО2 менше 50 % та при показнику позитивного тиску на кінці вдиху не більше 5 см вод.ст.; стабілізацію гемодинаміки без підтримки вазопресорами або інотропними засобами; відсутність явищ лівошлуночкової недостатності.
Важливо враховувати, що тривалість дії МГ становить 24–78 годин залежно від дози та рівня толерантності пацієнта, тому існує загроза рецидиву апное, що обумовлює необхідність проведення інтенсивного моніторингу життєвих функцій пацієнтів протягом цього часу.
Корекція функції серцево-судинної системи починалася з катетеризації судин із метою здійснення контролю тиску та введення інфузійних розчинів. Для пацієнтів II та III груп обов’язковим був моніторинг центрального венозного тиску. Інфузійна терапія здійснювалася з метою відновлення об’єму циркулюючої крові (ОЦК), втрат електролітів, додавання добових фізіологічних потреб у рідині та проведення детоксикації. Застосовували кристалоїди в композиції з ізотонічними розчинами глюкози та реологічними розчинами, бікарбонатом натрію. При значній гіповолемії в перші 6 годин застосовували введення багатокомпонентних сольових розчинів у дозі 10–20 мл/кг зі швидкістю 500–1000 мл за годину, надалі об’єм и швидкість змінювалися відповідно до індивідуальних потреб пацієнта. Одночасно здійснювали контроль діурезу (орієнтир — 1 мл/кг/год), перспіраційних втрат, центрального венозного тиску.
Промивання шлунка за допомогою зонда є важливим елементом лікування і діагностики при гострому отруєнні МГ. Промивання шлунка до чистих промивних вод здійснювали ізотонічними розчинами, після закінчення вводили сорбенти.
Не слід вводити антидоти (налоксону гідрохлорид) пацієнтам з отруєннями МГ в умовах стаціонару. Численні клінічні випадки підтверджують, що введення незначних доз антидоту (1–2 мл) може спричинити «шквал» циркулярних порушень, що проявляється розвитком набряку легень, гострої серцево-судинної недостатності і набряком мозку. Досі остаточно не визначені механізми таких критичних порушень у відповідь на введення антагоністів опіоїдних рецепторів. Не виключено, що одними з факторів можуть бути різке конкурентне блокування антидотом значної частини опіоїдних рецепторів і вивільнення великої кількості МГ разом із різноманітними медіаторами (дофамін, серотонін, ГАМКергічні молекули та ін.). Разом із тим короткочасна дія антидоту не забезпечує стабільне відновлення свідомості і дихання, що створює проблему повернення коми й апное.
Особливої уваги потребувала діагностика отруєнь МГ, що ускладнені синдромом тривалої компресії м’яких тканин та гострим пошкодженням нирок (гостре пошкодження нирок, англ. Acute kidney injury). Такі ускладнення спостерігалися в пацієнтів II та III групи. У пацієнтів II групи порушення функції нирок на фоні синдрому тривалої компресії м’яких тканин мали транзиторний характер і при адекватному і своєчасному лікуванні функція нирок самостійно відновлювалася без застосування ГД протягом 72 годин. Лікування пацієнтів II групи складалося з відновлення ОЦК, нормалізації реологічних показників крові, кислотно-лужного стану, після чого здійснювалися введення салуретиків (фуросемід однократно 2 мг/10 кг маси тіла) і спостереження за інтенсивністю сечовиділення. За відсутності діурезу протягом 24 годин починали ГД залежно від волемічного стану пацієнта й індивідуальних особливостей перебігу отруєння, застосовували ультрафільтрацію.
Показанням до гемодіалізу був симптомокомплекс: ішемія м’яких тканин (≥ 5 % від загальної поверхні тіла), олігурія/анурія протягом 24 годин, збільшення рівнів КФК плазми крові, підвищення рівня креатиніну, водно-електролітний і кислотно-лужний дисбаланс, загроза судинного тромбозу внаслідок посилення компресії в зоні ішемії м’яких тканин.
Розвиток синдрому ГПН був обумовлений преренальними (гіповолемія, низький серцевий викид, зниження тонусу ниркових судин) і ренальними (гостре токсичне ураження паренхіми нирок) чинниками. Протягом перших 72 годин процедури ГД + УФ здійснювалися щоденно до стабілізації показників гомеостазу. Надалі сеанси ГД + УФ проводилися переважно 1 раз на 2–3 доби за індивідуальними показаннями і до повного відновлення діурезу (1,5–2 л/добу) та нормалізації біохімічних і клінічних показників.
Ключовими індикаторами ефективності застосування ГД при отруєнні МГ тяжкого ступеня ми вважаємо такі:
— нормалізацію електролітних показників плазми крові;
— нормалізацію ОЦК;
— зменшення (або усунення) клінічних проявів набряку мозку;
— зменшення периферичних набряків (при компресійному ураженні кінцівок);
— нормалізацію показників креатиніну і сечовини плазми крові;
— зменшення ступеня прояву інтоксикаційного синдрому та метаболічних порушень.
Плазмаферез застосовувався в пацієнтів всіх груп. У пацієнтів I групи процедури ПФ призначали після стабілізації стану пацієнта, зазвичай через 24 години після надходження до відділення. У пацієнтів II та III груп плазмаферез призначався з 3–5-ї доби залежно від стану пацієнта. Орієнтовним показником об’єму ексфузії плазми може бути 1 % від маси тіла пацієнта. Максимальний обсяг плазми не повинен перевищувати обсяг, що розраховується за формулою: 0,01 × m + 200 мл, де m — маса тіла. Також кількість плазми для видалення можна обчислити через загальний об’єм плазми. Так, за один сеанс не можна видалити більше ніж 1/3 загального об’єму. Об’єм видаленої плазми також залежить від початкової кількості альбумінів крові і може бути обчислений шляхом помноження показника концентрації альбумінів на 15.
Ключовими індикаторами ефективності застосування ПФ при отруєнні МГ тяжкого ступеня ми вважали такі:
— зменшення проявів абстинентного синдрому і підвищення ефективності замісної терапії і знеболювання;
— нормалізацію реологічних показників крові;
— зниження клінічних проявів інтоксикації (нормалізація розрахункових індексів інтоксикації, визначених за методом Кальф-Каліфа Я.).
Важливим компонентом посилення механізмів природної детоксикації при отруєннях МГ є озонування крові. Метод озонотерапії в лікуванні пацієнтів I–III груп здійснювався протягом всього періоду лікування за такими методиками:
— озонування 200 мл фізіологічного розчину (доза озону — 0,48 мг) із наступним внутрішньовенним введенням (щоденно або через день);
— озонування 400 мл крові пацієнта (сумарна доза озону за сеанс — 3,6–5,4 мг) із наступним внутрішньовенним введенням (2–3 рази на тиждень).
Ключові індикатори ефективності озонування при отруєнні МГ тяжкого ступеня були такі: зниження ступеня больового й абстинентного синдрому; поліпшення реологічних показників крові; зменшення ступеня і площі набряку м’яких тканин або зони ішемії; пришвидшення процесів очищення ран і появи грануляційної тканини; скорочення періоду загоєння ран.
У пацієнтів I–III груп супровідна терапія включала: антикоагулянти (гепарин та низькомолекулярні гепарини), амінокислотні розчини (нефротект (фрезеніус) — 250,0 мл), ентеросорбенти, послабляючі засоби (лактулозу), знеболюючі, антибіотики, симптоматичні засоби, ентеральне харчування. Місцева терапія зон ішемії м’яких тканин здійснювалася консервативно. На завершальному етапі лікування призначалися фізіотерапія, лікувальний масаж, консультації нарколога, психіатра й інших спеціалістів.
Обговорення
Протягом останніх 3 років нами зібрано масивний клінічний матеріал, який підтверджує, що отруєння МГ є найбільш поширеним видом гострих побутових отруєнь психоактивними речовинами серед дорослих у місті Києві.
За весь період спостереження, що тривав упродовж 2005–2019 рр., було проліковано 1320 пацієнтів, серед яких померли 38 осіб. Аналіз смертельних випадків при отруєнні МГ довів, що 38 % пацієнтів загинули в першу добу після надходження до лікарні з явищами негоспітальної пневмонії — 80 %; хронічної токсичної гепатонефропатії — 34,3 %, гострого пошкодження нирок — 11,43 %, масивного рабдоміолізу — 22,9 % та хронічного сепсису — 14,2 % [4]. За період 2018–2019 рр. серед 186 пацієнтів із гострими отруєннями МГ померли 3. Серед причин, що обумовили настання смерті пацієнтів, були такі: тривала гіпоглікемія до моменту госпіталізації, аспірація шлункового вмісту, велика зона ішемії м’яких тканин, пневмонія, тромбоз магістральних судин кінцівок, постреанімаційна хвороба, тяжка супутня соматична патологія.
Установлено, що отруєння спричинені поєднанням МГ й етанолу, є найбільш небезпечними, що підтверджується особливо тяжким станом пацієнтів, розвитком життєво небезпечних ускладнень (синдром тривалої компресії м’яких тканин), досить тривалим періодом інтенсивного лікування і необхідністю застосування методів штучної детоксикації. Різноманітність порушень, що реєструються при клінічному і біохімічному обстеженні таких пацієнтів, підтверджує складність і поліморфізм патологічного процесу, що розгортається у відповідь на дію токсичних агентів МГ і етанолу. Таким чином, комбіновані отруєння МГ становлять в переважній кількості випадків не класичний опіоїдний синдром, а складний комплекс поліорганних ушкоджень.
Дослідження біохімічних показників крові пацієнтів дозволило встановити, що підвищення рівнів ферментів плазми крові (АСАТ, АЛАТ, ЛДГ, КФК, лактату), зниження рівня альбуміну, тромбоцитів і гемоглобіну та фоні підвищення гематологічних індексів токсичності можуть бути покладені в основу прогнозування раннього розвитку системних органних порушень і застосування методів екстракорпоральної детоксикації та можуть бути чутливими маркерами токсичного процесу для даної категорії хворих.
Комплексна терапія із застосуванням методів пролонгованого вено-венозного гемодіалізу з ультрафільтрацією, плазмаферезу й озонування крові дозволила забезпечити високий рівень ефективності лікування, зменшити летальність, скоротити період перебування пацієнтів в умовах відділення інтенсивної терапії та екстракорпоральної детоксикації. Важливою перевагою зазначеного методу лікування є можливість контролю за периферичними набряками і можливість зменшення компресії м’яких тканин, у результаті чого в жодному випадку не було застосоване хірургічне лікування при ураженні кінцівок внаслідок синдрому тривалої компресії м’яких тканин. У багатьох випадках плани лікування розроблялися індивідуально для кожного окремого пацієнта.
З урахуванням різноманітності токсичних речовин, зокрема постійної появи нових синтетичних наркотиків, що потребують подальшого вивчення, залишається актуальним пошук методів детоксикації, що дозволять у короткі терміни здійснювати корекцію критичних порушень гомеостазу. На наступному етапі дослідження ми плануємо узагальнити підходи до застосування сучасних методів екстракорпоральної детоксикації й органопротекторної терапії при комбінованих отруєннях і підготувати рекомендації для практичних лікарів із цих питань.
Висновки
1. За останнє десятиріччя в Україні проблема гострих отруєнь метадону гідрохлоридом вийшла за межі наркологічної або психіатричної практики та стала справжнім випробуванням для відділень інтенсивної терапії, що спеціалізуються на лікуванні отруєнь. Прийом метадону гідрохлориду часто поєднується з вживанням різноманітних психоактивних речовин, зокрема етанолу, що підвищує загрозу виникнення синдрому тривалої компресії м’яких тканин, рабдоміолізу і гострого пошкодження нирок.
2. Біомаркерами токсичного процесу при комбінованих отруєннях метадону гідрохлоридом тяжкого ступеня можуть слугувати підвищені рівні АСАТ, АЛАТ, ЛДГ, КФК, лактату на фоні гіпоальбумінемії і тромбоцитопенії як свідчення тяжких поліорганних ушкоджень.
3. Різноманітність порушень гомеостазу при комбінованих отруєннях метадону гідрохлоридом й етанолом обумовлює потребу в ранньому застосуванні (протягом перших 24–48 годин) методів екстракорпоральної детоксикації, зокрема поєднання пролонгованого вено-венозного гемодіалізу з ультрафільтрацією, мембранного плазмаферезу й озонотерапії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/62.jpg)
/63.jpg)
/64.jpg)