Журнал «Медицина неотложных состояний» Том 16, №6, 2020
Вернуться к номеру
Аналіз періопераційного ведення пацієнтів зі супутньою серцево-судинною патологією при некардіальних операційних втручаннях
Авторы: Гарбар М.О., Фесенко У.А., Підгірний Я.М., Світлик Ю.О., Світлик Г.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
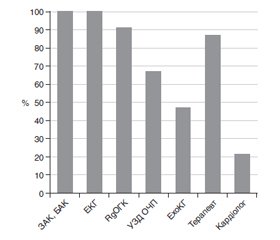
Актуальність. Добре спланована та обґрунтована доопераційна підготовка є важливим інструментом зменшення ризику періопераційних ускладнень. Європейським товариством кардіологів (ESC, 2014 р.) та Європейським товариством анестезіологів (ESA, 2018 р.) опубліковано рекомендації щодо підготовки пацієнта із супутньою кардіальною патологією до некардіальних операційних втручань. Проте в нашу клінічну практику дані рекомендації імплементовані недостатньо. Метою нашої роботи було проаналізувати рутинну доопераційну підготовку пацієнта та виявити моменти, які можна наблизити до рекомендованих стандартів із метою зниження періопераційних серцево-судинних ускладнень. Матеріали та методи. Ми проаналізували 242 історії хвороби пацієнтів, які надійшли на планове стаціонарне хірургічне лікування. Була проаналізована доопераційна підготовка з огляду на клінічні кардіальні фактори ризику та фактори ризику операційного втручання. Результати. Пацієнтам проведено стандартні обстеження згідно з встановленими правилами. У всіх осіб зареєстровані показники електрокардіограми, 47 % хворим проведено ехокардіографію спокою, 3 % виконано тропоніновий тест. З урахуванням інтерполяції рекомендацій ESC та ESA на нашу вибірку визначення функціональної спроможності було доцільним у 167 осіб (69 %) із подальшими оцінкою клінічних кардіальних факторів ризику та визначенням потреби проведення неінвазивних стрес-тестів особам високого ризику виникнення інфаркту міокарда та серцевої смерті. Кардіальні біомаркери було доцільно визначити в 44 осіб (18 %), реєструвати показники електрокардіограми спокою — у 127 пацієнтів (53 %), а ехокардіографії спокою — у 38 осіб (16 %). Така тактика вимагає налагодження комунікації між амбулаторною та стаціонарною ланками медичної системи. Висновки. Доопераційна підготовка більшості пацієнтів відбувається протягом 24–48 годин після госпіталізації в хірургічне відділення. Ми не використовуємо визначення функціональної спроможності пацієнта, не застосовуємо шкал оцінки ризику, не проводимо неінвазивні стрес-тести, недостатньо визначаємо кардіальні біомаркери. Однак частіше проводимо рутинні обстеження, які не є вирішальними в даній клінічній ситуації. У сучасних умовах наші клініки мають достатньо ресурсів для імплементації рекомендацій ESC та ESA у клінічну практику.
Актуальность. Хорошо спланированная и обоснованная дооперационная подготовка является важным инструментом снижения риска периоперационных осложнений. Европейским обществом кардиологов (ESC, 2014) и Европейским обществом анестезиологов (ESA, 2018) опубликованы рекомендации по подготовке пациента с сопутствующей кардиальной патологией к некардиальным операционным вмешательствам. Однако в нашу клиническую практику данные рекомендации имплементированы недостаточно. Целью нашей работы было проанализировать рутинную дооперационную подготовку пациента и выявить моменты, которые можно приблизить к рекомендованным стандартам с целью снижения периоперационных сердечно-сосудистых осложнений. Материалы и методы. Мы проанализировали 242 истории болезни пациентов, поступивших на плановое стационарное хирургическое лечение. Была проанализирована дооперационная подготовка с учетом клинических кардиальных факторов риска и факторов риска оперативного вмешательства. Результаты. Пациентам проведены стандартные обследования согласно установленным правилам. У всех пациентов зарегистрированы показатели электрокардиограммы, 47 % больным проведена эхокардиография покоя, 3 % выполнен тропониновый тест. С учетом интерполяции рекомендаций ESC и ESA на нашу выборку определение функциональной способности было целесообразным у 167 человек (69 %) с последующими оценкой клинических кардиальных факторов риска и определением необходимости проведения неинвазивных стресс-тестов лицам высокого риска возникновения инфаркта миокарда и сердечной смерти. Кардиальные биомаркеры было целесообразно определить у 44 пациентов (18 %), регистрировать показатели электрокардиограммы покоя — у 127 пациентов (53 %), а эхокардиографии покоя — у 38 лиц (16 %). Такая тактика требует налаживания коммуникации между амбулаторным и стационарным звеньями медицинской системы. Выводы. Дооперационная подготовка большинства пациентов происходит в течение 24–48 часов после госпитализации в хирургическое отделение. Мы не используем определение функциональной способности пациента, не применяем шкалы оценки риска, не проводим неинвазивные стресс-тесты, недостаточно определяем кардиальные биомаркеры. Однако чаще проводим рутинные обследования, которые не являются решающими в данной клинической ситуации. В современных условиях наши клиники имеют достаточно ресурсов для внедрения рекомендаций ESC и ESA в клиническую практику.
Background. Optimal and well-grounded pre-operative assessment is an important tool for improving patients’ outcomes. Despite published guidelines by the European Societies of Cardiology and Anesthesiology (ESC, ESA) Ukrainian medicine has not routinely accepted the algorithm of modern pre-operative assessment. The purpose of our study was to analyze standards of current pre-operative cardiac assessment of adults undergoing elective non-cardiac surgery and identify aspects that can be improved for the benefit of a patient and the clinic. Materials and methods. We have examined 242 elective surgery cases and peculiarities of all pre-operative assessments and interventions taking into account patients’ characteristics and surgery type. Results. All patients underwent standard examinations according to the established rules. The ECG was recorded in all subjects, resting echocardiography was performed to 47 %, troponin test was in 3 %. According to ESC and ESA guidelines, functional capacity should be evaluated in 167 (69 %) individuals with further assessing clinical cardiac risk factors and non-invasive stress tests performing in persons with a high risk of myocardial infarction and cardiac death. Cardiac biomarkers should be determined in 44 patients (18 %), resting ECG was registered to 127 patients (53 %) and resting echocardiography – to 38 people (16 %). Such tactics require communication between the outpatient and inpatient units of the medical system. Conclusions. Pre-operative evaluation of almost all patients takes place within 24–48 hours after hospitalization. Elective non-cardiac surgery patients don’t have sufficient time to implement interventions to improve outcomes. We don’t promote functional capacity assessment, risk-scales, non-invasive stress-tests, and biomarkers for predicting adverse outcomes. Ukraine has all resources to implement current Guidelines on pre-operative evaluation to an individual patient and hospital benefits.
періопераційний ризик; несерцева хірургія; супутня кардіальна патологія
периоперационный риск; некардиальная хирургия; сопутствующая кардиальная патология
perioperative risk; non-cardiac surgery; concomitant cardiac pathology
Вступ
Матеріали та методи
/79.jpg)
Результати та обговорення
/79_2.jpg)
Висновки
- Kristensen S.D., Knuuti J., Saraste A. et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). European Heart Journal. 2014. 35(35). 2383-2431. doi: 10.1093/eurheartj/ehu282.
- De Hert S., Staender S., Fritsch G. et al. Pre-operative evaluation of adults undergoing elective noncardiac surgery: Updated guideline from the European Society of Anaesthesiology. European Journals of Anaesthesiology. 2018. 35(6). 407-465. doi: 10.1097/EJA.0000000000000817.
- Revised cardiac risk index for pre-operative risk. https://www.mdcalc.com/revised-cardiac-risk-index-pre-operative-risk.
- Gupta P.K., Gupta H., Sundaram A. et al. Development and validation of a risk calculator for prediction of cardiac risk after surgery. Circulation. 2011. 124(4). 381-387. doi: 10.1161/circulationaha.110.015701.
- Biccard B.M. Relationship between the inability to climb two flights of stairs and outcome after major non-cardiac surgery: implications for the pre-operative assessment of functional capacity. Anaesthesia. 2005. 60(6). 588-593. doi: 10.1111/j.1365-2044.2005.04181.x/.
- Bierle D.M., Raslau D., Regan D.W., Sundsted K.K., Mauck K.F. Preoperative evaluation before noncardiac surgery. Mayo Clinic Proceedings. 2020. 95(4). 807-822. doi: 10.1016/j.mayocp.2019.04.029.
- Devereaux P.J., Chan M.T., Alonso-Coello P. et al. Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA. 2012. 307(21). 2295-2304. doi: 10.1001/jama.2012.5502.
- Duceppe E., Parlow J., MacDonald P. et al. Canadian cardiovascular society guidelines on perioperative cardiac risk assessment and management for patients who undergo noncardiac surgery. The Canadian journal of cardiology. 2017. 33(1). 17-32. doi: 10.1016/j.cjca.2016.09.008.

/80.jpg)