Журнал «Медицина неотложных состояний» Том 16, №6, 2020
Вернуться к номеру
Вплив методів післяопераційного знеболювання на моторну функцію шлунково-кишкового тракту в дітей із перитонітом, ускладненим інтраабдомінальною гіпертензією
Авторы: Перова-Шаронова В.М.
Львівський національний медичний університет ім. Данила Галицького, м. Львiв, Україна
Комунальне некомерційне підприємство Львівської обласної ради «Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ», м. Львiв, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
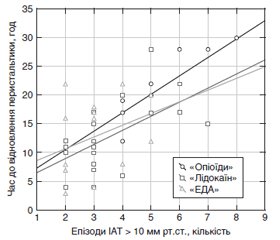
Актуальність. Метод післяопераційного знеболювання може впливати на швидкість відновлення моторної функції шлунково-кишкового тракту, рівень інтраабдомінального тиску (ІАТ) і розвиток інтраабдомінальної гіпертензії (ІАГ). Мета: дослідити вплив методів післяопераційного знеболювання на моторну функцію кишечника в дітей з перитонітом, ускладненим ІАГ. Матеріали та методи. 115 дітей, яким були проведені оперативні втручання з приводу апендикулярного перитоніту, рандомізовано на групи залежно від методу післяопераційного знеболювання: «Опіоїди» (n = 36, внутрішньовенна інфузія морфіну), «Лідокаїн» (n = 40, внутрішньовенна інфузія лідокаїну), «ЕДА» (n = 39, епідуральна аналгезія). Залежно від рівня ІАТ і наявності органної дисфункції дітей кожної групи було поділено на підгрупи: «без ІАГ» (ІАТ < 10 мм рт.ст.), «ІАГ» (ІАТ > 10 мм рт.ст.) і «АКС» (абдомінальний компартмент-синдром, ІАГ з органною дисфункцією). Усім дітям у післяопераційному періоді проводилось вимірювання рівня ІАТ та оцінка швидкості відновлення моторної функції шлунково-кишкового тракту. Результати. У всіх підгрупах групи «ЕДА» час до відновлення перистальтики й перших випорожнень та об’єм залишку по назогастральному зонду були статистично значуще меншими порівняно з аналогічними показниками в підгрупах групи «Опіоїди» (Р < 0,05). У підгрупах «ІАГ» і «АКС» групи «ЕДА» був також статистично значуще меншим час до перших випорожнень порівняно з аналогічними показниками підгруп групи «Лідокаїн» (Р < 0,05). Статистично значуще меншими були час до відновлення перистальтики та об’єм залишку по назогастральному зонду в усіх підгрупах групи «Лідокаїн» порівняно з показниками групи «Опіоїди» (Р < 0,05). Епізоди підвищення ІАТ > 10 мм рт.ст. значно частіше спостерігались у групі «Опіоїди», ніж у групах «Лідокаїн» та «ЕДА» (Р < 0,05). Кількість епізодів ІАТ > 10 мм рт.ст. мала пряму кореляцію зі швидкістю відновлення перистальтики в усіх групах, але сила такої кореляції була найбільш вираженою в групах «Опіоїди» (rs = 0,78; p = 0,001 і rs = 0,76; p = 0,01) і «Лідокаїн» (rs = 0,58; p = 0,008 і rs = 0,95; p = 0,01) і помірною — у групі «ЕДА» (rs = 0,39; p = 0,16 і rs = 0,46; p = 0,43). Висновки. ЕДА є оптимальним методом післяопераційного знеболювання в дітей з перитонітом, ускладненим ІАГ, що призводить до раннього відновлення моторної функції шлунково-кишкового тракту й запобігає подальшому зростанню ІАТ. Внутрішньовенна інфузія лідокаїну може бути використана як альтернативний метод знеболювання. Системна опіоїдна аналгезія має негативний вплив на моторику шлунково-кишкового тракту.
Актуальность. Метод послеоперационного обезболивания может влиять на скорость восстановления моторной функции желудочно-кишечного тракта, уровень интраабдоминального давления (ИАД) и способствовать развитию интраабдоминальной гипертензии (ИАГ). Цель: исследовать влияние методов послеоперационного обезболивания на моторную функцию кишечника у детей с перитонитом, осложненным ИАГ. Материалы и методы. 115 детей, которым были проведены оперативные вмешательства по поводу аппендикулярного перитонита, рандомизированы на группы в зависимости от метода послеоперационного обезболивания: «Опиоиды» (n = 36, инфузия морфина), «Лидокаин» (n = 40, инфузия лидокаина), «ЭДА» (n = 39, эпидуральная аналгезия). В зависимости от уровня ИАД и наличия органной дисфункции дети каждой группы были разделены на подгруппы: «без ИАГ» (ИАД < 10 мм рт.ст.), «ИАГ» (ИАД > 10 мм рт.ст.) и «АКС» (абдоминальный компартмент-синдром, ИАГ с органной дисфункцией). Всем детям в послеоперационном периоде проводилось измерение уровня ИАД и оценка скорости восстановления моторной функции желудочно-кишечного тракта. Результаты. Во всех подгруппах группы «ЕДА» время до восстановления перистальтики и первых испражнений и объем остатка по назогастральному зонду были статистически значимо меньшими по сравнению с аналогичными показателями в подгруппах группы «Опиоиды» (Р < 0,05). В подгруппах «ИАГ» и «АКС» группы «ЭДА» также было статистически значимо меньшим время до первых испражнений по сравнению с аналогичными показателями в подгруппах группы «Лидокаин» (Р < 0,05). Статистически значимо меньшими были время до восстановления перистальтики и объем остатка по НГЗ во всех подгруппах группы «Лидокаин» по сравнению с аналогичными показателями группы «Опиоиды» (Р < 0,05). Эпизоды повышения ИАД >10 мм рт.ст. значительно чаще встречались у детей в группе «Опиоиды», чем в группах «Лидокаин» и «ЭДА» (Р < 0,05). Количество эпизодов ИАД > 10 мм рт.ст. имело прямую корреляцию с длительностью времени восстановления перистальтики, но сила такой корреляции была выше в группах «Опиоиды» (rs = 0,78; p = 0,001 и rs = 0,76; p = 0,01) и «Лидокаин» (rs = 0,58; p = 0,008 и rs = 0,95; p = 0,01), чем в группе «ЭДА» (rs = 0,39; p = 0,16 и rs = 0,46, p = 0,43). Выводы. ЭДА является оптимальным методом послеоперационного обезболивания у детей с перитонитом, осложненным ИАГ, который приводит к раннему восстановлению моторной функции ЖКТ и предотвращает дальнейший рост ИАД. Инфузия лидокаина может быть использована как альтернативный метод обезболивания. Системная опиоидная аналгезия оказывает негативное влияние на моторику желудочно-кишечного тракта.
Background. The postoperative analgesia method can affect gastrointestinal motility, the level of intra-abdominal pressure (IAP) and lead to intra-abdominal hypertension (IAH). The purpose was to study the effect of different postoperative analgesia methods on gastrointestinal motility in children with appendicular peritonitis complicated with IAH. Materials and methods. One hundred and fifteen children operated for appendicular peritonitis were randomized into three groups depending on the postoperative analgesia method: opioids (n = 36, intravenous morphine infusion), lidocaine (n = 40, intravenous lidocaine infusion) and EDA (n = 39, epidural analgesia). The patients in each group were retrospectively divided into subgroups according to the IAP level and the presence of organ dysfunction: without IAH (IAP < 10 mmHg), IAH (IAP > 10 mmHg) and ACS (abdominal compartment syndrome, IAH with organ dysfunction). IAP level and motor function of the gastrointestinal tract were evaluated in postoperative period in all children. Results. The time needed to restore bowel motility and first feces were significantly shorter and the gastric residual volume was lower in all subgroups of EDA group compared to opioid (Р < 0.05) group. Also, the time to first feces was significantly shorter in IAH and ACS subgroups of EDA group compared to relevant subgroups in lidocaine group (Р < 0.05). The children in all subgroups of lidocaine group had statistically significantly earlier bowel motility restoration and lower gastric residual volume compared to those in opioid group (Р < 0.05). Episodes of IAP > 10 mmHg were registered significantly more often in opioid group than in lidocaine and EDA groups (Р < 0.05). The number of IAP episodes > 10 mmHg correlated positively with the time for motility restoration in all groups, and the strength of such correlation was most pronounced in opioid (rs = 0.78, p = 0.001, and rs = 0.76, p = 0.01) and lidocaine groups (rs = 0.58, p = 0.008, and rs = 0.95, p = 0.01), and moderate — in EDA group (rs = 0.39, p = 0.16, and rs = 0.46, p = 0.43). Conclusions. EDA is the most optimal method of postoperative analgesia for children with peritonitis and IAH. EDA accelerated restoration of gastrointestinal motility and prevents further increase in IAP. Intravenous lidocaine infusion can be used as an alternative method of postoperative analgesia in these patients. Systemic opioid analgesia has a negative effect on gastrointestinal motility.
інтраабдомінальна гіпертензія; внутрішньовенна інфузія лідокаїну; епідуральна аналгезія; опіоїдна аналгезія; діти
интраабдоминальная гипертензия; инфузия лидокаина; эпидуральная аналгезия; опиоидная аналгезия; дети
intra-abdominal hypertension; intravenous lidocaine infusion; epidural analgesia; opioid analgesia; children
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Montravers P., Blot S., Dimopoulos G., Eckmann C., Eggimann P., Guirao X. et al. Therapeutic management of peritonitis: a comprehensive guide for intensivists. Intensive Care Med. 2016 Aug. 42(8). 1234-47. doi: 10.1007/s00134-016-4307-6. Epub 2016 Mar 16. PubMed PMID: 26984317.
- Reintam Blaser A., Malbrain M.L.N.G., Regli A. Abdominal pressure and gastrointestinal function: an inseparable couple? Anaesthesiol. Intensive Ther. 2017. 49(2). 146-158. doi: 10.5603/AIT.a2017.0026. Epub 2017 May 17. Review. PubMed PMID: 28513822.
- Kirkpatrick A.W., Roberts D.J., De Waele J., Jaeschke R., Malbrain M.L., De Keulenaer B. et al. Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013. 39(7). 1190-1206.
- Reintam Blaser A., Starkopf J., Malbrain M.L. Abdominal signs and symptoms in intensive care patients. Anaesthesiol. Intensive Ther. 2015. 47(4). 379-87. doi:10.5603/AIT.a2015.0022. Epub 2015 May 14. Review. PubMed PMID: 25973664
- Leppäniemi A., Kimball E.J., De Laet I., Malbrain M.L., Balogh Z.J., De Waele J.J. Management of abdominal sepsis — a paradigm shift? Anaesthesiol. Intensive Ther. 2015. 47(4). 400-8. doi: 10.5603/AIT.a2015.0026. Epub 2015 May 14. Review. PubMed PMID: 25973662
- Thabet F.C., Ejike J.C. Intra-abdominal hypertension and abdominal compartment syndrome in pediatrics. A review. J. Crit. Care. 2017 Oct. 41. 275-282. doi:10.1016/j.jcrc.2017.06.004. Epub 2017 Jun 7. Review. PubMed PMID: 28614762
- Barletta J.F., Asgeirsson T., Senagore A.J. Influence of intravenous opioid dose on postoperative ileus. Ann. Pharmacother. 2011 Jul. 45(7–8). 916-23. doi: 10.1345/aph.1Q041. Epub 2011 Jul 5. PubMed PMID: 21730280.
- Van Noord B.A., Roffey P., Thangathurai D. Abdominal compartment syndrome following opioid-induced postoperative ileus. J. Clin. Anesth. 2013 Mar. 25(2). 146-9. doi: 10.1016/j.jclinane.2012.07.004. Epub 2013 Jan 17. PubMed PMID: 23333788.
- Harvey K.P., Adair J.D., Isho M., Robinson R. Can intravenous lidocaine decrease postsurgical ileus and shorten hospital stay in elective bowel surgery? A pilot study and literature review. Am. J. Surg. 2009 Aug. 198(2). 231-6. doi: 10.1016/j.amjsurg.2008.10.015. Epub 2009 Mar 12. Review. PubMed PMID: 19285304.
- Guay J., Nishimori M., Kopp S.L. Epidural Local Anesthetics Versus Opioid-Based Analgesic Regimens for Postoperative Gastrointestinal Paralysis, Vomiting, and Pain After Abdominal Surgery: A Cochrane Review. Anesth. Analg. 2016 Dec. 123(6). 1591-1602. Review. PubMed PMID: 27870743.
- Hakobyan R.V., Mkhoyan G.G. Epidural analgesia decreases intraabdominal pressure in postoperative patients with primary intra-abdominal hypertension. Acta Clin. Belg. 2008 Mar-Apr. 63(2). 86-92. PubMed PMID: 18575048.
- Onoglu R., Narin C., Kiyici A., Sarkilar G., Hacibeyoglu G., Baba F. et al. The Potential Effect of Epidural Anesthesia on Mesenteric Injury after Supraceliac Aortic Clamping in a Rabbit Model. Ann. Vasc Surg. 2016 Jul. 34. 227-33. doi: 10.1016/j.avsg.2015.11.013. Epub 2016 Feb 21. PubMed PMID: 26902941.
- Kapral S., Gollmann G., Bachmann D., Prohaska B., Likar R., Jandrasits O. et al. The effects of thoracic epidural anesthesia on intraoperative visceral perfusion and metabolism. Anesth. Analg. 1999 Feb. 88(2). 402-6. PubMed PMID: 9972765.
- Reintam Blaser A., Malbrain M.L., Starkopf J., Fruhwald S., Jakob S.M., De Waele J. et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems. Intensive Care Med. 2012 Mar. 38(3). 384-94. doi: 10.1007/s00134-011-2459-y. Epub 2012 Feb 7. PubMed PMID: 22310869; PubMed Central PMCID: PMC3286505.
- Pereira B.M., Pereira R.G., Wise R., Sugrue G., Zakrison T.L., Dorigatti A.E. et al. The role of point-of-care ultrasound in intra-abdominal hypertension management. Anaesthesiol. Intensive Ther. 2017. 49(5). 373-381. doi: 10.5603/AIT.a2017.0074. Epub 2017 Nov 28. PubMed PMID: 29182210.
- Leslie J.B., Viscusi E.R., Pergolizzi J.V. Jr, Panchal S.J. Anesthetic Routines: The Anesthesiologist's Role in GI Recovery and Postoperative Ileus. AAdv. Prev. Med. 2011. 2011. 976904. doi: 10.4061/2011/976904. Epub 2010 Dec 29. PubMed PMID: 21991449; PubMed Central PMCID: PMC3168940.
- Rollins K.E., Javanmard-Emamghissi H., Scott M.J., Lobo D.N. The impact of peri-operative intravenous lidocaine on postoperative outcome after elective colorectal surgery: A meta-analysis of randomised controlled trials. Eur. J. Anaesthesiol. 2020 Feb 26. doi: 10.1097/EJA.0000000000001165. [Epub ahead of print] PubMed PMID: 32141934.
- Dunn L.K., Durieux M.E. Perioperative Use of Intravenous Lidocaine. Anesthesiology. 2017 Apr. 126(4). 729-737. doi: 10.1097/ALN.0000000000001527. Review. PubMed PMID: 28114177.
- Cooke C., Kennedy E.D., Foo I., Nimmo S., Speake D., Paterson H.M. et al. Meta-analysis of the effect of perioperative intravenous lidocaine on return of gastrointestinal function after colorectal surgery. Tech. Coloproctol. 2019 Jan. 23(1). 15-24. doi: 10.1007/s10151-019-1927-1. Epub 2019 Feb 5. PubMed PMID: 30721376; PubMed Central PMCID: PMC6394718.
- El-Deeb A., El-Morsy G.Z., Ghanem A.A.A., Elsharkawy A.A., Elmetwally A.S. The effects of intravenous lidocaine infusion on hospital stay after major abdominal pediatric surgery. A randomized double-blinded study. Egypt. J. Anaesth. 2013. 29. 225-230. DOI: 10.1016/j.egja.2013.02.005.
- Shi W.Z., Miao Y.L., Yakoob M.Y., Cao J.B., Zhang H., Jiang Y.G. et al. Recovery of gastrointestinal function with thoracic epidural vs. systemic analgesia following gastrointestinal surgery. Acta Anaesthesiol. Scand. 2014 Sep. 58(8). 923-32. doi: 10.1111/aas.12375. Epub 2014 Jul 24. Review. PubMed PMID: 25060245.
- Swenson B.R., Gottschalk A., Wells L.T., Rowlingson J.C., Thompson P.W., Barclay M. et al. Intravenous lidocaine is as effective as epidural bupivacaine in reducing ileus duration, hospital stay, and pain after open colon resection: a randomized clinical trial. Reg. Anesth. Pain. Med. 2010 Jul-Aug. 35(4). 370-6. doi: 10.1097/AAP.0b013e3181e8d5da. PubMed PMID: 20588151.
- Wongyingsinn M., Baldini G., Charlebois P., Liberman S., Stein B., Carli F. Intravenous lidocaine versus thoracic epidural analgesia: a randomized controlled trial in patients undergoing laparoscopic colorectal surgery using an enhanced recovery program. Reg. Anesth. Pain Med. 2011 May-Jun. 36(3). 241-8. doi: 10.1097/AAP.0b013e31820d4362. PubMed PMID: 21519309.

/104.jpg)
/105.jpg)
/106.jpg)