Журнал «Медицина неотложных состояний» Том 16, №6, 2020
Вернуться к номеру
Експериментальне моделювання холінореактивності головного мозку при черепно-мозковій травмі: вплив на центральну гемодинаміку
Авторы: Худолій С.О.(1), Зябліцев С.В.(2)
(1) — Медичний центр сучасної адиктології MedicoMente, м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Найбільше значення для адекватної відповіді на черепно-мозкову травму (ЧМТ) має первинна реакція медіаторних систем центральної нервової системи у гострий період, коли формуються основні патогенетичні зрушення. Мета дослідження: визначення впливу стану холінореактивності (активації або блокади центральних холінергічних систем; ЦХС) на летальність, неврологічний дефіцит і стан центральної гемодинаміки в гострому періоді ЧМТ. Матеріали та методи. Травму моделювали при вільному падінні вантажу на фіксовану голову тварини. Для активації ЦХС щурам до травми вводили холіну альфосцерат (гліатилін; 6 мг/кг), для блокування — біперидену гідрохлорид (акінетон; 0,6 мг/кг). Неврологічний дефіцит оцінювали за 100-бальною шкалою Тодда. Параметри центральної гемодинаміки визначали методом тетраполярної імпедансної грудної реографії. Результати. Активація ЦХС у гострому періоді ЧМТ призводила до зменшення летальності й неврологічного дефіциту. Відмічено істотне збільшення серцевого викиду та зниження опору судин (гіпердинамичний тип). Блокада ЦХС супроводжувалося значним неврологічним дефіцитом, зниженням серцевого викиду й артеріального тиску на тлі збільшення опору судин (гіподинамічний тип). Висновки. Отримані результати підтвердили ключову роль ЦХС у реалізації реакції на ЧМТ та обґрунтували можливий напрямок подальших досліджень — застосування холіноміметиків центральної дії для корекції неврологічних порушень. Обмеженням активації ЦХС може бути перенавантаження міокарда з формуванням посттравматичної міокардіодистрофії.
Актуальность. Наибольшее значение в формировании ответа на черепно-мозговую травму (ЧМТ) имеет первичная реакция медиаторных систем центральной нервной системы в острый период, когда формируются основные патогенетические сдвиги. Цель исследования: определение влияния холинореактивности (активации или блокады центральных холинергических систем; ЦХС) на летальность, неврологический дефицит и состояние центральной гемодинамики в остром периоде ЧМТ. Материалы и методы. Травму моделировали при свободном падении груза на фиксированную голову животного. Для активации ЦХС крысам до травмы вводили холина альфосцерат (глиатилин; 6 мг/кг), для блокировки — биперидена гидрохлорид (акинетон; 0,6 мг/кг). Неврологический дефицит оценивали по 100-балльной шкале Тодда. Параметры центральной гемодинамики определяли методом тетраполярной импедансной грудной реографии. Результаты. Активация ЦХС в остром периоде ЧМТ приводила к уменьшению летальности и неврологического дефицита. Отмечено существенное увеличение сердечного выброса и снижение сопротивления сосудов (гипердинамический тип). Блокада ЦХС сопровождалось значительным неврологическим дефицитом, снижением сердечного выброса и артериального давления на фоне увеличения сопротивления сосудов (гиподинамический тип). Выводы. Результаты подтвердили ключевую роль ЦХС в реализации реакции на ЧМТ и обосновали возможное направление дальнейших исследований — применение холиномиметиков центрального типа действия для купирования неврологических нарушений. Ограничением активации ЦХС может быть перегрузка миокарда с формированием посттравматической миокардиодистрофии.
Background. The primary reaction of the central nervous mediator systems in the acute period of traumatic brain injury (TBI) when the main pathogenetic shifts are formed has greatest importance. The aim of the study was to determine the effect of cholinoreactivity (activation or blockade of the central cholinergic systems; CChS) on mortality, neurological deficit, and the state of central hemodynamics in the acute period of TBI. Material and methods. The trauma was simulated with the free fall of the load onto the fixed head. To activate the CChS, choline alfoscerate (gliatilin; 6 mg/kg) was administered to rats before injury, and biperiden hydrochloride (akinetone; 0.6 mg/kg) was used for blocking. Neurological deficits were assessed using the 100-point Todd scale. Central hemodynamic parameters were determined by tetrapolar impedance chest rheography. Results. The activation of the CChS in the acute period of TBI led to a decrease in mortality and neurological deficits. There was a significant increase in cardiac output and a decrease in vascular resistance (hyperdynamic type). The CChS blockade was accompanied by a significant neurological deficit, a decrease in cardiac output and blood pressure against an increase in vascular resistance (hypodynamic type). Conclusions. The results confirmed the key role of CChS in the realization of the response to TBI and substantiated a possible direction for further research — the use of central cholinomimetics for the relief of neurological disorders. The limitation of CChS activation may be myocardial overload with the formation of post-traumatic myocardial dystrophy.
черепно-мозкова травма; центральна гемодинаміка; холінореактивність
черепно-мозговая травма; центральная гемодинамика; холинореактивность
traumatic brain injury; central hemodynamics; cholinoreactivity
Вступ
Матеріали та методи
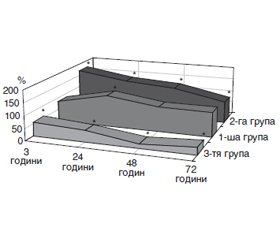
Результати та обговорення
/119.jpg)
Висновки
- Педаченко Е.Г., Семисалов С.Я., Ельский В.Н., Кардаш А.М. Клиническая эпидемиология черепно-мозговой травмы. Донецк: Апекс, 2002. 156.
- Льовкін О.А., Голдовський Б.М., Серіков К.В. Аналіз надання спеціалізованими бригадами екстреної (швидкої) медичної допомоги постраждалим з тяжкою черепно-мозковою травмою. Медицина невідкладних станів. 2014. 7. 118-120.
- Гук А.П. Закономірності смертності від травм голови та черепно-мозкових травм в Україні. Україна. Здоров’я нації. 2010. 3. 48-53.
- Гук А.П. Клініко-епідеміологічні характеристики черепно-мозкової травми в Україні за 1999–2008 роки. Україна. Здоров’я нації. 2011. 2. 52-56.
- Abou-El-Hassan H., Dia B., Choucair K., Eid S.A., Najdi F., Baki L., Talih F., Eid A.A., Kobeissy F. Traumatic brain injury, diabetic neuropathy and altered-psychiatric health: The fateful triangle. Med. Hypotheses. 2017 Oct. 108. 69-80.
- Єльський В.Н., Кардаш А.М., Гордник Г.А. Патофизиология, диагностика и интенсивная терапия тяжелой черепно-мозговой травмы. Под ред. проф. В.И. Черния. Донецк: Новый мир, 2004.
- Зябліцев С.В., Єльський В.М. Синдроми травматичної хвороби при черпно-мозковій травмі. Kраматорськ: Каштан, 2020.
- Laurer H.L., McIntosh T.K. Pharmacologic therapy in traumatic brain injury: update on experimental treatment strategies. Curr. Pharm. Des. 2001 Oct. 7(15). 1505-16.
- Nokkari A., Abou-El-Hassan H., Mechref Y., Mondello S., Kindy M.S., Jaffa A.A., Kobeissy F. Implication of the kallikrein-kinin system in neurological disorders: quest for potential biomarkers and mechanisms. Prog. Neurobiol. 2018 Jun-Aug. 165-167. 26-50.
- Bortolotti P., Faure E., Kipnis E. Inflammasomes in tissue damages and immune disorders after trauma. Front. Immunol. 2018 Aug 16. 9. 1900.
- Zhao J., Hylin M.J., Kobori N., Hood K.N., Moore A.N., Pramod K., Dash P.K. Post-injury administration of galantamine reduces traumatic brain injury pathology and improves outcome. J. Neurotrauma. 2018 Jan 15. 35(2). 362-374.
- Belluardo N., Mudo G., Blum M., Amato G., Fuxe K. Neurotrophic effects of central nicotinic receptor activation. J. Neural. Transm. 2000. Suppl. 227-245.
- Mudo G., Belluardo N., Fuxe K. Nicotinic receptor agonists as neuroprotective/neurotrophic drugs. Progress in molecular mechanisms. J. Neural. Transm. (Vienna). 2007 Jan. 114(1). 135-47.
- Kalappa B.I., Sun F., Johnson S.R., Jin K., Uteshev V.V. A positive allosteric modulator of α7 nAChRs augments neuroprotective effects of endogenous nicotinic agonists in cerebral ischaemia. Br. J. Pharmacol. 2013 Aug. 169(8). 1862-78.
- Gorman L.K., Fu K., Hovda D.A., Murray M., Traystman R.J. Effects of traumatic brain injury on the cholinergic system in the rat. J. Neurotrauma. 1996 Aug. 13(8). 457-63.
- Shin S.S., Dixon C.E. Alterations in cholinergic pathways and therapeutic strategies targeting cholinergic system after traumatic brain injury. J. Neurotrauma. 2015 Oct 1. 32(19). 1429-40.
- Dixon C.E., Ma X., Marion D.W. Effects of CDP-choline treatment on neurobehavioral deficits after TBI and on hippocampal and neocortical acetylcholine release. J. Neurotrauma. 1997 Mar. 14(3). 161-9.
- Jonnala R.R., Buccafusco J.J. Relationship between the increased cell surface alpha7 nicotinic receptor expression and neuroprotection induced by several nicotinic receptor agonists. J. Neurosci Res. 2001 Nov 15. 66(4). 565-72.
- Yu T.S., Kim A., Kernie S.G. Donepezil rescues spatial learning and memory deficits following traumatic brain injury independent of its effects on neurogenesis. PLoS One. 2015 Feb 25. 10(2). e0118793.
- Shaw K.E., Bondi C.O., Light S.H., Massimino L.A., McAloon R.L., Monaco C.M., Kline A.E. Donepezil is ineffective in promoting motor and cognitive benefits after controlled cortical impact injury in male rats. J. Neurotrauma. 2013 Apr 1. 30(7). 557-64.
- Ельский В.Н., Зяблицев С.В. Моделирование черепно-мозговой травмы. Донецк: Новый мир, 2008.
- Gotshall Robert W., Breay-Pilcher Julie C., Boelcskevy Bence D. Cardiac output in adult and neonatal rats utilizing impedance cardiography. Amer. J. Physiol. 1987. 253. 5. Pt2. H1298-H1304.
- Карпинский В.В., Словеснов С.В., Рерих Р.А. Определение сердечного выброса у мелких лабораторных животных методом тетраполярной реографии. Пат. физиол. и эксперим. терапия. 1986. 1. 74-7.
- Ельский В.Н., Зяблицев С.В. Нейрогормональные регуляторные механизмы при черепно-мозговой травме: Донецк: Новый мир, 2008.

/118.jpg)