Журнал «Медицина неотложных состояний» Том 16, №6, 2020
Вернуться к номеру
Операционный стресс-ответ в малоинвазивной хирургии
Авторы: Мынка Н.В.
КУ «Днепропетровская областная клиническая офтальмологическая больница», г. Днепр, Украина
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті наведений опис дослідження, спрямованого на визначення маркерів операційної стрес-відповіді й динаміки післяопераційного больового синдрому в пацієнтів офтальмохірургічного профілю, які перенесли трансплантацію рогівки. Проаналізовані дані пацієнтів, які оперувалися на базі КЗ «Дніпропетровська обласна клінічна офтальмологічна лікарня» з 2017 по 2019 р. У процесі дослідження в пацієнтів визначалися основні параметри гемодинаміки й газообміну, вираженість операційної стрес-відповіді шляхом аналізу динаміки рівнів лейкоцитів, глюкози крові і С-реактивного білка, а також вираженість больового синдрому в післяопераційному періоді. Забір крові здійснювався на 4 етапах дослідження. У результаті було встановлено статистично значуще підвищення концентрації глюкози крові і лейкоцитів у пацієнтів після операції порівняно з доопераційним рівнем. Також було встановлено, що післяопераційне знеболювання не може вважатися адекватним більш ніж у 70 % пацієнтів. Отримані дані свідчать про розвиток у пацієнтів офтальмохірургічного профілю операційного стресу і роблять проблему пошуку альтернативних стрес-лімітуючих схем анестезіологічного забезпечення в офтальмохірургії актуальною і вимагаючою подальшого дослідження.
В статье представлено описание исследования, направленного на определение маркеров операционного стресс-ответа и динамики послеоперационного болевого синдрома у пациентов офтальмохирургического профиля, перенесших трансплантацию роговицы. Проанализированы данные пациентов, оперированных на базе КУ «Днепропетровская областная клиническая офтальмологическая больница» с 2017 по 2019 г. В процессе исследования у пациентов определялись основные параметры гемодинамики и газообмена, выраженность операционного стресс-ответа путем анализа динамики уровней лейкоцитов, глюкозы крови и С-реактивного белка, а также выраженность болевого синдрома в послеоперационном периоде. Забор крови осуществлялся на 4 этапах исследования. В результате было установлено статистически значимое повышение концентрации глюкозы крови и лейкоцитов у пациентов после операции в сравнении с дооперационным уровнем. Также было установлено, что послеоперационное обезболивание не может считаться адекватным более чем у 70 % пациентов. Полученные данные свидетельствуют о развитии у пациентов офтальмохирургического профиля операционного стресса и делают проблему поиска альтернативных стресс-лимитирующих схем анестезиологического обеспечения в офтальмохирургии актуальной и требующей дальнейшего исследования.
The article describes a study aimed at markers that identify the surgically induced stress response and the dynamics of postoperative pain in ophthalmic patients after corneal transplantation. We analyzed the data of patients operated on the basis of Dnipropetrovsk Regional Clinical Ophthalmologic Hospital from 2017 to 2019. During the research, we determined such main parameters in patients as the main parameters of hemodynamics and gas exchange, the severity of the surgically induced stress response by analyzing the dynamics of the levels of leukocytes, blood glucose, and C-reactive protein, as well as the severity of postoperative pain. Blood sampling was carried out at four stages of the study. As a result, a statistically significant postoperative increase in the concentration of blood glucose and leukocytes was established compared to the preoperative level. It was also found that postoperative analgesia cannot be considered sufficient in more than 70 % of patients. The data obtained demonstrated the development of surgically induced stress response in ophthalmic patients and make a search for stress-limiting schemes for anesthetic management relevant and requires further research.
операційна стрес-відповідь; післяопераційний біль; офтальмохірургія
операционный стресс-ответ; послеоперационная боль; офтальмохирургия
surgically induced stress response; postoperative pain; ophthalmic surgery
Введение
Материалы и методы
Результаты и обсуждение
/124.jpg)
Выводы
- Correll D.J., Vlassakov K.V., Kissin I. No evidence of real progress in treatment of acute pain. Journal of pain research. 2014. № 7. P. 199-210.
- Gerbershaden M.U., Hans J. et al. Pain intensity on the first day ater surgery: A Prospective Cohort Study Comparing 179 Surgical Procedures. Anaesthesiology. 2013. Vol. 118. № 4. P. 934-944.
- Баялиева А.Ж., Трифонов В.Р., Ямалиева И.И. Актуальность анестезиологической защиты на стресс-лимитирующие факторы в онкохирургии. Поволжский онкологический вестник. 2016. № 1 (23). С. 50-54.
- Desborough J.P. The stress response to trauma and surgery. British Journal of Anaesthesia. 2000. № 85 (1). P. 109-117.
- Кобеляцкий Ю.Ю. Новые подходы к регуляции операционного стресс-ответа. Здоров’я України. Тематичний номер «Хірургія. Ортопедія. Травматологія». 2017. № 2 (28). С. 5.
- Овечкин А.М. Хирургический стресс-ответ, его патофизиологическая значимость и способы модуляции. Регионарная анестезия и лечение острой боли. 2008. Т. 2. № 2. С. 49-62.
- Schricker T., Lattermann R. Strategies to attenuate the cata-bolic response to surgery and improve perioperative outcomes. Canadian Journal of Anesthesia. 2007. № 54 (6). P. 414-419.
- Айварджі О.О., Кобеляцький Ю.Ю. Шляхи підвищення ефективності контролю стресової та гемодинамічної відповіді при септопластиці. Вісник проблем біології і медицини. 2018. № 2 (144). С. 127-131.

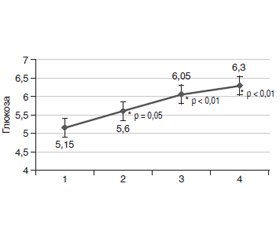
/123.jpg)
/124_2.jpg)
/125.jpg)