Международный эндокринологический журнал Том 16, №7, 2020
Вернуться к номеру
Можливості патогенетичного лікування діабетичної гастропатії в пацієнтів із цукровим діабетом 2-го типу
Авторы: Дорофєєв А.Е.(1), Чичула Ю.В.(1), Дядик О.О.(1), Даниленко А.Л.(2), Аветисян І.Л.(2)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — Київський міський клінічний ендокринологічний центр, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
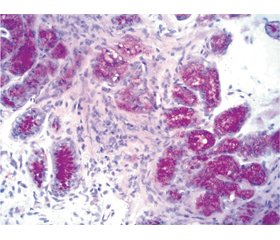
Мета дослідження: вивчити ефективність застосування Берлітіону в комплексній терапії діабетичного гастропарезу (ДГ) у хворих на цукровий діабет 2-го типу (ЦД2) і його вплив на моторно-евакуаторну функцію шлунка (МЕФШ) і стан слизового бар’єра в таких хворих. Матеріали та методи. Під спостереженням перебували 172 хворі на ЦД2 віком від 40 до 75 років. Тривалість захворювання на ЦД2 в обстежуваних пацієнтів становила 13,7 ± 9,2 року. Критерієм включення в дослідження були наявність у пацієнтів із ЦД2 клінічних симптомів діабетичного гастропарезу. Усім пацієнтам до та через 8 тижнів від початку лікування застосовували загальноклінічні, лабораторні й інструментальні методи дослідження, у тому числі відеоезофагогастродуоденоскопію з біопсією з антрального відділу шлунка, тіла й кута шлунка. Хворі були розподілені на дві групи: 48 осіб у першій (група контролю) і 46 — у другій групі. Хворі обох груп отримували комплексну гіпоглікемізуючу терапію на основі метформіну. Пацієнтам другої групи додатково призначали Берлітіон® 600 ОД довенно протягом двох тижнів і Берлітіон® 600 капсули протягом шести тижнів. Результати. У пацієнтів із ЦД2 порушення МЕФШ були виявлені у 94 (54,9 %) осіб. За результатами 13С-октаноєвого дихального тесту (13С-ОДТ) у 42 хворих (44,6 %) отримані результати свідчили про нормальну МЕФШ. У частини хворих — 55,4 % (52 особи) було виявлено помірне (42,6 %) й виражене (12,8 %) порушення МЕФШ. Через 8 тижнів пацієнтам повторно було проведено вивчення МЕФШ на основі клініко-анамнестичного й інструментального методів. Так, 71,7 % пацієнтів другої групи відмітили більш суттєве зменшення суб’єктивних проявів порушення моторики порівняно з 31,2 % пацієнтів групи контролю (р < 0,05). За даними 13С-ОДТ, серед хворих з помірним зниженням МЕФШ у 35 % пацієнтів другої групи зареєстровано нормальні показники порівняно з 10 % пацієнтів групи контролю (р < 0,05). У хворих із вираженим зниженням МЕФШ на тлі додавання до комплексного лікування Берлітіону була виявлена лише тенденція до нормалізації МЕФШ (у 33,2 % пацієнтів другої групи дані свідчили про помірне зниження МЕФШ на відміну від групи контролю, у якій динаміки показників тесту виявлено не було). Згідно з даними морфологічного дослідження, у пацієнтів після лікування виявлено зменшення запального клітинного інфільтрату в біоптаті шлунка, особливо в тих хворих, яким була проведена ерадикаційна антихелікобактерна терапія. Інтенсивність забарвлення біоптатів пацієнтів другої групи при проведенні PAS-реакції і мембранна експресія клаудину-1 вірогідно підвищувалась порівняно з групою контролю, що свідчить про нормалізацію процесів слизоутворення, нормалізацію проникності слизового бар’єра шлунка й ущільнення міжклітинних контактів. Висновки. Застосування препарату Берлітіон® 600 ОД і Берлітіон® 600 капсули у комплексній терапії хворих на ЦД2 із діабетичним гастопарезом є доцільним та ефективним. Берлітіон не тільки мінімізує прояви автономної нейропатії у хворих на ЦД2, що покращує моторно-евакуаторну функцію шлунка, а ще й чинить патогенетичний вплив на процеси слизоутворення й стабілізує стан слизового бар’єра шлунка за рахунок покращення щільних клітинних контактів.
Цель исследования: изучить эффективность использования Берлитиона в комплексной терапии диабетического гастропареза у больных сахарным диабетом 2-го типа (СД2) и его влияние на моторно-эвакуаторную функцию желудка (МЭФЖ) и состояние слизистого барьера у таких больных. Материалы и методы. Под наблюдением находилось 172 больных СД2 в возрасте от 40 до 75 лет. Длительность заболевания составила 13,7 ± 9,2 года. Критерием включения в исследование было наличие у больных СД2 клинических симптомов диабетического гастропареза. Всем пациентам до и через 8 недель от начала лечения применяли общеклинические, лабораторные и инструментальные методы исследования, в том числе видеоэзофагогастродуоденоскопию с биопсией из антрального отдела желудка, тела и угла желудка. Больные были рандомизированы на 2 группы: 48 человек в первой (группа контроля) и 46 — во второй. Пациенты обеих групп получали комплексную гипогликемическую терапию на основании метформина. Больным второй группы дополнительно назначали Берлитион® 600 ЕД внутривенно в течение 2 недель и Берлитион® 600 капсулы в течение 6 недель. Результаты. У больных СД2 нарушения МЭФЖ были выявлены у 94 (54,6 %) человек. По результатам 13С-октаноевого дыхательного теста (13С-ОДТ) у 42 больных (44,6 %) была выявлена нормальная моторно-эвакуаторная функция. У части больных — 55,4 % (52 человека) было выявлено умеренное (42,6 %) и выраженное (12,8 %) снижение МЭФЖ. Через 8 недель у пациентов проводили повторное исследование МЭФЖ на основании клинико-анамнестического и инструментального методов. Было выявлено, что у 71,7 % пациентов второй группы было отмечено более существенное уменьшение субъективных проявлений нарушений моторики по сравнению с 31,2 % пациентов группы контроля (р < 0,05). По данным 13С-ОДТ, среди больных с умеренным снижением МЭФЖ у 35 % пациентов второй группы зарегистрированы нормальные показатели по сравнению с 10 % пациентов группы контроля (р < 0,05). У больных с выраженным снижением МЭФЖ на фоне включения в комплексную терапию Берлитиона была отмечена лишь тенденция к нормализации МЭФЖ (у 33,2 % больных второй группы результаты свидетельствовали об умеренном снижении МЭФЖ в отличие от группы контроля, где изменений показателей теста в динамике отмечено не было). Согласно данным морфологического исследования, в биоптате желудка пациентов после лечения отмечено уменьшение воспалительного клеточного инфильтрата, особенно у тех, кому была проведена антихеликобактерная терапия. Интенсивность окрашивания биоптатов пациентов второй группы при проведении PAS-реакции, а также мембранная экспрессия клаудина-1 достоверно увеличивались по сравнению с группой контроля, что свидетельствует о нормализации процессов слизеобразования, проницаемости слизистого барьера желудка и уплотнении межклеточных контактов. Выводы. Использование препарата Берлитион® 600 ЕД и Берлитион® 600 капсулы в комплексной терапии больных СД2 с диабетическим гастропарезом целесообразно и эффективно. Берлитион не только минимизирует проявления автономной нейропатии у больных СД2, что улучшает МЭФЖ, но и оказывает патогенетическое влияние на процессы слизеобразования и стабилизирует состояние слизистого барьера желудка за счет улучшения плотных клеточных контактов.
Background. The purpose of study — to investigate the efficacy of Berlithion application in the comprehensive treatment of diabetic gastroparesis in patients with type 2 diabetes mellitus (DM), its effect on gastric motility and the state of the mucosal barrier in such patients. Materials and methods. Under our supervision, there were 172 patients with type 2 DM, aged from 40 to 75 years. The disease duration was 13.7 ± 9.2 years. The inclusion criterion was the presence of clinical symptoms of diabetic gastroparesis in patients with type 2 DM. Before treatment and 8 weeks after its start, all patients underwent general clinical, laboratory and instrumental examinations, including video esophagogastroduodenoscopy with biopsy. Patients were randomized into 2 groups: 48 people were in the first (controls) and 46 — in the second group. Patients of both groups received comprehensive hypoglycemic therapy based on metformin. Patients of the second group were additionally prescribed Berlithion 600 mg intravenously for 2 weeks and 600 mg in capsules for 6 weeks. Results. In patients with type 2 DM, disturbed gastric motility was detected in 94 (54.6 %) cases. According to the results of 13C-octanoic acid breath test, 42 (44.6 %) patients had normal gastric emptying. In some patients (52 (55.4 %) people), a moderate (42.6 %) and severe (12.8 %) decrease in gastric motility was revealed. After 8 weeks, patients underwent a second study of gastric emptying using clinical, anamnestic and instrumental methods. It was found that 71.7 % of patients in the second group had a more significant decrease in subjective manifestations of dysmotility compared with 31.2 % of patients in the control group (p < 0.05). According to 13C-octanoic acid breath test, in a moderate decrease in gastric motility, 35 % of patients in the second group had normal values compared to 10 % of patients in the control group (p < 0.05). In the subgroup with a severe decrease in gastric motility against the background of Berlithion use as a part of the comprehensive therapy, there was only a tendency to normalization of gastric emptying (in 33.2 % of patients of the second group, the results indicated a moderate decrease in gastric motility in contrast to the control group, which had no changes in the test parameters). According to the morphological study, patients after treatment had a decrease in inflammatory cell infiltrate in the gastric tissue biopsy, especially those who underwent anti-Helicobacter therapy. The intensity of staining of biopsy samples in patients of the second group during the periodic acid Schiff reaction, as well as the membrane expression of claudin 1 significantly increased compared to the control group, which indicates the normalization of mucus formation, normalization of gastric mucosal permeability and compaction of extracellular contacts. Conclusions. Berlithion application in the comprehensive treatment of patients with type 2 diabetes mellitus with diabetic gastroparesis is appropriate and effective. Berlithion not only minimizes the manifestations of autonomic neuropathy in patients with type 2 diabetes mellitus, which improves gastric motility, but also has a pathogenetic effect on mucus processes and stabilizes the state of the gastric mucosal barrier by improving tight cellular contacts.
діабетична автономна нейропатія; діабетичний гастропарез; епітеліальний бар’єр; міжклітинні щільні контакти; клаудин-1; 13С-октаноєвий дихальний тест
диабетическая автономная нейропатия; диабетический гастропарез; эпителиальный барьер; межклеточные плотные контакты; клаудин-1; 13С-октаноевый дыхательный тест
diabetic autonomic neuropathy; diabetic gastroparesis; epithelial barrier; intracellular tight junctions; claudin 1; 13C-octanoic acid breath test
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Абатуров О.Є., Ликова А.Е. Хронічна Helicobacter pylori-асоційована інфекція у дітей, парацелюлярна проникність слизової оболонки шлунка та харчова алергія. Здоров’я дитини. 2019. Т. 14. № 1. С. 44-49.
- Абатуров О.Є., Герасименко О.Є. Модуляція активності TLR4 епітеліоцитів слизової оболонки шлунка при хелікобактерній інфекції. Современная педиатрия. 2009. № 6(28). С. 141-146.
- Абатуров А.Е., Герасименко О.Н., Завгородняя Н.Ю. Хронические CagA(+) Helicobacter pylori-ассоциированные гастриты у детей: научное издание. Харьков: САМ, 2014.
- Ахмадулина Г.И., Курникова И.А., Нуруллина Г.М. Системные нарушения, коморбидная патология и функция желудка у больных сахарным диабетом 2-го типа. Международный научно-исследовательский журнал. 2016. № 5(47). C. 125-131.
- Звягинцева Т.Д., Чернобай А.И. Функциональные заболевания органов пищеварения и их сочетание в свете современных представлений: от патогенеза до лечения. Сучасна гастроентерологія. 2015. № 3(83). C. 61-72.
- Кожевніков О.М. Значення 13С-октаноєвого дихального тесту для виявлення порушень моторно-евакуаторної функції шлунка. Сучасна гастроентерологія. 2006. № 2(28). C. 4-6.
- Коротько Г.Ф. Желудочное пищеварение. Краснодар, 2007. 256 с.
- Лычкова А.Э., Тропская Н.С., Попова Т.С., Смирнов В.М. Механизм активации пищевой моторики желудка и двенадцатиперстной кишки. Рос. ж. гастроэнтерол., гепатол., колопроктол. 2002. Т. 12. № 5. С. 160.
- Лычкова А.Э. Серотониновая регуляция моторной функции тонкой кишки. Экспериментальная и клиническая гастроэнтерология. 2011. № 3. С. 130-135.
- Новиков В.И., Новиков К.Ю. Тиоктовая кислота: точка приложения — диабетическая нейропатия. Эффективная фармакотерапия. Эндокринология. 2014. № 6. С. 46-54.
- Олейникова Н.А., Харлова О.А., Мальков П.Г., Данилова Н.В. Особенности экспрессии клаудинов в новообразованиях толстой кишки. Архив патологии. 2017. № 79. C. 28-35.
- Ткач С.М. Диабетический гастропарез: эпидемиология, механизмы развития, современные подходы к ведению больных. Клінічна ендокринологія та ендокринна хірургія. 2017. № 2(58). C. 9-18.
- Ametov A., Barinov A., O’Brien P. et al. The sensory symptoms of diabetic polyneuropathy are improved with alpha-lipoic acid: the SYDNEY trial. Diabetes Care. 2003. 26. 770-776.
- Anderson J.M., Van Itallie C.M. Physiology and Function of the Tight Junction. Cold Spring Harb. Perspect. Biol. 2009. 1(2). a002584. doi: 10.1101/cshperspect.a002584.
- Balda M.S., Matter K. The tight junction protein ZO-1 and an interacting transcription factor regulate ErbB-2 expression. EMBOJ. 2000. 19(9). 2024-2033.
- Bruno G., Lopetuso L.R., Ianiro G., Laterza L., Gerardi V., Petito V. et al. 13C-octanoic acid breath test to study gastric emptying time. European review for medical and pharmacological sciences. 2013. 17(2). 59-64.
- Bureković A., Terzić M., Alajbegović S. et al. The role of alpha-lipoic acid in diabetic polyneuropathy treatment. Bosn. J. Basic Med. Sci. 2008. 8(4). 341-345.
- Bytzer P., Talley N.J., Leemon M. et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: a population-based survey of 15,000 adults. Arch. Intern. Med. 2001. 161. 1989-1996.
- Camilleri M., Bharucha A.E., Farrugia G. Epidemiology, Mechanisms, and Management of Diabetic Gastroparesis. Clin. Gastroenterol. Hepatol. 2011. 9. 5-12.
- Camilleri M., Parkman H.P., Shafi M.A., Abell T.L., Gerson L.; American College of Gastroenterology. Clinical Guideline: Management of Gastroparesis. Am. J. Gastroenterol. 2013. 108. 18-37.
- Furness J.B. Types of neurons in the enteric nervous system. J. Auton. Nerv. Syst. 2000. 81. 87.
- Furness J.B., Kunze W.A., Clerc N. Nutrient tasting and signaling mechanisms in the gut. II. The intestine as a sensory organ: neural, endocrine, and immune responses. Am. J. Physiol. 1999. 277(5). 922-928.
- Furuse M., Fujita K., Hiiragi T., Fujimoto K., Tsukita K. Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. J. Cell Biol. 1998. 141(7). 1539-50. doi:10.1083/jcb.141.7.1539.
- Furuse M. Molecular Basis of the Core Structure of Tight Junction. Cold Spring Harb. Perspect Biol. 2010. 2(1). a002907. doi: 10.1101/cshperspect. a002907.
- Gregus Z., Stein A. Effects of lipoic acid on biliary excretion of glutatione and metals. Toxicol. Appl. Pharmacol. 1992. 114. 88-96.
- Hauser В., Roelants M., Schepper J. De, Veereman G., Caveliers V., Devreker T., Greef E. De, Vandenplas Y. Gastric emptying of solids in children: reference values for the 13C-octanoic acid breath test. Neurogastroenterology & Motility. 2016. 28(10). 1480-7. doi: 10.1111/nmo.12845.
- Huo Q., Kinugasa T., Wang L., Huang J., Zhao J., Shibaguchi H. et al. Claudin-1 protein is a major factor involved in the tumorigenesis of colorectal cancer. Anticancer Res. 2009. 29(3). 851-857.
- Janssen P., Harris M.S., Jones M. et al. The relation between symptom improvement and gastric emptying in the treatment of diabetic and idiopathic gastroparesis. Am. J. Gastroenterol. 2013. 108. 1382-91. doi: 10.1038/ajg.2013.118.
- Kryvy V., Klyarytska I., Semenichina E., Rabotyagova Y., Ratan G., Tsapyak T. 13C-octanoic acid breath test in diagnosis of gastroesophageal reflux disease in obese patients with type 2 diabetes mellitus. Neurogastroenterology & Motility. 2015. 27. 78.
- Ma Z.F., Majid N.A., Yamaoka Y., Lee Y.Y. Food allergy and Helicobacter pylori infection: a systematic review. Front. Microbiol. 2016. 23. 7. 368. doi: 10.3389/fmicb.2016.00368.
- Ordög T., Ward S.M., Sanders K.M. Interstitial cells of Cajal generate electrical slow waves in the murine stomach. J. Physiol. (Lond.). 1999. 518. 257-269.
- Parkman H.P., Hasler W.L., Barnett J.L., Eaker E.Y., American Motility Society Clinical GI Motility Testing Task Force. Electrogastrography: a document prepared by the gastric section of the American Motility Society Clinical GI Motility Testing Task Force. Neurogastroenterol. Motil. 2003. 15. 89-102.
- Perri F., Bellini M., Portincasa P. 13С-octanoic acid breath test (OBT) with a new test meal (EXPIROGer): Toward standardization for testing gastric emptying of solids. Dig. Liver. Dis. 2010. 42. 549-553.
- Roxas J.L., Viswanathan V.K. Modulation of intestinal paracellular transport by bacterial pathogens. Compr. Physiol. 2018. 8(2). 823-842.
- Sang Q., Williamson S., Young H.M. Projections of chemically identified myenteric neurons of the small and large intestine of the mouse. J. Anat. 1997. 190. 209-222.
- Singh A.B., Sharma A., Dhawan P. Claudin family of proteins and cancer: an overview. J. Oncol. 2010. 2010. 541957. doi:10.1155/2010/541957.
- Soler A.P., Miller R.D., Laughlin K.V., Carp N.Z., Klurfeld D.M., Mullin J.M. Increased tight junctional permeability is associated with the development of colon cancer. Carcinogenesis. 1999. 20(8). 1425-1431.
- Tankova T., Koev D., Dakovska L. Alpha-lipoic acid in the treatment of autonomic diabetic neuropathy (controlled, randomized, open-label study). Rom. J. Intern. Med. 2004. 42(2). 457-464.
- Tesfaye S., Boulton A., Dyck P.J., Freeman R., Horowitz M., Kempler P. et al. Diabetic neuropathies: Update on definition, diagnostic criteria, estimation of severity, and treatments. Diabetes Care. 2010. 33. 2285-2293.
- Tyler J.C., Kathleen E.S., James G.F., Susan J.H. Tight junction disruption: Helicobacter pylori and dysregulation of the gastric mucosal barrier. World J. Gastroenterol. 2015. 21(40). 11411-27. doi: 10.3748/wjg.v21.i40.11411.
- Van Itallie C.M., Anderson J.M. Architecture of tight junctions and principles of molecular composition. Semin. Cell Dev. Biol. 2014. 36. 157-65. doi:10.1016/j.semcdb.2014.08.011.
- Vermette D., Hu P., Canarie M.F., Funaro M., Glover J., Pierce R.W. Tight junction structure, function, and assessment in the critically ill: a systematic review. Intensive Care Med. Exp. 2018. 6(1). 37. doi:10.1186/s 40635-018-0203-4.
- Vilinik A.I., Casellini C., Nevoret M.-L. Alternative quantitative tools in the assessment of diabetic peripheral and autonomic neuropathy. International Review of Neurobiology. 2016. 127. 235-286.
- Ward S.M., Baker S.A., de Faoite A., Sanders K.M. Propagation of slow waves requires IP3 receptors and mitochondrial Ca2+ uptake in canine colonic muscles. J. Physiol. (Lond). 2003. 549. 207-218.
- Ward S.M., Beckett E.A., Wang X. et al. Interstitial cells of Cajal mediate cholinergic neurotransmission from enteric motor neurons. J. Neurosci. 2000. 20. 1393-1403.
- Zeisel M.B., Dhawan P., Baumert T.F. Tight junction proteins in gastrointestinal and liver disease. Gut. 2018 Oct 8. pii: gutjnl-2018-316906. doi: 10.1136/gutjnl-2018-316906.
- Ziegler D., Low P.A., Litchy W.J. et al. Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes Care. 2011. 34(9). 2054-2060.
- Zyegler D., Reljanovic M., Mehnert H. et al. Alfa-Lipoic acid in the treatment of diabetic polyneuropathy in Germany current evidence front clinical trials. Exp. Clin. Endocrinol. Diabetes. 1999. 107. 421-30.

/35.jpg)
/36_2.jpg)
/36.jpg)