Международный эндокринологический журнал Том 16, №7, 2020
Вернуться к номеру
Гормональні та гемодинамічні зміни у міських мешканців середнього віку з ожирінням залежно від рівня артеріального тиску
Авторы: Місюра К.В.(1), Єфіменко Т.І.(1), Дунаєва І.П.(2)
(1) — ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
(2) — Харківський національний медичний університет, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
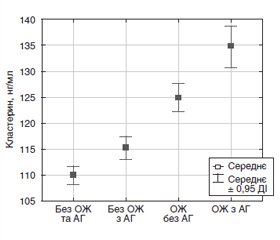
Актуальність. Актуальність дослідження обумовлена значною поширеністю надлишку маси тіла різного ступеня серед населення та високим ризиком розвитку коморбідних патологічних станів, зокрема артеріальної гіпертензії (АГ). Сьогодні невизначеними залишаються питання щодо гормонально-метаболічно-гемодинамічних відмінностей у представників української популяції з ожирінням (ОЖ) і АГ та з ОЖ без АГ. Вирішення цього питання дало б змогу оптимізувати алгоритм профілактичних заходів щодо розвитку АГ серед населення України. Мета: деталізувати особливості гемодинаміки, рідинних секторів тіла, функціонування ренін-альдостеронової системи, секреції лептину, інсуліну в осіб середнього віку з різною масою тіла та артеріальним тиском (АТ) з урахуванням вираженості хронічного неспецифічного запалення. Матеріали та методи. Обстежено 273 мешканці м. Харкова (чоловіки/жінки = 56/217) середнього віку (56,41 ± 6,93 року), які не лікувалися в минулому з приводу ОЖ та АГ. Визначали індекс маси тіла, обвід талії, вимірювали АТ. Методом біоімпедансного аналізу досліджували склад тіла (жирову, відносну жирову, безжирову, активну клітинну масу тіла), імуноферментним методом — рівні інсуліну, лептину, реніну, альдостерону та кластерину у сироватці крові. Результати. Пацієнти з ожирінням незалежно від наявності чи відсутності у них АГ мають вірогідне збільшення абсолютної гідратації організму з одночасним зростанням серцевого викиду та ударного об’єму порівняно як із здоровими особами, так і з пацієнтами без ожиріння з АГ. Ці зміни супроводжуються дійсним зростанням у осіб з ОЖ рівнів реніну та альдостерону у крові. Розвиток ожиріння у пацієнтів з АГ також супроводжується збільшенням у них об’єму циркулюючої крові, загального периферичного опору судин і середнього АТ, вираженості інсулінорезистентності та хронічного неспецифічного запалення, зростанням рівнів інсулін-, лептин-, ренін- та альдостеронемії. Доведено, що рівні циркулюючого реніну й альдостерону у сироватці крові осіб середнього віку прямо пов’язані зі ступенем інсулін-, лептин-, кластеринемії та індексом НОМА. Висновки. Приблизну оцінку рівнів ренінемії та альдостеронемії у міських мешканців України середнього віку при масових обстеженнях можна проводити шляхом вимірювання методом інтегральної реографії тіла з визначенням параметрів ударного індексу та ударного об’єму. Відповідні рівняння регресії щодо їх оцінки визначені в нашому дослідженні.
Актуальность. Актуальность исследования обусловлена значительным распространением избыточной массы тела разной степени выраженности среди населения и высоким риском развития коморбидных патологических состояний, в том числе артериальной гипертензии (АГ). Сегодня не до конца выясненным остается вопрос гормонально-метаболически-гемодинамических отличий у представителей украинской популяции с ожирением (ОЖ) и АГ и с ОЖ без АГ. Решение этого вопроса может помочь оптимизировать алгоритм профилактических мероприятий развития АГ среди населения Украины. Цель: детализировать особенности гемодинамики, водных секторов тела, функционирования ренин-альдостероновой системы, секреции лептина, инсулина у лиц среднего возраста с разной массой тела и артериальным давлением (АД) с учетом выраженности хронического неспецифического воспаления. Материалы и методы. Обследованы 273 жителя г. Харькова (мужчины/женщины = 56/217) среднего возраста (56,41 ± 6,93 года), которые не лечились в прошлом по поводу ОЖ и АГ. Определяли индекс массы тела, охват талии, измеряли АД. Методом биоимпедансного анализа исследовали состав тела (жировую, относительную жировую, безжировую, активную клеточную массу), иммуноферментным методом — уровни инсулина, лептина, ренина, альдостерона и кластерина в сыворотке крови. Рассчитывали индекс инсулинорезистентности НОМА. Результаты. Пациенты с ожирением независимо от наличия или отсутствия у них АГ имеют достоверное увеличение абсолютной гидратации организма с одновременным увеличением сердечного выброса и ударного объема в сравнении как со здоровыми лицами, так и с пациентами без ожирения с АГ. Доказано, что при этих изменениях имеет место достоверное увеличение уровней ренина и альдостерона крови у лиц с ожирением. Развитие ожирения у пациентов с АГ сопровождается увеличением у них объема циркулирующей крови, общего периферического сопротивления сосудов и среднего артериального давления, выраженности инсулинорезистентности и хронического неспецифического воспаления, повышением уровней инсулин-, лептин-, ренин- и альдостеронемии. Уровни циркулирующего ренина и альдостерона в сыворотке крови лиц среднего возраста прямо связаны со степенью инсулин-, лептин-, кластеринемии и индексом НОМА. Выводы. Приблизительную оценку уровней ренинемии и альдостеронемии у городских жителей Украины среднего возраста при массовых исследованиях можно проводить путем измерения интегральной реографии тела с определением параметров ударного индекса и ударного объема. Соответствующие уравнения регрессии касаемо их оценки определены в данном исследовании.
Background. The relevance of the study is due to the significant spread of overweight of varying severity among the population and a significant risk of developing comorbid pathological conditions, including arterial hypertension (AH). Today, the question of hormonal-metabolic-hemodynamic differences in representatives of the Ukrainian population with obesity and AH and with obesity without AH remains unclear. Solving this issue can help optimize the algorithm of preventive measures for the development of hypertension among the Ukrainian population. Aim: to detail the features of hemodynamics, fluid compartments of the body, functioning of the renin-aldosterone system, secretion of leptin, insulin in middle-aged people with different body weights and blood pressure, taking into account the severity of chronic nonspecific inflammation. Materials and methods. We examined 273 middle-aged (56.41 ± 6.93 years) residents of Kharkiv (males/females = 56/217) who had not been treated for obesity and AH. Body mass index was calculated, waist circumference, blood pressure were measured. Body composition (fat, relative fat, lean, active cell mass) was evaluated using bioimpedance analysis; serum levels of insulin, leptin, renin, aldosterone and clusterin — by means of immunoassay. The HOMA was calculated. Results. Obese patients, regardless of the presence or absence of AH, have a probable increase in the absolute hydration of the body with a simultaneous increase in cardiac output and stroke volume compared to both healthy individuals and non-obese patients with AH. These changes are associated with a significant increase in blood renin and aldosterone levels in obese individuals. The development of obesity in patients with AH is accompanied by an increase in their circulating blood volume, total peripheral vascular resistance and mean blood pressure, the severity of insulin resistance and chronic nonspecific inflammation, increased levels of insulin-, leptin-, renin- and aldosteronemia. The levels of circulating renin and aldosterone in the serum of middle-aged persons are probably directly related to the degree of insulin-, leptin-, clusterinemia and the HOMA. Conclusions. An approximate assessment of the levels of reninemia and aldosteronemia in middle-aged urban residents of Ukraine during screening examinations can be carried out by measuring the integral body rheography to determine the parameters of the stroke index and stroke volume. The corresponding regression equations for their estimation are defined in this study.
ожиріння; артеріальна гіпертензія; ренін; альдостерон; лептин; кластерин; інсулінорезистентність; гемодинаміка; рідинні сектори тіла
ожирение; артериальная гипертензия; ренин; альдостерон; лептин; кластерин; инсулинорезистентность; гемодинамика; водные сектора тела
obesity; arterial hypertension; renin; aldosterone; leptin; clusterin; insulin resistance; hemodynamics; body fluid compartments
Вступ
Матеріали та методи
Результати
/45_2.jpg)
Обговорення
Висновки
- Shariq O.A., McKenzie T.J. Obesity-related hypertension: a review of pathophysiology, management, and the role of metabolic surgery. Gland. Surg. 2020. 9(1). 80-93. doi: 10.21037/gs.2019.12.03.
- Jiang S.Z., Lu W., Zong X.F., Ruan H.Y., Liu Y. Obesity and hypertension. Exp. Ther. Med. 2016. 12(4). 2395-2399. doi: 10.3892/etm.2016.3667.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1–7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. doi: 10.5603/AH.a2019.0012.
- Schütten M.T., Houben A.J., de Leeuw P.W., Stehouwer C.D. The Link Between Adipose Tissue Renin-Angiotensin-Aldosterone System Signaling and Obesity-Associated Hypertension. Physiology (Bethesda). 2017. 32(3). 197-209. doi: 10.1152/physiol.00037.2016.
- Cabandugama P.K., Gardner M.J., Sowers J.R. The Renin Angiotensin Aldosterone System in Obesity and Hypertension: Roles in the Cardiorenal Metabolic Syndrome. Med. Clin. North. Am. 2017. 101(1). 129-137. doi: 10.1016/j.mcna.2016.08.009.
- Sokolova L.K., Belchina Yu.B., Pushkarev V.V., Cherviakova S.A., Vatseba T.S., Kovzun O.I. et al. The blood level of endothelin-1 in diabetic patients depending on the characteristics of the disease. Mìžnarodnij endokrinologìčnij žurnal. 2020. 16(3). 204-208. doi: 10.22141/2224-0721.16.3.2020.205267.
- Aronow W.S. Association of obesity with hypertension. Ann. Transl. Med. 2017. 5(17). 350. doi: 10.21037/atm.2017.06.69.
- Poirier P., Giles T.D., Bray G.A. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation. 2006. 113. 898-918. doi: 10.1161/CIRCULATIONAHA.106.171016.
- Lu Н., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotensin II increases adipose angiotensinogen expression. Am. J. Physiol. Endocrinol. Metab. 2007. 292. 1280-7. doi: 10.1152/ajpendo.00277.2006.
- Lastra-Lastra G., Sowerst J.R., Restrepo-Erazo K. et al. Role of aldosterone and angiotensin II in insulin resistance: an update. Clin. Endocrinol. 2009. 71(1). 1-6. doi: 10.1111/j.1365-2265.2008.03498.x.
- Guzik T.J., Hoch N.E., Brown K.A. et al. Role of the T cell in the genesis of angiotensin II — induced hypertension and vascular dysfunction. J. Exp. Med. 2007. 204. 2449-60. doi: 10.1084/jem.20070657.
- Kravchun N.O., Misiura K.V. Peculiarities of changes in body fluid sectors in obesity, found by studying its structure. Mìžnarodnij endokrinologìčnij žurnal. 2017. 13(1). 97-103. [in Ukrainian]. doi: https://doi.org/10.22141/2224-0721.13.1.2017.96761.
- Cancello R., Henegar C., Viguerie N. et al. Reduction of macrophage infiltration and chemoattractant gene expression changes in white adipose tissue of morbidly obese subjects after surgery-induced weight loss. Diabetes. 2005. 54. 2277-86. doi: 10.2337/diabetes.54.8.2277.
- Huber J., Kiefer F.W., Zeyda M. et al. CC chemokine and CC chemokine receptor profiles in visceral and subcutaneous adipose tissue are altered in human obesity. J. Clin. Endocrinol. Metab. 2008. 93(8). 3215-21. doi: 10.1210/jc.2007-2630.
- Weisberg S.P., McCann D., Desai M. et al. Obesity is associated with macrophage accumulation in adipose tissue. J. Clin. Invest. 2003. 112. 1796-1808. doi: 10.1172/JCI19246.
- Сlement K., Viguerie N., Poitou C. et al. Weight loss regulates inflammation-related genes in whitr adipose tissue of obese subjects. FASEB J. 2004. 18. 1657-69. doi: 10.1096/fj.04-2204com.
- Cancello R., Tordjman J., Poitou C. et al. Increased infiltration of macrophages in omental adipose tissue is associated with marked hepatic lesions in morbid human obesity. Diabetes. 2006. 55. 1554-61. doi: 10.2337/db06-0133.
- Nishimura S., Manabe I., Nagasaki M. et al. In vivo imaging in mice reveals local cell dynamics and inflammation in obese adipose tissue. J. Clin. Invest. 2008. 118. 710-21. doi: 10.1172/JCI33328.
- Cancello R., Clement K. Is obesity an inflammatory illness? Role of low-grade inflammation and macrophage infiltration in human white adipose tissue. BJOG. 2006. 113. 1141-7. doi: 10.1111/j.1471-0528.2006.01004.x.
- Sell H., Dietze-Schroeder D., Eckel J. The adipocyte-myocyte axis in insulin resistance. Trends Endocrinol. Metab. 2006. 17. 416-22. doi: 10.1016/j.tem.2006.10.010.
- Bell B.B., Rahmouni K. Leptin as a Mediator of Obesity-Induced Hypertension. Curr. Obes. Rep. 2016. 5(4). 397-404. doi: 10.1007/s13679-016-0231-x.
- Lim K., Jackson K.L., Sata Y., Head G.A. Factors Responsible for Obesity-Related Hypertension. Curr. Hypertens. Rep. 2017. 19(7). 53. doi: 10.1007/s11906-017-0750-1.
- Savji N., Meijers W.C., Bartz T.M. et al. The Association of Obesity and Cardiometabolic Traits with Incident HFpEF and HFrEF. JACC Heart Fail. 2018. 6(8). 701-9. doi: 10.1016/j.jchf.2018.05.018.
- Morimoto A., Kadoya M., Kakutani-Hatayama M. et al. Subclinical decrease in cardiac autonomic and diastolic function in patients with metabolic disorders: HSCAA study. Metabol. Open. 2020. 5. 100025. doi: 10.1016/j.metop.2020.100025.
- Ye S., Zhu C., Wei C. et al. Associations of Body Composition with Blood Pressure and Hypertension. Obesity (Silver Spring). 2018. 26(10). 1644-50. doi: 10.1002/oby.22291.
- Omura-Ohata Y., Son C., Makino H. et al. Efficacy of visceral fat estimation by dual bioelectrical impedance analysis in detecting cardiovascular risk factors in patients with type 2 diabetes. Cardiovasc Diabetol. 2019. 18(1). 137. doi: 10.1186/s12933-019-0941-y.
- Taing K.Y., Farkouh M.E., Moineddin R., Tu J.V., Jha P. Comparative associations between anthropometric and bioelectric impedance analysis derived adiposity measures with blood pressure and hypertension in India: a cross-sectional analysis. BMC Obes. 2017. 4. 37. doi: 10.1186/s40608-017-0173-1.
- Vaziri Y., Bulduk S., Shadman Z. et al. Lean Body Mass as a Predictive Value of Hypertension in Young Adults, in Ankara, Turkey. Iran J. Public. Health. 2015. 44(12). 1643-54.
- Jia A., Xu S., Ming J. et al. Body fat percentage cutoffs for risk of cardiometabolic abnormalities in the Chinese adult population: a nationwide study. Eur. J. Clin. Nutr. 2018. 72(5). 728-35. doi: 10.1038/s41430-018-0107-0.

/43.jpg)
/44.jpg)
/45.jpg)
/46.jpg)