В попередніх оглядах ми вивчали основні патогенетичні шляхи приєднання та/або прогресування діабетичної кардіоміопатії (КМП), класифікацію, інструментальні методи діагностики діабетичної КМП, діагностичні біомаркери діабетичної КМП (Міжнародний ендокринологічний журнал. 2020. № 4, 6, 7).
В даному огляді проведений аналіз літературних джерел, присвячених деяким ключовим аспектам сучасного стану проблеми лікування діабетичної кардіоміопатії.
Очевидно, що на першому плані лікування діабетичної КМП повинні бути заходи, спрямовані на зменшення інсулінової резистентності (ІР), корекцію гіперглікемії, дисліпопротеїнемій (ДЛП), порушень метаболізму міокарда, попередження та лікування тромбоутворення; симптоматичну терапію супутніх захворювань і синдромів (артеріальної гіпертензії (АГ), ішемічної хвороби серця (ІХС), серцевої недостатності (СН) та аритмій). В цьому напрямку необхідно проводити такі профілактично-лікувальні заходи: раціональне харчування та фізична активність, корекція ожиріння, обмеження вживання солі до 2–4 г/добу, виключення паління, вживання алкоголю, продуктів, що містять кофеїн [1–4].
Раціональне харчування та фізична активність
До дієтичних принципів належить отримання необхідної кількості енергії в поєднанні з фізіологічним раціоном харчування. Традиційна середземноморська дієта (Греція та Південна Італія) пов’язана з довголіттям і/або низькою смертністю внаслідок ускладнень серцево-судинних захворювань (ССЗ), зменшенням захворюваності на цукровий діабет (ЦД) 2-го типу, низькою частотою широкого спектра хронічних захворювань, у тому числі ревматоїдного артриту, хвороби Паркінсона та ін. Ця дієта сприяє зниженню артеріального тиску (АТ), позитивним змінам ліпідного спектра крові; має багато спільного з дієтичним підходом до лікування АГ (DASH-дієта — Dietary Approaches to Stop Hypertension) та оптимальним макрохарчуванням для профілактики захворювань серця (OmniHeart-дієта — збільшення вмісту ненасичених жирів і білка в раціоні), що сприяє зниженню АТ, вмісту холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), а також тригліцеридів [5].
Дієтичні поживні речовини є популярною темою для сучасної клінічної медицини. Зокрема, фолієва кислота, вітамін D та ω-3 поліненасичені жирні кислоти (ПНЖК) рекомендуються вагітним жінкам, немовлятам, дітям і людям літнього віку [6]. Однак значення Mg2+ обговорюється менш широко. Цікаво, що багато дорослих у розвинених країнах не вживають рекомендовану щоденну кількість продуктів, багатих Mg2+, таких як цільні зерна, горіхи та зелені листові овочі, а Mg2+ рідше згадується в дієтичних рекомендаціях та дослідженнях щодо запобігання ЦД 2-го типу й інсульту [7].
Водночас низький рівень Mg2+ пов’язаний з багатьма хронічними та запальними захворюваннями, такими як хвороба Альцгеймера, бронхіальна астма, ІР, ЦД 2-го типу, гіпертонічна хвороба (ГХ), ССЗ, остеопороз тощо [4].
Магній є кофактором ферментних систем, що регулюють різноманітні біохімічні реакції, включаючи синтез білка, нервово-м’язову провідність, контроль передачі сигналу у крові та контроль артеріального тиску. Магній також відіграє певну роль у транспортуванні іонів Ca2+ та K+ через клітинну мембрану та є вирішальним для структурної функції білків, нуклеїнових кислот, мітохондрій [8]. Повідомляється, що Mg2+ при ЦД залучений до процесів метаболізму глюкози й інсуліну, регулюючи активність тирозинкінази рецептора інсуліну. Магній також впливає на активність кінази фосфорилази b, вивільняючи глюкозо-1-фосфат з глікогену, та регулює транслокацію глюкози у клітину [9].
Рекомендована дієтична доза Mg2+ становить 350 мг/добу для дорослого чоловіка та 300 мг/добу для дорослої жінки, при цьому додаткові 150 мг/добу необхідно вживати під час вагітності та лактації. Однак, незважаючи на ці чітко встановлені рекомендації, дефіцит Mg2+ залишається глобальною проблемою охорони здоров’я. Зокрема, обстеження особливостей дієтичного харчування, проведене в Європі та США, показало, що щоденне споживання магнію зазвичай нижче за рекомендовану кількість [10]. Більше того, основною причиною дефіциту Mg2+ можна вважати нераціонально збалансоване харчування та/або порушення всмоктування в кишечнику [11].
Американська діабетична асоціація [12] рекомендує збільшити споживання горіхів, ягід, йогурту, кави та чаю особам, які мають високий ризик цукрового діабету. На основі минулих і сучасних даних про харчування та профілактику ЦД 2-го типу програмою профілактики ЦД у США (US Diabetes Prevention Program) проведено дослідження і продемонстровано, що раціональна модифікація способу життя (фізичні вправи та середземноморська дієта) суттєво знижує ризик розвитку ЦД 2-го типу [13]. Крім того, Національна служба охорони здоров’я Великобританії (The UK National Health Service) розпочала програму втручання, що включає контроль маси тіла, раціональне харчування, моніторинг, орієнтовану на 10 000 осіб, схильних до розвитку ЦД 2-го типу [14].
На сьогодні опрацьовано декілька програм, орієнтованих на профілактику ССЗ при ЦД, що зумовлюють включення в дієту та лікування хворих на ЦД низки фармакологічних агентів, біологічно активних речовин, вітамінів, мікроелементів.
Програма-мінімум. Зранку натщесерце необхідно вжити 130 мг гамма-ліноленової кислоти (γ-ЛЛК) у поєднанні з 100 мг альфа-ліпоєвої кислоти (α-ЛК) у співвідношенні 1,3 : 1,0. Протягом дня — 130 мг γ-ЛЛК у поєднанні з 500 мг вітаміну С і 500 мг N-ацетилцистеїну (натщесерце); 1500 мг таурину (під час сніданку); мультивітамінні препарати з мінералами та мікроелементами в поєднанні з 100 мг α-ЛК (після кожного прийому їжі); пентоксифілін 400 мг 1–2 рази на добу, поступово знижуючи дозу; 400 МО вітаміну Е (бажано у вигляді змішаних токоферолів) на добу.
Програма-максимум. Перед сніданком: 130 мг γ-ЛЛК у поєднанні з 500 мг вітаміну С, 1000 мг ацетил-L-карнітину і 500 мг N-ацетилцистеїну; 60 мг коензиму Q10; 1500 мг інозитолу в поєднанні з 1500 мг таурину, 100 мг α-ЛК, мультивітамінними препаратами з мікроелементами; перед обідом: 130 мг γ-ЛЛК у поєднанні з 100 мг α-ЛК; 5 мг біотину в поєднанні з 400 МО вітаміну Е, 100 мг α-ЛК, мультивітамінними препаратами з мікроелементами; під час вечері: оротат (або аспартат) магнію (в еквіваленті 100 мг чистого магнію) в поєднанні з 100 мг α-ЛК, мультивітамінними препаратами з мікроелементами; пентоксифілін (400 мг один раз на добу або 400 мг тричі на добу — залежно від показань) [15]. Відомо, що дотримання стандартних рекомендацій щодо стилю життя (фізичне навантаження, зменшення маси тіла тощо) сприяють покращенню чутливості до інсуліну. Малорухомий спосіб життя (< 1000 ккал/тиждень) супроводжується ризиком смерті, що втричі перевищує аналогічні показники при активному способі життя. Дозоване фізичне навантаження зменшує гіперінсулінемію та сприяє тенденції до нормалізації ліпідного обміну, що поєднується зі зменшенням індексу маси тіла [15, 16].
Оптимізація контролю глікемії
Досягнення стану компенсації ЦД 2-го типу визнається первинною метою в попередженні приєднання та/або прогресування серцево-судинних захворювань [17]. Інсулінова резистентність є характерною особливістю в більшості випадків ЦД 2-го типу, відіграє провідну роль у патогенезі серцево-судинних захворювань. Очевидно, що фармакологічні агенти, що використовуються в лікуванні діабетичної КМП, повинні мати позитивні ефекти щодо корекції функціонально-структурних порушень серцево-судинної системи. Теоретично найбільш привабливими в цьому плані виглядають фармакологічні агенти, що покращують чутливість тканин до інсуліну (метформін, тіазолідиндіони (ТЗД)). Метформін позитивно впливає на метаболізм глюкози у хворих з відсутністю СН, пацієнтів з ІР; концентрацію Сa2+ в кардіоміоцитах. Однак використання бігуанідів у хворих із СН обмежене внаслідок можливості розвитку молочнокислого ацидозу. Крім того, повідомляється, що метформін, на відміну від ТЗД, не виявляє жодного позитивного ефекту щодо оптимізації метаболізму глюкози в міокарді [18, 19]. Тіазолідиндіони стимулюють чинник транскрипції ядерних рецепторів активаторів проліферації пероксисом типу гамма (PPAR-γ), що покращують чутливість до інсуліну і зменшують рівень циркулюючих вільних жирних кислот (ВЖК). Ймовірно, що ТЗД, незважаючи на відсутність рецепторів PPAR-γ в міокарді, шляхом зменшення вмісту ВЖК покращують функціональний стан міокарда. В експериментальних моделях ІР-кардіоміопатії показано, що ТЗД поліпшують метаболізм глюкози в міокарді, попереджують розвиток систолічної дисфункції лівого шлуночка. Однак використання ТЗД у лікуванні хворих із СН обмежене у зв’язку з можливістю затримки рідини/розвитку набряків. Крім того, є повідомлення про можливість взаємозв’язку між призначенням ТЗД і розвитком інфаркта міокарда (ІМ), фатальних аритмій і вираженої серцевої недостатності [4].
Інсулін і/або секретагоги інсуліну
Інсулін і/або секретагоги інсуліну є потенційними фармакологічними агентами в лікуванні функціонально-структурних порушень захворювань серцево-судинної системи у хворих на ЦД. Теоретично їх використання може поліпшувати метаболізм глюкози в міокарді, зменшувати вміст вільних жирних кислот. Однак встановлено, що призначення цих лікарських засобів не сприяє попередженню інсулінорезистентної кардіоміопатії в експерименті [19]. Пригнічення експресії ядерних рецепторів активаторів проліферації пероксисом типу альфа (PPAR-α), що стимулюють метаболізм глюкози і гальмують обмін ВЖК, попереджує розвиток уражень міокарда в експерименті, а посилення викликає приєднання та/або прогресування функціонально-структурних порушень серця. Зменшення вмісту жирів у харчуванні тварин з посиленою експресією PPAR-α супроводжується попередженням розвитку ССЗ, що є ще одним підтвердженням патофізіологічного значення активації метаболізму вільних жирних кислот. Аналогічно, використання препаратів-сенситайзерів агоністів PPAR-γ сприяє активації метаболізму глюкози, пригніченню обміну ВЖК, попередженню приєднання серцево-судинних захворювань. Призначення дихлорацетату (активатора окиснення глюкози) або етомоксіру (пригнічує активність ключового ферменту метаболізму ВЖК, покращує чутливість до інсуліну) попереджує розвиток діабетичного серця [20].
Цукрознижувальні лікарські препарати — аналоги глюкагоноподібного пептиду-1 (ГПП-1) [21] і інгібітори натрій-глюкозного котранспортера-2 (інгібітори НГК-2) [22], що раніше мали обмеження в застосуванні у пацієнтів з хронічною СН (ХСН), на сьогодні продемонстрували не тільки кращий контроль рівня цукру крові, але й зниження серцево-судинних ускладнень і смертності у пацієнтів із ЦД 2-го типу [23].
Аналоги глюкагоноподібного пептиду-1
Глюкагоноподібний пептид-1 є одним із двох провідних інкретинів в організмі — гормонів, що стимулюють постпрандіальну секрецію та покращують чутливість до інсуліну. В експерименті встановлено, що використання ГПП-1 сприяє покращенню функціонального стану лівого шлуночка (ЛШ), гемодинамічних параметрів [24]. Оскільки під впливом дипептидилпептидази IV (ДПП-IV) ГПП-1 швидко руйнується (період напівжиття становить лише 1–2 хв), на сьогодні як лікарські препарати використовують аналоги ГПП-1. Експресія рецепторів ГПП-1 відбувається також і в кардіоміоцитах, що дає можливість впливати на роботу міокарда при використанні аналогів ГПП-1. Їх дія в міокарді здійснюється шляхом синтезу в кардіоміоцитах циклічного аденозинмонофосфату або частково за рахунок зміни рівня глюкози та інсуліну у крові [23]. Показано, що застосування аналогів ГПП-1 має перевагу порівняно з плацебо щодо кардіопротекції [24]. Однак ефективність ексенатиду і антагоністів ДПП-IV у призупиненні/профілактиці розвитку ССЗ при ЦД 2-го типу на сьогодні не з’ясована [24].
Інгібітори натрій-глюкозного котранспортера-2
На сьогодні існує кілька гіпотез, що здатні пояснити кардіопротекторні властивості інгібіторів НГК-2: 1) зменшення загального об’єму плазми (збільшення гематокриту на 5 % асоційоване з 35% зниженням відносного ризику госпіталізацій через ХСН); 2) відновлення клітинного енергетичного гомеостазу за рахунок активації аденозинмонофосфат-активованої протеїнкінази; 3) розвиток легкого ступеня кетозу, що може поліпшувати метаболізм міокарда і ниркову функцію, враховуючи, що окиснення кетонових тіл дає більше АТФ на одну спожиту молекулу кисню, ніж окиснення пальмітату; 4) виведення глюкози з сечею забезпечує зниження спожитих калорій, що корелює з втратою маси тіла [25].
Корекція метаболічних порушень у міокарді
Інсулінова резистентність впливає на функцію міокарда шляхом зниження транспорту глюкози і окиснення вуглеводів, посилення використання ВЖК, пригнічення транспорту Ca2+ в сарколемі, порушення структури і функції регуляторних скоротливих білків міофібрил. Зменшення утворення міокардом енергії при ЦД призводить до пригнічення окиснення глюкози і переважного окиснення ВЖК у міокарді та посмугованих м’язах, що підвищує чутливість міокарда до ішемії, призводить до значних порушень гомеостазу Ca2+, погіршення функції систолічної та діастолічної функцій міокарда. Наявність ІХС у хворих на ЦД значно погіршує перебіг захворювання і збільшує в декілька разів серцево-судинну смертність. Важливим є те, що дисфункція міокарда передує формуванню хронічної гіперглікемії. Отже, порушення метаболізму клітин, а не системна гіперглікемія є відповідальним за розвиток дисфункції міокарда [26].
Корекція метаболічних порушень у міокарді є базисом фармакотерапії, що оптимізує енергетичний обмін міокарда. Система фармакологічного впливу включає використання модуляторів метаболізму, енергозберігаючих засобів, активаторів ендогенної продукції макроергічних сполук і транспорту кисню, інгібіторів метаболічного ацидозу; мембранопротекцію: гальмування перекисного окиснення ліпідів мембран кардіоміоцитів, стабілізацію лізосомальних мембран, нейтралізацію мембранотропної дії гуморальних агентів лізосомальних протеаз та ін. [27].
Препарати, що покращують енергетичний стан клітин (потенційні засоби енергозабезпечення виживання ішемізованого міокарда)
Виснаження внутрішньоклітинних запасів вуглеводів потребує поповнення їх дефіциту шляхом використання засобів активації гліколізу. Засоби, що активують процеси гліколізу (макроергічні фосфати): АТФ, креатинфосфат, інозин, фосфаден, рибоза та ін. Використання АТФ як безпосереднього джерела енергії є проблематичним, оскільки терапевтичний ефект АТФ при ішемії міокарда, ймовірно, пов’язаний не стільки з утилізацією його макроергічного зв’язку, скільки з залученням продуктів катаболізму АТФ в енергетичний обмін кардіоміоцитів [26].
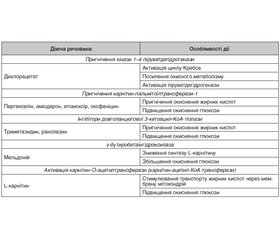
Існує необхідність у нових і ефективних альтернативних терапевтичних методах зниження захворюваності на ХСН у пацієнтів з ЦД 2-го типу. В цьому аспекті перспективним є вивчення змін енергетичних субстратів як потенційної мішені для використання фармакологічних засобів з метою поліпшення метаболізму міокарда [23, 27] (табл. 1).
Модулятори метаболізму
Метаболічні препарати
Метаболічні препарати порівняно з класичними гемодинамічними агентами не мають безпосередніх гемодинамічних, інотропних або хронотропних ефектів, однак захищають міокард від ішемії та сприяють антиангінальному ефекту завдяки збільшенню метаболізму глюкози внаслідок пригнічення β-окиснення вільних жирних кислот. Оптимізація енергетичного метаболізму міокарда базується на збільшенні окиснення глюкози міокардом, що посилює функцію серця і захищає тканини міокарда від ішемічних і реперфузійних уражень. Використання глюкози міокардом при хронічних станах може покращуватись внаслідок впливу на метаболізм ВЖК препаратів, що пригнічують їх окиснення. Триметазидин, пергекселин і ранолазин використовують як антиангінальні засоби, що збільшують ефективність енергії та за рахунок цього виявляють антиангінальний ефект [26].
Триметазидин
Триметазидин зменшує окиснення ВЖК; стимулює використання глюкози; відновлює зв’язок між гліколізом і окисненням вуглеводів, що призводить до утворення АТФ, зменшення споживання О2; переорієнтовує ВЖК в бік фосфоліпідів (завдяки стимуляції обміну фосфоліпідів мембрани при ішемії та реперфузії); збільшує толерантність клітин до ішемічного та реперфузійного пошкодження; посилює окиснення глюкози, активність Na+, К+-АТФази і Са2+-АТФази в саркоплазматичному ретикулумі, що, відповідно, покращує скоротливу функцію і розслаблення діастоли ЛШ; антиішемічні властивості триметазидину не залежать від змін гемодинаміки й асоційовані з вираженим відновленням механічної функції після ішемії, що дозволяє вважати його кардіоцитопротектором. Призначення триметазидину покращує функцію систоли та діастоли ЛШ у хворих на ЦД 2-го типу, ІХС із порушеною функцією лівого шлуночка. Отже, метаболічна терапія може поліпшувати обмін речовин в міокарді, особливо в ділянці гібернованого міокарда; поліпшує метаболізм глюкози; зменшує рівень ендотеліну-1 у хворих на ЦД із ССЗ, що свідчить про його вплив на ендотелій судин; супроводжується суттєвими позитивними змінами показників фракції викиду ЛШ (ФВЛШ) у хворих з СН; якості життя і параметрів функціонального класу NYHA [28].
Роль основних субстратів для покриття енергетичних потреб міокарда в нормі виконують жирні кислоти і глюкоза, а їх використання регулюється їх наявністю або відсутністю та визначається на рівні мітохондрій і на етапі перенесення через мембрану клітини. На сьогодні проводяться дослідження лікарських препаратів, здатних впливати на поглинання субстрату мітохондріями і клітинною мембраною. Так, на тваринах було показано, що триметазидин селективно пригнічує останній в ланцюгу β-окиснення фермент, тим самим впливаючи на енергетичний обмін шляхом часткового пригнічення окиснення жирних кислот [23, 29].
У 16 рандомізованих контрольованих дослідженнях пацієнтів з ХСН показано, що триметазидин знижує загальну смертність і покращує ФВЛШ, зменшує симптоми ХСН і знижує рівень N-кінцевого фрагмента попередника мозкового натрійуретичного пептиду (NT-proBNP) у плазмі крові. Згідно з висновками авторів дослідження, у пацієнтів з ЦД 2-го типу й ІХС триметазидин знижував ІР [28], однак питання попередження ХСН у пацієнтів з ЦД на ранній стадії в клінічних дослідженнях поки не вивчалось [23].
Пергекселин
Іншим фармакологічним агентом, що сприяє пригніченню метаболізму ВЖК, є пергекселин. Подібно до триметазидину, він використовується як антиангінальний засіб. Призначення пергекселину хворим із СН сприяє суттєвому покращенню показників фракції викиду ЛШ, VO2max і якості життя. Клінічне використання цього препарату обмежене внаслідок можливості розвитку гепатотоксичності та периферичної нейропатії [28].
Ранолазин
Ранолазин — третій антиангінальний фармакологічний агент з потенціалом модулятора метаболізму. Однак впровадити його використання не дозволяють такі чинники: ступінь пригнічення метаболізму ВЖК обмежується фізіологічними показниками; призначення ранолазину поєднується з можливістю пролонгації QTс [28].
L-карнітин
L-карнітин, відповідальний за перехід довголанцюгових жирних кислот в мітохондріальний матрикс, досліджувався на тваринних моделях з ожирінням і порушенням толерантності до глюкози. Основне питання — чи є зміна у використанні енергетичного субстрату при ЦД відповідальною за розвиток ремоделювання серця з розвитком його дисфункції — залишається відкритим. Також необхідні додаткові дослідження щодо оцінки кардіопротекторних ефектів гіпоглікемічних препаратів і метаболічних агентів, які вже використовуються. Пошук шляхів впливу на метаболізм міокарда розглядається на сьогодні як перспективна терапевтична мішень, а дослідження в цій галузі обіцяють значні досягнення [23].
L-карнітин — есенціальний кофактор метаболізму жирних кислот, човник у переміщенні кінцевих продуктів пероксимального окиснення жирних кислот у мітохондріях; модулятор внутрішньомітохондріального відношення «ацил-коензим А/коензим А». Провідна роль L-карнітину полягає в посиленні метаболізму ВЖК, однак існують експериментальні дані про активацію L-карнітином метаболізму глюкози. Вважається, що ЦД 2-го типу характеризується порушеннями обміну L-карнітину в мітохондріях. В результаті декількох досліджень встановлено, що призначення L-карнітину сприяє незначному покращенню енергозабезпечення і функціонування лівого шлуночка. Встановлено, що пропіоніл-L-карнітин сприяє поліпшенню функціонального стану, використанню як енергії окиснення глюкози в ураженому міокарді щурів (незважаючи на збільшений рівень ВЖК) [29]. Включення L-карнітину в режим харчування діабетичних мишей з ожирінням сприяє збільшенню рівня ацил-карнітину в плазмі крові, посмугованих м’язах, печінці та жировій тканині; активності піруватдегідрогенази в посмугованих м’язах; призначення комплексу «цинк — карнітин» зменшує гіперглікемію та покращує толерантність до глюкози. Інфузія L-карнітину за допомогою гіперінсулінемічної-еуглікемічної помпи поліпшує контроль глікемічного профілю, знижує концентрацію циркулюючих ліпідів. Призначення L-карнітину протягом трьох або шести місяців вперше діагностованим хворим на ЦД 2-го типу з порушеннями ліпідного обміну супроводжується статистично вірогідним зменшенням рівня ліпопротеїну (а) (ЛП(а)) у плазмі крові. Результати подвійного сліпого плацебо-контрольованого дослідження у пацієнтів з верифікованим гіперЛП(а) виявили, що призначення L-карнітину (2 г/добу) сприяє значному зменшенню концентрації ЛП(а) у плазмі крові; включення L-карнітину в режим харчування пацієнтів з вперше виявленим ЦД 2-го типу супроводжується аналогічними змінами; комбіноване лікування L-карнітином із симвастатином (20 мг/добу) сприяє більш значному зменшенню концентрації ліпідів, зокрема триацилгліцеринів (ТГ) і ЛП(а), ніж монотерапія статинами. Отже, L-карнітин може використовуватися як один із компонентів ліпід-модифікуючої терапії у хворих на ЦД 2-го типу, спрямованої на зменшення концентрації ліпопротеїнів (а) [29, 30].
Обмеження надходження позаклітинного Са2+ у клітини
Блокатори кальцієвих каналів
Блокатори Са2+-каналів чинять захисну дію на міокард при ішемії. Найбільш патогенетично обґрунтованим щодо корекції енергосистем клітини є використання блокаторів Ca2+-каналів, однак останні усувають лише вторинні ланцюги порушення окисного фосфорилювання в мітохондріях [31].
Блокатори β-адренергічних рецепторів
Призначення блокаторів β-адренергічних рецепторів хворим на ЦД 2-го типу з ІХС має вагоме патогенетичне обґрунтування, оскільки висока симпатична активність, що спостерігається при цьому, прискорює розвиток ССЗ та істотно погіршує прогноз. Блокатори β-адренергічних рецепторів здатні зменшувати частоту виникнення епізодів «мовчазної» ішемії міокарда та поліпшувати прогноз у таких пацієнтів. Однак блокатори β-адренергічних рецепторів негативно впливають на показники глікемічного профілю, посилюють ризик гіпоглікемії, приховують її прояви, уповільнюють відновлення рівня постгіпоглікемічної гіперглікемії, виявляють негативний ефект на ліпідний спектр крові, можуть провокувати розвиток гострої CН. Вищеописані небажані явища спостерігаються при призначенні неселективних β-адренергічних рецепторів [27].
Селективні блокатори β-адренергічних рецепторів, зокрема метопролол, позбавлені цих побічних ефектів. Метопролол є ефективним гіпотензивним препаратом, має антиангінальну активність і кардіопротекторні властивості, покращує прогноз у хворих на ІХС, задовільно переноситься хворими при тривалому застосуванні. Кардіоселективні β-адреноблокатори можуть також нівелювати ефекти автономної дисфункції, зокрема протидіючи симпатичним стимулам, здатні відновлювати парасимпатично-симпатичний баланс [19].
Хронічна стимуляція β-адренорецепторів (характерна для некомпенсованої СН) пригнічує інсулін-опосередковане трансмембранне проникнення глюкози і активує функціональний стан рецепторів інсуліну. Адренергічне блокування за допомогою карведилолу зменшує використання ВЖК у процесах метаболізму міокарда з одночасним поліпшенням його функціонування. Однак традиційні антиангінальні засоби, що впливають на гемодинамічні параметри (β-адреноблокатори, антагоністи Ca2+, нітрати), гірше переносяться хворими літнього віку через високий ризик взаємодії фармакологічних агентів і значну частоту побічних ефектів, зокрема порушення функції нирок і печінки [29].
Модуляція оксидантного стресу
Оксидантний стрес є одним із основних чинників, що сприяють приєднанню та/або прогресуванню діабетичного серця. У низці досліджень проведена оцінка можливостей зменшення накопичення активних форм кисню (АФК) [4].
Альфа-ліпоєва кислота
Зважаючи на те, що одним із провідних патогенетичних механізмів ССЗ при ЦД 2-го типу є оксидантний стрес (ОС), необхідність призначення антиоксидантів є очевидною. Значний терапевтичний потенціал відзначений у альфа-ліпоєвої кислоти (α-ЛК). Встановлено, що щоденне вживання 800 мг α-ЛК протягом 4 міс. супроводжується поліпшенням показників варіативності ритму серця (ВРС), інтервалу QT. Автори дійшли висновку, що тривале пероральне застосування α-ЛК полегшує клінічні прояви і послаблює об’єктивні порушення, пов’язані з ССЗ, і що α-ЛК є ефективним і безпечним фармакологічним агентом [31].
Найбільш ймовірним механізмом дії α-ЛК є здатність функціонувати в ролі радикального зв’язувача («очищувача»). На користь цього припущення свідчать наступні факти: антиоксидантна (зв’язуюча, «очисна») активність у хворих на ЦД 2-го типу пригнічена; збільшення вмісту вільних радикалів з одночасним порушенням показників гемостазу, пов’язаних з ушкодженням ендотелію, спостерігається у хворих на ЦД 2-го типу з мікроальбумінурією; глутатіон, пробукол, α-токоферол і α-ЛК запобігають порушенням мікроциркуляції в нервовій тканині при експериментальній діабетичній нейропатії; ліпофільні вільнорадикальні зв’язувачі («очищувачі»), такі як α-ЛК або пробукол, ефективніші, ніж гідрофільні, зокрема глутатіон; α-ЛК сприяє дозозалежній нормалізації кровотоку в капілярах нервової тканини, а також збільшенню вмісту глутатіону. Отримані результати свідчать про те, що одним із найбільш імовірних механізмів дії α-ЛК є посилення вільнорадикально-зв’язуючої активності [32, 33]. Отже, у α-ЛК, яка впливає на енергетичний метаболізм і редукцію ОС, відзначається значний терапевтичний потенціал, що зумовлює патогенетичну обґрунтованість для використання цього фармакологічного агента.
Бенфотіамін
Існує достатня кількість результатів експериментальних і клінічних досліджень, які дозволяють припустити, що гіперінсулінемія (ГІ), ІР, хронічна гіперглікемія при ЦД 2-го типу негативно впливають на метаболізм тіаміну, зокрема внаслідок пригнічення функціонального стану транспортеру тіаміну-1 (THTR-1) і THTR-2, активності транскетолази (ТК), що може призвести до накопичення інтермедіатів початкових стадій гліколізу (гліцеральдегід-3-фосфату (ГА-3-Ф), фруктозо-6-фосфату (Ф-6-Ф) і дигідроксиацетон-фосфату (ДГА-Ф)). Накопичення інтермедіатів в умовах хронічної гіперглікемії посилює продукцію вільних радикалів у мітохондріях, що супроводжується пригніченням активності гліцеральдегід-3-фосфатдегідрогенази. Збільшення концентрації ГА-3-Ф, Ф-6-Ф і ДГА-Ф може ініціювати індуковані гіперглікемією метаболічні шляхи, що сприяють приєднанню судинних ушкоджень, в тому числі активації протеїнкінази С (РКС), акумуляції кінцевих продуктів глікування (КПГ), активації шляхів біосинтезу гексозаміну, дикарбонільних сполук [34]. Посилення активності РКС збільшує проникність судин, активує чинник росту ендотелію судин і провокує процеси тромбоутворення в судинах внаслідок гіперекспресії інгібітору активатора плазміногену-1 (ІАП-1). Активація рецепторів КПГ (РКПГ), верифікована на ендотеліоцитах кардіоміоцитів, перицитів і подоцитів, стимулює передачу пострецепторних сигналів, формування внутрішньоклітинних АФК і гальмує експресію гена, що призводить до пошкодження функціонально-структурного стану судин. Активація шляху дикарбонільних сполук супроводжується подальшим стимулюванням утворення КПГ, що також пов’язане з порушеннями функціонально-структурного стану кардіоміоцитів. Активація гексозомонофосфатного шунта збільшує експресію ІАП-1 і трансформуючого фактора росту b1, що сприяє подальшому опосередкованому гіперглікемією пошкодженню судин [17, 35]. Отже, важливе значення в розвитку судинних захворювань при ЦД, ймовірно, належить патофізіологічним наслідкам пригнічення активності ТК і накопичення ГА-3-Ф, Ф-6-Ф і дигідроксиацетон-фосфату.
Корекція порушень статусу тіаміну повинна здійснюватись шляхом використання екзогенного вітаміну В1 або бенфотіаміну (монофосфату S-бензоїлтіаміну, високобіодоступних жиророзчинних похідних вітаміну В1). Повідомляється, що використання бенфотіаміну або вітаміну В1 у стрептозотоцин-індукованих діабетичних (СТД) тварин не супроводжується нормалізацією рівня глюкози у крові або концентрації HbA1c. Водночас вважається, що призначення бенфотіаміну в поєднанні з інсулінотерапією може бути перспективним варіантом контролю глікемії. Вживання бенфотіаміну протягом 14 тижнів (100 мг/кг/добу) діабетичними мишами супроводжується нормалізацією порушень гомеостазу Ca2+ і функціонування кардіоміоцитів. Використання тіаміну при СТД у щурів сприяло майже повній нормалізації значної гіперекспресії мозкового натрійуретичного пептиду; запобігало приєднанню фіброзу міокарда. Бенфотіамін, сприяючи підвищенню активності транскетолази, перешкоджає активації патофізіологічних механізмів шляхом переорієнтації напрямку метаболізму Ф-6-Ф і ГА-3-Ф; здатний сприяти корекції нейронального і судинного дефіциту за допомогою процесів, які відбуваються за участю оксиду азота (NO), що має значний терапевтичний потенціал для лікування серцево-судинних захворювань [17].
З метою досягнення тривалого терапевтичного ефекту необхідно проводити фармакологічну корекцію препаратами, що здатні підвищувати концентрацію тіаміну в клітинах. Даний ефект забезпечується бенфотіаміном — жиророзчинним похідним тіаміну. Значний терапевтичний потенціал бенфотіаміну дозволяє ефективно використовувати препарати, що містять жиророзчинні похідні тіаміну, з метою регуляції активності вільнорадикальних процесів, корекції дисфункції ендотелію при ССЗ, стабілізації клінічного й антиоксидантного ефектів. Бенфотіамін, сприяючи підвищенню активності ТК, перешкоджає активації патофізіологічних механізмів шляхом переорієнтації напрямку метаболізму Ф-6-Ф і гліцеральдегід-3-фосфату. Бенфотіамін здатний сприяти корекції нейронального та судинного дефіциту за допомогою процесів, які відбуваються за участю NO, що має значний терапевтичний потенціал для лікування cерцево-судинних захворювань [36].
Довголанцюгові ω-3 поліненасичені жирні кислоти
Позитивний зв’язок між споживанням довголанцюгових ω-3 ПНЖК, які містяться в риб’ячому жирі, та низькою поширеністю ІХС був уперше виявлений в 1980 р. H.O. Bang і J. Dyerberg [37] у гренландських ескімосів. Це, на думку авторів, є результатом постійного споживання риби та/або морепродуктів. Відомо, що ці традиційні продукти харчування ескімосів містять велику кількість ω-3 ПНЖК з риб’ячого жиру (C20-C22(ω-3)). У подальшому була виявлена негативна кореляція між смертністю внаслідок ІХС та споживанням риб’ячого жиру, що дозволило висловити припущення про антиатеросклеротичні та/або антитромботичні властивості ω-3 поліненасичених жирних кислот [38].
Результати дослідження GOCADAN уперше виявили статистично значущий зв’язок між рівнем діастолічного АТ (ДАТ) і концентрацією докозагексаєнової кислоти (ДГК) у мембранах еритроцитів. Одна з гіпотез механізму впливу ω-3 ПНЖК на ритм серця базується на тому, що ω-3 ПНЖК знижують рівень ДАТ, що сприяє більш повільному ритму серця. Омега-3 ПНЖК можуть стимулювати продукцію NO, що збільшує вазодилатацію великих артерій і судин та, відповідно, знижує ДАТ; сприяти збільшенню ФВЛШ за рахунок підвищення наповнення шлуночків під час діастоли і тим самим забезпечувати енергозберігаюче діастолічне розслаблення. Омега-3 ПНЖК позитивно впливають на рівень електричного порогу, за якого викликається фібриляція шлуночків, сприяють зниженню вмісту тромбоксану В2, поліпшенню кровотоку і зниженню жорсткості стінки судин. Крім того, ω-3 ПНЖК змінюють провідність іонних каналів у мембранах кардіоміоцитів і тим самим запобігають розвитку аритмії [39, 40]. Повідомлення про негативний зв’язок між наслідками вживання ω-3 ПНЖК і параметрами ритму серця дозволили сформулювати гіпотезу, що вплив ω-3 ПНЖК і ω-6 ПНЖК на ритм серця може сприяти більш низькому рівню смертності. Зокрема, призначення ω-3 ПНЖК сприяє підвищенню ВРС, а нормалізація параметрів ВРС поєднується з низьким ризиком раптової смерті [39, 40]. Аналіз результатів перехресного дослідження у хворих на ІХС виявив, що щоденне вживання 3 та/або 6 г ейкозапентаєнової кислоти (ЕПК) і ДГК сприяє підвищенню варіативності RR-інтервалів; при цьому зменшення співвідношення високочастотного компонента (HF) ритму та низькочастотного компонента (LF) свідчить про пригнічення активності симпатичної нервової системи. Результати FAAT Trial свідчать, що призначення хворим зі шлуночковою тахікардією/фібриляцією 2,6 г/добу ЕПК + ДГК протягом року супроводжується відтермінуванням часу появи шлуночкової тахікардії/фібриляції. Омега-3 ПНЖК сприяють зменшенню частоти серцевих скорочень і загального судинного опору, що, можливо, є результатом поліпшення функціонування шлуночків серця. Приєднання аритмій у пацієнтів з перенесеним ІМ та СН, можливо, є результатом тригерної активності та пролонгування дії потенціалів, а це варіант аритмії, при якому ω-3 ПНЖК виявляють захисний ефект [39, 41]. Особливості механізмів оберненого зв’язку між ритмом серця і ω-3 ПНЖК невідомі, однак, ймовірно, він не опосередкований n. vagus [39, 42]. Ймовірно, що ω-3 ПНЖК впливають на ритм серця завдяки їх включенню у мембрани кардіоміоцитів.
Сульфорафан
Сульфорафан — органічна сполука рослинного походження, яка є найбільш характерним ізотіоціанатом. Речовина сульфорафан ефективна в комплексному лікуванні цукрового діабету 1-го та 2-го типу і запальних реакцій. Сульфорафан міститься в їжі у формі, відомій як глюкорафанін. Це глікозид, який зазвичай розглядається як проліки або форма зберігання сульфорафану. Глюкорафанін у великій кількості міститься в овочах (брюссельська капуста, броколі, цвітна капуста, рукола, китайська броколі, кольрабі, гірчиця, ріпа, редис, крес-салат). Сульфорафан є активатором Nrf2 — фактора транскрипції, що регулює експресію кількох антиоксидантних білків [43].
Лікування сульфорафаном призводить до зменшення вироблення АФК у артеріолах діабетичних мишей [44], ослаблення ремоделювання та дисфункції міокарда, спричинених дієтою з високим вмістом жиру [45].
Коензим Q10
Проведено кілька досліджень, присвячених ефективності коензиму Q10 у зменшенні ОС та патологічної перебудови серця [46]. Лікування коензимом Q10 призводить до зниження систолічного та діастолічного артеріального тиску у хворих на цукровий діабет [47], оскільки він діє як судинорозширювальний засіб. Більше того, використання дієти з коензимом Q10 при моделюванні ЦД 1-го та 2-го типів у мишей супроводжується зменшенням хронічного запалення низької інтенсивності, фіброзу та гіпертрофії міокарда [46].
Магній
Магній є кофактором у механізмах трансмембранного транспортування глюкози, а також ферментних системах при окисненні вуглеводів, бере участь у процесах секреції, зв’язуванні та активності інсуліну. Припускають, що гіпомагніємія сприяє таким станам інсулінорезистентності, як АГ, МС та ЦД 2-го типу [48].
Збільшення споживання Mg2+ з їжею порівняно з пероральним і внутрішньовенним призначенням може лише помірно підвищити рівень магнію [48]. Однак повідомляється, що режим харчування діабетичних мишей з високим вмістом жирів сприяє приєднанню діастолічної дисфункції та гіпертрофії міокарда. Порівняно з контролем спостерігається гіпомагніємія, суттєве збільшення співвідношення E/e' (співвідношення пікової швидкості трансмітрального потоку в ранню діастолу та ранньої діастолічної швидкості мітрального кільця), кінцевого діастолічного об’єму лівого шлуночка, товщини задньої стінки лівого шлуночка в діастолу та співвідношення маси серця і довжини гомілки. У мітохондріях кардіоміоцитів шлуночків верифіковане зниження продукції АТФ, збільшення АФК у 1,7–2,2 раза, деполяризація мембранного потенціалу мітохондрій і перевантаження мітохондрій Са2+. Режим харчування тварин із додаванням 50 мг/мл Mg2+ у питну воду протягом 6 тижнів сприяє збільшенню концентрації Mg2+ у плазмі крові та покращенню функції міокарда. На клітинному рівні Mg2+ покращує мітохондріальну функцію зі зменшенням вмісту АФК, перевантаженням Са2+, збільшенням продукції АТФ і реполяризації мембранного потенціалу мітохондрій. Отже, режим харчування діабетичних тварин із додаванням Mg2+ покращує мітохондріальну функцію, зменшує оксидантний стрес і запобігає діастолічній дисфункції [49].
Результати рандомізованого подвійного сліпого плацебо-контрольованого клінічного випробування у 54 пацієнтів із ЦД 2-го типу показали, що щоденне вживання 300 мг елементарного магнію (у вигляді MgSO4) протягом трьох місяців суттєво поліпшує рівень пре- і постпрандіальної глікемії, показників ліпідного профілю, систолічного АТ (САТ) і ДАТ та активності печінкових ферментів [48]. Значне зниження рівня ХС ЛПНЩ у пацієнтів, які отримували MgSO4, визначає сприятливий вплив Mg2+ на атерогенний ліпідний профіль. Цей ефект можна пояснити значенням Mg2+ у регуляції активності ліпопротеїнліпази. Дефіцит Mg2+ посилює секрецію катехоламінів, що призводить до посилення ліполізу, відповідного збільшення рівня ВЖК, що може призвести до збільшення синтезу та секреції ЛПНЩ і триацилгліцеринів (ТГ) і підвищеної концентрації ТГ у плазмі крові [48]. Виражене зниження показників САТ, ДАТ та середнього АТ на фоні вживання MgSO4 можна пояснити зміною іонного складу внутрішньоклітинного середовища. Зростання внаслідок дефіциту Mg2+ внутрішньоклітинного співвідношення Са2+/Mg2+ супроводжується підвищенням тонусу непосмугованих м’язів судин, реакцією міоцитів на зовнішні подразники, що призводить до вазоконстрикції і, як наслідок, підвищення артеріального тиску. Повідомляється, що Mg2+ може зменшити чутливість судинного русла брижі до фенілефрину та показники співвідношення Са2+/Mg2+. Магній зменшує накопичення колагену, товщину інтими-медіа та співвідношення «просвіт/медіа» в аорті. Отже, ймовірно, що Mg2+ може знизити показники АТ шляхом запобігання судинним морфологічним змінам і зменшення чутливості судин до нейромедіатора [48].
L.E. Simental-Mendia et al. [50] систематизували результати опублікованих клінічних випробувань та виявили сприятливий ефект перорального використання магнію протягом 4 місяців і довше. Зокрема, як у хворих на ЦД, так і у пацієнтів без ЦД спостерігалось поліпшення чутливості до інсуліну та контролю рівня глюкози.
Перспективні шляхи у лікуванні діабетичної кардіоміопатії
Пептиди-міметики, мішенями для яких є L-тип Ca2+-каналів
На сьогодні проводяться активні експериментальні дослідження потенційних терапевтичних підходів до лікування діабетичної КМП, і, з огляду на істотну роль внутрішньоклітинного дисбалансу Ca2+ у скоротливій дисфункції міокарда, були випробувані пептиди-міметики, мішенями для яких є L-тип Ca2+-каналів (LTCC). LTCC складаються з чотирьох різних субодиниць: α1-субодиниця (CaV1,1–CaV1,4), α2δ-субодиниця (α2δ1-4), цитозольна β-субодиниця (CaVβ1-4) і — в деяких тканинах — γ-субодиниця (γ1-8). Експериментально доведено, що молекулярний шаперон LTCC Cavβ2 регулює Ca2+-канали на рівні плазматичної мембрани. Отже, можливість корекції порушень життєвого циклу LTCC сприятиме позитивним змінам порушеної скоротливості міокарда. Конформаційна зміна Cavβ2 залежить від фосфорилювання серин-/треонін-протеїнкінази (Akt). Отже, до моменту надходження Ca2+ відбувається складний внутрішньоклітинний шлях, включаючи зменшення ретроградного обігу Cavα1.2 та деградацію білка за рахунок запобігання гуанозинтрифосфатазно-опосередкованого ендоцитозу LTCC, що сприяє антиретроградному обігу Cavβ2 та подальшій транскрипції Cavα2 [26].
Цей тип пептида-міметика є позитивним модулятором Ca2+ і, отже, збільшує ризик аритмогенезу. З огляду на це необхідні подальші дослідження щодо фармакокінетичного аналізу, оскільки надфізіологічні рівні Cavα1.2 та Cavβ2 чинять згубний вплив на функцію кардіоміоцитів. Оскільки Cavβ2 має значне поширення в різних тканинах, не тільки в міокарді, виникають труднощі, які, ймовірно, можна подолати за допомогою наночастинок, що, можливо, дозволить ефективно впливати на функціональний стан міокарда при діабетичній кардіоміопатії [26].
Некодуючі мікроРНК і довгі некодуючі РНК
МікроРНК (міРНК) — численний клас малих регуляторних некодуючих РНК, що контролюють експресію близько 60 % генів у ссавців і людини та беруть участь у регуляції багатьох біологічних процесів: синтезі білків, диференціюванні тканин, онтогенезі тварин, циркадних ритмах на посттранскрипційному рівні [51]. Вони відіграють важливу функціональну роль у розвитку різних патологічних процесів, зокрема цукрового діабету. МікроРНК — ключові регулятори посттранскрипційної експресії генів певних етапів онтогенезу [52].
МікроРНК-223, яка секретується тромбоцитами, здатна до стимуляції апоптозу ендотеліальних клітин, що може чинити згубну дію щодо розвитку ендотеліальної дисфункції [53, 54], яка є одним із поширених ускладнень ЦД 2-го типу.
Експресія міРНК зазнає змін у діабетичному серці. Модуляція міРНК може бути відповіддю на кілька патофізіологічних ланцюгів, включаючи гіперглікемію, гіперінсулінемію, ОС і хронічне запалення низької інтенсивності. Досягнення нормоглікемії у стрептозотоцин-індукованих діабетичних мишей не здатне попередити зміни міРНК в міокарді, спричинені гіперглікемією. Це дозволяє припустити, що діабетична кардіоміопатія та пов’язані з нею зміни міРНК можуть прогресувати, незважаючи на нормалізацію рівня глюкози у крові [55].
Повідомляється, що вміст міРНК-1, найбільш вагомої міРНК у серці, постійно збільшується — від ранніх проявів до пізніших фаз діабетичної кардіоміопатії. МікроРНК-1 негативно регулює експресію серин-/треонін-протеїнкінази Pim 1 та регулятора апоптозу Bcl-2, що є антиапоптичними та кардіопротекторними білками. Примітно, що трансфекція анти-міРНК-1 активує сигнали про виживання кардіоміоцитів і клітин-попередників ендотеліоцитів, які зазнають вплив високого рівня глюкози [56]. З іншого боку, експресія міРНК-133a різко знижується в міокарді стрептозотоцин-індукованих діабетичних мишей. Пригнічення регуляції корелює зі збільшенням вмісту маркерів фіброзу, таких як трансформуючий чинник росту β, фібронектин і колаген. Цукровий діабет корелює зі зниженою експресією міРНК-30c та міРНК-181a та надмірною експресією генів p53 та p21 міокарда у пацієнтів із ЦД та в кардіоміоцитах діабетичних тварин з гіпертрофією кардіоміоцитів і апоптозом, індукованими високим вмістом глюкози в режимі харчування [57]. Гіперглікемія зменшує експресію міРНК-146a в ендотеліоцитах міокарда, а ендотеліально залежна надмірна експресія міРНК-146a послаблює патологічне ремоделювання в діабетичному серці та зменшує інтенсивність хронічного запалення низької інтенсивності [58]. Цікаво, що надмірна експресія міРНК-133a послаблює розвиток фіброзу. Отже, ця міРНК може бути потенційною терапевтичною мішенню в лікуванні діабетичного фіброзу міокарда та пов’язаної з ним серцевої дисфункції.
Нещодавно був знайдений новий клас РНК — довгі некодуючі РНК (днкРНК), пов’язані з низкою біологічних процесів у відповідь на фізичне навантаження, що активуються на різних етапах генної експресії. Продемонстровано важливе значення днкРНК у фізіологічних процесах розвитку міокарда та при виникненні захворювань серця; зокрема показано, що деякі днкРНК можуть виступати чинниками гіпертрофії лівого шлуночка [59].
Нещодавні дослідження показали, що ЦД корелює з аберрантною експресією цих молекул [60]. Корекція їх аберантної експресії при моделюванні діабетичної КМП супроводжується поліпшенням функції міокарда та зменшенням апоптозу кардіоміоцитів [28]. Таким чином, пошук шляхів впливу на стан міРНК та днкРНК може стати багатоцільовим механізмом корекції, що викликає одночасну регуляцію важливих шляхів і залучає їх до модуляції патофізіологічних ланок, які беруть участь у патогенезі діабетичної кардіоміопатії [43].
Отже, нові терапевтичні підходи, включаючи вплив на генно-інженерному рівні, корекцію функціонального стану некодуючих мікроРНК і довгих некодуючих РНК, які на сьогодні досліджуються експериментально, представляють новий перспективний напрямок лікування хворих із діабетичною кардіоміопатією. Однак необхідні подальші дослідження, щоб сформувати реальний прикладний потенціал у клінічній практиці.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Гонорар: не задекларовано.
Конкурентні інтереси: фінансуючі організації не відігравали жодної ролі при написанні статті або в рішенні подати звіт для публікації.
Участь авторів у підготовці статті: Сергієнко О.О. — концепція і дизайн, написання тексту, редагування; Сергієнко В.О. — концепція і дизайн, аналіз літератури, написання тексту, редагування.