Резюме
Актуальність. Останнім десятиліттям ближня інфрачервона спектроскопія набула популярності у відділеннях новонароджених. З урахуванням сучасного міжнародного досвіду в наведеній роботі проведена оцінка особливостей церебральної оксиметрії в дітей із природженими вадами розвитку хірургічного профілю при різних видах комбінованої анестезії. Мета дослідження: оцінити стан церебральної оксигенації в новонароджених і немовлят із природженими вадами розвитку при різних видах анестезіологічного супроводу. Матеріали та методи. У ретроспективне дослідження були включені 150 новонароджених і немовлят із природженими вадами розвитку хірургічного профілю залежно від анестезії (інгаляційне + регіональне; інгаляційне + внутрішньовенне та тотальне внутрішньовенне знеболювання). Аналізувалися показники церебральної оксиметрії порівняно з показниками периферійної сатурації, артеріального тиску, парціальної напруги СО2, О2 в крові, рН. Результати. Мінімальний показник церебральної оксиметрії відзначено з лівої півкулі мозку в дітей І групи — 50,57 ± 16,66, що може бути несприятливим прогностичним фактором у подальшому відновленні та впливі на когнітивні функції головного мозку дитини. Через 1 годину після операції діти І групи, які отримували комбіновану анестезію севораном із регіональним знеболюванням, демонстрували гірші показники церебральної оксиметрії порівняно з дітьми ІІ і ІІІ груп (rSO2 правої півкулі в І групі — 56,84 ± 12,27, rSO2 лівої півкулі в І групі — 57,53 ± 13,32, р = 0,0001; 0,0028), тоді як відмінності в показниках ІІ і ІІІ груп не виявлені (р = 0,4167; 0,4029). Висновки. Ближня параінфрачервона спектрометрія зарекомендувала себе як простий, доцільний та корисний метод контролю за станом насиченості киснем головного мозку. При виборі комбінованої анестезії інгаляційним методом із регіональним знеболюванням у дітей із природженими вадами розвитку для проведення оперативного лікування слід більш ретельно контролювати церебральну оксигенацію з додатковим контролем периферійної сатурації, артеріального тиску, парціальної напруги СО2, О2 в крові та рН.
Актуальность. В последнее десятилетие ближняя инфракрасная спектроскопия приобрела популярность в отделениях новорожденных. С учетом современного международного опыта в представленной работе проведена оценка особенностей церебральной оксиметрии у детей с врожденными пороками развития хирургического профиля при различных видах комбинированной анестезии. Цель исследования: оценить состояние церебральной оксигенации у новорожденных и младенцев с врожденными пороками развития при различных видах анестезиологического сопровождения. Материалы и методы. В ретроспективное исследование были включены 150 новорожденных и младенцев с врожденными пороками развития хирургического профиля в зависимости от анестезии (ингаляционное + региональное; ингаляционное + внутривенное и тотальное внутривенное обезболивание). Анализировались показатели церебральной оксиметрии по сравнению с показателями периферической сатурации, артериального давления, парциального напряжения СО2, О2 в крови, рН. Результаты. Минимальный показатель церебральной оксиметрии отмечен с левого полушария мозга у детей I группы — 50,57 ± 16,66, что может быть неблагоприятным прогностическим фактором в дальнейшем восстановлении и влиянии на когнитивные функции головного мозга ребенка. Через 1 час после операции дети I группы, получавшие комбинированную анестезию севораном с региональным обезболиванием, демонстрировали худшие показатели церебральной оксиметрии по сравнению с детьми II и III групп (rSO2 правого полушария в I группе — 56,84 ± 12,27, rSO2 левого полушария в I группе — 57,53 ± 13,32, р = 0,0001; 0,0028), в то время как различия в показателях II и III групп не выявлены (р = 0,4167; 0,4029). Выводы. Ближняя параинфракрасная спектрометрия зарекомендовала себя как простой, целесообразный и полезный метод контроля за состоянием насыщенности кислородом головного мозга. При выборе комбинированной анестезии ингаляционным методом с региональным обезболиванием у детей с врожденными пороками развития для проведения оперативного лечения следует более тщательно контролировать церебральную оксигенацию с дополнительным контролем периферической сатурации, артериального давления, парциального напряжения СО2, О2 в крови и рН.
Background. In the past decade, near-infrared spectroscopy has gained popularity in neonatal wards. Taking into account modern international experience, the presented work assesses the features of cerebral oximetry in children with surgical congenital malformations under various types of combined anesthesia. The purpose of the study was to assess the state of cerebral oxygenation in newborns and infants with congenital malformations in various types of anesthetic support. Materials and methods. A retrospective study included 150 newborns and infants with surgical congenital malformations, depending on the anesthesia (inhalation + regional anesthesia; inhalation + intravenous and total intravenous anesthesia). The parameters of cerebral oximetry were analyzed in comparison with peripheral saturation, blood pressure, partial pressure of CO2, O2 in the blood, and pH. Results. The minimum index of cerebral oximetry was observed in the left brain hemisphere of children in group I — 50.57 ± 16.66 that may be an unfavorable prognostic factor for further recovery and influence on the cognitive functions of the brain. One hour after the operation, the children of the first group, who received combined anesthesia with sevorane and regional anesthesia, showed the worse indicators of cerebral oximetry compared to groups II and III (rSO2 of the right hemisphere in the first group — 56.84 ± 12.27, rSO2 of the left hemisphere in the first group — 57.53 ± 13.32, p = 0.0001; 0.0028), while the differences in this indicator between groups II and III were not found (p = 0.4167; 0.4029). Conclusions. Near-infrared spectroscopy has proven to be a simple, feasible and useful method for monitoring the oxygen saturation of the brain. When choosing a combined anesthesia by inhalation and regional anesthesia in children with congenital malformations for surgical treatment, cerebral oxygenation should be more carefully monitored with additional control of peripheral saturation, blood pressure, partial pressure of CO2, O2 in the blood and pH.
Вступ
Останнім десятиліттям ближня інфрачервона спектроскопія (Near-Infrared Spectroscopy — NIRS) набула популярності у відділеннях новонароджених [1]. NIRS забезпечує постійне, неінвазивне вимірювання оксигенації тканин органів (rSO2), а простота її застосування та потенційна корисність сприяли все ширшому використанню цього методу, особливо в дуже недоношених дітей. Церебральна NIRS забезпечує потенційне вікно в церебральному та гемодинамічному статусі новонародженого.
У двох нещодавніх пілотних рандомізованих контрольованих дослідженнях було підкреслено потенціал моніторингу оксигенації мозку для безпосереднього управління в пологовому залі та відділенні інтенсивної терапії новонароджених [2]. Однак автори закликали бути обережними щодо рутинного його використання та очікувати результатів подальших досліджень у цій галузі, перш ніж розглядати цей тип моніторингу як стандарт лікування [2].
Однак моніторинг NIRS або окремо, або спільно з іншими методами може потенційно відігравати важливу роль у догляді за новонародженими. Зараз деякі центри регулярно використовують cNIRS для допомоги в прийнятті рішень біля ліжка дитини, особливо при догляді за недоношеними немовлятами [3].
На відміну від пульсової оксиметрії, що вимірює насичення артеріального кисню, NIRS вимірює насичення тканин киснем, що складається з поєднання артеріальної, венозної та капілярної крові. Хоча моніторинг NIRS забезпечує відносну регіональну насиченість і пропонуються контрольні настанови [4, 5], на сьогодні наукові праці неоднорідні за своєю сукупністю досліджень та результатами [6], а також було показано, що значення змінюються залежно від гестаційного віку [7].
Клініцисти все більше усвідомлюють важливість інтерпретації фізіологічних даних у контексті кожного окремого немовляти, а не підходу «єдиного розміру», щоб забезпечити оптимальний та відповідний індивідуальний догляд [3]. Як результат проблема, з якою стикається багато спеціалістів, полягає в інтерпретації цього відносно нового приліжкового пристрою. Показники та сигнали на ньому дають багато інформації [8, 9], але на відміну від рівнів периферичного насичення киснем (SpO2) на насичення мозкової тканини киснем впливає багато потенційних змінних, включаючи серцеву (артеріальний тиск (АТ) та серцевий викид), дихальну (парціальний тиск вуглекислого газу та кисню в артеріальній крові) та метаболічні параметри (глікемія). Правильна інтерпретація показників/тенденцій мозкової оксигенації у світлі таких змінних є важливою для здійснення відповідних втручань, а зміни в мозкових значеннях NIRS повинні спонукати до клінічної оцінки немовляти для визначення їх основної причини [3].
З урахуванням сучасного міжнародного досвіду в наведеній роботі проведена оцінка особливостей церебральної оксиметрії в дітей із природженими вадами розвитку (ПВР) хірургічного профілю при різних видах комбінованої анестезії.
Мета дослідження: оцінити стан церебральної оксигенації в новонароджених і немовлят із природженими вадами розвитку при різних видах анестезіологічного супроводу.
Матеріали та методи
У ретроспективне дослідження були включені 150 новонароджених і немовлят із ПВР, які отримали хірургічне лікування в м. Дніпрі у 2019 році. За характером ПВР у дослідженні брали участь діти з патологією, що наведена в табл. 1. Найбільш часто серед природжених аномалій зустрічалися непрохідність кишечника (24 %) та пухлини черевної порожнини (21,3 %).
Було сформовано 3 групи залежно від типу комбінованої анестезії при хірургічній корекції аномалій: І група (50 дітей із ПВР) — інгаляційне (севоран) + регіональне знеболювання; ІІ (50 дітей із ПВР) — інгаляційне (севоран) + внутрішньовенне знеболювання (фентаніл); ІІІ (50 дітей із ПВР) — тотальна внутрішньовенна анестезія 2 препаратами: знеболюючим (фентаніл) та медикаментозним сном на тлі внутрішньовенної ін’єкції гіпнотиків (20% оксибутират натрію). Проведено операції: торакальні, урологічні, абдомінальні.
Ретроспективна оцінка в дослідженні проводилася за такими етапами: 1) до проведення хірургічного лікування та анестезіологічного супроводу (І етап); 2) уведення дитини в наркоз (ІІ етап); 3) травматичний етап операції: середина операції або максимально болісний етап хірургічного втручання (ІІІ етап); 4) післяопераційний період (протягом 1 години після транспортування дитини у відділення інтенсивної терапії) (ІV етап); 5) через 24 години після операції (V етап).
Ключовим дослідженням протягом усіх етапів було проведення NIRS на апараті Somanetics INVOS 5100 C (США).
Для правильної інтерпретації даних додатково оцінювалися рівень периферичного насичення киснем (SpO2) та потенційні змінні, які відображають характер насичення мозкової тканини киснем, — серцеві (АТ та серцевий викид), дихальні (парціальний тиск вуглекислого газу та кисню в артеріальній крові) та метаболічні параметри (глікемія). Вимірювання вітальних показників проводилося на моніторі Nihon Kohden (Japan), дослідження кислотно-лужного стану (КЛС) виконувалося за допомогою іоноселективного іонізатора електролітів і газів крові Medica Easy Lyte (США).
Нормальні діапазони обраних показників враховувались у межах: NIRS (rSO2): для новонароджених і немовлят — від 75 до 95 %; SpO2 — 95–100 %; артеріальний тиск: для новонароджених: систолічний — 60–96 мм рт.ст., діастолічний — 40–65 мм рт.ст.; для немовлят: систолічний — 90–112 мм рт.ст., діастолічний — 50–75 мм рт.ст. [10, 11].
Обробка даних проводилась методом варіаційної статистики. Оскільки при більшій кількості порівнянь критерій Ньюмена — Кейлса дає більш точну оцінку ймовірності альфа, застосовували двосторонні тести значущості, та альфа був встановлений для р < 0,05. Поправки Бонферроні були використані для вирішення множинних порівнянь.
Результати та обговорення
Природжені захворювання в дітей, які вимагали оперативного лікування, розподілили так: абдомінальні операції — 98 (67 %), торакальні — 26 (18 %), урологічні — 23 (15 %).
Розподіл досліджуваних новонароджених із ПВР за масою тіла та віком по групах на момент госпіталізації в стаціонар із приводу хірургічної корекції наведений у табл. 2. Вірогідних відмінностей між групами не виявлено. У дітей всіх груп превалювала маса тіла більше 3000 г, а постнатальний вік при надходженні в дитячий хірургічний стаціонар досягав 2 тижнів.
/60.jpg)
Насичення крові киснем має велике значення при проведенні будь-якої операції, особливо в дитячому віці. Знижений об’ємний кровообіг у тканині (ішемія) або знижений вміст кисню в артеріальній крові (гіпоксія) формують тканинний дефіцит кисню, при якому страждають усі органи та системи дитини, особливо уразливими є нирки, кишечник, головний мозок. Відомо, що одним із перших компенсаторних механізмів, спрямованих на ліквідацію тканинного дефіциту О2, є збільшення його екстракції з плинної крові. Результатом підвищеної тканинної екстракції кисню є неминуче зниження вмісту кисню у венозній крові, яка відтікає насамперед із тієї його фракції, яка пов’язана з гемоглобіном. Зважаючи на важливість цих патофізіологічних процесів і їх неминучість при хірургічній корекції ПВР, вважається за доцільне моніторувати периферійну та центральну оксиметрію методами пульсоксиметрії та ближньої інфрачервоної спектрометрії, що дозволяє оцінити кількісно відсоток насичення гемоглобіну киснем [1, 2].
NIRS — метод безперервного цілодобового неінвазивного вимірювання регіонарного насичення киснем тканин, зокрема головного мозку, — церебральної оксиметрії (ЦО), в основі якого лежить принцип оптичної спектроскопії із застосуванням інфрачервоного світла з діапазоном від 650 до 1100 нм [2]. Світловий промінь цього діапазону, з одного боку, проникає через скальп, кістки склепіння черепа і мозкову речовину. З іншого боку, цей діапазон світла вибірково поглинається специфічними молекулами хромофорів, до яких належать окси- і дезоксигемоглобін, цитохром-С-оксидаза і деякі інші. Слід зазначити, що рівень окси- і дезоксигемоглобіну в мозковій тканині в десятки разів перевершує вміст всіх інших хромофорів. Метод дозволяє оцінювати кисневий статус гемоглобіну, який знаходиться в судинах досліджуваної ділянки головного мозку, що зближує його з методом пульсової оксиметрії, та добре відомий у неонатології протягом 10–15 років [3, 6].
Морфометричне дослідження головного мозку показало, що приблизно 85 % обсягу його судинного русла доводиться на венозні судини, 10 % — на артерії і близько 5 % — на капіляри [12]. З цього випливає те, що ЦО дозволяє оцінювати оксидативний статус (насичення гемоглобіну киснем) головним чином у крові церебральних венозних судин, що дозволяє якісно моніторувати стан мозкового кровотоку в дітей на усіх етапах до, протягом та після оперативного втручання, а показники використовувати як аналіти контролю.
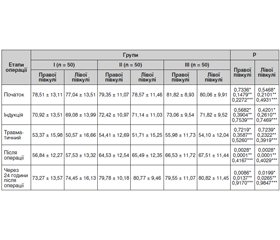
У нашому дослідженні рівень насичення головного мозку дітей по групах залежно від анестезіологічного супроводу наведений у табл. 3.
При аналізі отриманих даних привертає увагу динамічне зниження церебральної оксигенації в дітей усіх груп незалежно від обраного виду анестезіологічного супроводу при хірургічному втручанні (р > 0,05). На початку оперативного втручання rSO2 з обох півкуль коливалася в межах 77–82 %.
На II етапі операції, коли пацієнт перебуває на штучній вентиляції легень і життєві функції його організму повністю залежать від базових показників насичення крові киснем та препаратів анестезії, rSO2 стрімко знижується з максимальним зменшенням на III стадії операції, що характеризується найбільш травматичним і болісним періодом для пацієнта.
Причому вірогідних відмінностей між групами дітей не визначено (р > 0,05). Однак найбільш уразливими до гіпоксії та ішемії мозку були діти І групи на ІІІ етапі операції. Мінімальний показник ЦО відзначено з лівої півкулі мозку — 50,57 ± 16,66, що може бути несприятливим прогностичним фактором у подальшому відновленні дитини.
У подальшому через 1 годину після операції (ІV етап дослідження) діти І групи, які отримували комбіновану анестезію севораном із регіональним знеболюванням, демонстрували гірші показники церебральної оксиметрії порівняно з результатами ІІ і ІІІ груп (rSO2 правої півкулі в І групі — 56,84 ± 12,27, rSO2 лівої півкулі в І групі —57,53 ± 13,32, р = 0,0001; 0,0028), тоді як відмінностей у показниках ІІ і ІІІ груп не визначено (р = 0,4167; 0,4029).
Відомо, що церебральна гемодинаміка першою реагує на ноцицептивний подразник під час больових етапів операції, що необхідно враховувати при виборі тактики оперативного втручання та корекції анестезії [12]. Тому важливо моніторувати наповнення лівої і правої півкулі мозку киснем, адже за визначенням ступеня насичення гемоглобіну киснем у венозній крові можна діагностувати церебральну ішемію і гіпоксію.
Після хірургічного втручання через 24 години в дітей ІІ та ІІІ груп скоріше відновлювалася церебральна оксигенація до фізіологічного стану порівняно з І групою (р = 0,0086; 0,0137).
Відомо, що насичення крові киснем має велике значення при проведенні будь-якої операції, особливо в дитячому віці. Знижений об’ємний кровообіг у тканині (ішемія) або знижений вміст кисню в артеріальній крові (гіпоксія) формують тканинний дефіцит кисню, при якому страждають усі органи та системи дитини, особливо уразливими є нирки, кишечник, головний мозок зокрема [3].
Ураховуючи отримані дані ЦО і найбільш уразливу до ішемії мозку І групу дітей, було цікаво зіставити отримані дані з потенційними змінними, які відображають характер насичення мозкової тканини киснем.
Відомо що одним із перших компенсаторних механізмів, спрямованих на ліквідацію тканинного дефіциту О2, є збільшення його екстракції з плинної крові. Результатом підвищеної тканинної екстракції кисню є неминуче зниження вмісту кисню у венозній крові, що відтікає насамперед з тієї його фракції, яка пов’язана з гемоглобіном. У нашому дослідженні значних патологічних змін показників кислотно-лужного стану протягом усіх періодів не знайдено [13]. При аналізі показників PvO2 у дітей при різних видах анестезії звертає увагу тенденція до зниження їх при проведенні комбінованої анестезії внутрішньовенним уведенням 2 знеболюючих препаратів у післяопераційному періоді (р ≥ 0,05).
При оцінці показників PvCO2 встановлено, що саме в І групі з анестезіологічним супроводом інгаляційно (севоран) та регіональним знеболюванням знижена парціальна напруга СО2 з початку підготовки до операції (31,3 ± 6,5), у момент індукції в наркоз (31,3 ± 6,2), під час максимально болісного, травматичного етапу (30,6 ± 6,7) та після операції (31,0 ± 9,2). Причому отримані значення вірогідно відрізнялися від таких в групах з іншими типами комбінованої анестезії (р < 0,001).
Відновлювався показник PvCO2 у дітей І групи тільки через 24 години після хірургічного лікування. Клінічна ситуація в даному випадку, ймовірно, вказує на дихальний алкалоз внаслідок гіпервентиляції та підвищення частоти дихання під час проведення лікарем дихальної підтримки дитині.
Підтвердженням гіпокапнії та наявності дихального алкалозу є показники рН у дітей І групи. У динаміці спостереження рівень рН незначно підвищено та коливається в межах 7,41 ± 0,08–7,44 ± 0,12 від початку до післяопераційного періоду. Причому при порівнянні рН відразу після хірургічного втручання в дітей І групи (7,44 ± 0,12) з таким у дітей з іншими видами комбінованих знеболювань (у ІІ групі — 7,39 ± 0,08; ІІІ — 7,38 ± 0,08) відзначена вірогідна різниця (р = 0,0094; 0,0084 відповідно).
Отже, при виборі інгаляційної анестезії та регіонального знеболювання в дитини при проведенні хірургічної корекції слід застерігатися гіпервентиляції, що повинно контролюватися КЛС та своєчасно коригуватися параметрами вентиляції.
Для правильної інтерпретації ЦО ми додатково проаналізували периферійну сатурацію (SpO2) в обстежених дітей при різних видах комбінованої анестезії — значущих відмінностей не отримано.
У нашому дослідженні показники периферійної сатурації новонароджених і немовлят із ПВР критично не знижувались і не виходили за межі 97 % на всіх етапах спостереження, що, найімовірніше, було визначено бажанням лікаря підтримувати оксигенацію всіх тканин організму дитини на достатньому рівні.
Однак винятком було отримане зменшення SpO2 у дітей І групи порівняно з ІІІ групою на етапі індукції в наркоз (97,79 ± 2,45 проти 98,79 ± 1,63, при р = 0,0194 відповідно), у максимально болісний момент хірургічного втручання (96,29 ± 3,47 проти 98,10 ± 2,47 при р = 0,0368), а також у дітей ІІ групи порівняно з ІІІ групою після операції (95,63 ± 3,47 проти 96,92 ± 2,94 відповідно при р = 0,0507). Наведені результати І групи свідчать про більшу кисневу залежність дітей при аналгезії севораном у комбінації з регіональним знеболюванням, що обумовлено механізмом дії наркозу на організм дитини, але й не виключає наявності больового синдрому під час проведення операції.
Наступним досліджуваним показником вітальних функцій дітей був середній АТ.
При аналізі показників середнього АТ обстежених груп дітей значущих відмінностей не спостерігалось. Однак саме в ІІІ групі дітей, які отримували комбіноване внутрішньовенне знеболювання 2 препаратами, відзначено вірогідне збільшення середнього АТ від початку оперативного лікування до відновлення дитини після хірургічного втручання (49,49 ± 10,71 — на І етапі, 56,18 ± 8,05 — на V етапі; р ˂ 0,01).
Висновки
При узагальненні отриманих даних під час проведення дослідження було визначено таке:
1. Ближня параінфрачервона спектрометрія зарекомендувала себе як простий, доцільний та корисний метод контролю за станом насиченості киснем головного мозку.
2. Найбільш уразливими до гіпоксії та ішемії мозку були діти І групи в максимально травматичний момент операції. Мінімальний показник ЦО rSO2 відзначено з лівої півкулі мозку — 50,57 ± 16,66, що може бути несприятливим прогностичним фактором у подальшому відновленні та впливу на когнітивні функції головного мозку дитини. Через 1 годину після операції діти І групи, які отримували комбіновану анестезію севораном із регіональним знеболюванням, демонстрували гірші показники церебральної оксиметрії порівняно з дітьми ІІ і ІІІ груп (rSO2 правої півкулі в І групі — 56,84 ± 12,27, rSO2 лівої півкулі в І групі — 57,53 ± 13,32, р = 0,0001; 0,0028), тоді як відмінностей у показниках ІІ і ІІІ груп не визначено (р = 0,4167; 0,4029).
3. Отже, при виборі комбінованої анестезії інгаляційним методом із регіональним знеболюванням у дітей із ПВР для проведення оперативного лікування слід більш ретельно контролювати церебральну оксигенацію з додатковим контролем периферійної сатурації, артеріального тиску, парціальної напруги СО2, О2 в крові та рН.
4. Отримані дані потребують подальшого аналізу, обґрунтування та визначення кореляційних взаємозв’язків.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/59.jpg)
/60.jpg)
/61.jpg)