Журнал «Медицина неотложных состояний» Том 17, №1, 2021
Вернуться к номеру
Когнітивний дефіцит як наслідок загального знеболювання в офтальмохірургії у післяопераційних пацієнтів
Авторы: Дорофєєва Г.С.
КП «Дніпропетровська обласна клінічна офтальмологічна лікарня», м. Дніпро, Україна
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
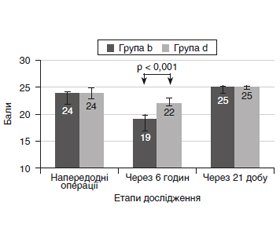
В цьому дослідженні було розглянуто вплив обраного методу знеболювання на стан когнітивних функцій у післяопераційному періоді. Аналіз когнітивного статусу був проведений за допомогою нейропсихологічного тестування: шкала лобних дисфункцій (Frontal Assessment Battery, FAB), коротка шкала оцінювання психічного статусу (Mini-Mental State Examination, MMSE). Оцінювання проводилось у кілька етапів: напередодні операційного втручання, через 6 годин після нього та на 21-шу добу післяопераційного періоду. Пацієнти були розподілені на дві групи: хворі групи d отримували загальну анестезію з додаванням дексмедетомідину за 40 хвилин до операції, підтримання анестезії — севофлурано-киснева суміш на малому потоці газу; в групі b метод загальної анестезії був доповнений блокадою крилопіднебінної ямки за 20 хвилин до втручання. Групи були статистично порівнянними за віко-статевими характеристиками. Оцінювання глибини аналгезії проводилось за допомогою індексу аналгезії при ноцицептивній дії (Аnalgesia Nociception Index, ANI), оцінювання глибини анестезії — за біспектральним індексом (Bispectral Index, BIS). Результати проведеного дослідження показали, що за даними нейропсихологічного тестування, згідно зі шкалами MMSE та FAB, показники були більш знижені в післяопераційному періоді при поєднанні методу загального знеболювання з блокадою крилопіднебінної ямки, ніж у групі з використанням дексмедетомідину як компонента мультимодального знеболювання (p < 0,001). За оцінюванням по закінченні 6 годин післяопераційного періоду в групі b за шкалою MMSE показники зменшились на 20,8 %, за шкалою лобної дисфункції FAB — на 28,6 % від початкового рівня. Під час аналізу результатів у групі d через 6 годин після оперативного втручання показники когнітивного стану за шкалою MMSE були нижче від вихідного рівня на 8,3 %, за шкалою FAB — на 13,3 %. Нейропсихологічне тестування на 21-шу добу за шкалами MMSE та FAB зафіксувало відновлення стану когнітивних функцій в обох групах. Висновок. Когнітивний стан у офтальмохірургічних пацієнтів після наскрізної кератопластики згідно зі шкалами MMSE та FAB при обох видах знеболювання суттєво відрізнявся на другому етапі досліджень (через 6 годин), а з часом (через 21 добу) відмінності між групами з використанням блокади крилопіднебінної ямки та із застосуванням дексмедетомідину були незначними (p > 0,05).
В этом исследовании рассматривалось влияние выбранного метода анестезии на когнитивные функции в послеоперационном периоде. Анализ когнитивного статуса проведен при помощи нейропсихологического тестирования: шкала лобных дисфункций (Frontal Assessment Battery, FAB), краткая шкала оценки психического статуса (Mini-Mental State Examination, MMSE). Оценивание проводилось в три этапа: накануне оперативного вмешательства, через 6 часов после него и на 21-й день послеоперационного периода. Пациенты были распределены на две группы: больные группы d получали общую анестезию с применением дексмедетомидина за 40 минут до операции, поддержание анестезии — севофлурано-кислородная смесь на малом потоке газа; в группе b общая анестезия была дополнена блокадой крылонебной ямки за 20 минут до вмешательства. Группы были статистически сопоставимы по возрасту и полу. Оценка глубины анальгезии контролировалась при помощи показателя индекса анальгезии при ноцицептивном воздействии (Аnalgesia Nociception Index, ANI), оценка глубины анестезии — по биспектральному индексу (Bispectral index, BIS). Результаты проведенного исследования показали, что согласно данным нейропсихологического тестирования по шкалам MMSE и FAB показатели были более низкими в послеоперационном периоде в группе с использованием общего обезболивания в комбинации с блокадой крылонебной ямки, чем в группе с использованием дексмедетомидина как компонента мультимодального обезболивания (p < 0,001). При оценке результата через 6 часов после оперативного вмешательства в группе b по шкале MMSE показатели снизились на 20,8 %, по шкале FAB — на 28,6 % от начального уровня. При проведении анализа результатов в группе d через 6 часов после оперативного вмешательства показатели когнитивного состояния по шкале MMSE были ниже исходного уровня на 8,3 %, по шкале FAB — на 13,3 %. Нейропсихологическое тестирование на 21-е сутки по шкалам MMSE и FAB зафиксировало восстановление состояния когнитивных функций в обеих группах. Вывод. Когнитивное состояние у офтальмохирургических пациентов после сквозной кератопластики согласно шкалам MMSE и FAB при обоих видах обезболивания существенно отличалось на втором этапе исследования (через 6 часов), а со временем (через 21 день) различия между группами с использованием блокады крылонебной ямки и применением дексмедетомидина стали незначительными (p > 0,05).
This study considered the influence of the chosen method of analgesia on the state of cognitive functions in the postoperative period. Cognitive status analysis was performed using neuropsychological testing: Frontal Assessment Battery (FAB) and Mini-Mental State Examination (MMSE). The examination was performed in several stages: the day before surgery, 6 hours after it and on day 21 of the postoperative period. Patients were divided into two groups: group d received general anesthesia with the addition of dexmedetomidine for 40 minutes before surgery, anesthesia was maintained with sevoflurane-oxygen mixture on a small gas flow. In group b, the method of general anesthesia was supplemented by the pterygopalatine fossa blockade for 20 minutes prior to the intervention. The groups were statistically comparable in terms of age and sex. Evaluation of the depth of analgesia was performed using analgesia nociception index, evaluation of the depth of anesthesia — with bispectral index. The result of the study showed that, according to neuropsychological testing on the MMSE and FAB, the indicators were more reduced in the postoperative period when using a combination of general anesthesia and the pterygopalatine fossa blockade than in the group received dexmedetomidine as a component of multimodal analgesia (p < 0.001). According to the examination after 6 hours of the postoperative period in group b, the MMSE indicators decreased by 20.8 %, the FAB — by 28.6 % from baseline. When analyzing the results in group d 6 hours after intervention, the indicators of cognitive status on the MMSE were below baseline by 8.3 %, on the FAB — by 13.3 %. Neuropsychological testing on day 21 using the MMSE and FAB showed recovery of cognitive function in both groups. Conclusion. Cognitive status in ophthalmic patients after penetrating keratoplasty according to the MMSE and FAB in both types of anesthesia differed significantly at the second stage of the study (in 6 hours), and over time (21 days after) differences between the groups of the pterygopalatine fossa blockade and of dexmedetomidine were insignificant (p > 0.05).
післяопераційна когнітивна дисфункція; шкала MMSE; FAB; блокада крилопіднебінної ямки; дексмедетомідин
послеоперационная когнитивная дисфункция; шкала MMSE; FAB; блокада крылонебной ямки; дексмедетомидин
postoperative cognitive dysfunction; Mini-Mental State Examination; Frontal Assessment Battery; pterygopalatine fossa blockade; dexmedetomidine
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Emery N. Brown, Kara J. Pavone, Marusa Naranjo. Multimodal General Anesthesia: Theory and Practice. Anesth. Analg. 2018. Nov. 127(5). 1246-1258.
- Cameron R. Smith, Erik Helander, Neil N. Chheda. Trigeminal Nerve Blockade in the Pterygopalatine Fossa for the Management of Postoperative Pain in Three Adults Undergoing Tonsillectomy: A Proof-of-Concept Report. Pain Med. 2020 Oct 1. 21(10). 2441-2446. doi: 10.1093/pm/pnaa062.
- Nalini Kotekar, Anshul Shenkar, and Ravishankar Nagaraj. Postoperative cognitive dysfunction — current preventive strategies. Clin. Interv. Aging. 2018. 13. 2267-2273. Published online 2018 Nov 8. doi:10.2147/CIA.S133896.
- Акименко Т.И., Женило В.М., Здирук С.В., Александрович Ю.С. Снижение частоты послеоперационных когнитивных нарушений после ампутации матки при ингаляционной анестезии севофлураном. Альманах клинической медицины. 2018. 46(7). 699-707.
- Melanie Varin, Marie-Jeanne Keroat, Sylvie Belleville and oth. Age-Related Eye Desease and Cognitive Function. Ophtalmology. Oktober 09 2019.
- De Oliveira G.S. Jr., Almeida M.D., Benzon H.T., McCarthy R.J. Perioperative single dose systemic dexamethasone for post-operative pain: A meta-analysis of randomized controlled trials. Anesthesiology. 2011. 115. 575-88.
- Криштафор А.А., Йовенко И.А., Черненко В.Г., Клименко К.А., Криштафор Д.А. Особенности когнитивных нарушений при ранениях, полученных в условиях боевых действий. Медицина неотложных состояний. 2018. 2(81). http://dx.doi.org/10.22141/2224-0586.2.81.2017.99701
- Ayvardgi A.A., Kobeliatskyy Yu.Yu. ANI-monitoring in assessing the effectiveeness of the anesthetic management for plastic surgery of the nose. Emergency medicine. 2018. 1(88). 103-107. doi: https://doi.org/10.22141/2224-0586.1.88.2018.124975.
- Щуко А.Г., Юрьева Т.Н., Олещенко И.Г. Роль крылонебной блокады в программе ранней реабилитации детей после хирургии врожденной катаракты. Офтальмологические ведомости. 2017. Т. 10. № 4. С. 18-23. doi: 10.17816/OV10418-23.
- Антомонов М.Ю. Математическая обработка и анализ медико-биологических данных. Киев. 2017. 578 с.

/66.jpg)
/66_2.jpg)