Журнал «Медицина неотложных состояний» Том 17, №1, 2021
Вернуться к номеру
Методика оценки количества жидкости в грудной клетке, основанная на антропометрических данных пациента и определении электрического импеданса грудной клетки
Авторы: Курсов С.В., Никонов В.В., Белецкий А.В., Загуровский В.М., Феськов А.Э.
Харьковская медицинская академия последипломного образования, г. Харьков, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
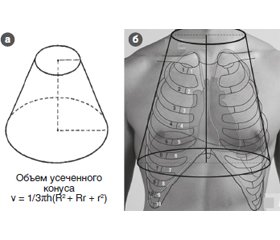
Актуальність. Визначення в динаміці об’єму рідини в грудній клітці набуває все більшого поширення в клінічних дослідженнях і є перспективним методом моніторингу в пацієнтів відділень інтенсивної терапії різного профілю. Найбільш доступними й економічними методами моніторингу об’єму рідини в грудній клітці в даний час є методи, засновані на вимірюванні електричного імпедансу грудної клітки при скануванні її високочастотним струмом. Ці методики забезпечують хорошу повторюваність результатів і практично не залежать від оператора. Мета роботи: розробка власної оригінальної методики визначення вмісту рідини в грудній клітці. Матеріали та методи. Електричний грудний імпеданс вимірювався при скануванні грудної клітки електричним струмом частотою 32 КГц з накладенням двох пар стрічкових електродів за В. Кубічеком. Окружність шиї і грудної клітки в місці накладення електродів була ретельно виміряна. Також визначалася відстань між вимірювальними електродами. Обсяг грудної клітки розраховувався на основі моделі усіченого конуса. Об’єм рідини в грудній клітці розраховувався за формулою V = γν/Z(R – r), де V — об’єм рідини в грудній клітці; γ — усереднене значення електропровідності крові; ν — об’єм грудної клітки, розрахований на моделі усіченого конуса; Z — величина електричного імпедансу грудної клітки; R — радіус грудної клітки, а r — радіус основи шиї, внесення різниці між ними у формулу має зменшити помилку, пов’язану з присутністю в грудній клітці сполучної тканини, яка має електропровідність, що відрізняється від електропровідності крові. Дослідження проведені як у практично здорових добровольців, так і у пацієнтів відділення політравми з торакальною травмою і ознаками дихальної недостатності. Результати. Наші спостереження показали, що величина об’єму рідини в грудній клітці, обчислена за пропонованою нами методикою, у нормі наближається до 60 % (59 ± 2) об’єму грудної клітки, розрахованого на основі моделі усіченого конуса. У найбільш тяжких випадках торакальної травми відносний вміст рідини в грудній клітці постраждалих досягав 75–80 %, а величина об’єму рідини в грудній клітці, виражена в умовних одиницях на 1/КΩ, перебувала на рівні 45–50 умовних 1/КΩ. Ці події були асоційовані з наявністю клінічної картини гострого респіраторного дистрес-синдрому 2-го ступеня тяжкості, і всі пацієнти перебували на примусовій штучній вентиляції легенів (ШВЛ) зі створенням постійного позитивного тиску в дихальних шляхах і респіраторного плато на рівні 25–27 см Н2О. Позитивна динаміка процесу була асоційована зі зростанням величини індексу оксигенації, можливістю переводу пацієнтів на самостійне дихання. При цьому відносний вміст рідини в грудній клітці постраждалих знижувався до 60–67 %, а у тих, хто потребував продовження ШВЛ, — до 68–73 %. Величина об’єму рідини в грудній клітці, виражена в умовних одиницях на КΩ, при швидкому поліпшенні і можливості припинення ШВЛ становила 37–42 умовних 1/КΩ, а при необхідності продовження ШВЛ — 43–46 умовних 1/КΩ. Результати визначення об’єму рідини в грудній клітці за методом авторів краще відповідали клінічній картині торакальної травми, тяжкості проявів синдрому гострої дихальної недостатності, ніж показники методики NICOM. Висновки. Розроблена методика визначення вмісту рідини в грудній клітці може бути застосована в наукових дослідженнях та клінічній практиці в процесі проведення інтенсивної терапії у пацієнтів із синдромом гострої дихальної недостатності.
Актуальность. Определение в динамике объема жидкости в грудной клетке приобретает все более широкое распространение в клинических исследованиях и является перспективным методом мониторинга у пациентов отделений интенсивной терапии различного профиля. Наиболее доступными и экономичными методами мониторинга объема жидкости в грудной клетке в настоящее время являются методы, основанные на измерении электрического импеданса грудной клетки при сканировании ее высокочастотным током. Эти методики обеспечивают хорошую повторяемость результатов и практически не зависят от оператора. Цель работы: разработка собственной оригинальной методики определения содержания жидкости в грудной клетке. Материалы и методы. Электрический грудной импеданс измерялся при сканировании грудной клетки электрическим током частотой 32 КГц с наложением двух пар ленточных электродов по В. Кубичеку. Окружность основания шеи и грудной клетки в месте наложения электродов была тщательно измерена. Также определялось расстояние между измерительными электродами. Объем грудной клетки рассчитывался на основании модели усеченного конуса. Объем жидкости в грудной клетке рассчитывался по формуле V = γν/Z(R – r), где V — объем жидкости в грудной клетке; γ — усредненное значение электропроводности крови; ν — объем грудной клетки, рассчитанный на модели усеченного конуса; Z — величина электрического импеданса грудной клетки; R — радиус грудной клетки, а r — радиус основания шеи, внесение разницы между ними в формулу должно уменьшить ошибку, связанную с присутствием в грудной клетке соединительной ткани, обладающей электропроводностью, которая отличается от электропроводности крови. Исследования проведены как у практически здоровых добровольцев, так и у пациентов отделения политравмы с торакальной травмой и признаками дыхательной недостаточности. Результаты. Наши наблюдения показали, что величина объема жидкости в грудной клетке, вычисленная по предлагаемой нами методике, в норме приближается к 60 % — 59 ± 2 % объема грудной клетки, рассчитанного на основе модели усеченного конуса. В наиболее тяжелых случаях торакальной травмы относительное содержание жидкости в грудной клетке пострадавших достигало 75–80 %, а величина объема жидкости в грудной клетке, выраженная в условных единицах на 1/КΩ, находилась на уровне 45–50 условных 1/КΩ. Эти события были ассоциированы с наличием клинической картины острого респираторного дистресс-синдрома 2-й степени тяжести, и все пациенты находились на принудительной искусственной вентиляции легких (ИВЛ) с созданием постоянного положительного давления в дыхательных путях и респираторного плато на уровне 25–27 см Н2О. Положительная динамика процесса была ассоциирована с возрастанием величины индекса оксигенации, возможностью перевода пациентов на самостоятельное дыхание. При этом относительное содержание жидкости в грудной клетке пострадавших снижалось до 60–67 %, а у тех, кто нуждался в продолжении ИВЛ, — до 68–73 %. Величина объема жидкости в грудной клетке, выраженная в условных единицах на 1/КΩ, при быстром улучшении и возможности прекращения ИВЛ составляла 37–42 условных 1/КΩ, а при необходимости продолжения ИВЛ — 43–46 условных 1/КΩ. Результаты определения объема жидкости в грудной клетке по методу авторов лучше соответствовали клинической картине торакальной травмы, тяжести проявлений синдрома острой дыхательной недостаточности, чем показатели методики NICOM. Выводы. Разработанная методика определения содержания жидкости в грудной клетке может быть применена в научных исследованиях и клинической практике в процессе проведения интенсивной терапии у пациентов с синдромом острой дыхательной недостаточности.
Background. Determination of the thoracic fluid content in the dynamics is becoming increasingly common in clinical trials and is a promising method for monitoring patients of intensive care units of various profiles. The most affordable and cost-effective methods for monitoring the amount of fluid in the chest at present are those based on measuring the electrical impedance of the chest when scanning it with high-frequency current. These techniques provide good repeatability of results, and are virtually independent of the operator. The purpose of the work is to develop own original technique for determining the thoracic fluid content. Materials and methods. The electric chest impedance was measured when scanning the chest with an electric current of 32 KHz using two pairs of band electrodes according to V. Kubicek. The circumference of the base of the neck and chest at the site of application of the electrodes was measured carefully. The distance between electrodes was also determined. Chest volume was calculated based on the truncated cone model. The thoracic fluid content was evaluated by the equation: V = γν/Z(R – r), where V is the volume of fluid in the chest; γ is the average electrical blood conductivity; ν is the volume of the thorax, calculated on the model of a truncated cone; Z is the value of the electrical impedance of the chest; R is the radius of the thorax, and r is the radius of the base of the neck. The difference between them in this equation should reduce the error associated with the presence in the thorax of connective tissue that has an electrical conductivity different from the electrical conductivity of the blood. Studies were performed in both apparently healthy volunteers and in polytrauma patients with thoracic injury and signs of acute respiratory failure. Results. Our observations showed that the amount of fluid in the chest, calculated by our method, normally approaches 60 % — 59 ± 2 % of the chest volume, calculated on the base of the truncated cone model. In the most severe cases of thoracic injury, the relative fluid content in the chest of victims reached 75–80 %, and the amount of fluid in the chest, expressed in conventional units per 1/KΩ, was at the level of 45–50 conventional 1/КΩ. These events were associated with the presence of a clinical picture of acute respiratory distress syndrome degree 2, and all patients were on mandatory pulmonary mechanical ventilation with the creation of constant positive airway pressure and respiratory plateau at the level of 25–27 cm H2O. The positive dynamics of the process was associated with an increase in the oxygenation index, the ability to transfer patients to spontaneous breathing. At the same time, the relative thoracic fluid content in patients decreased to 60–67 %, and in those who needed continued mechanical ventilation — to 68–73 %. The thoracic fluid content, expressed in conventional units per 1/KΩ, with rapid improvement and the possibility of discontinuation of ventilation was 37–42 conditional 1/KΩ, and if it was necessary to continue mechanical ventilation — 43–46 conditional 1/KΩ. The results of determining the thoracic fluid content by the authors’ method better corresponded to the clinical picture of thoracic trauma, the severity of the manifestations of acute respiratory distress syndrome than the noninvasive cardiac output monitoring. Conclusions. The developed method for determining the thoracic fluid content can be applied in researches and clinical practice during intensive care of patients with acute respiratory distress syndrome.
електричний імпеданс біологічних тканин; імпедансметрія; вміст рідини в грудній клітці; гостра дихальна недостатність
электрический импеданс биологических тканей; импедансметрия; содержание жидкости в грудной клетке; острая дыхательная недостаточность
electrical impedance of biological tissues; impedancemetry; thoracic fluid content; acute respiratory failure
Введение
Материалы и методы
/76.jpg)
/77_4.jpg)
/77_3.jpg)
Результаты и обсуждение
Выводы
- Fathy S., Hasanin A.M., Raafat M., Mostafa M.M.A., Fetouh A.M., Elsayed M. et al. Thoracic fluid content: a novel parameter for predicting failed weaning from mechanical ventilation. Journal of Intensive Care. 2020. Vol. 8. Article 20. Available from: https://jintensivecare.biomedcentral.com/articles/10.1186/s40560-020-00439-2.
- Yoon T.-G., Jang K., Oh C.-S., Kim S.-H., Kang W.-S. The Correlation between the Change in Thoracic Fluid Content and the Change in Patient Body Weight in Fontan Procedure. Hindawi: BioMed Research International. 2018. Vol. 2018. Article ID3635708. Avai–lable from: https://www.hindawi.com/journals/bmri/2018/3635708/
- Dovancescu S., Saporito S., Herold I.H.F., Korsten H.H.M., Aarts R.M., Mischi M. Monitoring thoracic fluid content using bioelectrical impedance spectroscopy and Cole modeling. Journal of Electrical Bioimpedance. 2017. Vol. 8. № 1. Р. 107-115. Available from: https://content.sciendo.com/view/journals/joeb/8/1/article-p107.xml?language=en&tab_body=article_recommendations.
- Powers K.A., Dhamoon A.S. Physiology, Pulmonary, Ventilation and Perfusion. StatPearls [Last Update: April 6, 2019] URL: https://www.ncbi.nlm.nih.gov/books/NBK539907/
- Siddall E., Khatri M., Radhakrishnan J. Capillary leak syndrome: etiologies, pathophysiology, and management. Kidney International. 2017. Vol. 92. № 1. Р. 37-46. URL: https://www.kidney-international.org/article/S0085-2538 (17)30073-X/fulltext.
- Barker K.R., Conroy A.L., Hawkes M., Murphy H., Pandey P., Kain K.C. Biomarkers of hypoxia, endothelial and circulatory dysfunction among climbers in Nepal with AMS and HAPE: a prospective case-control study. Journal of Travel Medicine. 2016. Vol. 23. № 3. taw005. URL: https://academic.oup.com/jtm/article/23/3/taw005/2580592.
- Tkacs N.C., Porter C.S., Barker N.A. Lungs. In Advanced Physiology & Pathophysiology Essentials for Clinical Practice. Edited by N.C. Tkacs, L.L. Herrmann, R.L. Johnson. New York: Springer Publishing Company, 2020. P. 389-426. URL: https://books.google.com.ua/books?id=El2jDwAAQBAJ&pg=PA424&lpg=PA424&dq=systemic+hypoxia+increases+the+permeability+of+pulmonary+capillaries.
- Chioncel O., Collins S.P., Ambrosy A.P., Gheorghiade M., Filippatos G. Pulmonary Oedema — Therapeutic Targets. Cardiac. Failure Review. 2015. Vol. 1. № 1. Р. 38-45. doi: 10.15420/CFR.2015.01.01.38.
- Khosravi P.M., Reuter D., Kassiri N., Hashemian S.M. Extravascular lung water measurement in critically ill patients. Biomedical & Biotechnology Research Journal. 2018. Vol. 2. № 4. Р. 237-241. URL: http://www.bmbtrj.org/article.asp?issn=2588-9834;year=2018;volume=2;issue=4;spage=237;epage=241;aulast=Khosravi.
- Jozwiak M., Teboul J.-L., Monnet X. Extravascular lung water in critical care: recent advances and clinical applications. Annals of Intensive Care. 2015. Vol. 5. Article 38. URL: https://annalsofintensivecare.springeropen.com/articles/10.1186/s13613-015-0081-9.
- Cheung H., Dong Q., Dong R., Yu B. Correlation of cardiac output measured by non-invasive continuous cardiac output monito–ring (NICOM) and thermodilution in patients undergoing off-pump coronary artery bypass surgery. Journal of Anesthesia. 2015. Vol. 29. P. 416-420.URL: https://link.springer.com/article/10.1007/s00540-014-1938-z.
- García X., Simon P., Guyette F.X., Ramani R., Alvarez R., Quintero J. et al. Noninvasive Assessment of Acute Dyspnea in the ED. Chest. 2013. Vol. 144. № 2. Р. 610-615. DOI: https://doi.org/10.1378/chest.12-1676.
- Narula J., Kiran U., Malhotra Kapoor P., Choudhury M., Rajashekar P., Kumar C.U. Assessment of changes in hemodyna–mics and intrathoracic fluid using electrical cardiometry during autologous blood harvest. Journal of Cardiothoracic & Vascular Anesthesia. 2017. Vol. 31. P. 84-89. URL: https://www.jcvaonline.com/article/S1053-0770 (16)30296-8/fulltext.
- Hammad Y., Hasanin A., Elsakka A., Refaie A., Abdelfattah D., Rahman S.A. et al. Thoracic fluid content: a novel parameter for detection of pulmonary edema in parturients with preeclampsia. Journal of Clinical Monitoring & Computing. 2019. Vol. 33. P. 413-418. URL: https://doi.org/10.1007/s10877-018-0176-6.
- Kubicek W.G., Patterson R.P., Witsoe D.A. Impedance Cardio–graphy as a Noninvasive Method of Monitoring Cardiac Function and Other Parameters of the Cardiovascular System. Annals of the New York Academy of Sciences. 2006. Vol. 170. № 2. Р. 724-732. URL: https://www.researchgate.net/publication/229747174_Impedance_Cardio–graphy_as_a_Noninvasive_Method_of_Monitoring_Cardiac_Function_and_Other_Parameters_of_the_Cardiovascular_System.
- Гуревич М.И., Соловьев А.И., Литовченко Л.П., Доломан Л.Б. Импедансная реоплетизмография. Киев: Наукова думка, 1982. 176 с.
- Курсов С.В., Білецький О.В., Шарлай К.Ю. Церебральна імпедансна плетизмографія, реоенцефалографічний моніторинг та спектральна імпедансметрія в інтенсивній терапії критичних станів. Харків: ТОВ «Планета-Принт», 2018. 116 с.
- Sanidas E.A., Grammatikopoulos K., Anastasiadis G., Papadopoulos D., Daskalaki M., Votteas V. Thoracic Fluid Content and Impedance Cardiography: A Novel and Promising Noninvasive Method for Assessing the Hemodynamic Effects of Diure–tics in Hypertensive Patients. Hellenic Journal of Cardiology. 2009. Vol. 50. № 6. Р. 465-471. URL: https://www.researchgate.net/publication/40035713_Thoracic_Fluid_Content_and_Impedance_Cardiography_A_Novel_and_Promising_Noninvasive_Method_for_Assessing_the_Hemodynamic_Effects_of_Diu.
- MEDIS. Products: Devices for Patient Monitoring and Cardio-Vascular Diagnosis. ICG: Impedance Cardiography. Medizinische Messtechnik GmbH [cited Sep 21, 2020]. URL: https://medis.company/cms/index.php?page=icg-impedance-cardiography.
- SonoSite Inc. BioZ Cardio Profile: A new generation of continuous, noninvasive, hemodynamic monitoring for the hospital [cited Sep. 21, 2020]. URL: https://www.sonosite.com/sites/default/files/1173_BioZ_Cardio_Profile_Advantage_Sheet_v9.pdf.
- Mahmoud K.H., Mokhtar M.S., Soliman R.A., Khaled M.M. Non invasive adjustment of fluid status in critically ill patients on renal replacement therapy. Role of Electrical Cardiometry. The Egyptian Journal of Critical Care Medicine. 2016. Vol. 4. № 2. Р. 57-65. URL: https://www.sciencedirect.com/science/article/pii/S2090730316300263.
- Sanders M., Servaas S., Slagt C. Accuracy and precision of non-invasive cardiac output monitoring by electrical cardiometry: a systematic review and meta-analysis. Journal of Clinical Monitoring and Computing. 2020. Vol. 34. P. 433-460. URL: https://link.sprin–ger.com/article/10.1007/s10877-019-00330-y.
- Naranjo-Hernández D., Reina-Tosina J., Roa M.R., Barbarov-Rostán G., Aresté-Fosalba N., Lara-Ruiz A. et al. Smart Bioimpedance Spectroscopy Device for Body Composition Estimation. Sensors. 2019. Vol. 20. P. 70. doi: 10.3390/s20010070.
- Білецький О.В., Курсов С.В. Оцінка вмісту рідини в грудній клітці у пацієнтів із забоєм легень на тлі політравми та його зміни під впливом заходів інтенсивної терапії. Проблеми безперервної медичної освіти та науки. 2019. № 1 (33). С. 40-48.
- Білецький О.В., Курсов С.В. Ефект застосування магнію сульфату з метою стабілізації гемодинаміки на ранньому шпитальному етапі у постраждалих з міокардіальною контузією на тлі політравми. Вісник проблем біології і медицини. 2019. № 1. Випуск 1 (148). С. 96-101.
- Курсов С.В., Білецький О.В. Оцінка вмісту рідини у грудній клітці у постраждалих із забоєм легень на тлі політравми за допомогою визначення електричного грудного імпедансу. Медицина невідкладних станів. 2019. № 2 (97). Т. 15. С. 223.

/75.jpg)
/76_2.jpg)