Спалах гострого респіраторного синдрому, спровокованого коронавірусом (SARS-CoV-2) у грудні 2019 року в місті Ухань (Китай), призвів до світової пандемії (COVID-19). Хоча симптоми коронавірусної інфекції здебільшого мають характер легкого респіраторно-вірусного захворювання й обмежуються такими проявами, як збільшення температури, втрата нюху та смаку, головний біль, інколи кишкові розлади, відомо, що тяжкий перебіг COVID-19 доволі часто супроводжується розвитком синдрому системної запальної відповіді (SIRS — systemic inflammatory response syndrome), синдрому поліорганної дисфункції (MODS — multiplе organ dysfunction syndrome) і синдрому поліорганної недостатності (MOF — multiple organ failure, основний), особливо на пізніх строках тяжкого перебігу хвороби (Liu та співавт., 2020) [1]. Зрозумілим стає той факт, що залучення в процес перебігу захворювання інших органів і систем подовжує тривалість перебування пацієнтів у лікувальному закладі і збільшує летальність. У наведеній статті ми мали на меті дослідити частоту та вираженість органної дисфункції в пацієнтів із тяжким перебігом COVID-19, а також визначити потенційні механізми поліорганної недостатності, спровокованої SARS-CoV-2.
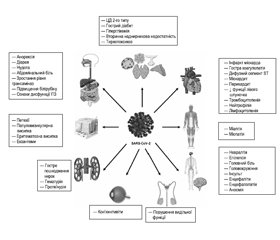
Відомо, що проявами поліорганної дисфункції можуть бути гостра легенева недостатність у поєднанні з однією з таких патологій: гострим пошкодженням печінки, гострим пошкодженням нирок (ГПН), серцево-судинними захворюваннями, а також широким спектром гематологічних відхилень (коагулопатій) та неврологічних розладів. Найважливішим тригером розвитку тяжкого перебігу COVID-19 є прямий і непрямий вплив SARS-CoV-2 на організм людини, й однією з теорій є вплив саме через рецептори ангіотензинконвертуючого ферменту 2 (АГР-2), що наявні в легенях, серці, нирках, яєчках, печінці, лімфоцитах, клітинах нервової системи тощо. Проте на сьогодні дані про виявлення РНК у клітинах зазначених органів надзвичайно контроверсійні. Більше того, порушення роботи органів може бути спричинене дисбалансом цитокінів («цитокіновий шторм»), результатом підвищеного рівня медіаторів запалення, дисфункцією ендотелію, порушенням згортання крові й інфільтрацією запальних клітин в органи [2].
Патогенез SIRS/MODS/MOF
В одному з досліджень (Baud та співавт., 2020) тяжкий перебіг COVID-19 спостерігався в 15,7 % пацієнтів серед госпіталізованих, 5 % із цих пацієнтів були переведені у відділення інтенсивної терапії, 2,3 % були заінтубовані, а летальність становила 1,4 % [2]. За даними Lei та співавт. (2020), у пацієнтів із легким перебігом спостерігалися гіпертермія, сухий кашель, міалгія, слабкість, а погіршення перебігу коронавірусної інфекції відмічалося в пацієнтів старшого віку зі супутніми серцево-судинними захворюваннями, патологією нирок, цукровим діабетом (ЦД), високим артеріальним тиском, ожирінням і хронічними респіраторними захворюваннями [3, 4]. Через тиждень після початку захворювання COVID-19 може прогресувати в тяжкий перебіг із гіпоксемією та задишкою та швидко перерости в гострий респіраторний дистрес-синдром (ГРДС) [5].
/31.jpg)
За період із листопада 2020 по січень 2021 року обстежені та проліковані 394 пацієнти з коронавірусною хворобою, середній вік хворих жіночої статі — 70,1 року (52–91), чоловічої статі — 53,5 року (52–71). Основні дані стосовно розвитку в пацієнтів супутньої органної дисфункції наведені в табл. 1.
COVID-19 і легеневі прояви — основні патофізіологічні аспекти
Пневмонія є найбільш частим та серйозним симптомом COVID-19, виникнення якої супроводжується сухим кашлем, підвищенням температури тіла, вкороченням вдиху, болем у грудній клітці, задишкою, слабкістю і білатеральними дифузними інтерстиціальними інфільтратами, що діагностуються під час виконання комп’ютерної томографії (КТ). Проте такі зміни не завжди є специфічними саме для COVID-19 порівняно з іншими респіраторно-вірусними захворюваннями (Mukherjee та співавт., 2020; Yi та співавт., 2020) [6, 7]. Після маніфестації захворювання, за даними різних авторів, ГРДС розвивається в 17–65 % випадків, погіршує перебіг захворювання і часто призводить до розвитку синдрому поліорганної недостатності та супроводжується високим відсотком летальності (Chen та співавт., 2020) [8]. За даними Wu та співавт. (2020), ГРДС частіше був діагностований у пацієнтів старшої вікової групи (> 65 років) із супутньою гіпертонічною хворобою (ГХ) та ЦД [9].
Інфекція SARS-CоV-2 може пошкоджувати легені прямим і непрямим впливом. Хоча АГР-2 має захисні властивості проти прогресування гострого пошкодження легень (Imai та співавт., 2005), він є функціональним рецептором для проникнення SARS-CoV та SARS-CoV-2 (Hamming та співавт., 2004) [10]. Приєднання вірусу до АГР-2 та інвазія до клітин-хазяїнів можуть безпосередньо їх інфікувати та посилити прояв запальної реакції, а отже, призвести до загибелі клітин та легеневих ускладнень. АГР-2 — це білок на поверхні клітин, розташованих у верхніх дихальних шляхах (келихоподібні та миготливі епітеліальні клітини), епітелії нижніх дихальних шляхів (альвеолярний тип II) та легеневих судин, таких як гладкі м’язи артерій, а також ендотеліальних клітин вен та артерій. Висока концентрація АГР-2 виявлена саме на поверхні альвеолоцитів легень 2-го типу. Доведено, що інгібування АГР-2 відіграє вирішальну роль у контролі патологічних змін у легенях, індукованих інфекцією SARS-CoV-2, що призводить до гострого пошкодження легень та тяжкої пневмонії (Pyrc та співавт., 2007) [11]. На моделі мишей S-білок SARS-CoV зв’язується з АГР-2 і призводить до набряку легень та зниження їх функції за рахунок зростання проникності легеневих судин, індукованої активацією АГР-2 (Imai та співавт., 2005) [12]. Оскільки ангіотензин-2 (АГ-2) — це ключовий регулятор артеріального тиску й об’єму позаклітинної рідини, очевидно, що інфекція SARS-CoV-2 призводить до інтерстиціального запалення та пошкодження альвеол. Патологічні особливості розвитку гострого респіраторного дистрес-синдрому також пов’язані з активацією шляхів впливу АГ-2, що перешкоджає відповіді адаптаційному імунітету через стимуляцію макрофагів та інших імунних клітин, а також із підвищеними концентраціями інтерлейкіну (IЛ) 6, фактора некрозу пухлини альфа (TNF-α) як основних запальних цитокінів (Yamamoto та співавт., 2011) [13]. Активовані дендритні клітини та макрофаги посилюють фагоцитоз інфікованих апоптотичними вірусами клітин епітелію. Підвищені рівні прозапальних медіаторів, наприклад інтерферону-гамма (IFN-γ), ІЛ (-1β, -6 та -12), та хемокінів, наприклад CXC L10 та CCL2, добре відомих як «цитокіновий шторм» та подальший синдром гіперзапалення, були підтверджені при запаленні легень, індукованому інфекціями SAR-CoV, MERS-CoV, SARS-CoV-2 (Channappanavar і Perlman, 2017; Lei та співавт., 2020) [14, 15]. Отже, патологічні зміни при ГРДС із пошкодженнями альвеолокапілярної мембрани в результаті посиленої проникності легень та витікання набрякової рідини в повітряні простори з подальшим розвитком дихальної недостатності були пов’язані з «цитокіновим штормом». Активація системи комплементу, С4, С3, С5b-9 та манозозв’язуючий лектин, медіатори гострого та хронічного запалення були виявлені в легеневій тканині пацієнтів із COVID-19 після розтину: в клітинах альвеолярного епітелію, деяких пневмоцитах, імунних клітинах й ексудаті альвеол (Gao та співавт., 2020) [16].
/33.jpg)
Нещодавнє дослідження Ciceri та співавт. (2020) продемонструвало чіткий зв’язок розвитку ГРДС з обструктивним тромбозапальним синдромом (MicroCLOTS) у мікросудинах легень пацієнтів із COVID-19 [17]. Утворення мікротромбів у судинних структурах легеневої тканини призводить до легеневої гіпертензії, легеневих кровотеч, інфаркту легень тощо [18]. У поєднанні пряме зараження легень вірусом, «цитокіновий шторм» та утворення мікротромбів слід розглядати як основні механізми легеневої недостатності, індукованої інфекцією SARS-CoV-2.
Основними радіологічними проявами маніфестації легеневих уражень COVID-19 є схожі рентгенологічні ознаки, які виявляються і при інших вірусних пневмоніях, а саме двосторонні інфільтрати за типом «матового скла» та консолідаційні інфільтрати легень. Цікаво, що на пізніх стадіях захворювання при виконанні КТ були такі знахідки: плевральний випіт, прогресування поширення інфільтратів та консолідаційних ущільнень.
/34.jpg)
Із метою спостереження в динаміці за станом легень, прогресування чи зменшення консолідатів, оцінки ефективності проведення респіраторної підтримки, виявлення ускладнень (пневмоторакс, гідроторакс) у клінічній практиці лікарі дедалі частіше використовують реанімаційний ультразвук (POCUS — Point-Of-Care Ultrasound), частиною якого є різновиди протоколу B.L.U.E., LUS (lung ultrasound score) та інші. Саме через низку технічних причин (недоступність КТ у багатьох лікувальних закладах, обмежений ресурс медичного персоналу для транспортування, відсутність достатньої кількості кисню під час транспортування та в кабінеті КТ, нестабільність пацієнта та переважання шкоди транспортування перед користю отриманої інформації внаслідок втрати ПТКВ, відлучення від неінвазивної вентиляції, високе іонізуюче навантаження, контамінація простору під час логістичного скерування інфікованого пацієнта, надлишкова вага, вагітність тощо) ультразвук ввійшов у протокол динамічного спостереження в поєднанні з клінічним оглядом пацієнтів із COVID-19.
COVID-19 і серцево-судинні захворювання
Залучення в тяжкий патологічний процес перебігу коронавірусної хвороби органів серцево-судинної системи може виникати або на фоні попередньо наявних захворювань, або за умов виникнення нових епізодів. Пацієнти з наявними в анамнезі захворюваннями серцево-судинної системи мають вищий ризик тяжкого перебігу COVID-19, що, за даними метааналізу (46 248 пацієнтів із підтвердженим COVID-19), особливо стосується супутньої гіпертонічної хвороби (17 %), цукрового діабету (8 %) та ішемічної хвороби серця (ІХС) (5 %) [19]. З іншого боку, існує загальноприйнята думка, що COVID-19 може також чинити несприятливий вплив на стан серцево-судинної системи, завдаючи або посилюючи пошкодження серця, що відображене в дослідженні Wang та співавт. (2020), в якому в 7,2 % пацієнтів або спостерігався підвищений рівень тропоніну І, або з’являлися нові електрокардіографічні чи ехокардіографічні аномалії, що свідчать про пошкодження серця [20]. Чіткого опису механізму ураження серця при COVID-19 у літературі не знайдено, окрім теорій наявності великої кількості ангіотензинових рецепторів, що підвищує ймовірність прямого вірусного впливу на серцевий м’яз, та опосередкованого впливу наслідків перенесеного «цитокінового шторму», гіпоксії на фоні ГРДС, застосованих методик респіраторної підтримки з недотриманням параметрів протективності, гіповолемії тощо. Підвищення рівня цитокінів внаслідок гіперзапальної відповіді або вторинного гемофагоцитарного лімфогістіоцитозу та збільшення потреби міокарда в кисні в умовах гострої інфекції можуть призвести до нестабільності атеросклеротичних бляшок та травми міокарда, збільшуючи ризик гострої ішемії/інфаркту [21]. Часто в пацієнтів спостерігається тенденція до гіпертензії, а також епізоди появи загрозливих аритмій.
Гематологічні зрушення при COVID-19
SARS-CoV-2-інфекція чинить помітний вплив на систему кровотворення і гемостазу. Найважливішими лабораторними знахідками з прогностичним потенціалом є лімфопенія (зменшення периферичних CD4+ і CD8+ Т-клітин) та лейкопенія, які можуть збільшити ризик бактеріальної інфекції [22]. За даними Mina та співавт. (2020), основними клінічно значущими лабораторними зрушеннями вважають лімфоцитопенію (< 1,0 × 109/л): 96,1 vs 80,4 %; лейкопенію (лейкоцити < 3,7 × 109/л): 61,1 vs 28,1 %, і тромбоцитопенію (тромбоцити < 100 × 109/л): 57,7 vs 31,6 % [23]. Результати метааналізу показали, що тромбоцитопенія суттєво корелює з тяжкістю захворювання (Lippi та співавт., 2020) [24]. Крім того, пікове співвідношення тромбоцитів/лімфоцитів та співвідношення нейтрофілів/лімфоцитів (NLR — neutrophil/leucocytes ratio) є важливими прогностичними предикторами COVID-19 (Terpos та співавт., 2020) [25]. Знижений абсолютний рівень моноцитів і підвищений рівень NLR пов’язані з вищим рівнем смертності (Pakos та співавт., 2020). Крім того, аномалії коагуляції, наприклад тяжка тромбоцитопенія, тенденція до гіперкоагуляції крові, низький активований частковий тромбопластиновий час, подовжений протромбіновий час та посилення продуктів розпаду фібрину, збільшують ризик виникнення внутрішньосудинної коагуляції серед госпіталізованих пацієнтів (Becker та співавт., 2020) [26]. Частота розвитку легеневої тромбоемболії, за даними літератури, спостерігалася близько в 10 % критично хворих на COVID-19 (Moores та співавт., 2020). Зростання симптомів захворювання корелює з підвищеними концентраціями медіаторів запалення (наприклад, TNF-α, індукований IFN-γ білок 10 [IP-10], MCP-1, білки запалення макрофагів 1A [MIP1A], колонієстимулюючий фактор гранулоцитів, інтерлейкінів) [2, 6, 7], а також з індукцією «цитокінового шторму» та синдрому гіперзапалення (Lillicrap, 2020; Quirch та співавт., 2020). Крім того, показники запалення, такі як лактатдегідрогеназа, C-реактивний білок (СРБ) та IЛ-6, допомагають ви-явити випадки бактеріального інфікування та вплинути на схему лікування та наслідки захворювання (Chen та співавт., 2020c; Li та співавт., 2020c; Ling 2020). CРБ та NLR як біомаркери запалення використовуються для діагностики та оцінки багатьох захворювань, а значення СРБ понад 100 мг/л є показником тяжкої бактеріальної інфекції (Cals та співавт., 2010; Gille-Johnson та співавт., 2012) [27].
Збільшення рівнів інших біомаркерів, таких як сироватковий D-димер, феритин та прокальцитонін, супроводжується поганим прогнозом для одужання пацієнтів із тяжким перебігом коронавірусної інфекції (Huang та співавт., 2020). Підвищений D-димер може відображати прогрес тромбозу глибоких вен та/або емболії легеневої артерії, а також може передбачати як тяжкість, так і прогностичний відсоток летальності, проте завжди має оцінюватися паралельно з клінічною картиною та додатковими інструментальними обстеженнями (Aggarwal та співавт., 2020). Додатково, лактатдегідрогеназа є неспецифічним показником різних патологічних станів із клітинною загибеллю та масивним пошкодженням тканин (Wu та співавт., 2020) [29].
Гостре пошкодження нирок при коронавірусній хворобі
Гостре пошкодження нирок — це різка втрата функції нирок, що розвивається протягом 7 днів й оцінюється за зниженням темпу діурезу, підвищенням креатиніну тощо (критерії KDIGO). Частота розвитку ГПН, за даними літератури, коливається від 0,5 до 19 %, однак дослідження, що продемонструвало максимальну частоту (19 %), повідомляло лише про дані критично хворих пацієнтів, що пояснює дуже високий рівень захворюваності [30]. Більшість пацієнтів, які брали участь у даних дослідженнях, мали вихідну задовільну функцію нирок без хронічної хвороби нирок в анамнезі. Щодо середнього часу для розвитку ГПН від моменту надходження до лікарні, Zhou та співавт. повідомляють про медіану — 15 діб, тоді як Cheng та співавт. наголошу-ють на тому, що в більшості пацієнтів, у яких розвивалося ГПН, часовий термін збігався з 7-ю добою від моменту надходження в стаціонар [31, 32]. Хоча точний патогенез ураження нирок при COVID-19 потребує вивчення, відомо, що ГПН при COVID-19 часто супроводжують сепсис, поліорганна недостатність та шок, що підтверджується гострим канальцевим некрозом під час аутопсії [33]. Як альтернатива в дослідженні, заснованому на одноклітинному аналізі транскриптомів (транскриптом — сукупність усіх транскриптів, синтезованих однією клітиною чи групою клітин, включаючи матричні РНК і некодуючі РНК), довели експресію рецептора АГ-2 у клітинах нирок, вказуючи на високу вірогідність прямого пошкодження ниркових клітин SARS-CoV-2. Це підтверджується нещодавнім виявленням SARS-CoV-2 у зразках сечі інфікованих пацієнтів [34].
У деяких пацієнтів метаболічні наслідки ГПН неможливо адекватно контролювати за допомогою консервативного лікування; отже, може знадобитися замісна ниркова терапія — діаліз (RRT — renal replacement therapy). Однак, як відомо, конвекційна техніка проведення гострого діалізу може викликати утворення тромбів, а також потребує використання дорогих витратних матеріалів, залучення додаткової кількості персоналу, що може збільшити економічні витрати родини пацієнта та посилити перевантаження медичного персоналу.
Не виявлено закономірної появи мікросудинного тромбозу в ниркових зразках пацієнтів із COVID-19. У препаратах ниркової тканини в пацієнтів із COVID-19 під час розтину рідкою знахідкою були фібринові тромби в клубочкових ділянках, пов’язані з тяжкою травмою ендотелію (Su et al., 2020) [35].
SARS-CoV-2 і захворювання печінки
За даними літератури, ураження печінки посідає майже друге місце після пошкодження легень у разі тяжкого перебігу SARS-CoV-2. Легкі та транзиторні пошкодження печінки, за даними Wong та співавт. (2020), виникають у 0,7–7,8 % пацієнтів, а в 14,8–53,1 % пацієнтів із COVID-19 супроводжуються аномальним рівнем аланінамінотрансферази, аспартатамінотрансферази та білірубіну протягом хвороби, причому білірубін мав найменше підвищення. Крім того, автори повідомили, що тяжкість ураження печінки пропорційна тяжкості COVID-19 [36]. Найбільш частими причинами, крім фонових захворювань печінки, у пацієнтів із коронавірусною інфекцією можуть бути медикаментозно-індуковане ураження (антипіретики, антибіотики, противірусні засоби), сепсис та системна запальна відповідь. На фоні недостатнього харчування, застосування стероїдів, супутніх інфекційних ускладнень, неконтрольованого перебігу ЦД у пацієнтів із тяжкими печінковими проявами часто може розвиватися нециротична гіперамоніємія. Накопичення вільного іону NH4+ в цитозолі впливає на мембранний потенціал і роботу внутрішньоклітинних ферментів — він конкурує з іонними насосами для Na+ і K+. У нормі рівень аміаку —11–35 мкмоль/л або 15–45 мкг/дл. Продукт зв’язування аміаку з глутаміновою кислотою — глутамін є осмотично активною речовиною. Він призводить до затримки води в клітинах та їх набухання, що викликає набряк тканин. У разі нервової тканини це може спровокувати розвиток набряку мозку, кому і смерть. Одним зі способів боротьби із загрозливою для життя гіперамоніємією, крім забезпечення адекватної респіраторної підтримки, нормалізації рівня глікемічного профілю, нормалізації кислотно-лужного складу крові, підтримки задовільного рівня альбуміну сироватки крові, діалізу/перитонеального діалізу, використання лактулози, є налагодження задовільного клінічного харчування пацієнтів в умовах відділення інтенсивної терапії (використання збалансованого ентерального та/чи парентерального харчування), а також застосування додаткових медикаментозних засобів, наприклад Lola (L-ornithine L-aspartat).
Неврологічні розлади при COVID-19
Існує припущення, що вірусна інвазія в центральну нервову систему за допомогою SARS-CoV-2 можлива через синапси, як це спостерігається в разі інфікування іншими коронавірусами, такими як SARS-CoV; і може призвести до низки неврологічних ускладнень, включаючи атаксію, судоми, невралгію, непритомність, гострі цереброваскулярні захворювання та енцефалопатію [37]. Mao та співавт. (2020) повідомляють, що 36,4 % їх когорти пацієнтів мали неврологічні прояви, а пацієнти з тяжким перебігом коронавірусного захворювання мали більше шансів мати гострі цереброваскулярні захворювання, порушення свідомості та пошкодження скелетних м’язів [38]. Крім того, Li та співавтори висунули теорію про те, що саме потенційна вірусна інвазія може відігравати часткову роль у патофізіології гострої дихальної недостатності в пацієнтів із COVID-19 [39].
Киснева терапія/респіраторна підтримка
Як правило, пацієнтам із гіпоксемією при COVID-19 стартово рекомендується неінвазивна оксигенотерапія (назальні канюлі, маски з резервуаром) із перевагою до використання високопотокових назальних канюль. Перевага надається неінвазивній вентиляції з постійним позитивним тиском у дихальних шляхах та тиском підтримки, а не з двофазним позитивним тиском [40]. Запропоновано підтримувати цільове периферичне насичення киснем артеріальної крові (SpO2) 92–96 %. Ендотрахеальна інтубація показана лише при гострому погіршенні або відсутності результату проведення неінвазивної респіраторної підтримки шляхом оцінки клінічного стану пацієнта, кислотно-лужного стану крові, неврологічного статусу, гемодинамічних параметрів та оцінки ROX-індексу в тренді. При тяжкому ГРДС рекомендується вентиляція в положенні на животі протягом 16 годин на добу [41]. Додаткові рятувальні заходи включають екстракорпоральну мембранну оксигенацію, що виступає в ролі бриджинг-терапії і не є панацеєю.
Лікування інших проявів захворювання
Після діагностики сепсису якнайшвидше слід розпочати стандартну терапію, що включає введення рідинного болюсу та раннє використання вазопресорів при тенденції до гіпотензії [43, 44]. Настійно рекомендується профілактика тромбоемболічних ускладнень, перевагу віддають низькомолекулярним гепаринам, а також рекомендується застосування нефармакологічних методів, таких як періодичні пневматичні компресійні панчохи тощо.
Висновки
У тяжких випадках перебігу COVID-19, крім ураження легень, у патологічний процес долучаються й інші різні органи, такі як серце, печінка та нирки, а також гематологічна та нервова системи, що в кінцевому результаті стимулює розвиток поліорганної недостатності. SARS-CоV-2 може безпосередньо вторгнутись у клітини різних органів хазяїна через рецептори АГ-2. З іншого боку, активація системи комплементу, «цитокіновий шторм», порушення регульованої імунної відповіді, дисфункція системи коагуляції та інфільтрація запальних клітин при інфекції SARS-CoV-2 можуть також спричинити поліорганну дисфункцію в пацієнтів із коронавірусною хворобою. Клініцисти повинні мати розуміння про клінічні, лабораторні та рентгенологічні особливості COVID-19 у критично хворих із MODS/MOF, оскільки розширення знань із патофізіології індукованої SARS-CоV-2 поліорганної недостатності може в кінцевому результаті призвести до покращення результатів лікування пацієнтів із COVID-19 та зменшення летальності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 26.01.2021
Рецензовано/Revised 04.02.2021
Прийнято до друку/Accepted 08.02.2021
Список литературы
1. Liu D.X., Liang J.Q., Fung T.S. Human Coronavirus-229E, -OC43, -NL63, and -HKU1. Reference Module in Life Sciences. 2020a. B978-970-912-809633-809638.10.1016/B978-0-12-809633-8.21501-X.
2. Baud D., Qi X., Nielsen-Saines K., Musso D., Pomar L., Favre G. Real estimates of mortality following COVID-19 infection. Lancet Infect. Dis. 2020 Jul. 20(7). 773.
3. Lei F., Liu Y.M., Zhou F., Qin J.J., Zhang P., Zhu L. et al. Longitudinal Association Between Markers of Liver Injury and Mortality in COVID-19 in China. Hepatology. 2020 Aug. 72(2). 389-398.
4. Guzik T.J., Mohiddin S.A., Dimarco A., Patel V., Savvatis K. et al. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc. Res. 2020, Aug 1. 116(10). 1666-1687.
5. Cheng Y., Luo R., Wang K., Zhang M. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney Int. 2020 May. 97(5). 829-838.
6. Mukherjee A., Ahmad M., Frenia D. A Coronavirus Disease 2019 (COVID-19) Patient with Multifocal Pneumonia Treated with Hydroxychloroquine. Cureus. 2020, Mar 30. 12(3). e7473.
7. Yi Y., Lagniton P.N.P., Ye S., Li E., Xu R.H. COVID-19: what has been learned and to be learned about the novel coronavirus disease. Int. J. Biol. Sci. 2020. 16(10). 1753-1766.
8. Chen J., Qi T., Liu L., Ling Y., Qian Z. Clinical progression of patients with COVID-19 in Shanghai, China. J. Infect. 2020 May. 80(5). 1-6.
9. Wu C., Chen X., Cai Y., Xia J. Risk Factors Associated with Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern. Med. 2020, Jul 1. 180(7). 934-943.
10. Hamming I., Timens W., Bulthuis M.L., Lely A.T., Navis G., van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J. Pathol. 2004 Jun. 203(2). 631-637.
11. Pyrc K., Berkhout B., van der Hoek. The novel human coronaviruses NL63 and HKU1. J. Virol. 2007 Apr. 81(7). 3051-3057.
12. Imai Y., Kuba K., Rao S., Huan Y., Guo F., Guan B. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 2005, Jul 7. 436(7047). 112-116.
13. Yamamoto S., Yancey P.G., Zuo Y., Ma L.J. Macrophage polarization by angiotensin II-type 1 receptor aggravates renal injury-acceleration of atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 2011 Dec. 31(12). 2856-2864.
14. Channappanavar R., Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin. Immunopathol. 2017 Jul. 39(5). 529-539.
15. Lei F., Liu Y.M., Zhou F., Qin J.J., Zhang P. et al. Longitudinal Association Between Markers of Liver Injury and Mortality in COVID-19 in China. Hepatology. 2020 Aug. 72(2). 389-398.
16. Gao T. et al. Highly pathogenic coronavirus N protein aggravates lung injury by MASP-2-mediated complement over-activation. MedRxiv. 2020.
17. Ciceri F., Beretta L., Scandroglio A.M., Colombo S. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit. Care Resusc. 2020, Apr 15. 22(2). 95-97.
18. Wölfel R., Corman V.M., Guggemos W., Seilmaier M., Zange S. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020 May.
19. Yang J., Zheng Y., Gou X. Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis [published online ahead of print, 2020 Mar 12]. Int. J. Infect. Dis. 2020. doi: 10.1016/j.ijid.2020.03.017. S1201-9712(20)30136-3.
20. Wang D., Hu B., Hu C. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China [published online ahead of print, 2020 Feb 7]. JAMA. 2020. doi: 10.1001/jama.2020.1585.
21. Khashkhusha T.R., Chan J.S.K., Harky A. ACE inhibitors and COVID-19: We don’t know yet. J. Card. Surg. 2020. doi: 10.1111/jocs.14582.
22. Tan L., Wang Q., Zhang D. Lymphopenia predicts disease severity of COVID-19: a descriptive and predictive study. Sign. Transduct. Target. Ther. 2020. 5(1). 33.
23. Mina A., van Besien K., Platanias L.C. Hematological manifestations of COVID-19. Leukemia Lymphoma. 2020. DOI: 10.1080/10428194.2020.1788017 [Ref list].
24. Lippi G., Plebani M., Henry B.M. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta-analysis. Clin. Chim. Acta. 2020 Jul. 506. 145-148.
25. Terpos E. et al. Hematological findings and complications of COVID-19 American journal of hematology [Ref list]. 2020.
26. COVID-19 update: COVID-19-associated coagulopathy. Becker RCJ Thromb. Thrombolysis. 2020 Jul. 50(1). 54-67.
27. Cals J.W., Schot M.J., de Jong S.A., Dinant G.J., Hopstaken R.M. Point-of-care C-reactive protein testing and antibiotic prescribing for respiratory tract infections: a randomized controlled trial. Ann. Fam. Med. 2010 Mar-Apr. 8(2). 124-133.
28. Tan T., Khoo B., Mills E.G., Phylactou M., Patel B. Association between high serum total cortisol concentrations and mortality from COVID-19. Lancet Diabetes Endocrinol. 2020 Aug. 8(8). 659-660.
29. Wu M.Y., Yao L., Wang Y., Zhu X.Y., Wang X.F., Tang P.J., Chen C. Clinical evaluation of potential usefulness of serum lactate dehydrogenase (LDH) in 2019 novel coronavirus (COVID-19) pneumonia. Respir. Res. 2020, Jul 6. 21(1). 171.
30. Arentz M., Yim E., Klaff L. Characteristics and outcomes of 21 critically ill patients with COVID-19 in Washington State [published online ahead of print, 2020 Mar 19]. JAMA. 2020. 323(16). 1612-1614.
31. Zhou F., Yu T., Du R. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study [published correction appears in Lancet. 2020, Mar 28. 395(10229). 1038] [published correction appears in Lancet. 2020 Mar 28;395(10229):1038]. Lancet. 2020. 395. 1054-1062. doi: 10.1016/S0140-6736(20)30566-3.
32. Cheng Y., Luo R., Wang K. Kidney disease is associated with in-hospital death of patients with COVID-19 [published online ahead of print, 2020 Mar 20]. Kidney Int. 2020. doi: 10.1016/j.kint.2020.03.005. S0085-2538(20)30255-6.
33. Naicker S., Yang C.W., Hwang S.J., Liu B.C., Chen J.H., Jha V. The Novel Coronavirus 2019 epidemic and kidneys [published online ahead of print, 2020 Mar 7]. Kidney Int. 2020. doi: 10.1016/j.kint.2020.03.001.
34. Li Z., Wu M., Yao J. Caution on kidney dysfunctions of COVID-19 patients. medRxiv. 2020. doi: 10.1101/2020.02.08.20021212 [Cross Ref] [Google Scholar] [Ref list].
35. Su H., Yang M., Wan C., Yi L.X., Tang F., Zhu H.Y. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020 Jul. 98(1). 219-227.
36. Zhang C., Shi L., Wang F.S. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol. Hepatol. 2020. 5. 428-430. doi: 10.1016/S2468-1253(20)30057-1.
37. Beeching N., Fowler R. Coronavirus disease 2019 (COVID-19). BMJ Best Practice. 2020. https://bestpractice.bmj.com/topics/en-gb/3000168/emergingtxs. Published Updated: Apr 2020. Accessed: April 11 2020.
38. Mao L., Wang M.D., Chen S.H. Neurological manifestation of hospitalized patients with COVID-19 in Wuhan, China: a retrospective case series study. medRxiv. 2020. doi: 10.1101/2020.02.22.20026500 [CrossRef] [Google Scholar] [Ref list].
39. Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV-2 may play a role in the respiratory failure of COVID-19 patients [published online ahead of print, 2020 Feb 27]. J. Med. Virol. 2020. doi: 10.1002/jmv.25728 [PMC free article] [PubMed] [CrossRef] [Google Scholar] [Ref list].
40. NHS. Clinical guide for the optimal use of oxygen therapy during the coronavirus pandemic. Specialty guides for patient management during the coronavirus (COVID-19) pandemic. Published2020. Available at: https://www.england.nhs.uk/coronavirus/wp-content/uploads/sites/52/2020/04/C0256-specialty-guide-oxygen-therapy-and-coronavirus-9-april-2020.pdf [Accessed April 13, 2020]. [Ref list].
41. Guérin C., Reignier J., Richard J.C. Prone positioning in severe acute respiratory distress syndrome. N. Engl. J. Med. 2013. 368. 2159-2168. doi: 10.1056/NEJMoa1214103. [PubMed] [CrossRef] [Google Scholar] [Ref list].
42. Halushko O., Loskutov O., Kuchynska I., Synytsyn M., Boliuk M. The main causes of the complicated course of COVID-19 in diabetic patients (review). Georgian Medical News. 2020. № 10(307). 114-120.
43. Rhodes A., Evans L.E., Alhazzani W. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017. 43. 304-377. doi: 10.1007/s00134-017-4683-6 [PubMed] [CrossRef] [Google Scholar] [Ref list].
/34.jpg) Із метою спостереження в динаміці за станом легень, прогресування чи зменшення консолідатів, оцінки ефективності проведення респіраторної підтримки, виявлення ускладнень (пневмоторакс, гідроторакс) у клінічній практиці лікарі дедалі частіше використовують реанімаційний ультразвук (POCUS — Point-Of-Care Ultrasound), частиною якого є різновиди протоколу B.L.U.E., LUS (lung ultrasound score) та інші. Саме через низку технічних причин (недоступність КТ у багатьох лікувальних закладах, обмежений ресурс медичного персоналу для транспортування, відсутність достатньої кількості кисню під час транспортування та в кабінеті КТ, нестабільність пацієнта та переважання шкоди транспортування перед користю отриманої інформації внаслідок втрати ПТКВ, відлучення від неінвазивної вентиляції, високе іонізуюче навантаження, контамінація простору під час логістичного скерування інфікованого пацієнта, надлишкова вага, вагітність тощо) ультразвук ввійшов у протокол динамічного спостереження в поєднанні з клінічним оглядом пацієнтів із COVID-19.
Із метою спостереження в динаміці за станом легень, прогресування чи зменшення консолідатів, оцінки ефективності проведення респіраторної підтримки, виявлення ускладнень (пневмоторакс, гідроторакс) у клінічній практиці лікарі дедалі частіше використовують реанімаційний ультразвук (POCUS — Point-Of-Care Ultrasound), частиною якого є різновиди протоколу B.L.U.E., LUS (lung ultrasound score) та інші. Саме через низку технічних причин (недоступність КТ у багатьох лікувальних закладах, обмежений ресурс медичного персоналу для транспортування, відсутність достатньої кількості кисню під час транспортування та в кабінеті КТ, нестабільність пацієнта та переважання шкоди транспортування перед користю отриманої інформації внаслідок втрати ПТКВ, відлучення від неінвазивної вентиляції, високе іонізуюче навантаження, контамінація простору під час логістичного скерування інфікованого пацієнта, надлишкова вага, вагітність тощо) ультразвук ввійшов у протокол динамічного спостереження в поєднанні з клінічним оглядом пацієнтів із COVID-19.
/31.jpg)
/32.jpg)
/33.jpg)