Журнал «Медицина неотложных состояний» Том 17, №2, 2021
Вернуться к номеру
Вплив додаткової нейропротекції Гліатиліном на перебіг септичного процесу і вираженість енцефалопатії в структурі синдрому поліорганної недостатності
Авторы: Мальцева Л.О.(1), Ліснича В.М.(2), Кобеляцький Ю.Ю.(1), Казімірова Н.А.(2)
(1) — ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
(2) — КП «Дніпропетровська обласна клінічна лікарня ім. І.І. Мечнікова» ДОР, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
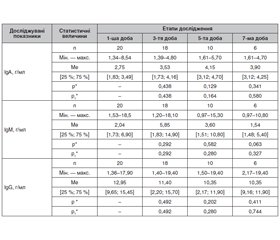
Актуальність. Сепсис, як реакція організму на інфекцію, включає такий етап розвитку, як синдром поліорганної недостатності (СПОН). Мозкова дисфункція в 70 % випадків є одним з перших симптомів сепсис-асоційованого СПОН, ще до клінічних проявів в інших системах життєзабезпечення. Сепсис-асоційована енцефалопатія — мультифокальне порушення функцій головного мозку за умови наявності інфекції, що супроводжується проявами системного запалення, але без клінічних і лабораторних доказів прямої причетності інфекції до пошкодження головного мозку. Залежно від критеріїв, покладених в основу діагностики, церебральна дисфункція-недостатність може бути виявлена в усіх хворих із сепсисом. Ступінь її вираженості корелює зі зростанням тяжкості септичного процесу. Сепсис-асоційована дисфункція-недостатність може бути незалежним предиктором летального кінця. Тяжкість церебральної дисфункції-недостатності коливається від летаргії і/або дезорієнтації до коми. Мета: вивчення впливу терапії відповідно до головних положень «Міжнародного керівництва з інтенсивної терапії сепсису та септичного шоку: 2016» із додатковою нейропротекцією Гліатиліном на перебіг септичного процесу й вираженість енцефалопатії в структурі синдрому поліорганної недостатності. Матеріали та методи. За період 2010–2015 рр. нами проведено контрольоване проспективне рандомізоване когортне дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії ДЗ «Дніпропетровська медична академія МОЗ України» і на базі відділення інтенсивної терапії сепсису КП «Дніпропетровська обласна клінічна лікарня ім. І.І. Мечникова» ДОР». У дослідження було включено 22 пацієнти. У всіх хворих було проведено рутинні лабораторні дослідження для визначення рівня клінічних і біохімічних маркерів системного запалення й органних дисфункцій за шкалами SOFA і LIFE. Для оцінки стану свідомості використовували шкалу коми Глазго. Концентрацію цитокінів (фактор некрозу пухлини α, інтерлейкін-1, інтерлейкін-4, інтерферон α) у сироватці крові вивчали імуноферментним методом. Базисна інтенсивна терапія здійснювалася відповідно до основних положень «Міжнародного керівництва з інтенсивної терапії сепсису та септичного шоку: 2016» з додатковим використанням нейропротекторного препарату Гліатиліну (холіну альфосцерат) 1000–3000 мг на добу внутрішньовенно, розчиненого в 0,9% розчині натрію хлориду, протягом 5–10 днів. Дослідження показників проводилося в чотири етапи: на 1-шу, 3-тю, 5-ту, 7-му добу. Результати. Узагальнюючи результати дослідження, можливо сказати, що на п’яту й сьому добу були відсутні клінічні прояви синдрому системної запальної відповіді в понад 75 % хворих; зменшилася тяжкість стану за APACHE II на 72,5 і 74,5 % (p < 0,001) і ступінь вираженості синдрому поліорганної недостатності за SOFA в 9 разів (p < 0,001) відповідно до етапів дослідження. Церебральна недостатність, оцінена за шкалою коми Глазго, становила 15 балів на п’яту й сьому добу дослідження, що відповідало стану ясної свідомості в понад 75 % хворих. Зазначене спостерігалося на тлі тенденції до збалансованості активності прозапальних і протизапальних ланок цитокінової системи, про що свідчили максимальні значення фактора некрозу пухлини α та інтерферону α на п’яту добу спостереження при зниженні концентрації інтерлейкіну-1 на 55,8 % щодо фону. Прогнозована летальність у пацієнтів другої групи становила 51 %, фактична летальність — 7,5 %. Отже, шляхом проведення даного варіанта інтенсивної терапії вдалося знизити передбачувану летальність на 43,5 %.
Background. Sepsis as the response to an infection includes such a developmental stage as multiple organ dysfunction syndrome. In 70 % of cases, cerebral dysfunction is one of the first symptoms of sepsis-associated multiple organ dysfunction syndrome before clinical manifestations in other life support systems. Sepsis-associated encephalopathy is a multifocal dysfunction of the brain in the presence of an infection, accompanied by manifestations of systemic inflammation, but without clinical and laboratory evidence of a direct involvement of the infection in brain damage. Depending on the criteria on which the diagnosis is based, cerebral dysfunction-insufficiency can be detected in all patients with sepsis. The degree of its severity correlates with an increase in the severity of the septic process. Sepsis-associated dysfunction-failure may be an independent predictor of mortality. The severity of cerebral dysfunction-failure ranges from lethargy and/or disorientation to coma. The purpose was to study the effect of the main provisions of the International Guidelines for Management of Sepsis and Septic Shock: 2016 with additional neuroprotection with Gliatilin on the course of the septic process and the severity of encephalopathy in the structure of multiple organ dysfunction syndrome. Materials and methods. In 2010–2015, we conducted a controlled prospective randomized cohort study at the clinical base of the Department of Anesthesiology and Intensive Care of the State Institution “Dnipropetrovsk Medical Academy of the Ministry of Health of Ukraine” and the Department of Intensive Care of Sepsis at Mechnikov Dnipropetrovsk Regional Clinical Hospital. The study included 22 patients. All of them underwent routine laboratory tests to determine the level of clinical and biochemical markers of systemic inflammation and organ dysfunction according to the Sequential Organ Failure Assessment score and Lausanne Intestinal Failure Estimation. The Glasgow Coma Scale was used to assess the level of consciousness. The concentration of cytokines (tumor necrosis factor α, interleukins 1, 4, interferon α) in the blood serum was studied by the enzyme immunoassay. Basic intensive care was carried out using the main provisions of the International Guidelines for Management of Sepsis and Septic Shock: 2016 with the additional use of the neuroprotective drug Gliatilin (choline alfoscerate) — 1,000–3,000 mg/day, which is dissolved in 0.9% sodium chloride solution, for 5–10 days. The study of indicators was carried out in four stages, on days 1, 3, 5, 7. Results. Summarizing the results of the study, we can say that on the fifth and seventh days, there were no clinical manifestations of the systemic inflammatory response syndrome in more than 75 % of patients; the severity of the condition according to Acute Physiology And Chronic Health Evaluation II system decreased by 72.5 and 74.5 % (p < 0.001) and the severity of the syndrome of multiple organ failure according to Sequential Organ Failure Assessment score decreased 9 times (p < 0.001), according to the stages of the study. Cerebral insufficiency assessed by the Glasgow Coma Scale was 15 points on the fifth and seventh days of the study, which corresponded to the level of clear consciousness in more than 75 % of patients. The above was observed against the background of a trend towards balanced activity of pro-inflammatory and anti-inflammatory links of the cytokine system, as evidenced by the maximum levels of tumor necrosis factor α and interferon α on the fifth day of observation with a decrease in the concentration of interleukin 1 by 55.8 % compared to baseline. The predicted mortality in patients of the second group was 51 %, the actual mortality was 7.5 %. So, carrying out this intensive care helped reduce the estimated mortality by 43.5 %.
сепсис; сепсис-асоційована енцефалопатія; інтерлейкіни; Гліатилін
sepsis; sepsis-associated encephalopathy; interleukins; Gliatilin

/51.jpg)
/52.jpg)
/53.jpg)
/54.jpg)