Вступ
Механічна жовтяниця пухлинного генезу залишається складною клінічною проблемою. П’ятирічна виживаність таких хворих становить менше 5 % [1]. У 80 % хворих захворювання виявляється на пізній стадії, коли радикальне хірургічне лікування неможливе [2]. Паліативна декомпресія жовчних проток на даний час є єдиним методом допомоги таким хворим: зменшення болю, симптомів, що пов’язані із жовтяницею, і в низці випадків проведення хіміотерапії [3]. Декомпресія жовчних проток не тільки покращує якість життя хворих, але і збільшує виживаність [4–6]. Вибір методу декомпресії жовчних проток досі дискутується [7]. Принципово існує два шляхи дренування жовчних проток — антеградний і ретроградний [8]. У хворих з високою (проксимальною або хілярною) непрохідністю жовчних проток застосовуються обидва підходи, але кожен з них має певні переваги і недоліки [9]. Як відомо, черезшкірний черезпечінковий підхід, забезпечуючи декомпресію жовчних шляхів, пов’язаний із втратою жовчі, тоді як ретроградний транспапілярний підхід позбавлений даного недоліку, але асоціюється з підвищеним ризиком холангіту [10]. Зовнішньо-внутрішнє дренування жовчних проток при хілярній обструкції може поєднати переваги обох підходів і бути методом вибору паліативного лікування таких хворих, однак це питання вивчено недостатньо.
Мета роботи: провести порівняльний аналіз частоти холангіту і виживаності при черезшкірній черезпечінковій і зовнішньо-внутрішній супрапапілярній холангіостомії у хворих з проксимальною механічною жовтяницею пухлинного генезу.
Матеріали та методи
У проспективне дослідження ввійшло 50 хворих з проксимальною механічною жовтяницею пухлинного генезу. Хворі, яким була виконана черезшкірна черезпечінкова холангіостомія, увійшли до групи ЧЧХС (n = 24); хворі, яким була виконана черезшкірна черезпечінкова супрапапілярна холангіостомія, увійшли до групи ЗВСХС (n = 26).
Критеріями включення до дослідження були наявність механічної жовтяниці (рівень білірубіну понад 34 мкмоль/л), вік пацієнта будь-якої статі від 18 років, неможливість проведення радикальної операції.
Критеріями невключення до дослідження були механічна перешкода жовчовідведенню без синдрому жовтяниці, вік менше 18 років, високий анестезіологічний ризик — АSА 4 [11], множинні метастатичні ураження печінки, асцит, геморагічний діатез, наявність запальних захворювань легень, сечовивідних шляхів.
Кінцевими точками дослідження були частота холангіту, індекс тривалості холангіту як кількість холангіто-днів на 100 пацієнто-днів у групі, кумулятивна виживаність.
Клінічний діагноз холангіту встановлювали на основі таких критеріїв: температура тіла вище 38,5 °C, кількість лейкоцитів > 10 × 109/л, а частка нейтрофільних гранулоцитів у білих кров’яних клітинах > 70 % [12, 13].
Після надання поінформованої згоди всім пацієнтам виконували холангіостомію під ультразвуковим і рентгенологічним контролем за стандартними методиками [10, 14] з використанням дренажів типу pig-tail (у групі ЧЧХС) і mini-pig (у групі ЗВСХС) –діаметром 9 Fr.
Зразки жовчі для дослідження на наявність бактерій отримували одразу після пункції жовчної протоки, об’ємом 10 мл та направлялися до бактеріологічної лабораторії. Після цього етапу всім хворим проводили антибіотикопрофілактику із застосуванням цефтріаксону 1 г в/в або ампіциліну/сульбактаму 1,5–3 г в/в, аналогічні дози на наступну добу. У разі наявності ознак холангіту, який існував до маніпуляції, антибіотики призначали до усунення ознак запалення (4–5 діб). У випадках післяопераційного холангіту антибіотикотерапія проводилася відповідно до чутливості мікрофлори, що була отримана з вмісту дренажу.
З метою підтримання прохідності дренажу рекомендували хворим самостійно проводити його санацію 20 мл фізіологічного розчину двічі на добу.
Відповідно до даних наших досліджень первинні холангіокарциноми класифікували за H. Bismuth, M.B. Corlette [15] та стадіювали відповідно до класифікації TNM [16].
Статистичну обробку отриманих даних проводили за допомогою статистичного пакета IBM SPSS Statistics 22. Виконували описову (дискриптивну) статистику. Оцінку нормальності розподілу змінних проводили за допомогою тесту Шапіро — Уїлка. Порівняння двох незалежних груп за однією кількісною ознакою проводили з використанням U-критерію Манна — Уїтні, порівняння груп за якісною ознакою проводили з використанням χ2-критерію Пірсона; аналіз зв’язку двох змінних (ознак) здійснювали за допомогою кореляційного аналізу Спірмена. Кореляційний аналіз проводили за Спірменом. Для оцінки виживання застосовували метод Каплана — Майєра, порівняння рівнів факторів проводили за допомогою лог-ранг тесту. Нульову гіпотезу рівності змінних відхиляли при р < 0,05.
Результати дослідження
Хворі обох груп не відрізнялися за середнім віком. Так, у групі ЗВСХС середній вік становив 60,4 ± 1,6 року, у групі ЧЧХС — 63,6 ± 1,7 року, р = 0,258 (рис. 1).
Також групи статистично не відрізнялися за гендерним складом: у групі ЗВСХС співвідношення чоловіків та жінок становило 14/12, у групі ЧЧХС — 11/13, р = 0,571.
Причинами високого блоку жовчовивідних шляхів в обох групах були переважно пухлини Клацкіна та рідше — метастази пухлин органів черевної порожнини (шлунка або кишечника). За причинами високого блоку жовчовивідних шляхів групи були статистично ідентичні, р = 0,887 (табл. 1).
Не було вірогідних відмінностей між групами стосовно розподілу категорій хілярних холангіокарцином за H. Bismuth, M.B. Corlette [15], р = 0,137 (табл. 2).
Групи дослідження також статистично не відрізнялись за критеріями ТNM та стадією онкологічного процесу, р > 0,05 (табл. 3).
Рівень білірубіну до виконання мініінвазивної процедури в групі ЗВСХС становив 196,8 ± 13,4 мкмоль/л (від 77,2 до 333,1 мкмоль/л), у групі ЧЧХС — 184,9 ± ± 15,4 мкмоль/л (від 69,3 до 383,4 мкмоль/л), р = 0,269 (рис. 2).
Тривалість жовтяниці у хворих групи ЗВСХС становила в середньому 16,8 ± 0,5 доби (від 14 до 24 діб), у хворих групи ЧЧХС — 17,7 ± 0,7 доби (від 9 до 23 діб), р = 0,269.
В обох групах при оперативному втручанні надавали перевагу правобічному доступу. У групі ЗВСХС правосторонній доступ здійснили у 17 (65,4 %), лівосторонній — у 9 (34,6 %) хворих; у групі ЧЧХС — відповідно у 15 (62,5 %) і 9 (37,5 %), р = 0,832.
Загальна середня кількість пункцій печінки, проведених для катетеризації біліарного дерева, у групі ЗВСХС становила 1,04 ± 0,19 спроби (діапазон: 1–2 спроби). У групі ЗВСХС і ЧЧХС дві спроби потребували лише по одному хворому — 3,9 та 4,2 % відповідно, р = 0,954.
У всіх хворих вдалося дренувати більше 50 % печінки. За розподілом відсотка дренованої печінки групи статистично не відрізнялися, р = 0,540 (табл. 4).
Технічний успіх мініінвазивних процедур, який визначався у разі розміщення дренажної трубки у біліарних протоках, в обох групах становив 100 %.
Загальний клінічний успіх, що визначався як зниження рівня загального білірубіну після процедури понад 50 %, протягом двох тижнів [17] становив 94,0 %: у групі ЗВСХС — 96,2 %, у групі ЧЧХС — 91,7 %, р = 0,504.
Суттєвих ускладнень у разі виконання ендобіліарних втручань не спостерігали. Мали місце три випадки незначної кровотечі з дренажу (6,0 %) без клінічних наслідків (два в групі ЗВСХС — 7,7 %, один у групі ЧЧХС — 4,2 %), транслокація дренажу виникла в одного хворого (4,2 %) групи ЧЧХС через 5 діб після встановлення.
Бактеріобілія у вигляді монокультури до холангіостомії виявлена у 12 хворих: у 6 (23,1 %) групи ЗВСХС та 6 (25,0 %) — групи ЧЧХС, р = 0,874. У тому числі з наявністю холангіту у 6 хворих: 2 (7,7 %) з групи ЗВСХС і 4 (16,7 %) з групи ЧЧХС, р = 0,329. У 6 хворих висівалися E.сoli, у 4 — Klebsiella spp., у 2 — Enterococcus spp. Усі бактерії були чутливі до антибіотиків. Наявні бактеріобілія і ознаки холангіту були усунені протягом 4–5 діб після дренування.
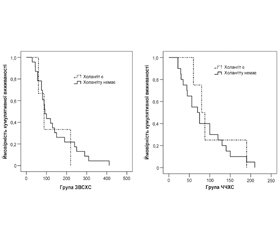
Холангіт протягом усього періоду спостереження за хворими виник у 7 (14,0 %). Не було вірогідної різниці у частоті холангіту між групами дослідження: 3 (11,5 %) хворих у групі ЗВСХС і 4 (16,7 %) хворих у групі ЧЧХС, р = 0,602. Водночас, враховуючи цензуровані дані (померлих хворих протягом цього періоду), різниця в кумулятивній частоті холангіту протягом терміну спостереження була більш суттєвою (у групі ЗВСХС — 25,6 %, у групі ЧЧХС — 49,1 %), але невірогідно, р = 0,142 (рис. 3).
Середній термін виникнення холангіту від початку мініінвазивної процедури був коротшим у групі ЧЧХС, ніж у групі ЗВСХС: 68,8 ± 14,7 доби проти 90,7 ± 42,0 доби, але невірогідно, р = 0,601.
Склад мікрофлори в зразках жовчі у разі холангіту був подібний в обох групах, р = 0,646 (табл. 5).
Усі виділені мікроби були чутливі до цефтріаксону. Регулярна санація дренажу поряд із призначенням цефтріаксону дозволила усунути клінічні прояви холангіту і досягти стерильності жовчі протягом 5–6 діб в обох групах. Водночас за індексом тривалості холангіту групи вірогідно відрізнялися: у групі ЗВСХС цей показник становив 0,46 холангіто-дня на 100 пацієнто-днів, у групі ЧЧХС — 1,4 холангіто-дня на 100 пацієнто-днів, р = 0,001.
Аналіз виживаності в групах показав більшу кумулятивну виживаність у хворих групи ЗВСХС порівняно з групою ЧЧХС. Так, медіана виживаності в групі ЗВСХС становила 90 діб (95% довірчий інтервал (ДІ) 70,0–109,9 доби), у групі ЧЧХС — 75 діб (95% ДІ 51,1–98,9 доби), р = 0,033 (рис. 4).
Кореляційний аналіз не виявив суттєвого зв’язку між наявністю холангіту і тривалості життя як у групі ЗВСХС (r = 0,047, р = 0,820), так і ЧЧХС (r = 0,134, р = 0,533). Також не було суттєвої різниці у кумулятивній частоті виживаності у хворих з епізодами холангіту і без такого в даних групах (рис. 5).
Медіана виживаності у хворих з епізодами холангіту в групі ЗВСХС становила 88 діб (95% ДІ 43,2–132,8 доби), без епізодів холангіту — 92 доби (95% ДІ 73,2–110,8 доби), р = 0,679. У хворих групи ЧЧХС медіана виживаності у разі холангіту становила 80 діб (95% ДІ 52,6–107,4 доби), без епізодів холангіту — 70 діб (95% ДІ 42,2–97,7 доби), р = 0,639.
Обговорення
Холангіокарцинома, що є основною причиною механічної хілярної жовтяниці, зустрічається в европейських країнах з частотою 0,5–2 людини на 100 000 населення на рік [18]. У Південно-Східній Азії частота вища — 60 на 100 000 на рік [19]. На холангіокарциному припадає лише 3 % злоякісних захворювань шлунково-кишкового тракту [20].
У 80 % хворих захворювання виявляється на пізній стадії, коли радикальне хірургічне лікування неможливе. Паліативна декомпресія жовчних проток на даний час є єдиним методом допомоги хворому: зменшення болю, симптомів, що пов’язані із жовтяницею, і в низці випадків проведення хіміотерапії [5, 10, 14]. Паліативні заходи не тільки подовжують тривалість життя, але й покращують його якість, а отже, збільшують комплаєнс таких процедур [21]. Протягом багатьох років варіанти лікування передбачають або ендоскопічне ретроградне стентування, або черезшкірну черезпечінкову холангіостомію [22, 23].
Існуючи методи паліативної декомпресії жовчних проток мають свої переваги та недоліки. Вважається, що холангіт є предиктором зменшення тривалості виживаності [13]. Найважливішими перевагами ЧЧХС є нижчий, ніж у разі ендоскопічного ретроградного біліарного стентування (ЕРБСт), рівень холангіту та можливість контролю дренажу [10, 14]. Нещодавнє дослідження показало, що ЕРБСт не має переваг щодо виживаності порівняно з ЧЧХС у пацієнтів із поширеною холангіокарциномою і злоякісною жовчною обструкцією [24]. Інші дослідження показали значне збільшення запальних маркерів у пацієнтів з ЕРБСт порівняно з пацієнтами з ЧЧХС [25].
Дослідження, що порівнюють ЧЧХС з ендоскопічним стентуванням у пацієнтів з пухлинами Клацкіна, також свідчать про більш високі показники технічного та клінічного успіху ЧЧХС у популяції з проксимальними перешкодами [26, 27].
До недоліків ЧЧХС, яких позбавлена ЕРБСт, можна віднести втрату жовчі. Відомо, що жовч і жовчні кислоти виконують важливі функції підтримки нормальної роботи та цілісності кишечника, а також функції кишкового бар’єру. Це позитивно впливає на імунну функцію кишечника. Жовчні кислоти пригнічують ріст деяких бактерій, таких як бактероїди, клостридії, лактобактерії та стрептококи [28]. Відсутність солей жовчі призводить до порушення балансу кишкових бактерій із переважанням грамнегативних, підвищує проникність кишечника, що спричиняє транслокацію бактерій та ендотоксинів і призводить до септичних та ниркових ускладнень [29]. Відсутність жовчі спричиняє пригнічення очищаючої здатності клітин Купфера — основної популяції макрофагів гепатоцитів через накопичення жовчних кислот у печінці, сприяючи тим самим поширенню ендотоксинів з портальної циркуляції в системний кровотік із вивільненням прозапальних цитокінів [30, 31].
Теоретично застосування ЗВСХС поєднує в собі переваги ЧЧХС і ЕРБСт. Але є роботи, які вказують, що смертність пацієнтів, яким встановлено зовнішньо-внутрішній дренаж, значно перевищує таку при ЧЧХС або ЕРБСт [32, 33], та на високу частоту холангіту — до 47,6 % [34]. Але ці дослідження не диференціюють характер зовнішньо-внутрішного дренажу. Водночас вони можуть бути принаймні двох типів: ті, що контактують з вмістом дванадцятипалої кишки, тобто проходять через фатерів сосок, і ті, що не контактують з ним і розташовуються субпапілярно. Це дуже важливий факт, адже серед шляхів інфекції дренажу: антеградного (ззовні), ретроградного (з кишкової флори) і гематогенного — найважливішим є ретроградний, і за умови ЗВСХС даний шлях інфікування виключається. Треба зазначити, що в літературі не наводяться дані щодо частоти холангіту при паліативному лікуванні хілярного блоку за допомогою саме ЗВСХС.
У нашому дослідженні ми встановили, що у разі ЗВСХС частота холангіту низька і не відрізняється від такої у разі застосування ЧЧХС — відповідно 3 (11,5 %) і 4 (16,7 %) хворих, р = 0,602. Водночас, враховуючи цензуровані дані (померлих хворих протягом цього періоду), різниця в кумулятивній частоті холангіту протягом терміну спостереження була більш суттєвою (у групі ЗВСХС — 25,6 %, у групі ЧЧХС— 49,1 %), але невірогідно, р = 0,142.
Склад мікрофлори в зразках жовчі у разі холангіту був подібний в обох групах. Як і інші автори (у разі ЧЧХС), висівали Escherichia coli, Enterobacter spp., Klebsiella spp., чутливі до антибіотиків [35].
Середній термін виникнення холангіту від початку мініінвазивної процедури був коротшим у групі ЧЧХС, ніж у групі ЗВСХС: 68,8 ± 14,7 доби проти 90,7 ± 42,0 доби, але невірогідно, р = 0,601. Водночас за індексом тривалості холангіту групи вірогідно відрізнялися: у групі ЗВСХС цей показник був меншим і становив 0,46 холангіто-дня на 100 пацієнто-днів проти 1,4 холангіто-дня на 100 пацієнто-днів у групі ЧЧХС, р = 0,001. Можливо, останній факт можна пояснити більшою кумулятивною виживаністю у хворих групи ЗВСХС порівняно з групою ЧЧХС. Так, медіана виживаності в групі ЗВСХС становила 90 діб (95% ДІ 70,0–109,9 доби), у групі ЧЧХС — 75 діб (95% ДІ 51,1–98,9 доби), р = 0,033.
В свою чергу, більша тривалість життя, можливо, пов’язана з відсутністю втрати жовчі у разі застосування ЗВСХС.
Висновки
Наші дослідження показують, що ЗВСХС має бути пріоритетним відносно ЧЧХС у разі паліативного лікування хілярної механічної жовтяниці пухлинного генезу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про внесок кожного автора: Сусак Я.М. — концепція та дизайн дослідження; Палиця Р.Я. — збір та обробка матеріалу, написання тексту; Маркулан Л.Ю. — аналіз отриманих матеріалів, статистична обробка; Максименко М.В. — збір матеріалу, оформлення статті.
Отримано/Received 14.01.2021
Рецензовано/Revised 25.01.2021
Прийнято до друку/Accepted 03.02.2021
Список литературы
1. Moole H., Bechtold M.L., Forcione D., Puli S.R. A meta-analysis and systematic review: success of endoscopic ultrasound guided biliarystenting in patients with inoperable malignant biliary strictures and a failed ERCP. Medicine. 2017. 96. e5154. PMID: 28099327.
2. Jarnagin W.R., Fong Y., DeMatteo R.P. et al. Staging, resectability, and outcome in 225 patients with hilar cholangiocarcinoma. Ann. Surg. 2001. 234(4). 507-517. doi: 10.1097/00000658-200110000-00010.
3. Parsi M.A. Common controversies in management of biliary strictures. World J. Gastroenterol. 2017. 23(7). 1119-1124. doi: 10.3748/wjg.v23.i7.1119.
4. Covey A.M., Brown K.T. Percutaneous transhepatic biliary drainage. Tech. Vasc. Interv. Radiol. 2008. 11(1). 14-20. doi: 10.1053/j.tvir.2008.05.003.
5. Vandenabeele L.A.M., Dhondt E., Geboes K.P., Defreyne L. Percutaneous stenting in malignant biliary obstruction caused by metastatic disease: clinical outcome and prediction of survival according to tumor type and further therapeutic options. Acta Gastroenterol. Belg. 2017. 80(2). 249-255. PMID: 29560690.
6. Sellier F., Bories E., Sibertin-Blanc C. et al. Clinical outcome after biliary drainage for metastatic colorectal cancer: survival analysis and prognostic factors. Dig. Liver Dis. 2017. 50(2). 189-194. DOI: 10.1016/j.dld.2017.09.121.
7. Fong Z.V., Brownlee S.A., Qadan M., Tanabe K.K. The Clinical Management of Cholangiocarcinoma in the United States and Europe: A Comprehensive and Evidence-Based Comparison of Guidelines. Ann. Surg. Oncol. 2021 Mar 1. doi: 10.1245/s10434-021-09671-y.
8. Soares K.C., Kamel I., Cosgrove D.P. et al. Hilar cholangiocarcinoma: diagnosis, treatment options, and management. Hepatobil. Surg. Nutr. 2014. 3. 18-34. PMID: 24696835.
9. Tian X., Zhang Z., Li W. Internal drainage versus external drainage in palliation of malignant biliary obstruction: a meta-analysis and systematic review. Arch. Med. Sci. 2020. 16(4). 752-763. doi: 10.5114/aoms.2020.94160.
10. Riaz A., Pinkard J.P., Salem R., Lewandowski R.J. Percutaneous management of malignant biliary disease. J. Surg. Oncol. 2019. 120(1). 45-56. doi: 10.1002/jso.25471.
11. Mayhew D., Mendonca V., Murthy B.V.S. A review of ASA physical status — historical perspectives and modern developments. Anaesthesia. 2019. 74. 373-9. PMID: 30648259.
12. Telford J.J., Carr-Locke D.L., Baron T.H., Poneros J.M., Bounds B.C., Kelsey P.B. et al. A randomized trial comparing uncovered and partially covered self-expandable metal stents in the palliation of distal malignant biliary obstruction. Gastrointest. Endosc. 2010. 72. 907-14. PMID: 21034891.
13. Yu H., Yuanyuan S., Guo Z., Xing W., Si T., Guo X., Liu F. Multifactorial analysis of biliary infection after percutaneous transhepatic biliary drainage treatment of malignant biliary obstruction. J. Cancer Res. Ther. 2018. 14(7). 1503-1508. doi: 10.4103/jcrt.JCRT_256_18.
14. Chandrashekhara S.H., Gamanagatti S., Singh A., Bhatnagar S. Current Status of Percutaneous Transhepatic Biliary Drainage in Palliation of Malignant Obstructive Jaundice: A Review Indian J. Palliat. Care. 2016. 22(4). 378-387. DOI: 10.4103/0973-1075.191746.
15. Liver Cancer Study Group of Japan. General rules for the clinical and pathological study of primary liver cancer, 2nd English edition. Tokyo, Japan: Kanehara, 2003.
16. Nishio H., Nagino M., Oda K., Ebata T., Arai T., Nimura Y. TNM classification for perihilar cholangiocarcinoma: comparison between 5th and 6th editions of the AJCC/UICC staging system. Langenbecks Arch. Surg. 2005. 390(4). 319-27. doi: 10.1007/s00423-005-0561-8.
17. Lesmana C.R., Gani R.A., Lesmana L.A. Non-alcoholic fatty pancreas disease, pancreatic cancer, and impact of endoscopic ultrasound examination on screening and surveillance. EMJ Gastroenterol. 2017. 6(1). 69-74. doi: 10.1002/jgh3.12032.
18. Bridgewater J.A., Goodman K.A., Kalyan A., Mulcahy M.F. Biliary Tract Cancer: Epidemiology, Radiotherapy, and Molecular Profiling. American Society of Clinical Oncology Educational Book. 2016. 35(36). e194-203. doi: 10.1200/EDBK_160831.
19. Bosman Frank T. “Chapter Chapter 5.6: Liver cancer”. World Cancer Report the International Agency for Research on Cancer, World Health Organization. Chapter 5.6. 2014. ISBN 978-92-832-0443-5.
20. De Jong M.C., Marques H., Clary B.M. et al. The impact of portal vein resection on outcomes for hilar cholangiocarcinoma: a multi-institutional analysis of 305 cases. Cancer. 2012. 118. 4737-47. Available at: https://onlinelibrary.wiley.com/doi/epdf/ 10.1002/cncr.27492.
21. Covey A.M., Brown K.T. Percutaneous transhepatic biliary drainage. Tech. Vasc. Interv. Radiol. 2008. 11(1). 14-20. doi: 10.1053/j.tvir.2008.05.003.
22. Lorenz J.M. Management of Malignant Biliary Obstruction. Semin. Intervent. Radiol. 2016. 33(4). 259-267. doi: 10.1055/s-0036-1592330.
23. Boulay B.R., Birg A. Malignant biliary obstruction: From palliation to treatment. World J. Gastrointest. Oncol. 2016. 8. 498-508.
24. Kurniawan J., Hasan I., Gani R.A. et al. Mortality-related factors in patients with malignant obstructive jaundice. Acta Med. Indones. 2016. 48(4). 282-8. PMID: 28143989.
25. Sabarudin A., Gani R.A., Abdullah M., Rumende C.M. Changes in tumor necrosis factor alpha and interleukin 6 levels in patients with obstructive jaundice due to pancreatobiliary cancer who underwent biliary drainage. Indones J. Gastroenterol. Hepatol. Dig. Endosc. 2016. 17(2). 93-8.
26. Walter T., Ho C.S., Horgan A.M. et al. Endoscopic or percutaneous biliary drainage for Klatskin tumors? J. Vasc. Interv. Radiol. 2013. 24(1). 113-121. PMID: 23182938.
27. Guidi M.A., Curvale C., Viscardi J. et al. Hilar bile duct tumors: endoscopic or percutaneous drainage? A prospective analysis. Rev. Esp. Enferm. Dig. 2015. 107. 488-494. doi: 10.17235/reed.2015.3704/2015.
28. Guibaud I., Bret P.M., Reinhold C., Atri M., Barkun A.N. Bile duct obstruction and choledocholithiasis: diagnosis with MR cholangiography. Radiology. 1995. 197. 109-115. doi: 10.1148/radiology.197.1.7568807.
29. Vagholkar K. Obstructive jaundice: understanding the pathophysiology. International Journal of Surgery and Medicine. 2020. 6(4). 26-31.
30. Sano T., Ajiki T., Takeyama Y., Kuroda Y. Internal biliary drainage improves decreased number of gut mucosal T lymphocyte and MAdCAM-1 expression in jaundiced rats. Surgery. 2004. 136. 693-699.
31. Assimakopoulos S.F., Scopa C.D., Vagianos C.E. Pathophysilogy of increased intestinal permeability in obstructive jaundice. World J. Gastroenterol. 2007. 13. 6458-6464.
32. Ho C.S., Warkentin A.E. Evidence-based decompression in malignant biliary obstruction. Korean J. Radiol. 2012. 13(Suppl. 1). S56-S61. doi: 10.3348/kjr.2012.13.S1.S56.
33. Manwong M., Songserm N., Promthet S. et al. Risk factors for cholangiocarcinoma in the lower part of Northeast Thailand: a hospital-based caseocontrol study. Asian Pac. J. Prev. 2013. 14. 5953-6. DOI: 10.7314/apjcp.2013.14.10.5953.
34. Xu C., Lv P.H., Huang X.E., Sun L., Wang S.X., Wang F.A. Internal-external percutaneous transhepatic biliary drainage for patients with malignant obstructive jaundice. Asian Pac. J. Cancer Prev. 2014. 15(21). 9391-4. doi: 10.7314/apjcp.2014.15.21.9391.
35. Barkay O., Khashab M., Al-Haddad M., Fogel E.L. Minimizing complications in pancreaticobiliary endoscopy. Current Gastroenterology Reports. 2009. 11(2). 134-141. doi: 10.1007/s11894-009-0021-7.

/96.jpg)
/96_2.jpg)
/97.jpg)
/97_2.jpg)
/98.jpg)
/98_2.jpg)
/99.jpg)