Вступ
Співіснування ревматичних і неопластичних процесів широко дискутується. Між ревматичними захворюваннями і раком існують складні двонаправлені відношення. Певні ревматичні захворювання, зокрема дерматоміозит, поліміозит, ревматоїдний артрит, системний червоний вовчак (СЧВ), синдром Шегрена і системний склероз, з одного боку, пов’язані з підвищеним ризиком виникнення злоякісних новоутворень на тлі перебігу захворювання, шляхом імунологічної стимуляції сприяючи канцерогенезу, а з іншого — можуть маніфестувати внаслідок автоімунних реакцій, обумовлених первинним онкологічним захворюванням [1]. Останнє називають паранеопластичним синдромом (ПНС). Паранеопластичний синдром — це клінічні прояви дистантного ефекту пухлини, що виникають в результаті біохімічних, гормональних або імунологічних порушень, індукованих пухлиною.
Крім того, відзначено, що протиревматичні препарати, які модифікують перебіг хвороби, також можуть збільшити ризик злоякісних новоутворень. Зокрема, повідомляється про підвищені ризики злоякісних новоутворень, найчастіше лімфом та раку січового міхура, на тлі лікування циклофосфамідом, лімфом — на тлі лікування метотрексатом і раку шкіри, особливо немеланомного, на тлі лікування інгібіторами фактора некрозу пухлини та метотрексатом [2–4].
У даній роботі наведені огляд літератури, присвяченої взаємозв’язку між автоімунними захворюваннями, більшою мірою СЧВ, і злоякісними новоутвореннями, та клінічне спостереження, в якому маніфестація люпус-нефриту збігалася з виявленням папілярної карциноми щитоподібної залози.
Клінічний випадок
Пацієнтка, 25 років, звернулася зі скаргами на виражені набряки ніг, збільшення живота, задишку, загальну слабкість, дифузну алопецію, підвищення температури до субфебрильних цифр.
Анамнез захворювання. Вважає себе хворою протягом року, коли зазначалися періодичні підвищення температури до 37,1–37,3 °С, болі в дрібних суглобах кистей, слабкість. До лікарів не зверталася, не обстежувалася. Протягом останнього місяця відзначались погіршення, збільшилась загальна слабкість, з’явились виражені набряки гомілок і стоп.
Об’єктивне дослідження. Загальний стан середньої тяжкості, пацієнтка нормостенічної статури (ІМТ 23 кг/м2), шкірні покриви та видимі слизові бліді, периферичні лімфатичні вузли і щитоподібна залоза не збільшені. Над легенями перкуторний звук ясний легеневий, нижче X ребра по лопатковій лінії — притуплений, дихання зліва і справа нижче кута лопатки ослаблене, на решті легень — везикулярне, межі відносної серцевої тупості не розширені, діяльність серця ритмічна, тони приглушені, шумів немає. Артеріальний тиск d = s 150/90 мм рт.ст. Пульс 88 ударів за хвилину, задовільних властивостей, ритмічний. Язик вологий, обкладений біло-жовтим нальотом. Живіт збільшений в об’ємі, ймовірно, за рахунок асциту, при пальпації м’який, безболісний. Кишечник для пальпації не доступний. Печінка перкуторно біля краю реберної дуги, селезінка не пальпується. Виражені набряки стоп, гомілок до колінних суглобів. Суглоби зовні не змінені, рух у них у повному обсязі, безболісні.
Пацієнтка дообстежена (дані лабораторних дообстежень наведені в табл. 1, 2). Привертала увагу увагу наявність лейкопенії (лейкоцити 3,23 × 109/л), збільшеної швидкості осідання еритроцитів (ШОЕ) — до 30 мм/год, гіпопротеїнемії (загальний білок — 26 г/л), гіперхолестеринемії, в загальному аналізі сечі й аналізі сечі на добовий білок — масивна протеїнурія (добова протеїнурія — 20 г/л, разова порція сечі — білок 4,58 г/л). Пацієнтці рекомендовано інструментальне та імунологічне дообстеження. При імунологічному дослідженні: ANA 1 : 1280, anti-dsDNA IgG > 300 ОД/мл (норма < 10 Од/мл), Anti-Sm 25 ОД/мл (норма < 10 Од/мл), anti-RNP «+», C3-компонент комплементу 0,21 г/л (норма 0,90–1,80 г/л), C4-компонент комплементу 0,06 г/л (норма 0,1–0,4 г/л), тиреотропний гормон (ТТГ) 4,4 мкМЕ/мл (0,27–4,2 мкМЕ/мл), антитіла до тиреопероксидази 87,6 МО/мл (0,00–34,00 МО/мл).
/37.jpg)
На ехокардіографічному дослідженні серця (ЕхоКГ) — ексудативний перикардит (сепарація листків перикарда до 10 мм), на рентгенографії органів грудної клітки — двосторонній гідроторакс (нижня межа легень на рівні 10-го ребра), при проведенні ультразвукового дослідження (УЗД) органів черевної порожнини — ознаки асциту, на УЗД щитоподібної залози — гіпоехогенний вузол з нечіткими контурами 16 × 9 × 12 мм, ехогенними включеннями і кальцинатами (TI-RADS 4C). Тонкоголкова аспіраційна пункційна біопсія щитоподібної залози — папілярна карцинома щитоподібної залози.
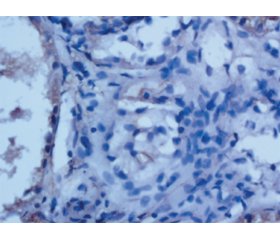
Проведена нефробіопсія. В біоптаті нирки до 21 клубочка, ознаки набряку, нерівномірна фокально-сегментарна, переважно слабо виражена проліферація мезангіальних клітин, в окремих петлях сегментарна проліферація ендотеліальних клітин; в просторі окремих капілярних петель, в стінках петель — моноцити, поодинокі поліморфноядерні лейкоцити, що зустрічаються в окремих клубочках клітини з ознаками апоптозу (рис. 1). Нерівномірне збільшення мезангіального матриксу; частина капілярних петель з ознаками вираженого набряку, окремі — лізовані, в частки — нерівномірне потовщення, переважно за рахунок набряку, дисмукоїдозу, в окремих петлях — фібриноїдний некроз (рис. 1), в частки капілярних петель — склероз; у багатьох клубочках — точкові, лінійні зрощення периферійних капілярних петель з капсулою Боумена (рис. 2). В просторі капсули Боумена багатьох клубочків — фібрин, білкові маси; нерівномірно виражене потовщення базальної мембрани капсули Боумена, в окремих клубочках — вогнищевий розрив базальної мембрани капсули Боумена (рис. 3). В канальцях різко виражені дегенеративні зміни (у вигляді зернистої, вакуольної/балонної дистрофії), некроз груп клітин епітелію, ділянки субатрофії та атрофії епітелію (до 15 % від об’єму біоптату), вогнищеві розриви базальної мембрани канальців (рис. 3); у просторі канальців — злущені клітини, білкові маси, в окремих канальцях — гіалінові циліндри; частка канальців — із різко звуженим простором/без простору за рахунок виражених дегенеративних змін; в стромі набряк, ділянки інтерстиціального фіброзу (до 15 % від об’єму біоптату; вогнищеві дрібні лімфогістіоцитарні клітинні інфільтрати) (рис. 4).
/39.jpg)
В судинах дрібного калібру — фібриноїдні зміни, в окремих — фібриноїдний некроз, в одній із судин з фібриноїдним некрозом — нерівномірно виражена проліферація клітин ендотелію, периваскулярно — щільний лімфогістіоплазмоцитарний клітинний інфільтрат, периваскулярний склероз, в судинах середнього калібру — ознаки спазму, дисмукоїдоз, периваскулярно — нерівномірно виражений склероз (рис. 5).
Імуногістохімічне дослідження: в клубочках фокально-сегментарні гранулярні депозити IgA, IgG, IgМ, С3 в мезангіумі, вздовж ендотелію, частини капілярів від + до ++; у стромі проміж канальцями, в перитубулярних капілярах депозитів — до ++; в епітелії канальців депозити IgA, IgG, С3 у вигляді зернистості від ++ до +++ (рис. 6). В судині з ознаками васкуліту депозити IgG (рис. 7). С1q: негативна експресія. СD20: поодинокі позитивні В-лімфоцити.
/40.jpg)
Патоморфологічний діагноз: з огляду на патоморфологічні, гістохімічні, імуногістохімічні, клініко-лабораторні дані ураження нирок має вторинний характер — може відповідати вовчаковому гломерулонефриту, фокальний морфологічний клас III — A/С (active/chronic) lesions, ISN/RPS (2003) з проявами лікувального патоморфозу (біопсія проведена після призначеного лікування) з вираженим тубулярним слабо вираженим інтерстиціальним компонентом, ознаками васкуліту, поодинокими позитивними В-лімфоцитами. Ступень хронізації (Sethi et al., 2017) — СG 2 (mild chronic change, total renal chronic score — TRCS 3): гломерулосклероз (GS) — 0, інтерстиціальний фіброз (ІФ) — 1, тубулярна атрофія (TA) — 1, артеріолосклероз (CV) — 1.
Ми зіткнулися з дилемою діагностики: чи це первинний СЧВ і розвиток на його тлі раку щитоподібної залози або паранеопластичний синдром на тлі папілярної карциноми щитоподібної залози. Згідно з оновленими критеріями ACR/EULAR 2019 діагноз СЧВ у пацієнтки є вірогідним [5]. Дотриманий вхідний критерій — позитивні ANA у високому титрі, лейкопенія — 3 бали, нерубцева алопеція — 2 бали, плевральний або перикардіальний випіт — 5 балів, клас III або IV вовчакового нефриту при нефробіопсії — 10 балів, низький С3 та низький С4 — 4 бали, антитіла анти-dsDNA та анти-Smith — 6 балів. Сумарно 30 балів. Для встановлення діагнозу необхідно більше 10 балів. Однак це не виключало виникнення паранеопластичного синдрому у вигляді СЧВ.
Для вирішення питання щодо тактики ведення пацієнтки був проведений мультидисциплінарний консиліум у складі ревматолога, онколога, ендокринолога і патогістолога. Зроблені висновки: з огляду на незаперечні дані нефробіопсії, дані імунологічного дослідження, вірогідний анамнез СЧВ протягом останнього року основний діагноз у пацієнтки — системний червоний вовчак, хронічний перебіг, тяжке загострення (SELENA/SLEDAI 18 балів), з ураженням нирок (хронічна хвороба нирок I стадії, швидкість клубочкової фільтрації 127 мл/хв, вовчаковий гломерулонефрит III фокального класу — A/с (active/chronic) lesions, ISN/RPS (2003), нефротичний синдром, вторинна артеріальна гіпертензія 1-го ступеня), придатків шкіри (дифузна алопеція), пансерозит (асцит, плеврит, перикардит), з гематологічним (лейкопенія) та імунологічним (анти-dsDNA, анти-Smith, ANA-позитивні, гіпокомплементемія) синдромами. Супутній — папілярна карцинома щитоподібної залози, гіпотиреоз.
Прийнято рішення ініціювати патогенетичне лікування СЧВ, а після терапії індукції ремісії провести тиреоїдектомію. Пацієнтці була проведена пульс-терапія метилпреднізолоном 1 г протягом трьох послідовних днів з подальшим призначенням преднізолону 60 мг протягом 4 тижнів з поступовим зниженням дози, терапія циклофосфаном — по 500 мг кожні 2 тижні (6 введень). Крім того, призначені гідроксихлорохін 200 мг, сечогінні препарати, інгібітори ангіотензинперетворюючого ферменту, препарати альбуміну в перший місяць терапії, препарати кальцію і вітаміну D, бісфосфонати з огляду на високі кумулятивні дози преднізолону. Як протективна терапія на тлі циклофосфану вводилась месна і призначений сульфаметоксазол/триметоприм. На тлі проведеної терапії відзначалась значна позитивна динаміка через три місяці (табл. 1, 2): нормалізувалися цифри ШОЕ, рівень лейкоцитів, збільшився рівень загального білка, зменшився рівень білка в сечі за даними добової протеїнурії в два рази, відзначалось значне зменшення набрякового синдрому — пастозність гомілок і стоп, за даними інструментальних досліджень, перикардиту, плевриту, асциту немає. Через 3 місяці терапії доза преднізолону становила 20 мг, розпочата терапія мікофенолату мофетилом у дозі 1,5 г. Через 5 місяців доза преднізолону становила 10 мг, проведена тиреоїдектомія. На контрольному огляді через 8 місяців після початку терапії пацієнтка приймає 7,5 мг преднізолону, 1,5 г мікофенолату, в аналізах крові і сечі патологій не виявлено, скарг немає.
Обговорення
Системні ревматичні захворювання пов’язані з підвищеним ризиком розвитку злоякісних новоутворень. Цей підвищений ризик є результатом впливу основних імунологічних ефектів при розвитку автоімунних процесів. Прискорене зростання ракових клітин у мишей з імунодефіцитом і підвищений ризик раку в пацієнтів із тяжкою імуносупресією підкреслюють важливість імунної системи як потужного бар’єра проти новоутворень [6]. Можна було очікувати, що імуносупресивне лікування неминуче призведе до ефектів, що сприяють зростанню злоякісних клітин. Проте нові дані підтверджують уявлення, яке було вперше сформульовано Рудольфом Вірховим в 1863 році та яке здається парадоксальним, що саме хронічне персистуюче запалення є критичним компонентом ініціації та прогресування раку і що зменшення системного запалення може знизити ризик раку в цих випадках [7].
Оцінка ризику раку при ревматичних захворюваннях має зіставлятися з ризиком розвитку раку протягом усього життя, який становить приблизно 20 % в Західній Європі і Північній Америці, при цьому 5 % населення в цілому мають рак сьогодні або в анамнезі [8]. У кожної 10-ї жінки розвинеться рак грудей, у кожного 8-го чоловіка — рак простати, у 1 з 25 осіб — колоректальний рак, у 1 з 40 — рак легенів і приблизно у 1 з 100 — лімфома або інше лімфопроліферативне злоякісне новоутворення. Деяке підвищення і зниження ризику різних видів раку при тих або інших ревматичних захворюваннях може призвести до нейтрального ефекту для злоякісних новоутворень в цілому, що підкреслює, чому з клінічної точки зору важливо ідентифікувати ризики, пов’язані з конкретним видом раку, які можуть бути незвичайними.
Ризик розвитку злоякісного новоутворення у пацієнтів із СЧВ є важливою проблемою. Зв’язок між автоімунним захворюванням і раком вивчається більше десяти років. Можливі зазвичай передбачувані шляхи, що зв’язують СЧВ і підвищений ризик раку, включають порушення роботи імунної системи в напрямку виявлення та знищення пухлини на ранній стадії внаслідок порушення імунного нагляду і прийому імунодепресантів [9]. Попередні звіти показують, що ризик раку має оборотний зв’язок із віком у пацієнтів з СЧВ, що відрізняється від загальної популяції.
У пацієнтів із СЧВ підвищується ризик принаймні деяких злоякісних новоутворень. Велике міжнародне дослідження, проведене в 30 центрах, що включало 16 409 пацієнтів, які спостерігаються протягом 121 283 (в середньому 7,4) пацієнто-років, повідомило про 644 ракові захворювання [10]. В цілому невелике підвищення ризику було виявлено для всіх видів раку (відношення ризиків (ВР) 1,14; 95% довірчий інтервал (ДІ) 1,05–1,23). Ризик гематологічних злоякісних новоутворень був значно підвищений (ВР 3,02; 95% ДІ 2,48–3,63), особливо неходжкінської лімфоми (ВР 4,39; 95% ДІ 3,46–5,49) і лейкемії. Ризик був особливо високий для дифузної крупноклітинної В-клітинної лімфоми, часто агресивних підтипів. Крім того, відзначений підвищений ризик раку вульви (ВР 3,78; 95% ДІ 1,52–7,78), легень (ВР 1,30; 95% ДІ 1,04–1,60), щитоподібної залози (ВР 1,76; 95% ДІ 1,13–2,61) і печінки (ВР 1,87; 95% ДІ 0,97–3,27). Ризик раку був нижчий для раку грудей (ВР 0,73; 95% ДІ 0,61–0,88), ендометрія (ВР 0,44; 95% ДІ 0,23–0,77) і раку яєчників (ВР 0,64; 95% ДІ 0,34–1,10) [11].
Походження будь-якого ризику розвитку злоякісних захворювань при СЧВ залишається неясним, хоча, як видно, значно не пов’язане з використанням імунодепресантів або цитотоксичних агентів; більшість когорт занадто малі, щоб дозволити виявити статистично значуще збільшення ризику в окремих випадках за короткі періоди спостереження. Раса та етнічна приналежність були визначені як основні чинники ризику раку при СЧВ [12].
Фактори ризику розвитку гематологічних злоякісних новоутворень можуть бути пов’язані з персистуючим запаленням і активністю захворювання, імунологічними дефектами і надекспресією онкогенів Bcl-2 і вірусів, особливо вірусу Епштейна — Барр [13]. В мережевому дослідженні типу «випадок — контроль», яке включало 6438 пацієнтів із СЧВ, пов’язаних з національним регістром раку в Швеції, було виявлено, що лейкопенія незалежно від імуносупресивного лікування є фактором ризику розвитку лейкозів. Пацієнтам із СЧВ з тривалою лейкопенією та анемією має бути запропоновано дослідження кісткового мозку [14]. Характеристики захворювання, що призводять до неходжкінскої лімфоми, включають більш тривалий перебіг і підвищену активність з помірно тяжким ураженням органів-мішеней [15].
У дослідженні A. Antonelli та співавт. (2010) [16] поширеність раку щитоподібної залози у 153 пацієнтів з СЧВ порівнювалася з такою в двох відповідних за статтю та віком контрольних групах. Рівні циркулюючого ТТГ, антитіл до тиреоглобуліну та тиреопероксідази були значно вищими у пацієнтів із СЧВ (P < 0,001 для всіх). Крім того, у пацієнтів із СЧВ продемонстрована більш значна поширеність гіпотиреозу (P < 0,001). Серед пацієнтів із СЧВ було виявлено п’ять випадків папілярного раку щитоподібної залози, тоді як серед осіб контрольної групи з дефіцитом йоду таких випадків не спостерігалося (P = 0,001), і тільки один випадок спостерігався серед осіб контрольної групи з достатнім вмістом йоду (P = 0,001). Серед пацієнтів із СЧВ з підтвердженим раком щитоподібної залози у 80 % були ознаки автоімунного тиреоїдиту, тоді як тільки в 31 % пацієнтів з СЧВ без раку щитоподібної залози продемонстровані ознаки автоімунного тиреоїдиту (P = 0,02). Ці дані свідчать про те, що поширеність папілярного раку щитоподібної залози у пацієнтів з СЧВ є вищою, ніж у контрольній групі осіб того ж віку, особливо в пацієнтів з автоімунним захворюванням щитоподібної залози. Отже, при подальшому спостереженні за цими пацієнтами рекомендується пильно стежити за станом щитоподібної залози.
Паранеопластичний синдром — це симптоми або сукупність симптомів, які є вторинними щодо первинного онкологічного процесу. Ці симптоми можуть бути викликані речовинами, які секретуються пухлиною (гормонами та іншими біологічно активними речовинами) або обумовлені реакцією імунної системи на пухлинні клітини (автоімунні реакції, утворення імунних комплексів, супресія імунної системи), що залучає в патологічний процес різні органи і системи, розташовані дистантно від первинного вогнища або метастазів [17]. Механізм формування ПНС пов’язаний з пухлинними антигенами, на появу яких імунна система людини реагує утворенням автоантитіл.
Актуальність знання ПНС важлива для лікарів будь-яких спеціальностей, тому що пухлини різної локалізації до появи місцевої симптоматики можуть проявлятися неспецифічними ознаками, які нерідко помилково трактуються як самостійні захворювання, що призводить до запізнілої діагностики пухлини та призначення неадекватної терапії.
Експресія неоантигена та протипухлинна імунна відповідь, що супроводжують злоякісну трансформацію клітин, можуть викликати імунну відповідь проти автоантигенів, які експресуються раковими клітинами, що призводить до розвитку ревматологічних синдромів у схильних людей. Було запропоновано кілька теорій патологічного механізму паранеопластичних ревматологічних захворювань [18, 19]. По-перше, ревматологічні захворювання можуть бути результатом прямої дії цитотоксинів, що продукуються злоякісними клітинами, які викликають запалення в таргетних органах. По-друге, як ревматологічне захворювання, так і злоякісне новоутворення можуть бути незалежними наслідками загального основного тригера, такого як вірусна інфекція або хімічний вплив. По-третє, паранеопластичне ревматологічне захворювання може розвиватися як вторинне щодо протипухлинної імунної відповіді, яка викликає вироблення автоантитіл проти автоантигенів, включаючи автоантигени, які експресуються апоптотичними пухлинними клітинами. Наявність автоантитіл до ядерних білків, дволанцюгової ДНК та інших тканинних антигенів підтверджує цей третій механізм. У більшості випадків паранеопластичний ревматологічний синдром має тенденцію поліпшуватися або повністю зникати після лікування основного злоякісного новоутворення. Це просто, коли пухлину можна видалити хірургічним шляхом, проте при метастатичному захворюванні відповідна терапевтична стратегія вимагає застосування імуносупресії, яка може прискорити розвиток або рецидив раку.
Тому підозра на рак є ключовим елементом для вперше діагностованих випадків з нестандартною клінічною картиною навіть при відсутності симптомів, пухлини повинні бути включені в диференціально-діагностичний алгоритм.
Ревматичні ПНС можуть виникати на тлі онкологічного захворювання, здатні передувати діагнозу на 1–2 роки, з’являтися одночасно з клінічним проявом онкологічного процесу або розвиватися через деякий час після діагностування пухлини. Часто буває складно відрізнити парнеопластичний стан від первинного ідіопатичного захворювання. Вважається, що наявність ПНС є прогностично несприятливим станом для перебігу злоякісного новоутворення. Одночасно з одужанням симптоматика ревматичного захворювання зникає, а її повторна поява може вказувати на рецидив захворювання.
Діагноз СЧВ може передувати діагностиці пухлини на термін до 5 років, хоча первинні пухлини найчастіше діагностуються протягом одного року після встановлення діагнозу СЧВ. З огляду на тривалий субклінічний період пухлини, СЧВ вважається ПНС, який може передувати раку [20].
Висновки
Наведений клінічний випадок є корисним для ознайомлення для лікарів терапевтів, онкологів, ревматологів і нефрологів. Клініцисти повинні знати як про цей можливий зв’язок розвитку автоімунного захворювання на тлі пухлинного процесу, так і про підвищений ризик раку на тлі активного автоімунного процесу, мати високу ступінь підозри при встановленні діагнозу, призначенні терапії і проводити рутинний і специфічний онкоскринінг у таких пацієнтів.
Щодо нашої пацієнтки ми припускаємо, що СЧВ маніфестував за 1 рік до розвитку вовчакового гломерулонефриту, а пухлина щитоподібної залози була тригером прогресування захворювання і розвитку люпус-нефриту, виникнення папілярної карциноми було простимульовано хронічним персистуючим запаленням. Слід наголосити на важливості проведення патогістологічного дослідження, зокрема нефробіопсії, для уточнення діагнозу особливо в діагностично складних випадках, що підкреслюється в останніх рекомендаціях з ведення пацієнтів з люпус-нефритом EULAR/ERA — EDTA 2019. Так, за допомогою нефробіопсії ми провели диференціальну діагностику між ПНС внаслідок папілярної карциноми щитоподібної залози і первинним СЧВ, що визначило стратегію лікування пацієнтки і виділення першочергової патогенетичної терапії люпус-нефриту. Крім того, наголошено на важливості ведення хворого в мультидисциплінарній команді, коли спільно прийняте рішення може призвести до сприятливих для пацієнта наслідків.
Внесок кожного автора: Єгудіна Є.Д., Трипілка С.А. — концепція і дизайн дослідження; Єгудіна Є.Д., Дядик О.О. — збір даних; Єгудіна Є.Д., Трипілка С.А. — аналіз і інтерпретація даних; Єгудіна Є.Д., Дядик О.О. — написання статті; Тер-Вартаньян С.Х. — редагування статті.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Джерела фінансування — немає.
Письмова інформована згода і згода на публікацію були отримані від пацієнта.
Отримано/Received 14.03.2021
Рецензовано/Revised 24.03.2021
Прийнято до друку/Accepted 30.03.2021

/37.jpg)
/39.jpg)
/40.jpg)