Вступ
Ретинопатія недоношених (РН) посідає одне з головних місць у структурі дитячої інвалідності із зору та виявляється серед всіх недоношених дітей, які вижили, у 9–47 % випадків, а серед глибоко недоношених — у 59–90 % випадків. У дітей із масою тіла менше 800 г при народженні частота РН досягає більше 90 %. Збільшення кількості пологів недоношеними дітьми поряд із кращими рівнями виживаності призводить до недостатнього виявлення ретинопатії на ранніх стадіях і може призводити до сліпоти [1]. Серед основних причин розвитку ретинопатії виділяють: дуже низьку масу тіла (менше 1500 г), материнський вік, кількість пологів, наявність хоріоамніоніту, перинатальні фактори ризику та ризики інтенсивної терапії недоношеного. Кожні 100 г ваги додають 27 % ризику розвитку РН, а зменшення строку гестації на 1 тиждень призводить до росту ризику на 19 %.
Недоношений новонароджений є складним коморбідним пацієнтом, який потребує цілого комплексу втручань. Серед них найвагоміший вплив на розвиток ретинопатії справляють штучна вентиляція легень (ШВЛ) та оксигенотерапія [2].
Ретинопатія недоношених збільшує частоту повторних госпіталізацій та звернень до стаціонару в 1,5–4 раза, а також інвалідизує пацієнтів. Звичайно, це впливає не тільки на пацієнта, а також на його родину і збільшує навантаження на медичні центри, що надають спеціалізовану допомогу таким пацієнтам [3]. Сьогодні існують дослідження, в яких указано, що ретинопатія тяжкого ступеня в недоношених новонароджених є самостійним предиктором смерті або глибокого неврологічного дефіциту у віці до 11 років життя [4].
У дослідженні Supplemental Therapeutic Oxygen for Prethreshold Retinopathy of Prematurity (STOP-ROP) розглядали питання впливу рівня оксигенації на розвиток аваскулярних зон сітківки і не виявили вірогідної різниці в показниках ретинопатії при сатурації крові на рівні 96–99 % порівняно з 85–89 % [5]. Однак ціла низка невеликих за обсягом досліджень демонструвала, що при зниженні цільової сатурації крові знижується ризик розвитку РН [6].
У більш пізньому дослідженні, що було проведено в Канаді (Canadian Oxygen Trial, COT), також не виявили суттєвих відмінностей у частоті розвитку ретинопатії недоношених за різних цільових показників сатурації крові [7]. Деякі дослідники вірять, що фактором ризику ретинопатії є насамперед різкі перепади оксигенації, а не певні цифри [8, 9].
Одне з останніх досліджень даного напрямку демонструє зростання шансів розвитку тяжкої РН при використанні кисню з досягненням показників сатурації 97–100 %, але не можна оцінити, при яких умовах даний кисень використовується, і вибірка складається із пацієнтів із гестаційним віком 24–27 тижнів, що є незалежним фактором ризику ретинопатії [10].
Крім того, останній метааналіз даних про різні методи вентиляції в недоношених новонароджених дітей показав, що неінвазивна вентиляція з підтриманням тиску в дихальних шляхах (Nasal Intermittent Positive Pressure Ventilation — NIPPV) є безпечнішим методом вентиляції порівняно зі ШВЛ, синхронізованою переміжною вентиляцією легень (Synchronized Intermittent Mandatory Ventilation — SIMV) та високочастотною вентиляцією (High-Frequency Oscillatory Ventilation — HFOV). Стратегічно даний метод вентиляції зменшує як частоту розвитку, так і летальність від внутрішньо-шлуночкових крововиливів, персистуючого артеріального протоку та ретинопатії недоношених (ВШ = 3,33, 95% ДІ 1,08–16,67, Р < 0,05 для HFOV, ВШ = 8,22, 95% ДІ 1,25–29,44, Р < 0,05 для SIMV) [11].
Інше дослідження, проведене в Китаї, в якому проаналізували ефективність респіраторної підтримки трьома основними неінвазивними методами в 512 новонароджених (високочастотна неінвазивна вентиляція (Noinvasive High-Frequency Oscillatory Ventilation), неінвазивна вентиляція з підтриманням тиску (NIPPV) та постійне підтримання позитивного тиску в дихальних шляхах (Nasal Continuous Airway Pressure)), не виявило суттєвої різниці в розвитку РН > ІІ стадії, але частота виявлення ретинопатії при використанні NIPPV та CPAP становила 7,3 та 8,2 % відповідно [12].
Бронхолегенева дисплазія та ретинопатія недоношених — це звичайні ускладнення періоду недоношеності, пов’язані з патологічним розвитком легень та ока. Хоча програми розвитку даних органів унікальні, але вони критично залежні від ангіогенезу. Порушення нормального ангіогенезу лежить в основі розвитку обох захворювань [13, 14]. Ангіогенез легень та сітківки здебільшого залежить від експресії судинного ендотеліального фактора росту, і його продукція зменшена при бронхолегеневій дисплазії та РН. Bernadette M. Levesque et al. отримали результати дослідження судинного ендотеліального фактора росту в сечі недоношених новонароджених на першому тижні життя, і в пацієнтів на CPAP та штучній вентиляції легень частота виявлення ретинопатії недоношених 3–4-ї ст. зростала на 33,2 та 46 % відповідно (р = 0,0002) [15].
Таким чином, респіраторна підтримка та окремі її елементи вірогідно впливають на розвиток тяжких форм ретинопатії. Оскільки в проведеному дослідженні метою було проаналізувати ефективність різних методів респіраторної підтримки для профілактики бронхолегеневої дисплазії, в ньому додатково було поставлено за мету проаналізувати частоту розвитку тяжких та середньотяжких форм РН.
Мета дослідження: проаналізувати вплив різних елементів інтенсивної терапії та особливостей респіраторної підтримки на розвиток середньотяжких та тяжких форм ретинопатії недоношених.
Матеріали та методи
Дане дослідження проводилося на базі відділень інтенсивної терапії новонароджених (ВАІТН) клінічних установ КП «Дніпропетровська обласна дитяча клінічна лікарня» ДОР» і КП «Дніпропетровський обласний перинатальний центр зі стаціонаром» ДОР». Просте ретроспективне сліпе нерандомізоване контрольоване дослідження проведене в період із 2016 по 2020 р. Дослідження здійснювалося без рандомізації за допомогою простого розподілу на групи за ознакою відкритим методом. Усі пацієнти, які перебували на лікуванні у ВАІТН, мали у своїх історіях хвороб інформовану згоду на обробку інформаційних даних та проведення досліджень і лікування відповідно до зазначеної нозології, що була підписана батьками дитини.
Для реалізації мети роботи та рішення поставлених завдань були досліджені 122 недоношені новонароджені дитини строком гестації 28–32 тижні з дихальними розладами, які перебували на лікуванні в стаціонарі з першої доби життя на базі двох клінічних установ.
Критеріями включення в дослідження недоношених новонароджених були: строк гестації 28–32 тижні, наявність респіраторного дистрес-синдрому при народженні, наявність інформованої згоди батьків або законних представників дитини на включення в дослідження та обробку персональних даних, наявність протоколу офтальмологічного дослідження.
Критеріями виключення із дослідження були: строк гестації менше 28 тижнів та більше 32 тижнів, відсутність потреби в проведенні респіраторної підтримки для лікування респіраторного дистрес-синдрому, маса тіла менше 750 г, діагностовані внутрішньошлуночкові крововиливи IV ступеня, наявність вроджених вад розвитку, що можуть незалежно вплинути на роботу дихання або розвиток ретинопатії недоношених.
Критеріями стратифікації пацієнтів були пріоритетний метод неінвазивної вентиляції та об’єм щодобової інфузії в перші 7 діб лікування.
У 1-шу групу (n = 52) ввійшли недоношені новонароджені, які перебували на респіраторній підтримці методом неінвазивної вентиляції, тригованої за тиском (Noinvasive Ventilation With Pressure Control — NIV PC), протягом раннього і/або пізнього неонатального періоду та отримували рестриктивну інфузійну терапію в перші 7 діб життя.
2-га група (n = 70) включала недоношених новонароджених, які перебували на респіраторній підтримці методом вентиляції з постійним позитивним тиском у дихальних шляхах у кінці видиху, СPAP протягом раннього і/або пізнього неонатального періоду та отримували традиційну ліберальну інфузійну терапію в перші 7 діб життя.
Аналіз показників проводився в 1-шу добу при надходженні у ВАІТН, коли почалася респіраторна підтримка. 7-ма доба — первинне відлучення від респіраторної підтримки методом ШВЛ або неінвазивної вентиляції легень, 14-та доба — первинний огляд офтальмолога, 21-ша доба — вторинний огляд офтальмолога, 28-ма доба — повторний огляд офтальмолога, 56-та доба життя або доба досягнення 36 тижнів постконцептуального віку. У разі виписки зі стаціонару раніше зазначених строків аналіз кінцевих даних збігався із датою виписки.
При первинній оцінці груп аналізувалися гендерний склад груп, гестаційний вік (тижні), вага при народженні (г), зріст (см), окружність голови та грудей (см), оцінка за Апгар на 1, 5 та 20-й хвилині після народження (бали). Аналізували результати патогістологічного дослідження плаценти для верифікації наявності хоріоамніоніту, використання в матері антенатально глюкокортикоїдів для профілактики респіраторного дистрес-синдрому, використання сурфактанту одразу після народження, реєстрували такі ускладнення пологів, як відшарування нормально розташованої плаценти та наявність меконію в навколоплідних водах, як фактори ризику розвитку гіповолемії та синдрому системної запальної відповіді.
Кінцевими точками дослідження були обрані розвиток середньотяжкої та тяжкої бронхолегеневої дисплазії, летальність у групах дослідження, тривалість перебування у ВАІТН, розвиток ретинопатії недоношених новонароджених та оцінка якості життя недоношеного новонародженого на момент виписки (за негативний результат приймався розвиток симптоматичної епілепсії новонароджених, бронхолегеневої дисплазії, ретинопатії недоношеного та функціонуючої відкритої артеріальної протоки).
Відповідно до протоколу № 1 від 16.01.2017 року засідання комісії з питань біомедичної етики ДЗ «Дніпровський державний медичний університет» МОЗ України» наукове дослідження визнається таким, що відповідає загальноприйнятим нормам моралі, вимогам дотримання права, інтересів та особистої гідності учасників дослідження.
У ВАІТН обох медичних установ проводився повний комплекс діагностичних та лікувальних процедур відповідно до клінічного протоколу надання допомоги новонародженій дитині з дихальними розладами згідно з Наказом МОЗ Україні № 484 від 21.08.2008 р.
З 1-ї доби надання допомоги новонароджені перебували в спеціалізованих інкубаторах для новонароджених Giraffe Omnibed, Weyer, Drager, Atom Medical із можливістю підтримання постійної температури середовища та цільової вологості залежно від потреб конкретного новонародженого. Температура регулювалася згідно з температурою дитини, що вимірювалася у пахвинній зоні, на рівні 36,6–37,5 ºС, вологість у середньому була від 60 до 80 % залежно від строку гестації дитини та маси, а також термолабільності.
Респіраторна підтримка в пацієнтів 1-ї і 2-ї груп проводилася за допомогою апаратів експертного класу Maquet Servo-i Neonatal та Maquet Servo-n (Maquet Critial Care, Gettinge, Швеція), а також у разі відносної стабільності респіраторної функції на апараті Babylog (Dragaer, Німеччина) під контролем сатурації крові та кислотно-лужного балансу з метою забезпечення цільових величин SpO2 92–98 % і рСО2 35–45 мм рт.ст.
При проведенні інтенсивної терапії порушень гемодинаміки корекція відносної гіповолемії з ознаками низької наповненості камер серця (за розрахунком серцевого індексу за даними ехокардіографічного дослідження (ЕхоКГ) та показників зниженого індексу резистентності за даними нейросонографічного дослідження головного мозку) проводилася за допомогою кристалоїдного розчину — фізіологічного розчину 0,9% NaCl у дозуванні 20 мл/кг за 20 хвилин, а при ознаках кровотечі або крововтрати — трансфузії одногрупних однорезусних еритроцитів 10 мл/кг із подальшою переоцінкою показників газів крові. За наявності ознак низького серцевого викиду, відповідно до Наказу МОЗ України від 28.03.2014 року № 225, клінічного протоколу «Початкова, реанімаційна і післяреанімаційна допомога новонародженим в Україні», контроль та підтримка стабільної гемодинаміки проводилися за допомогою кардіотропних препаратів. Стартовим препаратом після корекції відносної гіповолемії кристалоїдними розчинами був добутамін 0,5% або дофамін 4% залежно від стартового дозування 10 і 5 мкг/кг/хв відповідно в стаціонарі, при цьому не було перевищено дозування у 20 мкг/кг/хв у безперервній внутрішньовенній інфузії за допомогою інфузомату. Цільовим показником стабільної гемодинаміки приймали нижню межу норми, що відповідає гестаційному віку недоношеної новонародженої дитини.
Методика визначення РН
Огляд дітей проводився досвідченим офтальмологом безпосередньо у ВАІТН, починаючи з 3-го тижня після народження. Він включав офтальмоскопію з використанням бінокулярного налобного офтальмоскопа з асферичними лінзами (20, 28, 30 діоптрій). Процедура огляду очного дна не займала більше 2 хвилин, проводилася в умовах достатнього мідріазу (після дворазової (з інтервалом 15 хвилин) інстиляції 0,5% мідріацилу (тропікаміду) із використанням м’яких блефаростатів). Офтальмоскопію в динаміці повторювали регулярно з інтервалом 2 тижні до завершення васкуляризації або проявів РН. За наявності перших ознак РН огляд здійснювали щотижня до повного регресу захворювання або стихання активності процесу. У разі неможливості візуалізації очного дна або складності у визначенні стадії РН дітей направляли на обстеження ретинальною камерою на базі КЗ «Дніпропетровський спеціалізований клінічний медичний центр матері та дитини ім. проф. М.Ф. Руднєва» ДОР» або до КП «Дніпропетровська обласна клінічна офтальмологічна лікарня» ДОР».
Активна фаза ретинопатії визначається за стадіями, локалізацією та поширеністю процесу. I стадія — на межі васкуляризованої й аваскулярної сітківки утворюється демаркаційна лінія білого кольору, що становить собою скупчення судиноутворюючої мезенхімальної тканини. II стадія — у ділянці демаркаційної лінії формується виступ, що може мати рожеве забарвлення внаслідок інтраретинальної неоваскуляризації. ІІІ стадія — на місці виступу формується фіброзно-судинна екстраретинальна проліферація. ІІІ стадія із симптомами плюс-хвороби характеризується змінами судин заднього полюса у вигляді розширення вен і покручених артерій, плюс-хвороба супроводжується ригідністю зіниці, новоствореними судинами в райдужці, флером у склоподібному тілі, швидким прогресуванням. IV–V стадії супроводжуються субтотальним та тотальним відшаруванням сітківки.
Подальша інтенсивна терапія недоношеного новонародженого. При збереженні залежності новонародженої дитини від дотації кисню, епізодів апное, залежності від респіраторної підтримки методом неінвазивної вентиляції в новонароджених 1-ї і 2-ї груп дослідження на 14-ту добу життя розпочиналася небулайзерна терапія бронходилататорами та інгаляційними глюкокортикоїдами у вигляді сальбутамолу 0,25 мл 2–4 рази на день і будесоніду або флютиказону 0,25 мл 2–4 рази на день. Відміна препаратів проводилася при стабільності показників оксигенації та вентиляції новонародженого, а також за відсутності клінічних ознак респіраторних порушень, задишки більше 60 на 1 хв, функціональних порушень дихання, ретракцій, епізодів десатурацій.
У хворих 2-ї групи з метою запобігання синдрому апное з 1–2-ї доби життя в терапію додавався розчин кофеїну цитрату 20 мг/мл, вводився він в ударному дозуванні 20 мг/кг із подальшим зниженням дози до 5 мг/кг до 36-го тижня постконцептуального віку. У 1-й групі розчин кофеїну цитрату не використовувався.
Статистична обробка даних проводилась за допомогою пакетів програм LibreOffice та R (версія 3.6.3). Розподіл кількісних параметрів проводили за допомогою тесту Шапіро — Уїлка. З огляду на те, що розподіл більше 75 % кількісних даних був відмінний від нормального, вони були представлені у вигляді медіани та 25-го і 75-го перцентилів — Ме [25 %; 75 %]. Порівняння кількісних показників у незалежних вибірках проводили за допомогою критерію Манна — Уїтні. Якісні показники описували як n (%). Порівняння якісних показників у незалежних вибірках здійснювали за допомогою критерію хі-квадрат без поправки на безперервність. Оцінку часу до настання смерті проводили за допомогою побудови кривих Каплана — Маєра. При проведенні субаналізу з побудовою декількох кривих Каплана — Маєра значущість відмінностей між кривими оцінювали за допомогою логранг-тесту. Для визначення здатності прогнозувати середньотяжку та тяжку ретинопатію недоношених пацієнтів за клінічними характеристиками проводили уніваріантний логістичний регресійний аналіз з обчисленням відношення шансів та 95% довірчого інтервалу (95% ДІ). Наступним кроком вірогідні предиктори розвитку середньотяжкої та тяжкої РН додавали в множинну регресійну модель методом одночасного включення. Після цього покроковим прямим шляхом додавали вірогідні предиктори до логістичної регресії залежно від значення р предикторів у множинній регресійній моделі (першими включались предиктори з найнижчим значенням р). Для визначення дискримінаційної здатності предикторів у прогнозуванні середньотяжкої та тяжкої ретинопатії проводили ROC-аналіз (receiver operating characteristics) з обчисленням площі під ROC-кривою (area under the curve — AUC) із 95% ДІ. Порівняння ROC-кривих проводили за методом DeLong et al. [16]. Критичний рівень р при перевірці статистичних гіпотез був прийнятий < 0,05.
Результати та їх обговорення
При проведенні аналізу визначено, що розвиток середньотяжкої та тяжкої ретинопатії реєструвався у 18 % новонароджених груп спостереження з 14-ї доби проведення інтенсивної терапії. При цьому в пацієнтів 1-ї і 2-ї груп він реєструвався в 7 (13,4 %) і 15 (21,4 %) хворих відповідно, що було менше порівняно з пацієнтами з ретинопатією легкого ступеня тяжкості або без неї: у 1-ї групі — у 6,4 раза (45 хворих — 86,5 %), у 2-й групі — у 3,7 раза (55 хворих — 78,6 %). Дані з ретинопатії в групах вірогідно не відрізнялися (р = 0,26).
Серед пацієнтів із середньотяжкою та тяжкою ретинопатією переважали хлопчики — 16 осіб (72,7 %) проти 6 дівчаток (27,3 %), що було статистично незначуще (р = 0,06).
Маса тіла в пацієнтів із ретинопатією легкого ступеня або без неї була 1460,0 г [1210,0; 1802,5], що вірогідно перевищувало на 10,9 % (р = 0,04) масу тіла хворих із середньотяжкою та тяжкою ретинопатією — 1300,0 г [982,5; 1485,0]. Щодо росту новонароджених, то показники не відрізнялися вірогідно у хворих 1-ї і 2-ї груп спостереження і були 40,0 см [35,0; 42,0] і 38,5 см [33,8; 41,0] відповідно (р = 0,16).
Проаналізований вплив методів інтенсивної терапії на розвиток РН різного ступеня тяжкості (табл. 1). Так, у пацієнтів із ретинопатією легкого ступеня або без РН тривалість респіраторної підтримки становила 12,5 дня [4,8; 24,0]. При цьому визначено, що тривалість NIV PC була 3,0 дня [0,0; 9,0], а СРАР — 0 днів [0; 5,5]. Визначено, що оксигенотерапія з FiO2 > 30 % проводилась протягом 1,0 дня [0; 3,0].
У пацієнтів із середньотяжкою та тяжкою ретинопатією тривалість респіраторної підтримки становила 14,5 дня [5,2; 27,8]. При цьому тривалість неінвазивної ШВЛ зростала до 12,0 дня [4,2; 21,8], проведення ШВЛ — до 7,0 дня [0; 10,5], проведення СРАР — 4,5 дня [0; 13,5].
Визначено, що оксигенотерапія з FiO2 > 30 % даним хворим проводилась протягом 4,0 дня [1,0; 6,0]. Таким чином, визначено, що розвиток середньотяжкої та тяжкої ретинопатії асоційований зі збільшенням тривалості неінвазивної ШВЛ у 4 рази (р = 0,01), ШВЛ — у 2,3 раза (р = 0,33), проведення СРАР — у 4,5 раза (р = 0,05), тривалості кисневої терапії з FiO2 > 30 % — у 4 рази (р = 0,01).
При аналізі впливу проведення інфузійної терапії на можливий розвиток РН різного ступеня тяжкості визначено, що в пацієнтів із ретинопатією легкого ступеня або без неї добовий обсяг засобів, які вводилися внутрішньовенно, становив 98,8 мл [58,2; 115,8] та вірогідно не відрізнявся (р = 0,20) від об’єму інфузійної терапії пацієнтів із середньотяжкою та тяжкою ретинопатією — 108,5 [89,0; 116,0] (р = 0,2). При цьому потреба в призначенні вазопресорної підтримки була протягом 0,5 [0; 4,0] і 0 днів [0; 3,0] відповідно (р = 0,20).
Визначено, що пацієнтам із середньотяжкою та тяжкою ретинопатією вводили кофеїн у 15,6 % випадків, що було вірогідно частіше (р < 0,001) порівняно з тими хворими, яким кофеїн не вводили (2,4 %). За рештою досліджуваних показників статистично значущих відмінностей виявлено не було.
Наявність у недоношених новонароджених відкритої артеріальної протоки (ВАП) реєструвалася в 69,7 % пацієнтів без ретинопатії або з легким ступенем тяжкості даної патології та у 81 % пацієнтів із середньотяжкою та тяжкою ретинопатією, відмінності між групами невірогідні (р = 0,3). Важливо відзначити, що розмір ВАП у дітей із тяжкими формами ретинопатії був гемодинамічно значущим (2,4 мм [2,0; 3,2]) порівняно з групою новонароджених без ретинопатії або з легким її ступенем (2,0 мм [0; 2,7]), але відмінності статистично невірогідні (р = 0,11) (табл. 2).
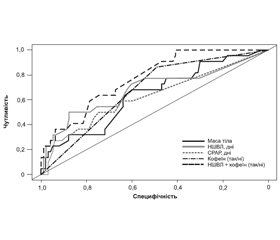
На підставі проведення ROC-аналізу визначено, що значущими предикторами розвитку середньотяжкої та тяжкої ретинопатії були маса тіла (AUC 0,64 (95% ДІ 0,51–0,77, р = 0,03)), тривалість неінвазивної вентиляції методом NIV PC (AUC 0,68 (95% ДІ 0,54–0,83, р < 0,01)), СРАР (AUC 0,63 (95% ДІ 0,49–0,76, р = 0,04)) та введення кофеїну (AUC 0,68 (95% ДІ 0,59–0,77, р = 0,01)).
При включенні предикторів у множинну регресійну модель статистично значущу прогностичну здатність зберегли тривалість NIV PC та введення кофеїну. Площа під ROC-кривою для множинної регресійної моделі була вищою, ніж для моделей з одним предиктором (0,77) (95% ДІ 0,68–0,87), але статистично значущих відмінностей між ROC-кривими виявлено не було (рис. 1).
/75.jpg)
Таким чином, використання навіть неінвазивної вентиляції, синхронізованої з пацієнтом без використання додаткового кисню в газовій суміші, збільшує ризик розвитку ретинопатії середньотяжкого та тяжкого ступенів, із кожним днем проведення респіраторної підтримки ризик збільшувався на 9 % (АUC = 0,68, 95% ДІ 0,54–0,83) (р < 0,01). Був виявлений суттєвий вплив кофеїну на ризик розвитку тяжкої ретинопатії недоношених, сам факт його використання в структурі лікування збільшував вірогідність розвитку даного патологічного стану в 5 разів (AUC = 0,68, 95% ДІ 0,59–0,77) (р = 0,01). При цьому на противагу іншим дослідженням останнього часу зв’язку між тривалістю штучної вентиляції легень та розвитком ретинопатії не виявлено (р = 0,33) [17, 18].
Важливо відзначити, що результати даного дослідження збігаються з подібними дослідженнями, де йдеться про зв’язок РН із масою пацієнта або так званою затримкою внутрішньоутробного розвитку, що частіше всього буває за гіпотрофічним типом. У нашому дослідженні при зменшенні маси на 100 г ризик розвитку РН зростає на 16 % (AUC = 0,64 (95% ДІ 0,51–0,77)) [19].
Висновки
З огляду на проведене дослідження предикторами ризику розвитку ретинопатії недоношених слід вважати будь-яку респіраторну підтримку, навіть синхронізовану з пацієнтом і без високих флуктуацій кисню у вдихуваній суміші. Важливо відзначити, що чим триваліша респіраторна підтримка, тим вірогідніший розвиток більш тяжких форм ретинопатії. Таким чином, слід уникати довготривалих періодів вентиляції без суттєвих показань, не допустимо використання превентивної вентиляції. Інша патологія періоду недоношеності, така як синдром апное, потребує протокольного лікування кофеїном або переводу на респіраторну підтримку. З огляду на результати даного дослідження слід обирати одну з можливих методик, уникати їх комбінації в пацієнта. Неінвазивна вентиляція будь-яким методом є ефективним методом профілактики апное, що може дозволити не використовувати кофеїн. Хоча в даному дослідженні не було виявлено вірогідного зв’язку між тривалістю оксигенотерапії з FiO2 > 30 % та розвитком РН, можна прослідкувати за тим, що даний фактор впливає на розвиток найтяжчих її форм, тому слід уникати або мінімізувати використання газової суміші з високою концентрацією кисню.
Слід використовувати всі доступні методи ефективного вигодовування пацієнтів, оскільки вагомим предиктором даного патологічного стану є затримка постнатального розвитку недоношеної дитини.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 05.02.2021
Рецензовано/Revised 17.02.2021
Прийнято до друку/Accepted 26.02.2021

/74.jpg)
/75.jpg)