Вступ
Блокатори кальцієвих каналів (БКК) широко застосовуються при лікуванні різноманітних патологічних станів, насамперед порушень з боку серцево-судинної системи (гіпертензія, ішемічна хвороба серця, порушення серцевого ритму тощо). Однак широке їх застосування є однією з причин передозування та використання з суїцидальною метою. Згідно з даними Американської асоціації центрів контролю отруєнь (American Association of Poison Control Centers, AAPCC), у 2019 р. повідомлено про 6020 епізодів отруєнь БКК, що стали причиною 31 смерті та 111 випадків украй тяжкого перебігу хвороби. Серед дітей, молодших 6 років, за цей період трапилося 1198 подібних випадків.
За даними Київського міського центру лікування гострих отруєнь, до стаціонару щорічно госпіталізується кілька пацієнтів (3–8 випадків) з отруєнням БКК, що, зазвичай, із суїцидальною метою приймаються у складі міксту медикаментів, але превалюють у суміші та визначають клінічний перебіг отруєння. Специфічний симптомокомплекс, властивий для отруєння БКК, вимагає від анестезіологів та лікарів невідкладної допомоги знань, необхідних для надання кваліфікованої допомоги у перші хвилини та години контакту з постраждалим. Це реанімаційні заходи, призначення засобів антидотної терапії, деконтамінація медикаментів, що не всмокталися, підтримка дихання та стабілізація показників серцево-судинної системи. Вважається, що токсичною може стати доза БКК, що переважає терапевтичну разову у 5–10 разів. Для дітей молодшого віку небезпечною може стати навіть одна таблетка препарату.
Клінічне спостереження
Пацієнтка — молода дівчина, 18 років, маса тіла — 50 кг, із суїцидальною метою прийняла 250 таблеток ніфедипіну (10 мг у таблетці, всього — близько 2500 мг) та 25 таблеток гідазепаму (по 0,02 — 500 мг). Період експозиції до прибуття бригади екстреної медичної допомоги становив близько години. Діагноз бригади екстреної медичної допомоги: «Гіпотонія. Отруєння медикаментами». Під час транспортування у зв’язку з колаптоїдним станом проводилася внутрішньовенна (в/в) інфузія дофаміну 4% 5,0 + адреналіну 0,18% 1,0 + преднізолону 150 мг на 300,0 мл 0,9% розчину хлориду натрію. Після прибуття до лікарні хвора була заінтубована та переведена на штучну вентиляцію легень (ШВЛ), госпіталізована до відділення інтенсивної терапії (ВІТ). Свідомість порушена за типом сопору (10 балів за шкалою коми Глазго), артеріальний тиск (АТ) — 60/30 мм рт.ст., частота серцевих скорочень і пульс — 150 скорочень за 1 хв, розпочато в/в введення антидотних засобів — хлориду кальцію 10% 10,0 (за першу годину — 3 г). При АТ 80/40 мм рт.ст. на тлі продовження інфузії дофаміну з адреналіном проведено промивання шлунка до чистих промивних вод, видалено певну кількість напіврозчинених таблеток, у зонд введені сорбенти (ентеросгель). Зроблено очисну клізму. Знято ЕКГ: синусова тахікардія, 150 за 1 хв. Порушення ритму і провідності серця не реєструється. У першу добу перебування у ВІТ проводився кардіомоніторинг, ШВЛ, продовжувалося введення препаратів кальцію (хлорид кальцію, глюконат кальцію), АТ утримувався на рівні 50–60–70/30–40 мм рт.ст. лише завдяки постійному дозованому введенню дофаміну та адреналіну. ЧСС зменшилася від 118 до 80 за 1 хв. Призначено також гормональні засоби (гідрокортизон, дексаметазон), сольові розчини (розчин Рінгера), гекотон, реосорбілакт. При першому біохімічному дослідженні виявилася гіперглікемія: глюкоза крові — 25 ммоль/л. Підключено дозоване в/в введення інсуліну (5 ОД/год) під контролем рівня глюкози у крові.
У подальші три дні хвора продовжувала перебувати на ШВЛ, у зв’язку зі збереженням свідомості проводилася аналгоседація (пропофол + фентаніл, морфін). Внаслідок нестабільних гемодинамічних показників дофамін був замінений на норадреналін (0,5–0,6 мкг/кг/хв), продовжилося введення препаратів кальцію. АТ стабілізувався на показниках 100–110/50–60 мм рт.ст., але зберігалася тахікардія (120–130 за 1 хв). Реєструвався кетоацидоз (ацетон, кетонові тіла у сечі), гіперглікемія була скорегована постійним дозованим введенням інсуліну під контролем рівня глюкози крові. Необхідно було контролювати плазмовий рівень кальцію як запоруку дієвості антидотної терапії. За аналізом електролітів крові на 2-й день перебування у стаціонарі рівень кальцію становив 2,58 ммоль/л (референтні значення — 2,15–2,5 ммоль/л).
УЗД виявило ішемію кори нирок (можливо, внаслідок вазопресорної терапії), полісерозит, що стало причиною корекції дози норадреналіну та підключення добутаміну з метою зменшення периферійного судинного опору та підтримання АТ на належному рівні. Динамічні оцінки ЕКГ виявляли синусову тахікардію, виражені дифузійні та метаболічні зміни міокарда. Ні порушення ритму серця, ні порушення провідності не реєструвалися.
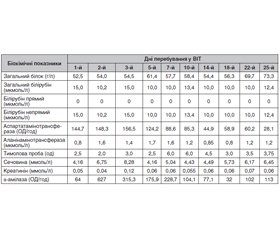
Дані динамічного клініко-лабораторного моніторингу прослідковуються за табл. 1–3.
Аналізуючи у динаміці клінічні лабораторні показники крові, можна помітити, що в перші три доби перебування у ВІТ реєструвався значущий лейкоцитоз та гіперглікемія. Лейкоцитоз слід пояснити стресовою реакцією та у подальшому приєднанням запальних процесів у легенях, що спричинило тривале перебування постраждалої на ШВЛ. Наявність гіперглікемії у перші дні перебування у стаціонарі патогномонічно для отруєння БКК і пояснюється блокадою активності секреторних клітин підшлункової залози із затримкою виділення інсуліну. Також наявність у сечі ацетону (+, аналіз на другий день перебування), кетонових тіл (++, аналіз на третій та шостий день перебування) свідчить про кетоацидоз.
Динамічна оцінка біохімічних показників дає підстави говорити про гіпопротеїнемію, що тривала майже три тижні, токсичну гепатопатію (стійке збільшення рівня трансаміназ) та токсичний панкреатит.
Іонограма була важлива для оцінки ефективності антидотної терапії препаратами кальцію. Для досягнення цієї мети слід підтримувати рівень кальцію у межах референтних значень, особливо у перші три доби, коли триває токсикогенна фаза отруєння. Визначення інших електролітів дозволяє вчасно проводити корекцію у разі виходу за межі референтних значень з метою підтримки належного гомеостазу.
У міру оцінки стану постраждалої, результатів лабораторного та інструментального обстежень був встановлений такий діагноз: «Гостре суїцидальне отруєння сумішшю медикаментів (ніфедипін 10 мг 250 табл., гідазепам 20 мг 25 табл.,) з переважною кардіотоксичною дією тяжкого ступеня. Гостра серцево-судинна недостатність ІІІ ст., гостра дихальна недостатність ІІІ ст., токсична гепатопатія, токсичний панкреатит».
Зберігалися негативні зміни на ЕКГ. Згідно з описом кардіограми, на третій день перебування у ВІТ реєструвалася тахікардія (140 за 1 хв, ритм синусовий), погіршилися метаболічні зміни у міокарді.
Із четвертого дня у стаціонарі стабілізувалися показники глюкози у крові, однак стан хворої ускладнився клінікою набряку легень (лікування проводилося призначенням морфіну в/в та збільшенням позитивного тиску наприкінці видиху до 10 см вод.ст. при ШВЛ). Був отриманий позитивний результат.
За даними УЗД черевної порожнини та легень, на 5-ту добу перебування виявлено позитивні ознаки з боку нирок, печінки, але УЗ-ознаки гострого панкреатиту. Обстеження органів грудної клітки показало УЗ-ознаки інтерстиціально-альвеолярного синдрому тяжкого ступеня, синдрому транслобарної консолідації нижньої частки правої легені, правобічного гідротораксу.
На 5-ту добу ЧСС становила 120 за 1 хв (ритм синусовий), зберігалися метаболічні зміни у міокарді.
На 6-ту добу у зв’язку зі стабільними показниками АТ добутамін був відмінений. Хвора продовжувала отримувати антибіотикотерапію (2 антибіотики), перебувала на ШВЛ (адаптація до респіратора дексмедетомідином), ентеральне харчування через зонд, альбумін, гепатопротектори, інфузійну терапію збалансованими сольовими розчинами, симптоматичне лікування.
Опис ЕКГ на 10-ту добу: ритм синусовий, ЧСС — 90 за 1 хв, зменшилися метаболічні порушення у міокарді. На 11-ту добу виконана трахеостома та продовжено ШВЛ у зв’язку з неефективним самостійним диханням. У той же день на черговій ЕКГ була зареєстрована негативна динаміка: ЧСС 150 за 1 хв, ритм синусовий, перевантаження правих відділів серця. Rö-графія органів грудної клітки дає висновок про правобічну нижньо-, середньочасткову пневмонію. Наступного дня стан хворої стабілізувався, і ще 10 днів вона продовжувала отримувати призначене лікування з поступовим тренуванням для переводу на спонтанну вентиляцію (1–2 год/добу залежно від самопочуття і показників SpO2).
На 24-й день повністю пацієнтка була переведена на спонтанну вентиляцію через трахеостомічну трубку з подачею зволоженого кисню. Їжу приймала природним способом за допомогою медичного персоналу та близьких.
Оглянута психіатром. Діагноз: «Тяжкий депресивний епізод. Суїцидальна спроба». На 26-й день трахео-стомічну трубку видалено та наступного дня пацієнтка переведена у стабільному стані до терапевтичного відділення.
Обговорення
Отруєння блокаторами кальцієвих каналів, а особливо при прийомі великих доз препарату, є нечастим випадком госпіталізації пацієнтів і вимагає роз’яснення механізму дії токсичних доз на організм постраждалих та наведення основних симптомокомплексів, властивих такій патології. Хоча у нашому випадку мав місце прийом міксту медикаментів, дія гідазепаму була не визначальною у клініці передозування й у обговоренні нам слід було зосередитися, насамперед, на патологічних ефектах, властивих ніфедипіну. Цей препарат за своїми хімічними властивостями належить до групи дигідропіридинів, для яких характерний не тільки вплив на провідну систему серця, але й судинорозширювальні ефекти. Механізм токсичної дії при передозуванні БКК зумовлений їх фармакологічними властивостями. Конформуючи специфічні кальцієві канали L-типу (повільні кальцієві канали), БКК блокують, насамперед, входження іонів Са2+ в клітини, внаслідок чого скорочується час відкриття кальцієвого каналу й опосередковано зменшується трансмембранний кальцієвий потік. Відбувається уповільнення 0-ї фази деполяризації у пейсмекерних клітинах серця і 2-ї фази (фаза плато) у кардіоміоцитах, клітинах волокон Пуркіньє та клітинах гладеньких м’язів стінок судин. Діючи подібним чином, БКК викликають розширення судин, зниження активності синоаурикулярного та атріовентрикулярного вузлів, клітини яких позбавлені натрієвих каналів, і провідність забезпечується винятково за допомогою іонізованого кальцію [3, 7, 8]. Залежно від виду БКК реалізуються і специфічні клінічні ефекти. БКК (крім депо-форм) досить швидко абсорбуються з тонкого кишечника. Зазвичай концентрація препарату у плазмі крові досягає пікових значень протягом 1–2 годин. При значному передозуванні цей період може затримуватися до 6 годин. Всі БКК метаболізуються у печінці з утворенням активних або неактивних метаболітів. Метаболізація цих препаратів супроводжується ентерогепатичною циркуляцією. Близько 96–99 % препарату зв’язується з білками плазми крові (альбумін, кислий глікопротеїн).
Отруєння БКК характеризується такими клінічними ознаками: 1) кардіотоксична дія; 2) шлунково-кишкові прояви; 3) нейротоксичні ефекти; 4) метаболічні прояви.
Кардіотоксичні ефекти. Протягом 0,5–2 годин з моменту отруєння внаслідок модифікації кальцієвих каналів і уповільнення внутрішньоклітинного входження Са2+ розвиваються гіпотензія, зумовлена комбінацією вазодилатації, порушення серцевої провідності (блокади різного ступеня) та негативний інотропний ефект. У деяких випадках настає критичне порушення насосної функції серця і смерть. При отруєнні ніфедипіном може реєструватися тахікардія, рефлекторно пов’язана зі зниженням АТ. За умови кардіотоксичної дії БКК, значного зниження АТ, розвитку синдрому малого серцевого викиду діагностують екзотоксичний шок, який проявляється зниженням діурезу, гальмуванням перистальтики кишечника, порушенням свідомості.
Шлунково-кишкові прояви характеризуються нудотою, блюванням, кишковою непрохідністю, що так само сприяє уповільненню виведення БКК з кишечника. Така симптоматика характерна для отруєнь БКК тяжкого ступеня і практично завжди поєднана з кардіотоксичною дією цих медикаментів. Отруєння може супроводжуватися токсичним гепатитом, що проявляється зростанням рівня трансаміназ і білірубіну (переважно прямої фракції) в плазмі крові, панкреатитом.
Нейротоксичні ефекти пов’язані з порушенням синтезу і вивільненням нейромедіаторів (насамперед дофаміну), гіпоксемією, обумовленою значним зниженням АТ. Відзначаються сонливість, пригнічення свідомості (сопор, кома), рідше — збудження, судоми.
Метаболічні розлади. У більшості випадків тяжке отруєння БКК супроводжується гіперглікемією через блокування кальцієвих каналів b-клітин підшлункової залози, що сприяє порушенню секреції інсуліну. Часто реєструють лактатацидоз, значно рідше — гіпокальціємію. До інших особливостей перебігу отруєння БКК зараховують некардіогенний набряк легень та ішемічне ураження внутрішніх органів (кишечника, нирок), сітківки ока тощо.
Як ми бачимо, переважна більшість характерних симптомів, властивих тяжкому отруєнню ніфедипіном, мала місце й у цьому клінічному випадку. Вже з етапу транспортування виникла необхідність залучення дофаміну, адреналіну та преднізолону, щоб підтримувати показники гемодинаміки на мінімально можливому рівні. Безперечно, при госпіталізації постраждала знаходилася у стані кардіотоксичного шоку з порушенням свідомості та спонтанної вентиляції.
На початку лікування, окрім стабілізації стану пацієнтки, існувала необхідність провести деконтамінацію шлунково-кишкового тракту для видалення медикаментів, що не всмокталися, та призначення антидотної терапії, в цьому випадку — препаратів кальцію. У хворих в тяжкому стані перед промиванням шлунка попередньо стабілізуються показники гемодинаміки та проводиться інтубація трахеї. Дослідження свідчать, що при промиванні шлунка через годину після отруєння можна видалити до 50 % речовини, що стала джерелом отруєння, а через 2 години — близько 40 % [2, 3, 7, 8]. У нашому випадку період експозиції був нетривалим. Це дозволило видалити медикаменти зі шлунка, що не встигли всмоктатися. Кардіотоксичні прояви, крім зниження АТ, характеризувалися тахікардією та значними порушеннями метаболізму у міокарді (відповідає описам ЕКГ). Не спостерігалися ні порушення провідності серця, ні атріовентрикулярні блокади, що, власне, і корелюється з отруєнням медикаментами групи дигідропіридинів. Антидотні засоби вводилися у необхідній дозі, що підтвердилося рівнем плазмової концентрації кальцію у хворої на другу добу з моменту отруєння. Препарати кальцію, за класифікацією експертів-токсикологів Міжнародної програми з хімічної безпеки, зараховують до групи В-3 (В — рекомендовано вживати не пізніше 2 годин з моменту отруєння; 3 — антидот використовується широко, однак необхідні додаткові дослідження його ефективності та показань до застосування). Підвищена концентрація Са2+ дозволяє витісняти БКК із зв’язку з α1-субодиницею повільних L-каналів. Це сприяє відновленню скорочувальної функції міокарда, нормалізації серцевого ритму і провідності [1, 4–6, 9].
Важливими при виборі тактики лікування є підходи до призначення засобів інфузійної терапії, особливо у випадку розвитку екзотоксичного шоку. Використовують переважно сольові розчини у загальній дозі 20–25 мл/кг/добу. За відсутності ефективності на початку інфузійної терапії (особливо при отруєнні препаратами з вираженим судинорозширювальним ефектом) до лікування долучають препарати гідроксіетилкрохмалів та медикаменти з інотропною та вазопресорною дією.
Вазопресори додають до лікування у випадках гіпотензії, яка не піддається корекції. Норадреналін сприяє підвищенню АТ внаслідок вираженої a-адреноміметичної дії на артеріоли, що не пов’язана з активацією кальцієвих каналів. Наш клінічний випадок підтвердив ефективність норадреналіну, але більш ефективним стало долучення добутаміну, яке дозволило зменшити тахікардію.
У хворої від початку перебування у ВІТ реєструвалася значуща гіперглікемія (до 25 ммоль/л), що вимагало призначення інсуліну через дозатор з частим визначенням глікемічного профілю. Це ще одна особливість, притаманна отруєнням БКК.
Один із рекомендованих методів лікування при отруєнні БКК — інсулін-декстрозна еуглікемія, при якій інсулін призначається у високих дозах: 0,5–1 ОД/кг/год. Разом з інсуліном вводиться 50% розчин декстрози (40,0–50,0 за 1 год). Раз у 1–2 год (а за необхідності і частіше) визначається рівень глюкози у крові. Введення інсуліну та декстрози сприяє поновленню енергетичного балансу кардіоміоцитів і опосередковано сприяє входженню до клітини іонів кальцію. Ця методика виправдала себе у випадках гіпотензії, стійкої до вазопресорів і препаратів ізотропної дії. Однак у нашому випадку вазопресорна та ізотропна терапія мала добрий ефект, тому інсулін-декстрозну/глюкозну еуглікемію ми не використовували.
Застосування методів екстракорпоральної детоксикації при отруєнні БКК — дискутабельне. Дослідники сходяться на думці, що гемодіаліз неефективний внаслідок високої спорідненості блокаторів кальцієвих каналів з білками плазми і великого об’єму розподілу. Більшість авторів обстоюють думку, що так само не ефективно використання гемосорбції, хоча існують непоодинокі описання клінічних випадків, які доводять користь застосування гемосорбції у разі відсутності ефекту від інших засобів терапії [5–8].
Ускладнення, таке як пневмонія, досить часто супроводжує тяжке отруєння БКК, особливо коли хворий тривалий час перебуває на ШВЛ. Лікування рутинне і не відрізняється від лікування пневмоній при інших захворюваннях.
Згідно з сучасними рекомендаціями [5, 6, 8], переведення хворих із відділення інтенсивної терапії здійснюється при ясній свідомості пацієнта, відсутності порушень провідності, ритму серця, показників гемодинаміки, принаймні, протягом останніх 24 годин і після огляду психіатра у разі скоєння суїцидальної спроби.
Висновки
1. Тяжке отруєння блокаторами кальцієвих каналів є досить рідкісним випадком навіть серед інших медикаментозних інтоксикацій, тому важливо володіти необхідними знаннями і застосовувати потрібний алгоритм дій для збереження здоров’я та життя пацієнта.
2. Своєчасна (за принципом «чим скоріше — тим краще», але за відсутності протипоказань) деконтамінація отрути зі шлунково-кишкового тракту може значно поліпшити стан пацієнта і прогноз отруєння.
3. Ефективність дії антидотних засобів (препарати кальцію) тісно пов’язана з плазмовою концентрацією кальцію.
4. Зважаючи на стійку гіпотензію, що зумовлена, насамперед, розширенням ємкісних периферійних судин при отруєннях БКК групи дигідропіридинів (ніфедипін), найефективнішим є призначення норадреналіну та його комбінації з добутаміном.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 03.02.2021
Рецензовано/Revised 10.02.2021
Прийнято до друку/Accepted 26.02.2021

/91.jpg)
/92.jpg)