Журнал «Медицина неотложных состояний» Том 17, №4, 2021
Вернуться к номеру
Застосування пекторальної та паравертебральної блокади в хірургії злоякісних новоутворень молочної залози з позиції концепції швидкого відновлення
Авторы: Марцінів В.В.
Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
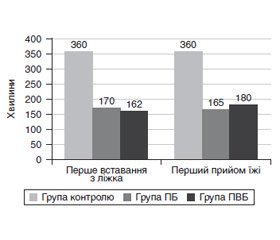
Актуальність. Хірургічні втручання з приводу онкологічних захворювань молочної залози супроводжуються вираженим болем, підвищеною частотою післяопераційної нудоти і блювання (ПОНБ), що сповільнює активізацію в післяопераційному періоді. Регіонарні методи анестезії забезпечують краще знеболювання і можуть бути компонентом концепції швидкого відновлення після цих операцій. Мета дослідження: порівняти вплив пекторальної, паравертебральної блокади та системної аналгезії на потребу в наркотичних анальгетиках, виникнення ПОНБ, початок прийому їжі та активізацію пацієнтів в постопераційному періоді хірургічних втручань з приводу новоутворень молочної залози. Матеріали та методи. У дослідження ввійшла 91 жінка після унілатеральної мастектомії або квадрантектомії з аксилярною лімфодисекцією. Пацієнти були рандомізовані в три групи залежно від виду анестезії: виключно загальна анестезія (ЗА) (група контролю), ЗА та пекторальна блокада розчином ропівакаїну 0,375% 30 мл (група ПБ), ЗА та грудна паравертебральна блокада розчином ропівакаїну 0,5% (група ПВБ). Оцінювали потребу в наркотичних анальгетиках під час і після операції, виникнення ПОНБ, час до першого прийому їжі та активізації пацієнтів у післяопераційному періоді. Результати. Доза фентанілу під час операції становила в групі контролю 2,6 (2,07–3,62) мкг/кг/год, у групі ПБ — 2,3 (1,86–2,94) мкг/кг/год, у групі ПВБ — 1,9 (1,62–2,24) мкг/кг/год (р = 0,003). Кількість пацієнтів, які потребували знеболювання промедолом 2% після операції, у групі контролю становила 9 (31 %), у групі ПВБ — 8 (27 %) та в групі ПБ — 6 (19 %) (р = 0,542). Час до першого вставання з ліжка був 360 (150–360) хв, 170 (120–240) хв та 162,5 (120–240) хв (р = 0,003), а час до першого прийому їжі — 360 (240–360) хв, 165 (120–240) хв та 180 (120–220) хв (р < 0,001) у групах контролю, ПБ та ПВБ відповідно. Частота виникнення ПОНБ була найменша в групі ПБ — 6 проти 27 і 31 % в групах ПВБ і контролю (р = 0,027) відповідно. Висновки. Найбільше переваг з позиції концепції швидкого відновлення після онкологічних втручань на молочній залозі серед досліджуваних методів аналгезії має використання пекторальної блокади.
Background. Breast cancer surgery is associated with severe postoperative pain and increased frequency of postoperative nausea and vomiting (PONV). It slows down patients’ mobilization in the postoperative period. Regional anesthesia provides better analgesia and can be part of enhanced recovery after surgery. The purpose of this study is to compare the efficacy of the pectoral nerve block type II, paravertebral block, and systemic analgesia concerning the opioids consumption, PONV, time to first food intake, and mobilization of patients in the perioperative period of breast cancer surgery. Materials and methods. Ninety-one adult women after unilateral radical mastectomy or quadrantectomy with axillary dissection were enrolled and randomized into three groups depending on the type of anesthesia. The control group included only patients with general anesthesia (GA), pectoral block group — GA plus pectoral nerve block type II with ropivacaine 0.375% 30 ml, and paravertebral block (PVB) group — GA plus thoracic paravertebral block with ropivacaine 0.5% 20 ml. The evaluated variables included opioids consumption during and after surgery, the occurrence of PONV, the time to the first feeding, and first mobilization in the postoperative period. Results. The dose of fentanyl during the operation was 2.6 (2.07‑3.62) μg/kg/h in the control group, 2.3 (1.86‑2.94) μg/kg/h in the PB group, 1.9 (1.62‑2.24) μg/kg/h in the PVB group (p = 0.003). Nine patients (31 %) in the control group, 8 patients (27 %) in the PVB group, and 6 patients (19 %) in the PB group required analgesia with promedol 2% after surgery (p = 0.542). The time to getting out of bed in the control, PB and PVB groups was 360 (150–360) min, 170 (120–240) min, and 162.5 (120–240) min, respectively (p = 0.003), and the time to the first meal was 360 (240–360) min, 165 (120–240) min, and 180 (120–220) min, respectively (p < 0.001). The incidence of PONV was the lowest in the PB group — 6 vs. 27 vs. 31 % in the PVB and control groups, respectively (p = 0.027). Conclusions. Among studied methods of analgesia in breast cancer surgery, the pectoral nerve block type II has the greatest advantages for enhanced recovery after surgery.
грудна паравертебральна блокада; пекторальна блокада; хірургія молочної залози
thoracic paravertebral block; pectoral nerve block; breast surgery
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Бюлетень Національного канцер-реєстру в Україні № 19. К., 2018. URL: http://www.ncru.inf.ua/publications/BULL_19/PDF_E/42-43-mol.pdf (дата звернення: 05.08.2018).
- Matsumoto M., Flores E.M., Kimachi P.P. et al. Benefts in radical mastectomy protocol: a randomized trial evaluating the use of regional anesthesia. Scientific RepoRts. 2018. 8(7815). 1-9. doi: 10.1038/s41598-018-26273-z. PMID: 29777144; PMCID: PMC5959858.
- Tan Y.Z., Lu X., Luo J. et al. Enhanced Recovery After Surgery for Breast Reconstruction: Pooled Meta-Analysis of 10 Observational Studies Involving 1,838 Patients. Front. Oncol. 2019 Jul 30. 9. 675. doi: 10.3389/fonc.2019.00675. PMID: 31417864; PMCID: PMC6682620.
- Pek C.H., Tey J., Tan E.Y. Ambulatory surgery for the patient with breast cancer: current perspectives. Open Access. Surgery. 2016. 9. 65-70. doi: 10.2147/OAS.S97551.
- Sittl R., Irnich D., Lang P.M. Update zur präemptiven Analgesie: Möglichkeiten und Grenzen der präoperativen Schmerztherapie [Update on preemptive analgesia: options and limits of preoperative pain therapy]. Anaesthesist. 2013 Oct. 62(10). 789-96. German. doi: 10.1007/s00101-013-2225-3. PMID: 24052051.
- Schnabel A., Reichl S.U., Kranke P., Pogatzki-Zahn E.M., Zahn P.K. Efficacy and safety of paravertebral blocks in breast surgery: a meta-analysis of randomized controlled trials. Br. J. Anaesth. 2010 Dec. 105(6). 842-52. doi: 10.1093/bja/aeq265. Epub 2010 Oct 14. Erratum in: Br. J. Anaesth. 2013 Sep. 111(3). 522. PMID: 20947592.
- Hussain N., Brull R., McCartney C.J.L. et al. Pectoralis-II Myofascial Block and Analgesia in Breast Cancer Surgery: A Systematic Review and Meta-analysis. Anesthesiology. 2019 Sep. 131(3). 630-648. doi: 10.1097/ALN.0000000000002822. PMID: 31408448.
- Jacobs A., Lemoine A., Joshi G.P., Van de Velde M., Bonnet F. PROSPECT guideline for oncological breast surgery: a systematic review and procedure-specific postoperative pain management recommendations. Anaesthesia. 2020 May. 75(5). 664-673. doi: 10.1111/anae.14964. Epub 2020 Jan 26. PMID: 31984479; PMCID: PMC7187257.
- Wahba S.S., Kamal S.M. Thoracic paravertebral block versus pectoral nerve block for analgesia after breast surgery. Egyptian Journal of Anaesthesia. 2014. 30. 129-135. doi: 10.1016/j.egja.2013.10.006
- Syal K., Chandel A. Comparison of the post-operative analgesic effect of paravertebral block, pectoral nerve block and local infiltration in patients undergoing modified radical mastectomy: A randomised double-blind trial. Indian J. Anaesth. 2017 Aug. 61(8). 643-648. doi: 10.4103/ija.IJA_81_17. PMID: 28890559; PMCID: PMC5579854.
- Lönnqvist P.A., MacKenzie J., Soni A.K., Conacher I.D. Paravertebral blockade. Failure rate and complications. Anaesthesia. 1995 Sep. 50(9). 813-5. doi: 10.1111/j.1365-2044.1995.tb06148.x. PMID: 7573876.
- Terkawi A.S., Tsang S., Sessler D.I. et al. Improving Analgesic Efficacy and Safety of Thoracic Paravertebral Block for Breast Surgery: A Mixed-Effects Meta-Analysis. Pain Physician. 2015 Sep-Oct. 18(5). E757-80. PMID: 26431130.
- Scherer R., Schmutzler M., Giebler R., Erhard J., Stöcker L., Kox W.J. Complications related to thoracic epidural analgesia: a prospective study in 1071 surgical patients. Acta Anaesthesiol. Scand. 1993 May. 37(4). 370-4. doi: 10.1111/j.1399-6576.1993.tb03731.x. PMID: 8322565.
- Kamiya Y., Hasegawa M., Yoshida T., Takamatsu M., Koyama Y. Impact of pectoral nerve block on postoperative pain and quality of recovery in patients undergoing breast cancer surgery: A randomised controlled trial. Eur. J. Anaesthesiol. 2018 Mar. 35(3). 215-223. doi: 10.1097/EJA.0000000000000762. PMID: 29227351.
- Versyck B., van Geffen G.J., van Houwe P. Prospective double blind randomized placebo-controlled clinical trial of the pectoral nerves (Pecs) block type II. J. Clin. Anesth. 2017 Aug. 40. 46-50. doi: 10.1016/j.jclinane.2017.03.054. PMID: 28625445.
- Hassn A., Zanfaly H., Biomy T. Pre-emptive analgesia of ultrasound-guided pectoral nerve block II with dexmedetomidine-bupivacaine for controlling chronic pain after modified radical mastectomy. Res. Opin. Anesth. Int. Care. 2016. 3. 6-12. doi 10.4103/2356-9115.184078.
- Wang W., Song W., Yang C. et al. Ultrasound-Guided Pectoral Nerve Block I and Serratus-Intercostal Plane Block Alleviate Postoperative Pain in Patients Undergoing Modified Radical Mastectomy. Pain Physician. 2019 Jul. 22(4). E315-E323. PMID: 31337173.
- Pandey R.K., Sharma A. et al. Pectoral nerve blocks to improve analgesia after breast cancer surgery: A prospective, randomized and controlled trial. J. Clin. Anesth. 2018 Mar. 45. 12-17. doi: 10.1016/j.jclinane.2017.11.027. Epub 2017 Dec 11. PMID: 29241077.
- Blanco R., Fajardo M., Parras Maldonado T. Ultrasound description of Pecs II (modified Pecs I): a novel approach to breast surgery. Rev. Esp. Anestesiol. Reanim. 2012 Nov. 59(9). 470-475. doi: 10.1016/j.redar.2012.07.003. PMID: 22939099.
- O’Riain S.C., Donnell B.O., Cuffe T., Harmon D.C., Fraher J.P., Shorten G. Thoracic paravertebral block using real-time ultrasound guidance. Anesth. Analg. 2010 Jan 1. 110(1). 248-251. doi: 10.1213/ANE.0b013e3181c35906. PMID: 19933536.
- Marhofer D., Marhofer P., Kettner S.C. et al. Magnetic resonance imaging analysis of the spread of local anesthetic solution after ultrasound-guided lateral thoracic paravertebral blockade: a volunteer study. Anesthesiology. 2013 May. 118(5). 1106-12. doi: 10.1097/ALN.0b013e318289465f. PMID: 23442752.
- Kulhari S., Bharti N., Bala I., Arora S., Singh G. Efficacy of pectoral nerve block versus thoracic paravertebral block for postoperative analgesia after radical mastectomy: a randomized controlled trial. Br. J. Anaesth. 2016 Sep. 117(3). 382-6. doi: 10.1093/bja/aew223. PMID: 27543533.
- Cheema S.P., Ilsley D., Richardson J., Sabanathan S. A thermographic study of paravertebral analgesia. Anaesthesia. 1995 Feb. 50(2). 118-121. doi: 10.1111/j.1365-2044.1995.tb15092.x. PMID: 7710020.
- Kim D.H., Kim S., Kim C.S. et al. Efficacy of Pectoral Nerve Block Type II for Breast-Conserving Surgery and Sentinel Lymph Node Biopsy: A Prospective Randomized Controlled Study. Pain Res. Manag. 2018 May 15. 2018. 4315931. doi: 10.1155/2018/4315931. PMID: 29861803; PMCID: PMC5976903.
- Li N.L., Yu B.L., Hung C.F. Paravertebral Block Plus Thoracic Wall Block versus Paravertebral Block Alone for Analgesia of Modified Radical Mastectomy: A Retrospective Cohort Study. PLoS One. 2016 Nov 9. 11(11). e0166227. doi: 10.1371/journal.pone.0166227. PMID: 27829018; PMCID: PMC5102399.
- Zhao J., Han F., Yang Y., Li H., Li Z. Pectoral nerve block in anesthesia for modified radical mastectomy: A meta-analysis based on randomized controlled trials. Medicine (Baltimore). 2019 May. 98(18). Е15423. doi: 10.1097/MD.0000000000015423. PMID: 31045802; PMCID: PMC6504333.
- El-Sheikh S.M., Fouad A., Bashandy G.N. et al. Ultrasound guided modified pectoral nerves block versus thoracic paravertebral block for perioperative analgesia in major breast surgery. Medical Journal of Cairo University. 2016. 84. 189-95. doi: 10.4103/sja.SJA_25_19. PMCID: PMC6753749. PMID: 31572077.
- Annamalai G., Durairaj A.K., Kailasam K.R. Pectoral nerve block versus thoracic paravertebral block — Comparison of analgesic efficacy for postoperative pain relief in modified radical mastectomy surgeries. Journal of Evolution of Medical and Dental Sciences. 2017. 6. 4412-16. doi: 10.4103/ija.IJA_523_17.
- Kasimahanti R., Arora S., Bhatia N., Singh G. Ultrasound-guided single- vs double-level thoracic paravertebral block for postoperative analgesia in total mastectomy with axillary clearance. J. Clin. Anesth. 2016 Sep. 33. 414-21. doi: 10.1016/j.jclinane.2016.01.027. Epub 2016 Jun 4. PMID: 27555203.

/55.jpg)
/56.jpg)
/56_2.jpg)
/57.jpg)
/57_2.jpg)