Журнал «Медицина неотложных состояний» Том 17, №5, 2021
Вернуться к номеру
Рання діагностика та профілактика гострого пошкодження нирок у пацієнтів похилого віку після ургентної абдомінальної хірургії
Авторы: Момот Н.В., Туманська Н.В., Петренко Ю.М., Воротинцев С.І.
Запорізький державний медичний університет, м. Запоріжжя, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У зв’язку зі стрімким старінням населення кількість пацієнтів похилого віку швидко зростає. Літні хворі — особлива когорта пацієнтів внаслідок характерних для них фізіологічних та анатомічних вікових змін, тендітності й коморбідності. Одним із загрозливих періопераційних ускладнень у пацієнтів похилого віку є гостре пошкодження нирок (ГПН), яке пов’язане з більш тривалим перебуванням в стаціонарі, підвищенням короткочасної та довгострокової летальності. Незважаючи на постійні зусилля щодо стандартизації визначення ГПН з використанням креатиніну сироватки крові, цей метод має низку недоліків, що обумовлює актуальність пошуків інших діагностичних критеріїв пошкодження нирок. Останнім часом усе більшої популярності набуває визначення біомаркерів (ліпокалін-2, інтерлейкін-18, цистатин С), які можуть бути корисними у ранній діагностиці ГПН. Зважаючи на те, що фільтруюча здатність нирок — єдиний фактор, що визначає концентрацію цистатину С в сироватці крові, цей маркер є найбільш цінним. Перспективним також вважається використання ультразвуку для ранньої діагностики ГПН. Декілька досліджень демонструють, що нирковий резистивний індекс і напівкількісна оцінка ниркового кровотоку добре зарекомендували себе для діагностики стійкого ГПН. Високий рівень смертності та відсутність спеціального лікування підсилюють необхідність профілактики ГПН у літніх людей, основою якої є ретельний клінічний моніторинг зі своєчасною корекцією гіповолемії і гіпотензії. При виконанні інвазивних процедур ризик ГПН можна зменшити, підтримуючи середній артеріальний тиск > 80 мм рт.ст. і гематокрит > 30 %, а також забезпечуючи адекватну оксигенацію та відновлення об’єму крові. Призначення препаратів має бути індивідуалізованим шляхом коригування доз відповідно до швидкості клубочкової фільтрації та віку пацієнта. Проте відкритим залишається питання специфічної медикаментозної профілактики ГПН. Ренопротективні властивості дексмедетомідину були підтверджені в декільках дослідженнях у кардіохірургії, також в літературі описано певний позитивний вплив пентоксифіліну при лікуванні патології нирок. Даний огляд розкриває тему ГПН у пацієнтів похилого віку в абдомінальній хірургії та зосереджує увагу на питаннях ранньої діагностики і профілактики цього синдрому.
Due to the rapidly aging of the population, the number of elderly patients is boosting. Elderly patients are a special cohort of patients due to their typical physiological and anatomical age-related changes, fragility, and comorbidity. One of the threatening perioperative complications is acute kidney injury (AKI), which is associated with a longer hospital stay, increased short-term and long-term mortality. Despite constant efforts to standardize the determination of AKI using serum creatinine, this method has several disadvantages, which makes the search for other diagnostic criteria for kidney damage urgent. Recently, the determination of biomarkers (lipocalin-2, interleukin-18, cystatin C), which can be useful in the early diagnosis of AKI, has become increasingly popular. Even though the filtration capacity of the kidneys is the only factor determining the serum cystatin C concentration, this marker is the most valuable. The use of ultrasound for the early diagnosis of AKI is also considered promising. Several studies show that the renal resistance index and semi-quantitative assessment of renal blood flow work are well for diagnosing persistent AKI. The high mortality rate and the lack of special treatment increase the need for AKI prevention in the elderly, the main one of which is careful clinical monitoring with timely correction of hypovolemia and hypotension. With invasive procedures, the risk of AKI can be reduced by maintaining mean arterial pressure > 80 mmHg and hematocrit > 30 %, as well as providing adequate oxygenation and volume restoration. Prescription of drugs should be individualized by adjusting doses based on the glomerular filtration rate and the patient’s age. However, the question of specific drug prevention of AKI remains open. Several studies have confirmed the renoprotective properties of dexmedetomidine in cardiac surgery, and some positive effects of pentoxifylline for the treatment of renal pathology are also described in the literature. This review explores the topic of AKI in elderly patients undergoing abdominal surgery and focuses on the early diagnosis and prevention of this syndrome.
абдоминальнальна хірургія; пацієнти похилого віку; гостре пошкодження нирок; огляд
bdominal surgery; elderly patients; acute kidney injury; review
Вступ
Актуальність
Визначення
Патофізіологія
Діагностика
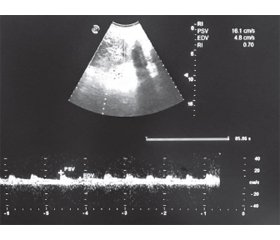
Ультразвукова діагностика як метод ранньої діагностики
/55.jpg)
Фактори ризику ГПН у літніх пацієнтів
Профілактика гострого пошкодження нирок
Висновки
- Dey A.B. World report on ageing and health. Indian J. Med. Res. 2017. 145(1). 150-151. doi: 10.4103/0971-5916.207249.
- Brinson Z., Tang V.L., Finlayson E. Postoperative Functional Outcomes in Older Adults. Curr. Surg. Rep. 2016. 4(6). 21. doi: 10.1007/s40137-016-0140-7.
- Rewa O., Bagshaw S.M. Acute kidney injury-epidemiology, outcomes and economics. Nat. Rev. Nephrol. 2014. 10(4). 193-207. doi: 10.1038/nrneph.2013.282.
- Kork F., Balzer F., Spies C.D. et al. Minor Postoperative Increases of Creatinine Are Associated with Higher Mortality and Longer Hospital Length of Stay in Surgical Patients. Anesthesiology. 2015. 123(6). 1301-1311. doi: 10.1097/ALN.0000000000000891.
- Cho E., Kim S.C., Kim M.G., Jo S.K., Cho W.Y., Kim H.K. The incidence and risk factors of acute kidney injury after hepatobiliary surgery: a prospective observational study. BMC Nephrol. 2014. 15. 169. Published 2014 Oct 23. doi: 10.1186/1471-2369-15-169.
- Hobson C., Ozrazgat-Baslanti T., Kuxhausen A. et al. Cost and Mortality Associated With Postoperative Acute Kidney Injury. Ann. Surg. 2015. 261(6). 1207-1214. doi: 10.1097/SLA.0000000000000732.
- Teixeira C., Rosa R., Rodrigues N. et al. Acute kidney injury after major abdominal surgery: a retrospective cohort analysis. Crit. Care Res. Pract. 2014. 2014. 132175. doi: 10.1155/2014/132175.
- Gameiro J., Fonseca J.A., Neves M., Jorge S., Lopes J.A. Acute kidney injury in major abdominal surgery: incidence, risk factors, pathogenesis and outcomes. Ann. Intensive Care. 2018. 8(1). 22. Published 2018 Feb 9. doi: 10.1186/s13613-018-0369-7.
- Biteker M., Dayan A., Tekkeşin A.İ. et al. Incidence, risk factors, and outcomes of perioperative acute kidney injury in noncardiac and nonvascular surgery. Am. J. Surg. 2014. 207(1). 53-59. doi: 10.1016/j.amjsurg.2013.04.006.
- Bellomo R., Ronco C., Mehta R.L. et al. Acute kidney injury in the ICU: from injury to recovery: reports from the 5th Paris International Conference. Ann. Intensive Care. 2017. 7(1). 49. doi: 10.1186/s13613-017-0260-y.
- Medeiros P., Nga H.S., Menezes P., Bridi R., Balbi A., Ponce D. Acute kidney injury in septic patients admitted to emergency clinical room: risk factors and outcome. Clin. Exp. Nephrol. 2015. 19(5). 859-866. doi: 10.1007/s10157-014-1076-9.
- Oweis A.O., Alshelleh S.A. Incidence and outcomes of acute kidney injury in octogenarians in Jordan. BMC Res. Notes. 2018. 11(1). 279. Published 2018 May 8. doi: 10.1186/s13104-018-3397-3.
- Yao H.K., Omer Binan A.Y., Konan S.D., N’Da K.J., Diopoh S.P. Mortality in the elderly with acute kidney injury in an internal medicine department in Abidjan, Cote D’Ivoire. Saudi J. Kidney Dis. Transpl. 2018. 29(2). 414-421. doi: 10.4103/1319-2442.229267.
- Rosner M.H., La Manna G., Ronco C. Acute Kidney Injury in the Geriatric Population. Contrib. Nephrol. 2018. 193. 149-160. doi: 10.1159/000484971.
- Chawla L.S., Bellomo R., Bihorac A. et al. Acute kidney disease and renal recovery: consensus report of the Acute Disease Quality Initiative (ADQI) 16 Workgroup. Nat. Rev. Nephrol. 2017. 13(4). 241-257. doi: 10.1038/nrneph.2017.2.
- Lewington A.J., Cerdá J., Mehta R.L. Raising awareness of acute kidney injury: a global perspective of a silent killer. Kidney Int. 2013. 84(3). 457-467. doi: 10.1038/ki.2013.153.
- Hoste E.A., Bagshaw S.M., Bellomo R. et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study. Intensive Care Med. 2015. 41(8). 1411-1423. doi: 10.1007/s00134-015-3934-7.
- Coca S.G., Singanamala S., Parikh C.R. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney Int. 2012. 81(5). 442-448. doi: 10.1038/ki.2011.379.
- Acuna K., Costa E., Grover A., Camelo A., Santos Júnior R. Características clínico-epidemiológicas de adultos e idosos atendidos em unidade de terapia intensiva pública da Amazônia (Rio Branco, Acre). Rev. Bras. Ter. Intensiva. 2007. 19(3). 304-309.
- Ishani A., Xue J.L., Himmelfarb J. et al. Acute kidney injury increases risk of ESRD among elderly. J. Am. Soc. Nephrol. 2009. 20(1). 223-228. doi: 10.1681/ASN.2007080837.
- Chawla L.S., Kimmel P.L. Acute kidney injury and chronic kidney disease: an integrated clinical syndrome. Kidney Int. 2012. 82(5). 516-524. doi: 10.1038/ki.2012.208.
- Chawla L.S., Eggers P.W., Star R.A., Kimmel P.L. Acute kidney injury and chronic kidney disease as interconnected syndromes. N. Engl. J. Med. 2014. 371(1). 58-66. doi: 10.1056/NEJMra1214243.
- Pannu N. Bidirectional relationships between acute kidney injury and chronic kidney disease. Curr. Opin. Nephrol. Hypertens. 2013. 22(3). 351-356. doi: 10.1097/MNH.0b013e32835fe5c5.
- Bell S., Davey P., Nathwani D. et al. Risk of AKI with gentamicin as surgical prophylaxis. J. Am. Soc. Nephrol. 2014. 25(11). 2625-2632. doi: 10.1681/ASN.2014010035.
- Correa-Gallego C., Berman A., Denis S.C. et al. Renal function after low central venous pressure-assisted liver resection: assessment of 2116 cases. HPB (Oxford). 2015. 17(3). 258-264. doi: 10.1111/hpb.12347.
- Kambakamba P., Slankamenac K., Tschuor C. et al. Epidural analgesia and perioperative kidney function after major liver resection. Br. J. Surg. 2015. 102(7). 805-812. doi: 10.1002/bjs.9810.
- Sun L.Y., Wijeysundera D.N., Tait G.A., Beattie W.S. Association of intraoperative hypotension with acute kidney injury after elective noncardiac surgery. Anesthesiology. 2015. 123(3). 515-523. doi: 10.1097/ALN.0000000000000765.
- Tomozawa A., Ishikawa S., Shiota N., Cholvisudhi P., Makita K. Perioperative risk factors for acute kidney injury after liver resection surgery: an historical cohort study. Can. J. Anaesth. 2015. 62(7). 753-761. doi: 10.1007/s12630-015-0397-9.
- Vaught A.J., Ozrazgat-Baslanti T., Javed A., Morgan L., Hobson C.E., Bihorac A. Acute kidney injury in major gynaecological surgery: an observational study. BJOG. 2015. 122(10). 1340-1348. doi: 10.1111/1471-0528.13026.
- Long T.E., Helgason D., Helgadottir S. et al. Acute Kidney Injury After Abdominal Surgery: Incidence, Risk Factors, and Outcome. Anesth. Analg. 2016. 122(6). 1912-1920. doi: 10.1213/ANE.0000000000001323.
- Meersch M., Schmidt C., Zarbock A. Perioperative Acute Kidney Injury: An Under-Recognized Problem. Anesth. Analg. 2017. 125(4). 1223-1232. doi: 10.1213/ANE.0000000000002369.
- Gumbert S.D., Kork F., Jackson M.L. et al. Perioperative Acute Kidney Injury. Anesthesiology. 2020. 132(1). 180-204. doi: 10.1097/ALN.0000000000002968.
- Hall J.E., Guyton A.C. Guyton and Hall textbook of medical physiology. Philadelphia, PA: Saunders Elsevier, 2011.
- Yong Z., Pei X., Zhu B., Yuan H., Zhao W. Predictive value of serum cystatin C for acute kidney injury in adults: a meta-analysis of prospective cohort trials. Sci. Rep. 2017. 7. 41012. Published 2017 Jan 23. doi: 10.1038/srep41012.
- Srisawat N., Praditpornsilpa K., Patarakul K. et al. Neutrophil Gelatinase Associated Lipocalin (NGAL) in Leptospirosis Acute Kidney Injury: A Multicenter Study in Thailand. PLoS One. 2015. 10(12). e0143367. Published 2015 Dec 2. doi: 10.1371/journal.pone.0143367.
- Nisula S., Yang R., Poukkanen M. et al. Predictive value of urine interleukin-18 in the evolution and outcome of acute kidney injury in critically ill adult patients. Br. J. Anaesth. 2015. 114(3). 460-468. doi: 10.1093/bja/aeu382.
- Shlipak M.G., Sarnak M.J., Katz R. et al. Cystatin C and the risk of death and cardiovascular events among elderly persons. N. Engl. J. Med. 2005. 352(20). 2049-2060. doi: 10.1056/NEJMoa043161.
- Hobson C., Ruchi R., Bihorac A. Perioperative Acute Kidney Injury: Risk Factors and Predictive Strategies. Crit. Care Clin. 2017. 33(2). 379-396. doi: 10.1016/j.ccc.2016.12.008.
- Regolisti G., Maggiore U., Cademartiri C. et al. Renal resistive index by transesophageal and transparietal echo-doppler imaging for the prediction of acute kidney injury in patients undergoing major heart surgery. J. Nephrol. 2017. 30(2). 243-253. doi: 10.1007/s40620-016-0289-2.
- Schnell D., Darmon M. Bedside Doppler ultrasound for the assessment of renal perfusion in the ICU: advantages and limitations of the available techniques. Crit. Ultrasound J. 2015. 7(1). 24. doi: 10.1186/s13089-015-0024-6.
- Darmon M., Bourmaud A., Reynaud M. et al. Performance of Doppler-based resistive index and semi-quantitative renal perfusion in predicting persistent AKI: results of a prospective multicenter study. Intensive Care Med. 2018. 44(11). 1904-1913. doi: 10.1007/s00134-018-5386-3.
- Kararmaz A., Kemal Arslantas M., Cinel I. Renal Resistive Index Measurement by Transesophageal Echocardiography: Comparison With Translumbar Ultrasonography and Relation to Acute Kidney Injury. J. Cardiothorac. Vasc. Anesth. 2015. 29(4). 875-880. doi: 10.1053/j.jvca.2014.11.003.
- Marty P., Szatjnic S., Ferre F. et al. Doppler renal resistive index for early detection of acute kidney injury after major orthopaedic surgery: a prospective observational study. Eur. J. Anaesthesiol. 2015. 32(1). 37-43. doi: 10.1097/EJA.0000000000000120.
- Boddi M., Bonizzoli M., Chiostri M. et al. Renal Resistive Index and mortality in critical patients with acute kidney injury. Eur. J. Clin. Invest. 2016. 46(3). 242-251. doi: 10.1111/eci.12590.
- Gornik I., Godan A., Gašparović V. Renal resistive index at ICU admission and its change after 24 hours predict acute kidney injury in sepsis. Crit. Care. 2014. 18(Suppl. 1). 366. doi: 10.1186/cc13556.
- Lahmer T., Rasch S., Schnappauf C., Schmid R.M., Huber W. Influence of volume administration on Doppler-based renal resistive index, renal hemodynamics and renal function in medical intensive care unit patients with septic-induced acute kidney injury: a pilot study. Int. Urol. Nephrol. 2016. 48(8). 1327-1334. doi: 10.1007/s11255-016-1312-1.
- Schnell D., Reynaud M., Venot M. et al. Resistive Index or Сolor-Doppler semi-quantitative evaluation of renal perfusion by inexperienced physicians: results of a pilot study. Minerva Anestesiol. 2014. 80(12). 1273-1281.
- Pedersen A.B., Gammelager H., Kahlert J., Sørensen H.T., Christiansen C.F. Impact of body mass index on risk of acute kidney injury and mortality in elderly patients undergoing hip fracture surgery. Osteoporos. Int. 2017. 28(3). 1087-1097. doi: 10.1007/s00198-016-3836-8.
- Yokota L.G., Sampaio B.M., Rocha E.P., Balbi A.L., Sousa Prado I.R., Ponce D. Acute kidney injury in elderly patients: narrative review on incidence, risk factors, and mortality. Int. J. Nephrol. Renovasc. Dis. 2018. 11. 217-224. Published 2018 Aug 14. doi: 10.2147/IJNRD.S170203.
- Silveira Santos C.G.D., Romani R.F., Benvenutti R., Ribas Zahdi J.O., Riella M.C., Mazza do Nascimento M. Acute Kidney Injury in Elderly Population: A Prospective Observational Study. Nephron. 2018. 138(2). 104-112. doi: 10.1159/000481181.
- Funk I., Seibert E., Markau S., Girndt M. Clinical Course of Acute Kidney Injury in Elderly Individuals Above 80 Years. Kidney Blood Press Res. 2016. 41(6). 947-955. doi: 10.1159/000452599.
- Petronijevic Z., Selim G, Petkovska L., Georgievska-Ismail L., Spasovski G., Tozija L. The Effect of Treatment on Short-Term Outcomes in Elderly Patients with Acute Kidney Injury. Open Access Maced. J. Med. Sci. 2017. 5(5). 635-640. Published 2017 Aug 9. doi: 10.3889/oamjms.2017.148.
- Hsu R.K., Siew E.D. The growth of AKI: half empty or half full, it’s the size of the glass that matters. Kidney Int. 2017. 92(3). 550-553. doi: 10.1016/j.kint.2017.04.047.
- Joannidis M., Druml W., Forni L.G. et al. Prevention of acute kidney injury and protection of renal function in the intensive care unit: update 2017: Expert opinion of the Working Group on Prevention, AKI section, European Society of Intensive Care Medicine. Intensive Care Med. 2017. 43(6). 730-749. doi: 10.1007/s00134-017-4832-y.
- Zarbock A., Koyner J.L., Hoste E.A.J., Kellum J.A. Update on Perioperative Acute Kidney Injury. Anesth. Analg. 2018. 127(5). 1236-1245. doi: 10.1213/ANE.0000000000003741.
- Teixeira C., Garzotto F., Piccinni P. et al. Fluid balance and urine volume are independent predictors of mortality in acute kidney injury. Crit. Care. 2013. 17(1). R14. Published 2013 Jan 24. doi: 10.1186/cc12484.
- Garzotto F., Ostermann M., Martín-Langerwerf D. et al. The Dose Response Multicentre Investigation on Fluid Assessment (DoReMIFA) in critically ill patients. Crit. Care. 2016. 20(1). 196. Published 2016 Jun 23. doi: 10.1186/s13054-016-1355-9.
- Neyra J.A., Li X., Canepa-Escaro F. et al. Cumulative Fluid Balance and Mortality in Septic Patients With or Without Acute Kidney Injury and Chronic Kidney Disease. Crit. Care Med. 2016. 44(10). 1891-1900. doi: 10.1097/CCM.0000000000001835.
- Thongprayoon C., Cheungpasitporn W., Podboy A.J., Gillaspie E.A., Greason K.L., Kashani K.B. The effects of contrast media volume on acute kidney injury after transcatheter aortic valve replacement: a systematic review and meta-analysis. J. Evid. Based Med. 2016. 9(4). 188-193. doi: 10.1111/jebm.12208.
- Amendola C.P., Silva-Jr J.M., Carvalho T. et al. Goal-directed therapy in patients with early acute kidney injury: a multicenter randomized controlled trial. Clinics (Sao Paulo). 2018. 73. e327. Published 2018 Oct 29. doi: 10.6061/clinics/2018/e327.
- Leite T.T., Macedo E., Martins Ida S., Neves F.M., Libório A.B. Renal Outcomes in Critically Ill Patients Receiving Propofol or Midazolam. Clin. J. Am. Soc. Nephrol. 2015. 10(11). 1937-1945. doi: 10.2215/CJN.02330315.
- Yoo Y.C., Shim J.K., Song Y., Yang S.Y., Kwak Y.L. Anesthetics influence the incidence of acute kidney injury following valvular heart surgery. Kidney Int. 2014. 86(2). 414-422. doi: 10.1038/ki.2013.532.
- Tan F., Chen Y., Yuan D., Gong C., Li X., Zhou S. Dexmedetomidine protects against acute kidney injury through downregulating inflammatory reactions in endotoxemia rats. Biomed. Rep. 2015. 3(3). 365-370. doi: 10.3892/br.2015.427.
- Yao H., Chi X., Jin Y. et al. Dexmedetomidine Inhibits TLR4/NF-κB Activation and Reduces Acute Kidney Injury after Orthotopic Autologous Liver Transplantation in Rats. Sci. Rep. 2015. 5. 16849. Published 2015 Nov 20. doi: 10.1038/srep16849.
- Malek M., Nematbakhsh M. Renal ischemia/reperfusion injury; from pathophysiology to treatment. J. Renal. Inj. Prev. 2015. 4(2). 20-27. Published 2015 Jun 1. doi: 10.12861/jrip.2015.06.
- Kwiatkowski D.M., Axelrod D.M., Sutherland S.M., Tesoro T.M., Krawczeski C.D. Dexmedetomidine Is Associated With Lower Incidence of Acute Kidney Injury After Congenital Heart Surgery. Pediatr. Crit. Care Med. 2016. 17(2). 128-134. doi: 10.1097/PCC.0000000000000611.
- Xue F., Zhang W., Chu H.C. Assessing perioperative dexmedetomidine reduces the incidence and severity of acute kidney injury following valvular heart surgery. Kidney Int. 2016. 89(5). 1164. doi: 10.1016/j.kint.2015.12.053.
- Balkanay O.O., Goksedef D., Omeroglu S.N., Ipek G. The dose-related effects of dexmedetomidine on renal functions and serum neutrophil gelatinase-associated lipocalin values after coronary artery bypass grafting: a randomized, triple-blind, placebo-controlled study. Interact. Cardiovasc. Thorac. Surg. 2015. 20(2). 209-214. doi: 10.1093/icvts/ivu367.
- Cho J.S., Shim J.K., Soh S., Kim M.K., Kwak Y.L. Perioperative dexmedetomidine reduces the incidence and severity of acute kidney injury following valvular heart surgery. Kidney Int. 2016. 89(3). 693-700. doi: 10.1038/ki.2015.306.
- Renke M., Tylicki L., Rutkowski P. et al. Effect of pentoxifylline on proteinuria, markers of tubular injury and oxidative stress in non-diabetic patients with chronic kidney disease — placebo controlled, randomized, cross-over study. Acta Biochim. Pol. 2010. 57(1). 119-123.
- Barkhordari K., Karimi A., Shafiee A. et al. Effect of pentoxifylline on preventing acute kidney injury after cardiac surgery by measuring urinary neutrophil gelatinase — associated lipocalin. J. Cardiothorac. Surg. 2011. 6. 8. Published 2011 Jan 19. doi: 10.1186/1749-8090-6-8.

/52.jpg)
/53.jpg)
/54.jpg)
/55_2.jpg)