Вступ
Статистика воєн, локальних військових конфліктів вказує на те, що частота вогнепальних поранень кінцівок становить 54–70 %. Під час війни в Чечні 1999–2002 рр. вогнепальні поранення кінцівок становили 53 % [13]. За даними Командування Медичних сил Збройних сил України, вогнепальні поранення кінцівок становлять приблизно 64 %, із них 74,8 % — поранення м’яких тканин, 25,2 % — вогнепальні переломи. Поранення верхніх кінцівок становлять 35,7 %, нижніх — 64,3 %. Кісткові дефекти відмічаються в 11,6 % пацієнтів. Поранені, яким у подальшому необхідно виконувати реконструктивні оперативні втручання, становлять 35–40 % [13]. Функціональні результати лікування незадовільні в 48,9 % пацієнтів [13]. У цивільному житті травматичні пошкодження, за даними Всесвітньої організації охорони здоров’я (ВООЗ), посідають перше місце у віковій групі хворих від 15 до 44 років і входять у першу п’ятірку основних причин смерті в загальній популяції [26].
Звичайно, травматичні пошкодження призводять до виникнення больового синдрому, а можливість отримати ефективне лікування болю визначається як одне з прав людини [30], що закріплене в Монреальській декларації. Незважаючи на те, що проблематиці болю присвячені численні дослідження, які детально висвітлені у світовій літературі [31], а в Україні ґрунтовно викладені в дисертаціях Ю.Л. Кучина, Ю.Ю. Кобеляцького та І.І. Лісного [2, 7, 8], проблема болю в комбатантів із вогнепальними пораненнями кінцівок та посттравматичними стресовими розладами (ПТСР) залишається недостатньо дослідженою.
Ефективне лікування післяопераційного больового синдрому призводить до більш швидкого одужання, скорочення тривалості госпіталізації [27]. Контроль над болем не лише зменшує страждання пацієнта, але й полегшує психологічні порушення [28]. Однією з причин неефективного знеболювання є недостатньо кваліфікована оцінка больового синдрому та неповне впровадження нових наукових даних про біль у клінічну практику [29].
Одним із надзвичайно сильних психосоціальних стресорів, що впливає на усі верстви суспільства, є війна [3, 10]. Даний стресор негативно діє на стан психічного здоров’я всіх громадян нашої країни, насамперед безпосередніх учасників бойових дій [11, 22]. Травматична криза, що вони пережили, є підґрунтям для формування станів психічного порушення адаптації [21], серед яких і ПТСР [14, 17]. За даними ВООЗ, 16,2 % населення світу страждають від наслідків війни, а ще 12,5 % мають травмованих війною родичів [6, 16]. ПТСР стає безпосередньою причиною станів психічної дезадаптації у 80 % поранених [20], а в її віддаленому періоді (1 місяць або більше) часто спостерігаються: саморуйнівна поведінка, депресія, суїцид, залежність від алкоголю, наркотиків, тривожні розлади та інші негативні наслідки [5, 15]. Проблеми у сфері психічного здоров’я та психосоціальні наслідки кризисних подій тісно пов’язані між собою [6].
Невідкладна допомога комбатантам із ПТСР передбачає застосування комплексних психокорекційних методик [4, 19], а от психосоціальна допомога з віддаленими, клінічно окресленими наслідками є набагато складнішим завданням [9, 23]. У літературі описаний широкий спектр психофармакологічних та психотерапевтичних втручань при ПТСР, однак дані про їх ефективність неоднозначні [18, 24, 25]. Хоча і сучасні уявлення щодо усунення наслідків ПТСР передбачають застосування комплексного підходу [1], дана проблема поранених комбатантів належить до кола недостатньо вивчених [1].
Не вивченим є питання особливостей больового синдрому в комбатантів із вогнепальними пораненнями кінцівок та ПТСР. Лікування больового синдрому в пацієнтів із ПТСР має свої особливості, адже саме визначення вказує на те, що біль — це суб’єктивне, неприємне відчуття, емоційне переживання, пов’язане з реальною або потенційною загрозою пошкодження тканин, а також неприємний сенсорний, емоційний досвід, пов’язаний зі справжнім чи потенційним пошкодженням. Тобто пацієнти, які в умовах бойових дій отримали поранення, через призму набутих посттравматичних стресових розладів мають й особливості больового синдрому, що клінічно відображається складністю досягнення стійкого результату — контролю над болем.
Мета роботи: вивчити особливості больового синдрому в пацієнтів із вогнепальними пораненнями кінцівок та посттравматичними стресовими розладами.
Матеріали та методи
Дослідження виконувалось на базі Національного військово-медичного клінічного центру «Головний військовий клінічний госпіталь», у відділенні травматології клініки ушкоджень та клініці судинної хірургії (місто Київ). Загальна кількість досліджуваних пацієнтів становила 218 осіб. Пацієнти були розподілені на три групи: 1-ша — пацієнти, у яких методом вибору анестезіологічного забезпечення була загальна анестезія — тотальна внутрішньовенна анестезія (n = 53); 2-га — пацієнти, у яких методом вибору анестезіологічного забезпечення була реґіонарна анестезія — периферичні блокади (n = 73); 3-тя — пацієнти, у яких методом вибору анестезіологічного забезпечення була реґіонарна анестезія із седацією: седація забезпечувалась 1% розчином пропофолу (n = 92). Знеболювання в післяопераційному періоді в пацієнтів із 1-ї групи здійснювалося за допомогою нестероїдних протизапальних лікарських засобів та наркотичних анальгетиків, у пацієнтів із 2-ї та 3-ї груп — периферичних блокад.
У всіх пацієнтів оцінку анестезіологічного ризику проводили за шкалою American Society of Anesthesiologists (ASA). Базовим інструментом дослідження інтенсивності болю була візуальна аналогова шкала (ВАШ). Дослідження нейропатичного компоненту болю здійснювалося за допомогою діагностичного опитувальника для виявлення нейропатичного болю Douleur Neuropathique 4 questions (DN4) (Didier Bouhassiraa, Nadine Attala et al. Pain. 2005. 114. 29-36).
Аналіз результатів дослідження був проведений у пакеті EZR v.1.35 (R statistical software version 3.4.3, R Foundation for Statistical Computing, Vienna, Austria). Для надання кількісних ознак розраховувалися середнє значення показника та стандартне відхилення (± SD). Для порівняння показників у трьох групах використаний критерій Крускала — Уолліса (закон розподілу відрізнявся від нормального), постеріорне порівняння проводилося за критерієм Данна. Аналіз зміни показників із часом здійснювався за критерієм Фрідмана (для повторних вимірювань). Для кількісної оцінки ступеня впливу факторної ознаки розраховувався показник відношення шансів та його 95% довірчий інтервал. При проведенні аналізу у всіх випадках критичний рівень значимості прийнятий за 0,05.
Дослідження виконувалось у рамках протоколу біотичної експертизи — Міністерство охорони здоров’я України, Національний медичний університет імені О.О. Богомольця, Київ, Україна: протокол № 125, 21.10.2019 року.
Результати та обговорення
Анестезіологічне забезпечення оперативних втручань на кінцівках проводилось у вигляді загальної або реґіонарної анестезії. Частина пацієнтів, яким проводилась реґіонарна анестезія, отримувала седацію. Залежно від вибору анестезіологічного забезпечення пацієнти були розподілені на 3 групи. Група 1 — загальна анестезія (n = 53). Для седації використовували постійну інфузію 1% пропофолу зі швидкістю 1–4 мг/кг/год
залежно від біспектрального індексу (60–70 — для реґіонарної анестезії та 40–60 — для загальної анестезії). Аналгезія забезпечувалась 0,005% фентанілом: при індукції — 3–10 мкг/кг або 0,05–0,2 мкг/кг/хв, а для підтримання аналгезії — 2–10 мкг/кг/год шляхом періодичного болюсного введення по 25–100 мкг або постійною інфузією. Група 2 — реґіонарна анестезія: периферичні блокади (n = 73). Група 3 — реґіонарна анестезія із седацією (n = 92). Реґіонарна анестезія виконувалась під ультразвуковим контролем (апарат Mindray DP-30 з лінійним датчиком 5–10 МГц). Голку підводили до нервових корінців та вводили 20–30 мл 0,5% розчину бупівакаїну. Знеболювання в післяопераційному періоді в пацієнтів із 1-ї групи забезпечували відповідно до локального клінічного протоколу: парацетамол ± нестероїдні протизапальні лікарські засоби ± опіоїди; у пацієнтів з 2-ї та 3-ї груп — повторні периферичні блокади чи введення в катетер для пролонгованої реґіонарної анестезії 0,25% розчину бупівакаїну. В усіх комбатантів ПТСР оцінювали за допомогою МШ ПТСР (в), анестезіологічний ризик — за шкалою American Society of Anesthesiologists (ASA), інтенсивність болю — за ВАШ: вимірювання здійснювалися перед операцією, після операції, через 2 та 6 годин після операції, далі — кожні 4 години протягом першої післяопераційної доби; на 2-гу, 3-тю та 4-ту післяопераційні доби оцінка інтенсивності болю здійснювалась кожні 4 години, починаючи з 8:00 і до 22:00 та перед випискою, потім через 1, 3, 6 та 12 місяців після виписки, а нейропатичний компонент болю — за допомогою діагностичного опитувальника DN4: перед операцією, перед випискою, далі через 1, 3, 6, 12 місяців після виписки.
Загальна характеристика досліджуваних груп
Наданий аналіз даних результатів лікування 218 пацієнтів, яким необхідно було виконати реконструктивні оперативні втручання в умовах анестезіологічного забезпечення. Загальна характеристика пацієнтів наведена в табл. 1.
При проведенні аналізу не було виявлено статистично значимої відмінності віку пацієнтів у трьох групах (p = 0,424 за критерієм Крускала — Уолліса). Групи зіставні за віком, зростом, вагою пацієнтів, тривалістю анестезії та тривалістю оперативного втручання.
У табл. 2 наведений аналіз за оцінкою стану пацієнтів перед хірургічним втручанням пацієнтів відповідно до класифікації ASA в трьох групах.
При проведенні аналізу не було виявлено статистично значимої відмінності пацієнтів у трьох групах за оцінкою стану пацієнтів перед хірургічним втручанням відповідно до класифікації ASA (p = 0,517 за критерієм хі-квадрат) — групи зіставлені за анестезіологічним ризиком.
1. Вивчення інтенсивності болю за візуально-аналоговою шкалою
1.1. Під час стаціонарного лікування
У табл. 3 наведений аналіз оцінки болю за даними ВАШ під час лікування в стаціонарі.
При проведенні аналізу не було виявлено статистично значимої відмінності показників ВАШ між групами (p = 0,341 за критерієм Крускала — Уолліса) щодо виду анестезії. Одразу після операції показники ВАШ у 1-й групі пацієнтів були вищими (p < 0,05), ніж у 2-й групі пацієнтів. Починаючи з 12-ї години 2-ї доби і до самої виписки показник ВАШ у 3-й групі був нижче (p < 0,05), ніж у пацієнтів у 1-й та 2-й групах. Динаміка показника ВАШ за період стаціонарного лікування наведена на рис. 1.
Аналізуючи динаміку показника ВАШ, ми використали критерій Фідмана для пов’язаних вибірок та отримали такі результати: 1) у пацієнтів із 1-ї групи виявлена зміна показника протягом періоду аналізу (p < 0,001), на 2-гу годину після операції показник мав найбільше значення (6,32 ± 0,78 бала) із поступовим його зниженням (p < 0,05) до часу виписки; 2) у пацієнтів із 2-ї групи виявлена зміна показника протягом періоду аналізу (p < 0,001), на 10-ту годину після операції показник мав найбільше значення (5,70 ± 1,19 бала) із поступовим його зниженням (p < 0,05) до виписки зі стаціонару; 3) у пацієнтів із 3-ї групи виявлена зміна показника протягом періоду аналізу (p < 0,001), на 8-му годину другої доби після операції показник мав найбільше значення (4,41 ± 0,52 бала) із поступовим його зниженням (p < 0,05) до виписки.
1.2. Після виписки зі стаціонару (віддалені результати)
У табл. 4 наведений аналіз оцінки болю за даними ВАШ після виписки зі стаціонару.
При проведенні аналізу віддалених результатів виявлено, що статистично значимо (p < 0,05) більші показники ВАШ у 1-й групі, ніж у 3-й групі, через 1 і 3 місяці після виписки зі стаціонару. Динаміка показників ВАШ у трьох групах протягом року наведена на рис. 2.
Аналізуючи динаміку показника ВАШ, ми використали критерій Фідмана: 1) у 1-й групі виявлено зміну показника протягом періоду аналізу (p < 0,001) із поступовим його зниженням (p < 0,05) протягом трьох місяців та подальшою стабілізацією; 2) у 2-й групі виявлено зміну показника протягом періоду аналізу (p < 0,001) із поступовим його зниженням (p < 0,05) протягом 1 місяця та подальшою стабілізацією; 3) у 3-й групі виявлено зміну показника (p < 0,001), після 1-го місяця показник не змінювався (p > 0,05).
2. Вивчення нейропатичного болю
2.1. Під час стаціонарного лікування
У табл. 5 наведений аналіз оцінки нейропатичного болю за даними шкали DN4 під час лікування в стаціонарі.
При проведенні аналізу було з’ясовано, що: 1) у 1-й групі показник діагностичного опитувальника DN4 до операції становив 5,02 ± 0,60, а перед випискою — 4,02 ± 0,14; 2) у 2-й групі — 5,07 ± 0,67 та 4,01 ± 0,12 відповідно; 3) у 3-й групі — 4,49 ± 0,50 та 4 ± 0 відповідно. Це вказує на те, що у всіх досліджуваних пацієнтів як при надходженні, так і при виписці був нейропатичний компонент болю.
Для аналізу динаміки показника DN4 був використаний Т-критерій Вілкоксона для пов’язаних вибірок.
Виявлене зниження (p < 0,001) показника DN4 на момент виписки для пацієнтів усіх груп.
2.2. Після виписки зі стаціонару (віддалені результати)
У табл. 6 наведений аналіз оцінки невропатичного болю за даними шкали DN4 після виписки зі стаціонару.
При проведенні аналізу віддалених результатів виявлено, що на момент виписки значення показників DN4 у трьох групах не відрізнялися (p = 0,459).
Уже через 1 місяць після виписки показники DN4 у 1-й групі пацієнтів були вищі (p < 0,05), ніж у хворих 2-ї та 3-ї груп, а в 3-й групі пацієнтів нижчі (p < 0,05), ніж для двох інших видів анестезії.
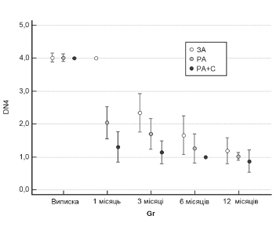
На рис. 3 наведена динаміка показника діагностичного опитувальника DN4 протягом року.
У 1-й групі виявлена зміна показника DN4 протягом періоду аналізу (p < 0,001 за критерієм Фрідмана). При цьому значення показника через 1 місяць після виписки зі стаціонару не відрізнялося від значення до виписки (p > 0,05). У подальшому відбувалося його поступове зниження (p < 0,05) протягом року.
У 2-й групі виявлена зміна показника протягом періоду аналізу (p < 0,001 за критерієм Фрідмана) із поступовим його зниженням (p < 0,05) протягом року.
У 3-й групі виявлена зміна показника протягом періоду аналізу (p < 0,001 за критерієм Фрідмана). Після 6 місяців значення показника стабілізувалося і в подальшому не змінювалося (p > 0,05).
Висновки
1. Вивчаючи інтенсивність болю за ВАШ, ми з’ясували, що одразу після операції в групі пацієнтів, де використовувалась загальна анестезія, показники були вищими (p < 0,05), ніж у групі пацієнтів із реґіонарною анестезією. Починаючи з 12-ї години другої доби і до самої виписки показник інтенсивності болю за ВАШ у групі, де використовувалась реґіонарна анестезія із седацією, був нижчим (p < 0,05), ніж у групі пацієнтів, де використовувались загальна та реґіонарна анестезія (без седації).
2. Аналізуючи дані інтенсивності болю за ВАШ (під час стаціонарного лікування), з’ясували: 1) у всіх групах пацієнтів спостерігалась постійна зміна протягом усього періоду аналізу (p < 0,001); у групах пацієнтів, де використовувалась загальна анестезія, на 2-гу годину після операції показник мав найбільше значення (6,32 ± 0,78 бала) із поступовим його зниженням (p < 0,05) до часу виписки зі стаціонару; 2) у пацієнтів, яким виконували реґіонарну анестезію, на 10-ту годину після операції показник мав найбільше значення (5,70 ± 1,19 бала) із поступовим його зниженням (p < 0,05) до виписки зі стаціонару; 3) у пацієнтів, яким виконували реґіонарну анестезію із седацією, на 8-му годину другої доби після операції показник мав найбільше значення (4,41 ± 0,52 бала) із поступовим його зниженням (p < 0,05) до виписки.
3. При дослідженні віддалених результатів виявлено, що статистично значимо (p < 0,05) більші показники інтенсивності болю за ВАШ у групі пацієнтів, де використовувалась загальна анестезія, ніж у групі пацієнтів, де використовувалась реґіонарна анестезія із седацією, і через 1, і через 3 місяці після виписки зі стаціонару.
4. Аналіз даних інтенсивності болю за ВАШ (після виписки зі стаціонару — віддалені результати) вказує на те, що: 1) у пацієнтів, яким виконували загальну анестезію, спостерігалась зміна показника протягом усього періоду аналізу (p < 0,001) із поступовим його зниженням (p < 0,05) протягом 3 місяців та подальшою стабілізацією; 2) у пацієнтів, яким виконували реґіонарну анестезію, спостерігалась зміна показника протягом усього періоду аналізу (p < 0,001) із поступовим його зниженням (p < 0,05) протягом 1 місяця та подальшою стабілізацією; 3) у пацієнтів, яким виконували реґіонарну анестезію із седацією показника (p < 0,001), після 1 місяця значення показника не змінювалося (p > 0,05).
5. Вивчаючи нейропатичний біль, ми з’ясували: 1) у групі пацієнтів, де використовувалась загальна анестезія, показник діагностичного опитувальника DN4 до операції становив 5,02 ± 0,60, а перед випискою — 4,02 ± 0,14; 2) у пацієнтів, яким виконувалася реґіонарна анестезія, — 5,07 ± 0,67 та 4,01 ± 0,12 відповідно; 3) у пацієнтів, яким виконувалася реґіонарна анестезія із седацією, — 4,49 ± 0,50 та 4 ± 0 відповідно. Це вказує на те, що у всіх досліджуваних пацієнтів як при надходженні, так і при виписці був нейропатичний компонент болю.
6. Вивчаючи нейропатичний біль при проведенні аналізу віддалених результатів, виявили, що на момент виписки значення показників DN4 у трьох групах не відрізнялися (p = 0,459). Але вже через 1 місяць після виписки зі стаціонару було з’ясовано: 1) показники DN4 у групі пацієнтів, де використовувалась загальна анестезія, були вищі (p < 0,05), ніж у пацієнтів, яким виконували реґіонарну анестезію та реґіонарну анестезію із седацією; 2) показники DN4 у групі пацієнтів, де використовувалась реґіонарна анестезія із седацією, нижчі (p < 0,05), ніж у пацієнтів, яким виконували реґіонарну анестезію без седації.
7. У всіх групах пацієнтів спостерігалась зміна показника DN4 протягом періоду аналізу (p < 0,001). Проте в групі пацієнтів, де використовувалась загальна анестезія, значення показника через 1 місяць після виписки зі стаціонару не відрізнялося від значення до виписки (p > 0,05). У подальшому відбувалося його поступове зниження (p < 0,05) протягом року. У групі пацієнтів, де використовувалась реґіонарна анестезія, спостерігалась поступова його зміна — зниження (p < 0,05) протягом року. У групі пацієнтів, де використовувалась реґіонарна анестезія із седацією, після 6 місяців спостерігалась стабілізація показника і в подальшому він не змінювався (p > 0,05).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Внесок авторів у підготовку статті: Кучин Ю.Л. — концепція і дизайн дослідження; Горошко В.Р. — збір, обробка матеріалів, аналіз отриманих даних, написання тексту, оформлення рисунків.
Отримано/Received 13.08.2021
Рецензовано/Revised 02.09.2021
Прийнято до друку/Accepted 09.09.2021
/39_2.jpg)

/36.jpg)
/37.jpg)
/38.jpg)
/38_2.jpg)
/39.jpg)