Журнал «Почки» Том 11, №2, 2022
Вернуться к номеру
Перитонеальний діаліз у 2022 році: сучасний ренесанс?
Авторы: Іванов Д.Д.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
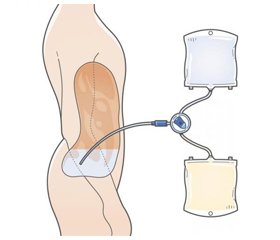
Огляд присвячений методу перитонеального діалізу як замісної ниркової терапії при хронічній хворобі нирок (ХХН) 5-ї стадії. Близько 10 % світового населення страждає на ХХН, але поширеність та захворюваність мають виражені відмінності у різних регіонах світу, що пов’язано із соціальними та економічними умовами. Основними напрямами нирково-замісної терапії на сьогодні залишаються гемодіаліз та перитонеальний діаліз, розпочинати які рекомендовано при ХХН 5-ї стадії. Обидва методи є ефективними та мають подібні показники виживання та смертності. Обидва успішно використовуються в усьому світі, однак перитонеальний діаліз є менш ресурсовитратним, що робить його методом вибору у багатьох менш забезпечених країнах. Перевагами перитонеального діалізу можуть бути: коротша тривалість сесій, менше обмеження пересування пацієнта, знаходження у родинному колі та краща якість життя за оцінками самих пацієнтів. Проводяться множинні дослідження із покращення надійності та якості перитонеального діалізу, у тому числі покращення доступу та профілактики інфекцій. Через низку епідеміологічних, соціоекономічних та екологічних проблем у світі, ймовірно, перитонеальний діаліз переживає власне відродження з усе більш широкою імплементацією у практику нирково-замісної терапії.
The review focuses on peritoneal dialysis as a renal replacement therapy for stage 5 chronic kidney disease (CKD). About 10 % of the world’s population suffers from CKD, but its prevalence and incidence vary widely across the world due to social and economic conditions. The main areas of renal replacement therapy today are haemodialysis and peritoneal dialysis, the beginning of which is recommended for CKD stage 5. Both methods are effective and have similar survival and mortality rates. Both techniques are used successfully around the world, but peritoneal dialysis is less resource-intensive, making it the method of choice in many less affluent countries. The advantages of peritoneal dialysis can be: shorter sessions, limited patient movement, being in the family circle and better quality of life according to the patients themselves. Numerous studies are being conducted to improve the reliability and quality of peritoneal dialysis, including access and prevention of infections.
перитонеальний діаліз; хронічна хвороба нирок 5-ї стадії; нирково-замісна терапія; тривалість життя при хронічній хворобі нирок
peritoneal dialysis; chronic kidney disease stage 5; renal replacement therapy; life expectancy in chronic kidney disease
Основні повідомлення
- Bello A.K., Levin A., Lunney M., Osman M.A., Ye F., Ashuntantang G., еt al. Global Kidney Health Atlas: A report by the International Society of Nephrology on the Global Burden of End-stage Kidney Disease and Capacity for Kidney Replacement Therapy and Conservative Care across World Countries and Regions. International Society of Nephrology, Brussels, Belgium, 2019.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Inter. Suppl. 2013. 3. 1-150.
- Yang C.-W., Harris D.C.H., Luyckx V.A., Nangaku M., Hou F.F., Garcia Garcia G., еt al. Global case studies for chronic kidney disease/end-stage kidney disease care. Kidney International Supplements. 2020. 10(1). e24-e48. doi: 10.1016/j.kisu.2019.11.010.
- Luyckx V. еt al. Preventing CKD in Developed Countries. Kidney International Reports. 2019. 5. Iss. 3. 263-277.
- Ameh O. et al. Preventing CKD in Low- and Middle-Income Countries: A Call for Urgent Action. Kidney International Reports. 2020. 5. Iss. 3. 255-262.
- Sola L., Levin N.W., Johnson D.W., Pecoits-Filho R., Aljubori H.M., Chen Y., еt al. Development of a framework for minimum and optimal safety and quality standards for hemodialysis and peritoneal dialysis. Kidney International Supplements. 2020. 10(1). e55-e62. doi: 10.1016/j.kisu.2019.11.009.
- Luyckx V.A., Smyth B., Harris D.C.H., Pecoits-Filho R. Dialysis funding, eligibility, procurement, and protocols in low- and middle-income settings: results from the International Society of Nephrology collection survey. Kidney International Supplements. 2020. 10(1). e10-e18. doi: 10.1016/j.kisu.2019.11.005.
- Klinger M., Madziarska K. Mortality predictor pattern in hemodialysis and peritoneal dialysis in diabetic patients. Adv. Clin. Exp. Med. 2019 Jan. 28(1). 133-135. doi: 10.17219/acem/76751. PMID: 30156388.
- Swanepoel C.R., McCulloch M.I., Abraham G., Donner J.-A., Alrukhaimi M.N., Blake P.G., еt al. Challenges for sustainable end-stage kidney disease care in low-middle-income countries: the problem of the workforce. Kidney International Supplements. 2020. 10(1). e49-e54. doi: 10.1016/j.kisu.2019.11.007.
- Global, regional, and national burden of chronic kidney disease, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017 (2020). https://doi.org/10.1016/S0140-6736(20)30045-3.
- Saran R., Robinson B., Abbott K.C., Agodoa L.Y., Albertus P., Ayanian J., еt al. US renal data system 2016 annual data report: epidemiology of kidney disease in the United States. American Journal оf Kidney Diseases. 2017. 69(3). A7-A8.
- Sanabria R.M., Vesga J.I., Johnson D.W., Rivera A.S., Buitrago G., Lindholm B., Sanchez R. Blood Purif. 2021 Dec 10. 1-11. doi: 10.1159/000520518. Online ahead of print.
- Bitar W., Helve J., Honkanen E., Rauta V., Haapio M., Finne P. Similar survival on home hemodialysis and automated peritoneal dialysis: an inception cohort study. Nephrol. Dial. Transplant. 2021 Aug 7. gfab233. doi: 10.1093/ndt/gfab233. Epub ahead of print. PMID: 34363472.
- Hausinger R., Schmaderer C., Heemann U., Bachmann Q. Innovationen in der Peritonealdialyse [Innovations in peritoneal dialysis]. Nephrologe. 2021 Nov 12. 1-7. German. doi: 10.1007/s11560-021-00542-x. Epub ahead of print. PMID: 34786026; PMCID: PMC8588934.
- Wilkie M., Davies S. Peritoneal Dialysis in the time of COVID-19. Peritoneal Dialysis International: Journal of the International Society for Peritoneal Dialysis. 2020. 089686082092165. doi: 10.1177/0896860820921657.
- Finderup J., Jensen J.D., Lomborg K. Shared decision-making in dialysis choice has potential to improve self-management in people with kidney disease: A qualitative follow-up study. J. Adv. Nurs. 2021 Apr. 77(4). 1878-1887. doi: 10.1111/jan.14726. Epub 2020 Dec 17. PMID: 33336465.
- Huong Quynh Bui T., Que Tran P., Truc Y., Nguyen N., Nguyen B. Quality of life assessment in patients on chronic dialysis: comparison between hemodialysis and peritoneal dialysis at a national hospital in Vietnam. Trop. Med. Int. Health. 2021 Dec 7. doi: 10.1111/tmi.13709. Epub ahead of print. PMID: 34873785.
- Chrifi Alaoui A., Touti W., Al Borgi Y., Sqalli Houssaini T., El Rhazi K. Comparison of quality of life in end-stage renal disease patients undergoing hemodialysis and peritoneal dialysis in a Moroccan city. Semin. Dial. 2021 Oct 26. doi: 10.1111/sdi.13034. Epub ahead of print. PMID: 34704278.
- Yu J.Y., Kim J.S., Hong C.M., Lee K.Y., Cho N.J., Park S., Gil H.W., Lee E.Y. Psychological distress of patients with end-stage kidney disease undergoing dialysis during the 2019 coronavirus disease pandemic: A cross-sectional study in a University Hospital. PLoS One. 2021 Dec 3. 16(12). e0260929. doi: 10.1371/journal.pone.0260929. PMID: 34860844; PMCID: PMC8641873.
- Vera M., Cheak B.B., Chmelíčková H., Bavanandan S., Goh B.L., Abdul Halim A.G., еt al. Current clinical practice in adapted automated peritoneal dialysis (aAPD) — A prospective, non-interventional study. PLoS One. 2021 Dec 9. 16(12). e0258440. doi: 10.1371/journal.pone.0258440. PMID: 34882678; PMCID: PMC8659299.
- Cullis B., Al-Hwiesh A., Kilonzo K., McCulloch M., Niang A., Nourse P., еt al. ISPD guidelines for peritoneal dialysis in acute kidney injury: 2020 update (adults). Perit. Dial. Int. 2021 Jan. 41(1). 15-31. doi: 10.1177/0896860820970834. Epub 2020 Dec 3. PMID: 33267747.
- Agarwal A., Whitlock R.H., Bamforth R.J., Ferguson T.W., Sabourin J.M., Hu Q., еt al. Percutaneous Versus Surgical Insertion of Peritoneal Dialysis Catheters: A Systematic Review and Meta-Analysis. Can. J. Kidney Health Dis. 2021 Nov 8. 8. 20543581211052731. doi: 10.1177/20543581211052731. PMID: 34795905; PMCID: PMC8593295.
- Szeto C.C., Ng J.K., Wing-Shing Fung W., Chan G.C., Cheng P.M., Lai K.B., еt al. Extended antibiotic therapy for the prevention of relapsing and recurrent peritonitis in peritoneal dialysis patients: a randomized controlled trial. Clin. Kidney J. 2021 Jan 17. 14(3). 991-997. doi: 10.1093/ckj/sfaa256. PMID: 34840733; PMCID: PMC8612137.
- Farkas A., Oikonomou K., Ghanbar M., Villasurda P., Varghese J., Lipman J., еt al. Antimicrob. Agents Chemother. 2021 Dec 13. AAC0167921. doi: 10.1128/AAC.01679-21. Online ahead of print.
- Bennett P.N., Bohm C., Harasemiw O., et al. Physical activity and exercise in peritoneal dialysis: international society for peritoneal dialysis and the global renal exercise network practice recommendations. Perit. Dial. Int. 2021. 0(0). 08968608211055290.
- Lee L., Scholes-Robertson N., Manera K. Exercising my right as a patient: Reflections on physical activity and exercise in peritoneal dialysis. Perit. Dial. Int. 2021 Dec 9:. 8968608211064152. doi: 10.1177/08968608211064152. Epub ahead of print. PMID: 34886739.
- Devia M., Vesga J., Sanchez R., Sanabria R.M., Figueiredo A.E. Development of an instrument to assess self-management capacity of patients receiving peritoneal dialysis: CAPABLE. Perit. Dial. Int. 2021 Dec 9. 8968608211059897. doi: 10.1177/08968608211059897. Epub ahead of print. PMID: 34886728.