Introduction
An uncommon low-grade astrocytoma with strong cellular differentiation, sluggish development, and widespread infiltration of surrounding brain regions, comparable to WHO grade II is called as diffuse astrocytoma (DA). The tumor usually affects young individuals and has an inhe-rent propensity to develop to high-grade glioma. Fibrillary, gemistocytic, and protoplasmic astrocytoma are histological variations. Patients most typically appear with seizures, but depending on the location, they may also present with other neurological or cognitive problems.
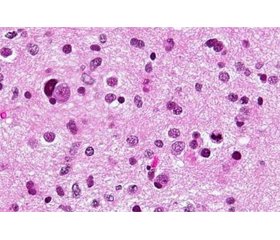
Because diffuse astrocytoma is an invasive tumor, there is no apparent division from the surrounding brain, and resection alone may not be adequate to cure it. The appearance of the tissue is only marginally different from that of a normal brain, although cells seem aberrant and conside-rably increased in number under the microscope. Seizures, focal neurologic deficiency (weakness or speech issues), headaches, personality changes, or vision loss are all possible symptoms. For first, conventional diagnostic imaging, magnetic resonance imaging (MRI) is preferred. More sophisticated imaging techniques may be necessary for a tumor near crucial brain areas (for example, speech or movement control).
CT and MR scans reveal the existence of this tumor, which does not generally “enhance” or “light up” when an intravenous contrast dye is administered. According to the WHO, diffuse gliomas are grouped together regardless of histological type (astrocytomas or oligodendrogliomas). The new categorization places diffuse astrocytic and oligodendroglial tumours closer together than diffuse astrocytoma and pilocytic astrocytoma. Surgery is advised to get a tumor sample for confirmation of the diagnosis and to remove as much of the tumor as feasible without causing substantial neurological issues. Although recent evidence shows that vigorous excision of low-grade gliomas may increase long-term survival, surgical eradication of the tumor may be difficult since it can be intermingled with normal brain tissue. If the tumor is in a vital section of the brain where removal would cause substantial neurological damage, a biopsy may be all that is required.
Incidence/epidemiology/distribution of DA
In the study of Okamoto et al. (2004) for the period 1980–1994, the incidence rate of low-grade diffuse astrocytomas was 2.28 per million people per year when adjusted to the World Standard Population, 2.59 when adjusted to the European Standard Population, and 3.69 when adjusted to the United States Standard Population. The incidence rate of oligoastrocytomas was 0.89 when corrected for the World Standard Population, 1.04 when adjusted for the European Standard Population, and 1.02 when adjusted for the United States Standard Population. The incidence rate of oligodendrogliomas was 2.45 in the World Standard Population, 2.66 in the European Standard Population, and 2.22 in the United States Standard Population [1].
According to the study of Gibson et al the incidence of astrocytoma is 0.23 per 100,000 people, with 700 new cases diagnosed each year. In the United States in 2012, an estimated 148,818 persons were diagnosed with brain and other nervous system cancer. Based on mortality figures from 2008 to 2012, the annual death rate was 4.3 per 100,000 people. The low-grade form is more common in children and young adults, whereas the high-grade type is more common in adults. Men are more likely to develop pilocytic astrocytoma, accounting for 62 % of all cases. The male-to-female ratio in diffuse astrocytoma is 1.5 : 1, while it is 1.8 : 1 in anaplastic astrocytoma. Astrocytoma is more prevalent among Caucasians [2].
Symptoms and characteristics of diffuse astrocytoma
The age at which symptoms of an illness first appear is referred to as the age of onset. The age of onset varies amongst illnesses and may be utilized by a clinician to make a diagnosis. Symptoms of various illnesses may appear in a single or many age groups. Symptoms of various diseases might appear at any moment during a person’s life. Astrocytoma symptoms and indicators are caused by increasing pressure as the tumor develops and pushes against brain regions. The symptoms of astrocytoma differ based on the location of the brain affected, as well as the size and grade of the tumor.
Headaches and Seizures are the most common symptoms of diffuse astrocytoma. Additional symptoms may occur depending on the size and location of the tumor, which may interfere with various brain processes. A diffuse astrocytoma in the motor cortex (which governs bodily movement), for example, may produce gradually progressive weakness on one side of the body.
The symptoms might be general (caused by obstructive hydrocephalus) or specific (caused by involvement of several cranial nerves): facial paresis, diplopia, hearing loss, dysphonia, and dysphagia. Ataxia is caused by the tumor spreading to the cerebellar peduncles. Motor weakness is determined by the participation of lengthy tracts. Pathological laughing and anxiety, in particular, were documented before the development of other more prevalent clinical indications in diffuse pontine glioma [3].
Seizures are the most common sign to cause concerns. There have been studies that show the existence of seizures at the debut in up to 80 % of patients, with around 50 % presenting with uncontrolled seizures at the time of surgery. The following factors contribute to a lower response to antiepileptic drugs: partial seizure type, temporal placement, and a longer seizure duration. The frontal lobe is the most common site for these tumors, followed by the temporal and parietal lobes. Other symptoms may occur as a result of the location. The most commonly cited symptoms include behavioral and personality abnormalities, visual difficulties, aphasia, or agnosia, although increased intracranial pressure symptoms appear later in the course of disease, associated to tumoral volumes and mass impact [4].
Astrocytoma seizures can produce twitching or jerky movements in the face, arm, or leg. A seizure in an astrocytoma patient is sometimes described as an incident in which the patient seems distant or gazing. In rare cases, astrocytomas that penetrate the spinal cord might induce weakness and paralysis due to nerve function where the tumor is placed (such as bowel or bladder problems). Astrocytoma patients frequently experience fatigue and sadness.
Histopathology and molecular features of diffuse astrocytoma
According to Zhang and William (2020) the nuclei of diffuse astrocytomas are elongated and have a darker staining (hyperchromaticism). Astrocytic tumors have eosinophilic cytoplasm (pink) and high levels of glial fibrillary acidic protein. Cysts can form a microcystic pattern, with a scattering of small cysts [5].
Sukheeja et al. (2015) made a study to in order to evaluate the squash smear technique’s utility in diagnosis of astrocytomas, we compared it with histopathology [6]. Furthermore, to investigate the relationship between various grades and their MIB-1 labelling index. 45 instances of radiologically suspected astrocytomas were sent for intraoperative cytology and histology. The ability of two approaches to diagnose and grade the tumor was compared. MIB-1 LI were also done on biopsy tissue. The immunological and histopathological grades were compared. The squash smear method properly identified 44 (97.7 %) of 45 cases. There were also substantial variations in MIB-1 LI levels between high-grade and low-grade astrocytomas. With rising grades, the MIB-1 LI increased in a gradual manner. MIB-1 LI was 0.05 % in grade I astrocytoma. It ranged from 0.8 to 2.6 % in grade II astrocytoma, except in one instance where it was 3.2 % who came with a recurring tumor. In grade IV, it was 10–20 %. Intraoperative cytology is a reasonably accurate and effective tool in intraoperative consulting. MIB-1 LI can also be used as an adjunct for grading, particularly in tiny biopsies.
Wesselling, Kros and Jeuken (2011) say that the gold standard for glioma categorization is histological diagnosis [7]. An accurate microscopic diagnosis provides essential prognostic information and serves as the foundation for subsequent patient therapy. Even with today’s standard of care (surgery, radiation, and chemotherapy), the majority of glioblastoma patients die within 1–2 years after diagnosis. Patients with a WHO grade II glioma, on the other hand, may live for more than ten years, although such tumors usually advance to a high-grade malignant lesion. Distant metastases of diffuse gliomas are quite uncommon. Despite this, diffuse gliomas are regarded one of the most lethal malignancies due to their locally aggressive behaviour and inability to be treated by existing therapy.
There is strong evidence that the combination of IDH1/2, TP53, and ATRX mutations is a critical molecular marker for adult astrocytomas. Given the improved prognosis conferred by this genotype, at least among histologically diagnosed AAs, the molecular categorization will have a considerable influence on clinical practise as well as clinical trial design. It will enable the classification of morphologically confusing tumors into a single molecularly defined group. It has been proposed that oligoastrocytoma should no longer be recognised as a distinct entity because their genotypes are virtually invariably those of astrocytomas or oligodendrogliomas, and their outcomes are comparable to their genotypic counterparts.
Although the histology and molecular information may not always match, clinicians are often left to interpret the results. A sequence-verified Anaplastic Astrocytoma (AA) with a wild-type IDH should be treated as a glioblastoma multiforme (GBM). The histological diagnosis of a GBM with concurrent IDH1/TP53/ATRX mutations should still be treated as a GBM (the majority, if not all, primary GBMs with IDH1/2 mutations have simultaneous TP53 mutations). Molecular information can be used in order to make a clinical decision or histology/grade can be considered part of an integrated diagnosis. Astrocytomas should be consi-dered in any future clinical trials. It may be possible to assess whether WHO grading is a prognostic factor independent of molecular classes.
A number of markers currently used to classify dise-ases need to be refined. The possibility of reclassifying IDH-wt glioma into biologically or prognostically relevant subgroups will depend on the development of additional, robust markers, whether morphological or molecular, that should predict the patient’s outcome. An understanding of the pathogenesis of this group of tumors would be necessary to fully implement the proposed molecular classification. A larger clinical study is necessary to provide this understanding.
Individualised targeted therapy is now possible thanks to molecular classification. A glioma xenograft that harbors the R132H mutation has been shown to develop resistance to an inhibitor against IDH1 R132H [8]. The inhibitor reduced the production of R(D)-2-HG from tumour cells and suppressed the growth of R132H-expressing Xenografts. The inhibitor targeting IDH2 R140Q also suppressed the growth of mutation-harbouring leukemia cells and inhibited the enzyme activity of mutant IDH2 producing 2HG [9]. The new inhibitors are currently being tested in clinical trials. A vaccine targeting mutant IDH1 is also in development. A preclinical model demonstrated that the endogenously processed peptides containing the R132 epitope of IDH1 may be presented on MHC class II, inducing a specific antitumor immune response against IDH1-mutant tumors. Patients with R132H-containing gliomas developed IDH1 R132H-specific antibodies [8]. As a whole, mutant IDH-targeting therapies hold the promise of revolutionizing the treatment of astrocytic tumors, an area that has lacked successful chemotherapeutic regimens to date.
Despite certain morphologic similarities, sequencing studies of juvenile diffuse astrocytomas revealed a strong molecular divergence from their adult counterparts. As additional molecular data becomes available, it is possible to imagine a combined histologic or molecular categorization for paediatric low-grade glioma, similar to what is already being proposed for adult lower-grade gliomas. Importantly, as our understanding of the molecular changes grows, we may provide better treatment for these juvenile patients, as seen by the initiation of clinical studies employing BRAF V600E targeted medicines for paediatric low-grade glioma. The development of genome sequencing technology has ushered in a new era in neuro-oncology. Among their most successful products are IDH1, ATRX, and H3F3A.
Classification of diffuse astrocytoma according to molecular
In 2016, the WHO classification of CNS tumors combined genotypic and clinical factors to develop a new nomenclature of diffuse gliomas based on the presence or absence of isocitrate dehydrogenase mutations. This resulted in more homogeneous and tightly defined categories with improved prognostic information accuracy, which played an important role in patient treatment. Astrocytomas are now histologically and genetically different, having IDH-mutant, ATRX-mutant, 1p/19q-intact profiles, whereas oligodendroglial tumors have IDH-mutant, ATRX-wildtype, and 1p/19q-codeleted profiles. Glioblastoma is now defined as primary or secondary based on IDH mutations, regardless of clinical history.
IDH1/2-mutant diffuse astrocytoma vs IDH-wildtype diffuse astrocytoma
Astrocytoma, IDH-mutant tumors, are WHO CNS grade II, III, or IV adult brain cancers. They are diffuse infiltrating astrocytic tumors with no discernible boundary between the tumor and normal brain tissue, despite imaging appearances to the contrary. Adult-type IDH-mutant astrocytomas are frequently identified in young adults, with a median age of 36 years for grades II and III (combined) and 38 years for grade IV. This is significantly younger than the median age of glioblastoma IDH-wildtype tumors (50–60 years). Men of all ages and tumor grades had a significantly greater incidence (M : F 1.5). Tumors with normal IDH genes, known as “IDH-wildtype” or “IDH negative”, are significantly more aggressive. IDH-wildtype low-grade gliomas have a comparable prognosis to main GBM.
In individuals with glioblastoma, anaplastic astrocytoma, and anaplastic oligoastrocytoma, but not anaplastic oligodendroglioma, IDH1/2 mutations were related with a younger age. For low-grade diffuse gliomas, oligoastrocytomas5, and oligodendrogliomas, the age of patients with and without IDH1/2 mutations appeared to be similar. In patients with low-grade diffuse gliomas, IDH1/2 mutations were substantially linked with older age (42.1 versus 35.8 years; P 0.0017). Low-grade diffuse gliomas lacking IDH1 mutations are more common in younger people.
Hasselbatt et al. (2018) say that diffuse astrocytomas are a kind of brain tumor that primarily affects young individuals [9]. According to WHO criteria, the majority of adult diffuse astrocytomas include IDH1 (R132) or IDH2 (R172) hotspot mutations, resulting in an integrated diagnosis of “diffuse astrocytoma, IDH-mutant”. Diffuse astrocytic tumors can be identified as “diffuse astrocytoma, IDH-wildtype” in the absence of IDH1/IDH2 mutations, although clinical and molecular aspects remain unknown, and the existence of diffuse astrocytoma, IDH-wildtype has been called into question. In a previous study of 160 IDH-wildtype diffuse astrocytic tumors (grades II and III) in adults, molecular analyses resolved the vast majority of cases into other tumor entities, with 78 percent of tumors exhibiting clinical features as well as genetic alterations and/or epigenetic profiles typical of glioblastoma. Because the most of these tumors were anaplastic astrocytomas and neuroimaging was not used, one may argue that sampling bias and intra-tumoral heterogeneity had a role in this series’ misdiagnosis of glioblastoma, IDH-wildtype as “astrocytoma, IDH-wildtype”. We sought to investigate the clinical, histopathological, and molecular characteristics of IDH-wildtype diffuse astrocytoma from a series of 215 consecutive diffuse astrocytomas (grade II WHO) of adult patients, which were carefully characterized using IDH1 (R132) immunohistochemistry, followed by IDH1/IDH2 sequencing, and neuroimaging review.
In the study of Makino et al. (2022) the features of IDH-wildtype lower-grade astrocytoma remain unknown. According to the third cIMPACTNOW update, IDH-wildtype astrocytomas with any of the following characteristics have a poor prognosis: chromosome 7 gain and 10 loss (+ 7/10), EGFR amplification, and/or TERT promoter (TERTp) mutation [10]. Multiplex ligation-dependent probe amplification (MLPA) is a low-cost method for detecting copy number changes. The goal of this work was to find an accurate, low-cost approach for predicting the prognosis of IDH-wildtype astrocytoma. Sanger sequencing, MLPA, and quantitative methylation-specific PCR were done on 42 IDH-wildtype lower-grade astrocytomas surgically treated at Kyoto University Hospital, and overall survival for 40 patients who received initial surgery was examined. Twenty-one of the 42 IDH-wildtype astrocytomas were graded 4 using cIMPACT-NOW version 3 criteria, and all contained either a TERTp mutation or EGFR amplification. The predictive importance of cIMPACT-NOW criteria was validated by Kaplan-Meier analysis, and World Health Organization grade was likewise prognostic. The Cox regression hazard model found PTEN loss (risk ratio, 9.75; p 0.001) and PDGFRA amplification (risk ratio, 13.9; p = 0.002) as independent important prognostic markers. Sanger sequen-cing and MLPA might be used to complete the categorization indicated by cIMPACT-NOW version 3. PTEN and PDGFRA were shown to be important prognostic variables for IDH-wildtype lower-grade astrocytoma.
According to Mirchia and Richardson (2020) IDH-wildtype lower-grade astrocytomas, like their IDH-mutant counterparts, include tumours with a WHO histologic grade II or III, but they have much shorter progression-free and overall survival periods following initial diagnosis and surgery [11]. Randomly chosen IDH-wildtype grade II–III astrocytomas have statistically identical prognoses to IDH-wildtype glioblastoma, and many tumors formerly identified as IDH-wildtype lower-grade astrocytomas can now be classified into other diagnostic categories. Lower-grade IDH-wildtype astrocytomas frequently have specific molecular alterations characteristic of IDH-wildtype glioblastoma, such as EGFR amplification, combined gain of chromosome 7 with loss of chromosome 10 (7+/10), and TERTp mutation, and tumors with these three factors have similar clinical outcomes to IDH-wildtype glioblastoma, whereas lower-grade tumors without these characteristic alterations have significantly better clinical outcomes.
The 2016 WHO categorization of CNS cancers remains “provisional”, and IDH1/2-wildtype gliomas have remained a diverse group of tumors that require more research for classification. Although less is known about IDH-wildtype lower grade gliomas than regarding IDH-mutant gliomas, the molecular and pathological features of IDH-wildtype lower grade gliomas are being identified. According to the study of Cho, Yang and Yoo (2021) lower grade gliomas with IDH1/2-wildtype do not always have a dismal prognosis [12]. Epidermal growth factor receptor (EGFR) amplification, telomerase reverse transcriptase (TERT) promoter mutation, chromosome 7 gain, and chromosomal 10q loss have all been linked to the prognosis of these cancers. As more information regarding the molecular kinds of IDH1/2-wildtype tumors with poor prognosis becomes available, cIMPACT-NOW has proposed diagnostic criteria to define them as “diffuse astrocytic glioma, IDH-wildtype, with molecular characteristics of glioblastoma, WHO grade IV”. Their findings indicate the need for a new genetic categorization of IDH1/2-wildtype gliomas, particularly anaplastic astrocytomas, and imply that these tumors may be more common than previously thought, depending on the community.
Radiological features of diffuse astrocytoma
The study of Villanueva-Meyer et al. (2017) aimed to determine the MRI parameters related with IDH mutational status and if MRI combined with IDH mutational status may better predict clinical outcomes of grade II DGs [13]. Preoperative MRIs were reviewed for qualitative tumor features such as location, size, cortical involvement, margin sharpness, cystic component, mineralization or bleeding, and contrast enhancement. Diffusion and perfusion measures were also evaluated quantitatively. The connection between MRI characteristics and IDH mutational status was assessed using logistic regression and ROC analysis. The Kaplan-Meier and Cox proportional hazards models were used to investigate the relationship between IDH mutational status, 1p19q codeletion, MRI characteristics, resection extent, and clinical outcomes. 78 grade II DGs were IDH-mutant, while 22 were IDH-wildtype. IDH-wildtype tumors had a higher age, multifocality, brainstem involvement, a lack of cystic alteration, and a reduced apparent diffusion coefficient (ADC). According to multivariable regression, age above 45 years old, as well as low minimum ADC (ADCmin), mean ADC, and maximum ADC values, were all independently linked with IDH mutational status. An ADCmin threshold of 0.9 103/s or below showed the highest sensitivity and specificity (91 % and 76 %, respectively) in identifying IDH-wildtype grade II DGs. The combination of low ADCmin and IDH-wildtype status resulted in poorer results than IDH-wildtype status alone. Grade II IDH-wildtype DGs had a lower ADC and poor clinical outcomes. It may be possible to predict more accurate clinical outcomes for patients with grade II DG by combining IDH mutational status and ADC.
According to Bulakbasi and Paksoy (2019) adult diffusely infiltrating low-grade gliomas (LGGs) are slow-growing gliomas with modestly enhanced cellularity that lack mitosis, necrosis, and microvascular proliferation [14]. When compared to a simple debulking, supra-total resection of LGG considerably enhances overall survival by delaying malignant transformation, hence precise MR diagnosis is critical for treatment planning. Meta-analysis data support the use of diffusion and perfusion-weighted MR imaging, as well as MR spectroscopy, in the diagnosis of suspected LGG. When compared to high-grade glioma, LGG shows poorer cellularity (ADCmin), angiogenesis (rCBVmax), capillary permeability (Ktrans), and mitotic activity (Cho/Cr ratio). The detection of 2-hydroxyglutarate by MR spectroscopy can indicate the tumor’s IDH status. The bad prognosis is supported by the initial low ADCmin, high rCBVmax, and Ktrans readings. The steady rise in intratumoral Cho/Cr ratio and rCBVmax values is strongly linked to tumor growth. Aside from MR-based technical artefacts, which are minimised by voxel-based assessment of data produced by histogram analysis, difficulties arising from the diversity and interpretation of imaging data should be tackled utilizing artificial intelligence approaches. LGG quantitative multiparametric MR imaging can either increase diagnostic accuracy or measure prognosis.
Surgical Treatment of Diffuse Astrocytoma
Surgery is generally the first line of defence against grade II astrocytomas. The goal is to get rid of as much of the tumor as feasible. The amount that can be removed will be determined by the location of the tumor in the brain. You may be advised about, or wish to inquire about, “biomarker testing” and “biobanking” at this stage. However, because these tumors are more diffuse (and hence less well-defined), total excision is frequently impossible. If the tumor cannot be removed fully, the surgeon will remove as much as feasible. This is referred to as “debulking” or “partial resection”. This is more frequent with grade II astrocytomas, which have less defined margins. Because these tumours are more prone to recur, surgery is frequently followed with radiation.
According to Picca, Berzero and Sanson (2018) surgery is an unavoidable step in obtaining a histological diagnosis and crucial molecular information [15]. When treating grade II gliomas, early resection should be preferable over cautious waiting. Intraoperative imaging methods, continuous electrophysiological monitoring, and awake surgery should be used to minimize surgical risks. Patients who get a gross complete resection live longer than those who have a partial resection or a biopsy. This finding is similar across research, but we currently lack randomized controlled trials in indivi-duals with low-grade gliomas. The biological profile of the tumor may impact its resectability: IDH-mutant gliomas may be more amenable to radical resections because they are less infiltrative. Because of the benefits of prolonged resection, several writers advocate for supratotal resection (resection beyond visible tumor borders). Aside from improving patient survival, surgical resection can significantly enhance seizure management.
In the study of Choi et al. (2020) the authors looked at predictive variables for adult low-grade glioma (LGG) using the revised WHO classification from 2016. Between 2003 and 2015, the records of 153 individuals diagnosed with WHO grade II LGG were examined retrospectively [16]. According to the 2016 WHO classification, 80 patients (52.3 %) had diffuse astrocytoma, IDH-mutant; 45 (30.4 %) had oligodendroglioma, IDH-mutant and 1p/19q-codeleted (ODG); and 28 (18.3 %) had diffuse astrocytoma, IDH-wildtype. GTR was done on 71 patients (46.4 %), subtotal resection on 31 (20.3 %), partial resection on 43 (28.1 %), and biopsy on 8 individuals (5.2 %). Postoperative radiation was administered to 102 patients (66.7 %). The 5- and 10-year progression-free survival (PFS) rates were 72.7 and 51.5 %, respectively, as were the 5- and 10-year overall survival (OS) rates of 82.5 and 63.5 %. GTR and IDH mutations, as well as 1p/19q codeletion, were predictive variables for PFS and OS. Patients with IDH-wildtype had a considerably shorter life expectancy. After radiation, no recurrence of ODG was detected in individuals who had GTR. Non-GTR patients usually reported recurrence following radiation (IDH-mutant: 47.6 %, IDH-wildtype: 57.9 %). Finally, molecular categorization of LGG was found to be prognostic, with IDH-wildtype individuals having a particularly dismal prognosis independent of therapy. Patients who had GTR had favourable outcomes.
According to the study of Xia, Fang, Cheng and Sun (2018) low-grade glioma surgical resection may result in dysfunction and a reduction in patients’ quality of life (QOL) [17]. According to certain studies, the 5-year and 10-year survival rates of individuals who received GTR were equivalent to those who received STR or no surgery at all. As a result, GTR is not recommended as first-line therapy for low-grade gliomas. In recent years, there has been a trend toward using GTR to treat low-grade gliomas.
Karschina et al. (2021) say that in diffuse glioma, surgical resection is the standard of therapy, and more extensive tumor excision appears to be associated with a better result [18]. Until date, language used to define the degree of resection has been inconsistently applied throughout clinical trials, making comparative analysis of cohorts across stu-dies difficult. Based on a thorough literature assessment, the authors generated evidence-based expert recommendations on resection extent categories. There are recommendations for the categories “biopsy”, “partial resection”, “subtotal resection”, “near total resection”, “full resection”, and “supramaximal resection”. The definitions are based on the decrease of contrast- and non-contrast-enhancing tumor in glioblastoma, as well as the reduction of T2/FLAIR-hype-rintense tumour in WHO grade II or III gliomas. The criteria for degree of resection include both relative decrease of tumor volume (in percentage) as a measure of surgical success and absolute residual tumor volume (in cm3) as a measure of remaining tumor burden. The suggested categories’ evidence classes span from IIB through IV.
Patel et al. (2019) found a link between more surgical resection and better overall survival in patients with IDH-mutant LGGs [19]. We found a link between surgical resection extent and overall survival in molecularly characterized IDH-mutant astrocytomas and oligodendrogliomas; however, the influence of extent of surgical resection on overall survival appears to be higher in astrocytomas. The reason for the stronger association with astrocytomas could be because oligodendrogliomas respond better to nonsurgical therapies than astrocytomas, or because oligodendrogliomas have longer survival times than astrocytomas, making it more difficult to demonstrate a survival benefit with surgery. Furthermore, the percentage of glioma resection was shown to be more significantly linked with overall survival than either pre-surgical or postsurgical glioma volume. Finally, the researchers discovered no link between surgical resection and overall survival in IDHwt LGGs.
Perioperative morbidity of microsurgical glioma excision has been documented to be very variable, currently ranging from 5 % to 20 % or more. Despite the fact that the risk factors for glioma surgery are poorly defined, the inclusion of older patients and/or those with a prominent tumor site may have raised the complication rate in some studies. However, the overall proportion of safe gross total resections has grown due to the use of sophisticated imaging and functional diagnostics before and during surgery. Recent findings indicate that pre- and intraoperative functional evaluations, neuronavigation, and in-situ imaging methods have the potential to reduce both the risk profile of resective therapy (morbi-dity < 5 %) and the fraction of complete resections in the vast majority of patients [20]. The extent to which patient selection contributed to these positive results is uncertain. Intraoperative neurophysiological mapping, involving awake craniotomy with language monitoring, has been proven to enhance postoperative functional scores and optimise safe EOR in eloquently placed glioma surgery. All of these ima-ging and monitoring approaches, however, were insufficient to account for the neurovascular hazards of resective therapy. Symptomatic ischemia episodes are likely in 6–10 % of patients, especially if surgery is conducted near tiny perforating arteries feeding highly eloquent regions like the insula or crus cerebri [21].
Conclusions
In conclusion, this comprehensive study provides the reliable basis for clinic-pathological and surgical management of diffuse astrocytoma. Headache and seizures were the most common symptoms with most of it. Our review confirm the prognostic benefit of gross total resection on DA and the influence of extent of surgical resection on overall survival appears to be higher in diffuse astrocytomas.
Received 15.04.2022
Revised 05.05.2022
Accepted 25.05.2022
Список литературы
1. Okamoto Y., Di Patre P., Burkhard C. et al. Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathologica. 2004. 108(1). P. 49-56.
2. Gibson M.C., Shojaei F., Susheela A. Retrieved from https://www.wikidoc.org/index.php/Astrocytoma_epidemiology_and_demographics.
3. Hargrave D.R., Mabbott D.J., Bouffet E. Pathological laughter and behavioural change in childhood pontine glioma. Journal of Neuro-Oncology. 2005. 77(3). 267-271. DOI: 10.1007/s11060-005-9034-8.
4. Chang E.F., Potts M.B., Keles G.E. et al. Seizure characteristics and control following resection in 332 patients with low-grade gliomas. Journal of Neurosurgery. 2008. 108(2). 227-235. DOI: 10.3171/JNS/2008/108/2/0227.
5. Zhang Y.-W., Chai R.-C., Cao R. et al. Clinicopathological characteristics and survival of spinal cord astrocytomas. Cancer Med. 2020. 9. 6996-7006. https://doi.org/10.1002/cam4.3364.
6. Sukheeja D., Singhvi S., Rai N.N., Midya M. A Comparative Study of Histopathology of Astrocytomas with Intraoperative Cytology with Special Reference to MIB-1 Labelling Index. Journal of Clinical and Diagnostic Research. 2015. 9(8). EC01-EC3. https://doi.org/10.7860/JCDR/2015/12372.6281.
7. Wesseling P., Kros J.M., Jeuken J.W.M. The pathological diagnosis of diffuse gliomas: Towards a smart synthesis of microscopic and molecular information in a multidisciplinary context. Diagnostic Histopathology. 2011. 17(11). 486-494. https://doi.org/10.1016/j.mpdhp.2011.08.005.
8. Rohle D., Popovici-Muller J., Palaskas N. et al. An inhibitor of mutant IDH1 delays growth and promotes differentiation of glioma cells. Science (New York, N.Y.). 2013. 340(6132). 626-630. https://doi.org/10.1126/science.1236062.
9. Duffau H. Long-term outcomes after supratotal resection of diffuse low-grade gliomas: a consecutive series with 11-year follow-up. Acta Neurochir. (Wien). 2016. 158(1). 51-58. https://doi.org/10.1007/s00701-015-2621-3.
10. Makino Y., Arakawa Y., Yoshioka E. et al. Prognostic stratification for IDH-wild-type lower-grade astrocytoma by Sanger sequen–cing and copy-number alteration analysis with MLPA. Sci Rep. 2021. 11. 14408. https://doi.org/10.1038/s41598-021-93937-8.
11. Mirchia K., Richardson T.E. Beyond IDH-Mutation: Emer–ging Molecular Diagnostic and Prognostic Features in Adult Diffuse Gliomas. Cancers. 2020. 12(7). 1817. https://doi.org/10.3390/cancers12071817.
12. Cho U., Yang S.H., Yoo C. Estimation of the occurrence rates of IDH1 and IDH2 mutations in gliomas and the reconsideration of IDH-wildtype anaplastic astrocytomas: an institutional experience. J. Int. Med. Res. 2021 Jun. 49(6). 3000605211019258. doi: 10.1177/03000605211019258. PMID: 34162262; PMCID: PMC8236789.
13. Villanueva-Meyer J.E., Wood M.D., Choi B.S., Mabray M.C., Butowski N.A., Tihan T., Cha S. MRI Features and IDH Mutational Status of Grade II Diffuse Gliomas: Impact on Diagnosis and Prognosis. American Journal of Roentgenology. 2018. 210(3). 621-628. https://doi.org/10.2214/AJR.17.18457.
14. Bulakbaşı N., Paksoy Y. Advanced imaging in adult diffusely infiltrating low-grade gliomas. Insights into Imaging. 2019. 10(1). 122. https://doi.org/10.1186/s13244-019-0793-8.
15. Picca A., Berzero G., Sanson M. Current therapeutic approaches to diffuse grade II and III gliomas. Therapeutic advances in neurological disorders. 2018. 11. 1756285617752039. https://doi.org/10.1177/1756285617752039.
16. Choi J., Kim, S.H., Ahn, S.S. et al. Extent of resection and molecular pathologic subtype are potent prognostic factors of adult WHO grade II glioma. Sci Rep. 2020. 10. 2086. https://doi.org/10.1038/s41598-020-59089-x.
17. Wang F., Travins J., DeLaBarre B. et al. Targeted inhibition of mutant IDH2 in leukemia cells induces cellular differentiation. Science. 2013. 340. 622-626.
18. Karschnia P., Vogelbaum M.A., van den Bent M. et al. Evidence-based recommendations on categories for extent of resection in diffuse glioma. European Journal of Cancer (Oxford, England). 2021. 149. 23-33. https://doi.org/10.1016/j.ejca.2021.03.002.
19. Patel S.H., Bansal A.G., Young E.B. et al. Extent of Surgical Resection in Lower-Grade Gliomas: Differential Impact Based on Molecular Subtype. American Journal of Neuroradiology. 2019. 40(7). 1149-1155. https://doi.org/10.3174/ajnr.A6102.
20. Xia L., Fang C., Chen G., Sun C. Relationship between the extent of resection and the survival of patients with low-grade gliomas: a systematic review and meta-analysis. BMC cancer. 2018. 18(1). 48. https://doi.org/10.1186/s12885-017-3909-x.
21. Ius T., Isola M., Budai R. et al. Low-grade glioma surgery in eloquent areas: volumetric analysis of extent of resection and its impact on overall survival. A single-institution experience in 190 patients. J. Neurosurg. 2012. 42(6). 1039-1052.