Журнал «Почки» Том 12, №1, 2023
Вернуться к номеру
Фармакологічне обґрунтування практичного використання комбінованих засобів з D-манозою та екстрактом журавлини в терапії інфекцій сечовивідних шляхів
Авторы: Кіреєв І.В., Литкін Д.В.
Національний фармацевтичний університет, м. Харків, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
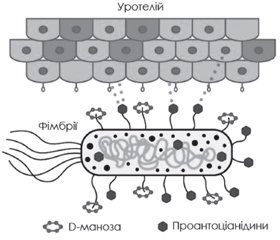
Інфекції сечовивідних шляхів (ІСШ) вважаються одними з найпоширеніших інфекційних захворювань у світі. Понад 150 млн пацієнтів щорічно страждають від ІСШ, а серед жінок, старших від 18 років, приблизно 11 % повідомляють про принаймні один епізод ІСШ на рік. Ризик розвитку ІСШ також збільшується у вагітних, пацієнтів із захворюваннями простати, цукровим діабетом і катетеризацією тощо. Основною причиною розвитку ІСШ є уропатогенна кишкова паличка, що спричиняє понад 80 % усіх зареєстрованих епізодів хвороби. Бактерія закріплюється на уротелії, розмножується й колонізує сечовидільні шляхи, що й призводить до маніфестації захворювання. Зростаюча антибіотикорезистентність уропатогенних штамів і схильність ІСШ до рецидивів обумовлюють актуальність пошуку альтернативних профілактичних і терапевтичних підходів. Вдалою комбінацією в комплексному лікуванні й профілактиці ІСШ може вважатись комплексний засіб Урорубін, до складу якого входять D-маноза, проантоціанідини журавлини й екстракт шавлії лікарської. Фармакологічне обґрунтування використання D-манози та екстракту журавлини для профілактики ІСШ базується на їх властивості інгібувати адгезію бактерій до уротеліальних клітин. Екстракт шавлії лікарської чинить бактерицидну, протизапальну, аналгетичну, сечогінну, нефропротекторну й антиоксидантну дію. Метааналізи й систематичні огляди, сформовані за результатами клінічних досліджень вищезазначених речовин, свідчать про доцільність застосування таких комбінованих засобів з метою профілактики й комплексного лікування ІСШ, а також вказують на сприятливий профіль їх безпеки. Окрім цього, такі комбінації мають незначний ризик розвитку резистентності в бактерій на відміну від антибіотиків і синтетичних антибактеріальних засобів. Отже, Урорубін, що являє собою натуральний засіб на основі D-манози, стандартизований за вмістом проантоціанідинів екстракту журавлини та екстракту шавлії лікарської, може бути рекомендований при гострому та хронічному циститі, а також як засіб профілактики, у тому числі з метою запобігання рецидивам інфекцій сечовивідних шляхів.
Urinary tract infections (UTIs) are considered one of the most common infectious diseases in the world. More than 150 million patients suffer from a UTI annually, and among women over the age of 18, approximately 11 % report at least one episode of UTI per year. The risk of developing a UTI also increases in pregnant women, patients with prostate diseases, diabetes and catheterization, etc. The main cause of UTI development is uropathogenic Escherichia coli, which causes more than 80 % of all recorded episodes of the disease. The bacterium attaches itself to the urothelium, multiplies and colonizes the urinary tract, which leads to the manifestation of the disease. The growing antibiotic resistance of uropathogenic strains and the propensity of UTIs to relapse determine the urgency of finding alternative preventive and therapeutic approaches. A successful combination in the comprehensive treatment and prevention of UTI can be considered Urorubin, which includes D-mannose, cranberry proanthocyanidins and sage (Salvia officinalis) extract. The pharmacological justification for the use of D-mannose and cranberry extract to prevent UTI is based on their ability to inhibit bacterial adhesion to urothelial cells. Sage extract has a bactericidal, anti-inflammatory, analgesic, diuretic, nephroprotective and antioxidant effect. Meta-analyses and systematic reviews, based on the results of clinical studies of the above-mentioned substances, testify to the feasibility of using such combined agents for the prevention and comprehensive treatment of UTIs, and also indicate a favorable safety profile. In addition, these combinations have a small risk of developing resistance in bacteria, unlike antibiotics and synthetic antibacterial drugs. Therefore, Urorubin, which is a natural remedy based on D-mannose, standardized by the content of cranberry proanthocyanidins and sage extract, can be recommended for acute and chronic cystitis, as well as a preventive measure, including for the purpose of preventing recurrent urinary tract infections.
інфекції сечовивідних шляхів; фармакотерапія; профілактика; D-маноза; проантоціанідини журавлини; шавлія лікарська
urinary tract infections; pharmacotherapy; prevention; D-mannose; cranberry proanthocyanidins; sage
Вступ
Сучасний стан антибіотикотерапії в лікуванні ІСШ
Використання D-манози в терапії ІСШ
Фармакологічна роль проантоціанідинів журавлини в лікуванні й профілактиці ІСШ
/21.jpg)
Супутні шляхи фармакотерапії ІСШ
Висновки
- Ala-Jaakkola R., Laitila A., Ouwehand A.C., Lehtoranta L. Role of D-mannose in urinary tract infections — a narrative review. Nutrition journal. 2022. 21(1). 18. https://doi.org/10.1186/s12937-022-00769-x.
- Aliaga L. Treatment of acute uncomplicated cystitis — A clinical review. Clin. Med. Invest. 2017. 2. DOI: 10.15761/CMI.1000142.
- Klein R.D., Hultgren S.J. Urinary tract infections: microbial pathogenesis, host-pathogen interactions and new treatment strategies. Nature reviews. Microbiology. 2020. 18(4). 211-226. https://doi.org/10.1038/s41579-020-0324-0.
- Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. 2017. World Health Organization. https://apps.who.int/iris/handle/10665/311820. License: CC BY-NC-SA 3.0 IGO.
- De Nunzio C., Bartoletti R., Tubaro A., Simonato A., Ficarra V. Role of D-Mannose in the Prevention of Recurrent Uncomplicated Cystitis: State of the Art and Future Perspectives. Antibiotics (Basel, Switzerland). 2021. 10(4). 373. https://doi.org/10.3390/antibiotics10040373.
- Hooton T.M., Gupta K., Calderwood S.B., Bloom A. Recurrent simple cystiti s in women. UpToDate. Last updated: 2022 Apr 22. https://www.uptodate.com/contents/recurrent-simple-cystitis-inwomen.
- Chen Z., Phan M.D., Bates L.J., Peters K.M., Mukerjee C., Moore K.H., Schembri M.A. The urinary microbiome in patients with refractory urge incontinence and recurrent urinary tract infection. International urogynecology journal. 2018. 29(12). 1775-1782. https://doi.org/10.1007/s00192-018-3679-2.
- Subashchandrabose S., Mobley H.L.T. Virulence and Fitness Determinants of Uropathogenic Escherichia coli. Microbiology spectrum. 2015. 3(4). 10.1128/microbiolspec.UTI-0015-2012. https://doi.org/10.1128/microbiolspec.UTI-0015-2012.
- Flores-Mireles A.L., Walker J.N., Caparon M., Hultgren S.J. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat. Rev. Microbiol. 2015. 13(5). 269-284.
- Lenger S.M., Bradley M.S., Thomas D.A., Bertolet M.H., Lowder J.L., Sutcliffe S. D-mannose vs other agents for recurrent urinary tract infection prevention in adult women: A systematic review and meta-analysis. Am. J. Obstet. Gynecol. 2020. 223. e1-e13. doi: 10.1016/j.ajog.2020.05.048.
- Salari N., Karami M.M., Bokaee S. et al. The prevalence of urinary tract infections in type 2 diabetic patients: a systematic review and meta-analysis. Eur. J. Med. Res. 2002. 27. 20. https://doi.org/10.1186/s40001-022-00644-9.
- Wagenlehner F.M., Weidner W., Pilatz A., Naber K.G. Urinary tract infections and bacterial prostatitis in men. Current opinion in infectious diseases. 2014. 27(1). 97-101. https://doi.org/10.1097/QCO.0000000000000024.
- Werneburg G.T. Catheter-Associated Urinary Tract Infections: Current Challenges and Future Prospects. Research and reports in urology. 2022. 14. 109-133. https://doi.org/10.2147/RRU.S273663.
- Heisig P. Urinary tract infections and antibiotic resistance. Urologe A. 2010. 49(5). 612-617.
- Naber K.G., Bonkat G., Wagenlehner F.M.E. The EAU and AUA/CUA/SUFU Guidelines on Recurrent Urinary Tract Infections: What is the Difference? European urology. 2020. 78(5). 645-646. https://doi.org/10.1016/j.eururo.2020.06.032.
- De Cueto M., Aliaga L., Alós J.I., Canut A., Los-Arcos I., Martínez J.A. et al. Executive summary of the diagnosis and treatment of urinary tract infection: Guidelines of the Spanish Society of Clinical Microbiology and Infectious Diseases (SEIMC). Enfermedades infecciosas y microbiologia clinica. 2017. 35(5). 314-320. https://doi.org/10.1016/j.eimc.2016.11.005.
- Mickiewicz K.M., Kawai Y., Drage L., Gomes M.C., Davison F., Pickard R. et al. Possible role of L-form switching in recurrent urinary tract infection. Nature communications. 2019. 10(1). 4379. https://doi.org/10.1038/s41467-019-12359-3.
- Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious disease clinics of North America. 2014. 28(1). 1-13. https://doi.org/10.1016/j.idc.2013.09.003.
- Kainz K., Bauer M.A., Madeo F., Carmona-Gutierrez D. Fungal infections in humans: the silent crisis. Microbial cell. (Graz, Austria). 2020. 7(6). 143-145. https://doi.org/10.15698/mic2020.06.718.
- Nordmann P., Poirel L., Mueller L. Rapid Detection of Fosfomycin Resistance in Escherichia coli. Journal of clinical microbiology. 2019. 57(1). e01531-18. https://doi.org/10.1128/JCM.01531-18.
- Sekyere J.О. Genomic insights into nitrofurantoin resistance mechanisms and epidemiology in clinical Enterobacteriaceae. Future science. 2018. 4(5). FSO293. https://doi.org/10.4155/fsoa-2017-0156.
- Grigoryan L., Zoorob R., Wang H., Horsfield M., Gupta K., Trautner B.W. Less workup, longer treatment, but no clinical benefit observed in women with diabetes and acute cystitis. Diabetes research and clinical practice. 2017. 129. 197-202. https://doi.org/10.1016/j.diabres.2017.05.005.
- Kyriakides R., Jones P., Somani B.K. Role of D-Mannose in the Prevention of Recurrent Urinary Tract Infections: Evidence from a Systematic Review of the Literature. European urology focus. 2021. 7(5). 1166-1169. https://doi.org/10.1016/j.euf.2020.09.004.
- Loubet P., Ranfaing J., Dinh A., Dunyach-Remy C., Bernard L., Bruyère F., Lavigne J.P., Sotto A. Alternative Therapeutic Options to Antibiotics for the Treatment of Urinary Tract Infections. Frontiers in microbiology. 2020. 11. 1509. https://doi.org/10.3389/fmicb.2020.01509.
- Scaglione F., Musazzi U.M., Minghetti P. Considerations on D-mannose Mechanism of Action and Consequent Classification of Marketed Healthcare Products. Frontiers in pharmacology. 2021. 12. 636377. https://doi.org/10.3389/fphar.2021.636377.
- Rellan-Pineiro M., Garcia-Rates M., Lopez N. A mechanism for the selective epimerization of the glucose mannose pair by Mo-based compounds: Towards catalyst optimization. Green Chem. 2017. 19. 5932-5939. DOI: 10.1039/C7GC02692G.
- Scribano D., Sarshar M., Prezioso C., Lucarelli M., Angeloni A., Zagaglia C., Palamara A.T., Ambrosi C. d-Mannose Treatment neither Affects Uropathogenic Escherichia coli Properties nor Induces Stable FimH Modifications. Molecules (Basel, Switzerland). 2020. 25(2). 316. https://doi.org/10.3390/molecules25020316.
- Zhang D., Chia C., Jiao X., Jin W., Kasagi S., Wu R. et al. –D-mannose induces regulatory T cells and suppresses immunopathology. Nature medicine. 2017. 23(9). 1036-1045. https://doi.org/10.1038/nm.4375.
- Alton G., Kjaergaard S., Etchison J.R., Skovby F., Freeze H.H. Oral ingestion of mannose elevates blood mannose le–vels: a first step toward a potential therapy for carbohydrate-deficient glycoprotein syndrome type I. Biochemical and molecular medicine. 1997. 60(2). 127-133. https://doi.org/10.1006/bmme.1997.2574.
- Westphal V., Kjaergaard S., Davis J.A., Peterson S.M., Skovby F., Freeze H.H. Genetic and metabolic analysis of the first adult with congenital disorder of glycosylation type Ib: long-term outcome and effects of mannose supplementation. Molecular gene–tics and metabolism. 2001. 73(1). 77-85. https://doi.org/10.1006/mgme.2001.3161.
- Harding V.J., Nicholson T.F., Armstrong A.R. Cutaneous blood-sugar curves after the administration of fructose, mannose and xylose. The Biochemical journal. 1933. 27(6). 2035-2042. https://doi.org/10.1042/bj0272035
- Zadeh F.М., Zarei H., Honarmand Jahromy S. Type1 and 3 fimbriae phenotype and genotype as suitable markers for uropathogenic bacterial pathogenesis via attachment, cell surface hydrophobicity, and biofilm formation in catheter-associated urinary tract infections (CAUTIs). Iranian journal of basic medical sciences. 2021. 24(8). 1098-1106. https://doi.org/10.22038/IJBMS.2021.53691.12079.
- Kalas V., Pinkner J.S., Hannan T.J., Hibbing M.E., Dodson K.W., Holehouse A.S. et al. Evolutionary fine-tuning of conformational ensembles in FimH during host-pathogen interactions. Science advances. 2017. 3(2). e1601944. https://doi.org/10.1126/sciadv.1601944.
- Sauer M.M., Jakob R.P., Luber T., Canonica F., Navarra G., Ernst B. et al. Binding of the Bacterial Adhesin FimH to Its Natural, Multivalent High-Mannose Type Glycan Targets. Journal of the American Chemical Society. 2019. 141(2). 936-944. https://doi.org/10.1021/jacs.8b10736.
- Poole N.M., Green S.I., Rajan A., Vela L.E., Zeng X.L., Estes M.K., Maresso A.W. Role for FimH in Extraintestinal Pathogenic Escherichia coli Invasion and Translocation through the Intestinal Epithelium. Infection and immunity. 2017. 85(11). e00581-17. https://doi.org/10.1128/IAI.00581-17.
- Bouckaert J., Berglund J., Schembri M., De Genst E., Cools L., Wuhrer M. et al. Receptor binding studies disclose a no–vel class of high-affinity inhibitors of the Escherichia coli FimH adhesin. Molecular microbiology. 2005. 55(2). 441-455. https://doi.org/10.1111/j.1365-2958.2004.04415.x.
- Feenstra T., Thøgersen M.S., Wieser E., Peschel A., Ball M.J., Brandes R., Satchell S.C., Stockner T., Aarestrup F.M., Rees A.J., Kain R. Adhesion of Escherichia coli under flow conditions reveals potential novel effects of FimH mutations. European journal of clinical microbiology & infectious diseases: official publication of the European Society of Clinical Microbiology. 2017. 36(3). 467-478. https://doi.org/10.1007/s10096-016-2820-8.
- Mydock-McGrane L.K., Hannan T.J., Janetka J.W. Rational design strategies for FimH antagonists: new drugs on the horizon for urinary tract infection and Crohn’s disease. Expert opinion on drug discovery. 2017. 12(7). 711-731. https://doi.org/10.1080/17460441.2017.1331216.
- Schwartz D.J., Kalas V., Pinkner J.S., Chen S.L., Spaul–ding C.N., Dodson K.W., Hultgren S.J. Positively selected FimH residues enhance virulence during urinary tract infection by altering FimH conformation. Proceedings of the National Academy of Sciences of the United States of America. 2013. 110(39). 15530-15537. https://doi.org/10.1073/pnas.1315203110.
- Sarshar M., Behzadi P., Ambrosi C., Zagaglia C., Palamara A.T., Scribano D. FimH and Anti-Adhesive Therapeutics: A Disarming Strategy Against Uropathogens. Antibiotics (Basel, Switzerland). 2020. 9(7). 397. https://doi.org/10.3390/antibiotics9070397.
- Parazzini F., Ricci E., Fedele F., Chiaffarino F., Esposito G., Cipriani S. Systematic review of the effect of D-mannose with or without other drugs in the treatment of symptoms of urinary tract infections/cystitis (Review). Biomedical reports. 2022. 17(2). 69. https://doi.org/10.3892/br.2022.1552.
- Murina F., Vicariotto F., Lubrano C. Efficacy of an orally administered combination of Lactobacillus paracasei LC11, cranberry and D-mannose for the prevention of uncomplicated, recurrent urinary tract infections in women. Urologia. 2021. 88(1). 64-68. https://doi.org/10.1177/0391560320957483.
- Rădulescu D., David C., Turcu F.L., Spătaru D.M., Popescu P., Văcăroiu I.A. Combination of cranberry extract and D-mannose — possible enhancer of uropathogen sensitivity to antibiotics in acute therapy of urinary tract infections: Results of a pilot study. Experimental and therapeutic medicine. 2020. 20(4). 3399-3406. https://doi.org/10.3892/etm.2020.8970.
- Russo E., Montt Guevara M., Giannini A., Mannella P., Palla G., Caretto M. et al. Cranberry, D-mannose and anti-inflammatory agents prevent lower urinary tract symptoms in women undergoing prolapse surgery. Climacteric: the journal of the International Menopause Society. 2020. 23(2). 201-205. https://doi.org/10.1080/13697137.2019.1679110.
- Genovese C., Davinelli S., Mangano K., Tempera G., Nicolosi D., Corsello S. et al. Effects of a new combination of plant extracts plus d-mannose for the management of uncomplicated recurrent urinary tract infections. Journal of chemotherapy (Florence, Italy). 2018. 30(2). 107-114. https://doi.org/10.1080/1120009X.2017.1393587.
- Fu Z., Liska D., Talan D., Chung M. Cranberry Reduces the Risk of Urinary Tract Infection Recurrence in Otherwise Healthy Women: A Systematic Review and Meta-Analysis. The Journal of nutrition. 2017. 147(12). 2282-2288. https://doi.org/10.3945/jn.117.254961.
- Heim K.E., Tagliaferro A.R., Bobilya D.J. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships. The Journal of nutritional biochemistry. 2002. 13(10). 572-584. https://doi.org/10.1016/s0955-2863(02)00208-5.
- Yu D., Huang T., Tian B., Zhan J. Advances in Biosynthesis and Biological Functions of Proanthocyanidins in Horticultural Plants. Foods (Basel, Switzerland). 2020. 9(12). 1774. https://doi.org/10.3390/foods9121774.
- Mannino G., Chinigò G., Serio G., Genova T., Gentile C., Munaron L., Bertea C.M. Proanthocyanidins and Where to Find Them: A Meta-Analytic Approach to Investigate Their Chemistry, Biosynthesis, Distribution, and Effect on Human Health. Antioxidants (Basel, Switzerland). 2021. 10(8). 1229. https://doi.org/10.3390/antiox10081229.
- de Llano D.G., Liu H., Khoo C., Moreno-Arribas M.V., Bartolomé B. Some New Findings Regarding the Antiadhesive Activity of Cranberry Phenolic Compounds and Their Microbial-Derived Metabolites against Uropathogenic Bacteria. Journal of agricultural and food chemistry. 2019. 67(8). 2166-2174. https://doi.org/10.1021/acs.jafc.8b05625.
- González de Llano D., Moreno-Arribas M.V., Bartolomé B. Cranberry Polyphenols and Prevention against Urinary Tract Infections: Relevant Considerations. Molecules (Basel, Switzerland). 2020. 25(15). 3523. https://doi.org/10.3390/molecules25153523.
- Urena-Saborio H., Udayan A.P.M., Alfaro-Viquez E., Madrigal-Carballo S., Reed J.D., Gunasekaran S. Cranberry Proanthocyanidins-PANI Nanocomposite for the Detection of Bacteria Associated with Urinary Tract Infections. Biosensors. 2021. 11(6). 199. https://doi.org/10.3390/bios11060199.
- Liu H., Howell A.B., Zhang D.J., Khoo C. A randomized, double-blind, placebo-controlled pilot study to assess bacterial anti-adhesive activity in human urine following consumption of a cranberry supplement. Food & function. 2019. 10(12). 7645-7652. https://doi.org/10.1039/c9fo01198f.
- Baron G., Altomare A., Regazzoni L., Fumagalli L., Arta–sensi A., Borghi E. et al. Profiling Vaccinium macrocarpon components and metabolites in human urine and the urine ex-vivo effect on Candida albicans adhesion and biofilm-formation. Biochemical pharmaco–logy. 2020. 173. 113726. https://doi.org/10.1016/j.bcp.2019.113726.
- Scharf B., Sendker J., Dobrindt U., Hensel A. Influence of Cranberry Extract on Tamm-Horsfall Protein in Human Urine and its Antiadhesive Activity Against Uropathogenic Escherichia coli. Planta medica. 2019. 85(2). 126-138. https://doi.org/10.1055/a-0755-7801.
- Scharf B., Schmidt T.J., Rabbani S., Stork C., Dobrindt U., Sendker J. et al. Antiadhesive natural products against uropathogenic E.coli: What can we learn from cranberry extract? Journal of ethnopharmacology. 2020. 257. 112889. https://doi.org/10.1016/j.jep.2020.112889.
- Aragón I.M., Herrera-Imbroda B., Queipo-Ortuño M.I., Castillo E., Del Moral J.S., Gómez-Millán J. et al. The Urinary Tract Microbiome in Health and Disease. European urology focus. 2018. 4(1). 128-138. https://doi.org/10.1016/j.euf.2016.11.001.
- Feliciano R.P., Meudt J.J., Shanmuganayagam D., Krueger C.G., Reed J.D. Ratio of “A-type” to “B-type” proanthocyanidin interflavan bonds affects extra-intestinal pathogenic Esche–richia coli invasion of gut epithelial cells. Journal of agricultural and food chemistry. 2014. 62(18). 3919-3925. https://doi.org/10.1021/jf403839a.
- Xia J.Y., Yang C., Xu D.F., Xia H., Yang L.G., Sun G.J. Consumption of cranberry as adjuvant therapy for urinary tract infections in susceptible populations: A systematic review and meta-analysis with trial sequential analysis. PloS one. 2021. 16(9). e0256992. https://doi.org/10.1371/journal.pone.0256992.
- Valente J., Pendry B., Galante E. Cranberry (Vaccinium macrocarpon) as a prophylaxis for urinary tract infections in women: A systematic review with meta-analysis. Journal of Herbal Medicine. 2022. 36. 100602. https://doi.org/10.1016/j.hermed.2022.100602.
- Wang T.K., Xu S., Li S., Zhang Y. Proanthocyanidins Should Be a Candidate in the Treatment of Cancer, Cardiovascular Diseases and Lipid Metabolic Disorder. Molecules (Basel, Switzerland). 2020. 25(24). 5971. https://doi.org/10.3390/molecules25245971.
- Rauf A., Imran M., Abu-Izneid T., Iahtisham-Ul-Haq, Patel S., Pan X. et al. Proanthocyanidins: A comprehensive review. Biomedicine & pharmacotherapy. 2019. 116. 108999. https://doi.org/10.1016/j.biopha.2019.108999
- Hooton T.M., Vecchio M., Iroz A., Tack I., Dornic Q., Seksek I., Lotan Y. Effect of Increased Daily Water Intake in Premenopausal Women With Recurrent Urinary Tract Infections: A Randomized Clinical Trial. JAMA internal medicine. 2018. 178(11). 1509-1515. https://doi.org/10.1001/jamainternmed.2018.4204.
- Dobrek Ł. Drug-related urinary tract infections. Wiadomosci lekarskie (Warsaw, Poland: 1960). 2021. 74(7). 1728-1736.
- Fazly Bazzaz B.S., Darvishi Fork S., Ahmadi R. et al. Deep insights into urinary tract infections and effective natural remedies. Afr. J. Urol. 2021. 27. 6. https://doi.org/10.1186/s12301-020-00111-z.
- Ong Lopez A.M.C., Tan C.J.L., Yabon A.S. 2nd, Masbang A.N. Symptomatic treatment (using NSAIDS) versus antibiotics in uncomplicated lower urinary tract infection: a meta-analysis and systematic review of randomized controlled trials. BMC infectious diseases. 2021. 21(1). 619. https://doi.org/10.1186/s12879-021-06323-0.
- Carey M.R., Vaughn V.M., Mann J., Townsend W., Chopra V., Patel P.K. Is Non-Steroidal Anti-Inflammatory Therapy Non-Inferior to Antibiotic Therapy in Uncomplicated Urinary Tract Infections: a Systematic Review. Journal of general internal medicine. 2020. 35(6). 1821-1829. https://doi.org/10.1007/s11606-020-05745-x.
- Ko K., Lee W.K., Oh C.Y., Lee S.H., Cho S.T., Bang W.J. et al. Is A Combination of Antibiotics and Non-Steroidal Anti-Inflammatory Drugs More Beneficial Than Antibiotic Monotherapy For The Treatment of Female Acute Uncomplicated Cystitis? A Rando–mized Controlled Pilot Study. Urology journal. 2018. 15(6). 365-369. https://doi.org/10.22037/uj.v0i0.3716.
- Ghorbani A., Esmaeilizadeh M. Pharmacological properties of Salvia officinalis and its components. Journal of traditional and complementary medicine. 2017. 7(4). 433-440. https://doi.org/10.1016/j.jtcme.2016.12.014.

/17.jpg)
/18.jpg)
/19.jpg)
/20.jpg)