На сьогодні ішемічний інсульт залишається однією з головних причин смертності й інвалідності в усьому світі. У 2016 році це захворювання посідало 5-те місце серед усіх причин смерті після ішемічної хвороби серця, хронічної обструктивної хвороби легень, геморагічного інсульту й інфекцій нижніх дихальних шляхів. Ішемічний інсульт має різні наслідки, які залежать від тяжкості й локалізації ураження мозку.
Стандартною ознакою ішемічного інсульту, поряд з руховим дефіцитом і проблемами з мовленням, є когнітивна дисфункція. На відміну від фізичних порушень, які зазвичай поліпшуються на етапі відновлення, когнітивний дефіцит, незалежно від ступеня тяжкості післяінсультного стану, поступово погіршується, що негативно впливає на якість життя пацієнтів.
З епідеміологічної точки зору поширеність когнітивних порушень коливається в широкому діапазоні — від 20 до 80 % усіх випадків інсульту залежно від кількох факторів, що включають соціально-економічні детермінанти здоров’я (вік, раса, професія, географічний розподіл), судинні фактори ризику (артеріальна гіпертензія, цукровий діабет, гіперліпідемія, куріння, фібриляція передсердь) і діагностичні критерії, включно з комплексною нейропсихологічною оцінкою.
Судинні когнітивні порушення — це широкий спектр судинних розладів, починаючи від легкого когнітивного дефіциту і закінчуючи деменцією, з наслідками для всіх когнітивних і поведінкових доменів. Лакунарні інсульти, мікроінфаркти і «тихі» інсульти є важливими факторами ризику деменції. Вони негативно впливають на виконавчу діяльність, зокрема робочу пам’ять, абстрактне мислення, розмірковування, швидкість мовлення і когнітивну гнучкість. Тому постійний пошук шляхів оптимізації інструментів для прогнозування, моніторингу і клінічного ведення пацієнтів, які перенесли інсульт, має першорядне значення.
Мемопрув є засобом на основі пептидів, який у даний час продається під брендами Cebrium® і Memoprove®. В експериментальних роботах, а також клінічних дослідженнях, що проводились серед пацієнтів, які страждали від вікового когнітивного дефіциту, цей засіб продемонстрував нейропротекторну й прокогнітивну дію. Було доведено, що прийом 90 мг Мемопруву один раз на добу протягом 30 днів вірогідно поліпшує порушення пам’яті в літніх людей із суб’єктивними скаргами на пам’ять (Crook Т.Н. et al., 2005). Крім того, було задокументовано, що 90-денний курс прийому Мемопруву у дозі 90 мг/день забезпечує сприятливий лікувальний ефект на когнітивний дефіцит після ішемічного інсульту в дорослих. При використанні кількісного аналізу спектральної електроенцефалографії X.A. Alvarez et al. (2005) продемонстрували, що одноразовий прийом Мемопруву призводить до зниження повільної дельта-активності мозку й поліпшує пильність.
У пілотному рандомізованому контрольованому клінічному дослідженні фази IV N-PEP-12 STROKE (Balea M. et al., 2020), яке проводилося в осіб середнього й старшого віку, що перенесли супратенторіальний ішемічний інсульт, оцінювалися ефективність і безпека перорального прийому 90 мг Мемопруву один раз на добу протягом 90 днів для підтримки процесів нейровідновлення порівняно з контрольною групою.
Критерії включення/виключення з дослідження
Критеріями включення в дослідження були: початок інсульту за 30–120 днів до скринінгу; ішемічний характер інсульту; супратенторіальна локалізація інсульту; підтвердження його на КТ або МРТ; відсутність значущої інвалідності в результаті інсульту (показник за модифікованою шкалою Ранкіна до інсульту становив 0 або 1); показник за комунікативною шкалою Goodglass і Kaplan > 2 під час скринінгу; протягом 3 місяців до даного інсульту в пацієнта не було жодних інших інсультів; вік від 18 до 80 років (включно); надання пацієнтом письмової інформованої згоди на участь у дослідженні.
З дослідження були виключені пацієнти з уже існуючими активними неврологічними й хронічними психіатричними захворюваннями (депресія, шизофренія, біполярна хвороба або деменція за даними короткого інформаційного опитувальника щодо зниження когнітивних функцій у літніх людей), тяжкими хворобами печінки, нирок, серця або легенів, термінальними захворюваннями з прогнозом виживання до 1 року, залежністю від будь-яких речовин (включно з алкоголем), травмами домінуючої руки, що (на думку дослідника) могли б впливати на збір даних, вагітністю, лактацією, геміанопсією, глаукомою і короткозорістю понад 3,00 діоптрії (включно).
Проведення дослідження
Оцінки досліджень проводились протягом трьох візитів: 1) на початковому етапі; 2) на 30-й день і 3) на 90-й день. Пацієнти, які відповідали критеріям включення й виключення, за допомогою генератора випадкових чисел були рандомізовані (у співвідношенні 2 : 1)
у групу прийому Мемопруву або контрольну групу. Доза засобу, шлях його введення і тривалість лікування були обрані відповідно до стандартних інструкцій із застосування, наданих виробником Мемопруву. Пацієнти з групи лікування самостійно приймали перорально 90 мг Мемопруву у формі капсул один раз на день протягом 90 днів поспіль після базової оцінки показників.
Дослідники, які проводили оцінку клінічних результатів, були «засліплені» щодо будь-якої інформації, яка могла вказувати на розподіл досліджуваних груп. Усі дані, отримані в контексті клінічного дослідження, підпадали під дію стандартних процедур захисту даних відповідно до загального регламенту.
Оцінка результатів дослідження
Для оцінки первинного результату було обрано п’ять нейропсихологічних шкал на основі даних щодо надійності, валідності й широкого застосування в інших клінічних дослідженнях інсульту і когнітивних порушень: 1) Монреальська когнітивна шкала; 2) індекс швидкості обробки (шкала інтелекту Векслера для дорослих, третє видання) — 2 субшкали (пошук символів, кодування цифрових символів); 3) запам’ятовування цифр (шкала інтелекту Векслера для дорослих, третє видання); 4) госпітальна шкала тривоги та депресії і 5) тест відновлення послідовності кольорів — 2 субшкали.
Монреальська когнітивна шкала — це інструмент оцінки когнітивних порушень за шкалою від 0 до 30. Індекс швидкості обробки (PSI) оцінює такі навички, як фокусування уваги й швидке сканування, а також розрізнення й послідовне впорядкування візуальної інформації. Ці навички вимагають наполегливості й здатності до планування, але вони чутливі до мотивації, труднощів у роботі під тиском часу і координації рухів, а також пов’язані з навичками читання, математичними навичками і функціями пам’яті. PSI включає субтести цифрового кодування символів і пошуку символів. Завдання з пошуку символів оцінює вербальну робочу пам’ять людини. На продуктивність також впливають здатність до концентрації уваги й розуміння. Завдання із запам’ятовуванням цифр є загальним компонентом багатьох шкал, включно з широко використовуваною шкалою WAIS (шкала інтелекту Векслера для дорослих). Госпітальна шкала тривоги та депресії зазвичай використовується для визначення рівня тривожності й депресії в людини. Тест відновлення послідовності кольорів (CTT) був розроблений для потреб щодо чутливості й специфічності стандартного тесту Trail Making Test (TMT).
Протягом клінічного дослідження особлива увага приділялася побічним явищам і побічним реакціям, пов’язаним із прийомом досліджуваного засобу.
Статистичний аналіз
Основною метою аналізу було показати перевагу Мемопруву над контрольною групою щодо показників нейровідновлення через 90 днів. Був обчислений описовий облік базових відмінностей (середнє значення, стандартне відхилення (SD), дисперсія), а також гістограми для всіх змінних безперервного результату. Середні, медіанні й різницеві гіпотези в групі розподілу були перевірені щодо відмінності від базового показника, і ці значення різниці розраховані за допомогою незалежного зразкового t-критерію та U-тесту Манна — Уїтні. Для оптимальної порівнянності між шкалами внаслідок неоднорідного параметричного й непараметричного розподілу змінних результатів останню обрали для повідомлення результатів дослідження. Розміри ефектів (η2, dCohen) розраховували за допомогою спеціалізованого програмного забезпечення, починаючи із статистики U-тесту Манна — Уїтні на основі загальновживаних формул перетворень та інтерпретованого показника Cohen (1988).
Трансформацію величини ефекту у співвідношення шансів (OR) було проведено на основі оцінки dCohen з використанням методів, розроблених Borenstein et al. (2009). Оцінки розміру ефекту Манна — Уїтні були додатково інтерпретовані з використанням досягнень, описаних Rahlfs і Zimmerman (2019). Було складено двосторонній багатовимірний дисперсійний аналіз (MANOVA), щоб оцінити, чи відрізняються комбіновані змінні результату залежно від дослідницьких груп за допомогою зваженої складової змінної. Припущення й передумови для моделі MANOVA були перевірені й враховані при поданні результатів.
Результати
У дослідження N-PEP-12 STROKE було включено 121 особу (контрольна група — 41, група лікування — 80), які перенесли ішемічний інсульт за 30–120 днів до скринінгу. У 9 осіб не проводилося спостереження, оскільки вони добровільно вибули з дослідження (група Мемопруву — 5 осіб, контрольна група — 4 особи). Повний аналіз популяції цього дослідження проведений у 112 осіб, які перенесли інсульт (рис. 1).
Вивчені групи були порівнянними щодо середнього віку і маси тіла. Розподіл за статтю становив приблизно 3 : 1 (чоловіки й жінки відповідно). Описова статистика щодо різниці базових показників на 30-й і 90-й день за всіма шкалами результатів наведена в табл. 1.
/29.jpg)
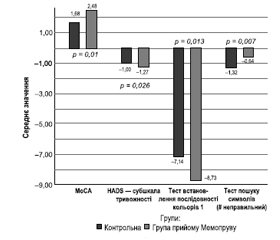
Показники за шкалами MoCA, HADS — субшкала тривожності, показники тесту встановлення послідовності кольорів 1 і пошуку символів (неправильне число) на 90-й день були статистично вірогідними. Розподіл був однаковим за візуальною оцінкою, що вказує на середню різницю між двома групами. За шкалою MoCA на 90-й день спостерігався граничний «проміжний ефект» на користь групи прийому Мемопруву (dCohen = 0,491, η2 = 0,057, OR = 2,436, p = 0,010). За HADS — субшкалою тривожності й у тесті встановлення послідовності кольорів 1 на 90-й день зареєстрували ефект від малого до середнього на користь Мемопруву (dCohen = 0,424, η2 = 0,043, OR = 2,157, p = 0,026; dCohen = 0,481, η2 = 0,055, OR = 2,3927, р = 0,013 відповідно). Щодо помилок у тесті пошуку символів спостерігався «проміжний» ефект на користь контрольної групи (dCohen = 0,501, η2 = 0,059, OR = 2,4811, р = 0,007). Непараметричні різниці в групах, які були статистично вірогідними на 90-й день, наведені у вигляді стовпчикових діаграм (рис. 2).
/30.jpg)
На основі різниці в групах було проведено односторонній багатовимірний дисперсійний аналіз для визначення ефекту розподілу лікування на комбінований ансамбль залежних змінних на 90-й день: MoCA, HADS — субшкала тривожності, HADS — субшкала депресії, тест запам’ятовування цифр у прямому порядку, тест запам’ятовування цифр у зворотному порядку, тест встановлення послідовності кольорів 1, тест встановлення послідовності кольорів 2, кодування цифрових символів, тест пошуку символів (# правильний), тест пошуку символів (# неправильний). Особи в групі лікування Мемопруву мали загальну описову перевагу. Відмінності між двома групами в рамках комбінованої моделі були статистично вірогідними (F = 2,191, p = 0,024; A Wilks’ Λ = 0,882).
Існував лінійний взаємозв’язок між залежними змінними, оцінений за допомогою діаграми розподілу, і не було жодних доказів мультиколінеарності за кореляцією Пірсона (r < 0,9). За оцінкою під час огляду бокс-ділянки було встановлено декілька одноваріантних відхилень даних, а за оцінкою з використанням відстані Махаланобіса не встановлено жодних великих багатоваріантних неточних даних. За оцінкою за тестом Шапіро — Уїлка встановлений нормальний розподіл шкал результатів (р > 0,05). Комбінована модель у багатовимірному тесті дала значення p = 0,024 для суміжних залежних змінних без коригування Бонферроні. Оцінки контрастності доступні для всіх показників у табл. 2.
/30_2.jpg)
Частота побічних ефектів у досліджуваних групах була однаковою (лікування: 16 % проти контролю: 13,5 %). Оцінки ризику побічних ефектів також були однаковими (у контрольній групі співвідношення шансів = 1,145; 95% довірчий інтервал: 0,520–2,250; в групі лікування співвідношення шансів = 0,939; 95% довірчий інтервал: 0,670–1,318). Смертей під час дослідження не зафіксовано.
Отже, в клінічному дослідженні оцінювали безпеку й ефективність засобу Мемопруву у дорослих середнього і старшого віку, які перенесли супратенторіальний ішемічний інсульт за 30–120 днів до включення в дослідження. Результати вказують на перевагу Мемопруву на 30-й і 90-й дні після лікування. Статистично вірогідні відмінності показників на 90-й день на користь групи лікування проявлялися в невеликому/середньому ступені вираженості ефектів за шкалами MoCA, HADS — субшкала тривоги і тестом встановлення послідовності кольорів 1, продовжуючи чітку тенденцію, що спостерігалася на 30-й день. Щодо одного параметра субшкали пошуку символів (кількість помилок), незважаючи на описову перевагу Мемопруву в іншому оціненому показнику індексу швидкості обробки (кодування символів цифр), спостерігалися статистично вірогідні результати на користь контрольної групи (тобто в контрольній групі було зареєстровано більш виражене поліпшення у вигляді меншої кількості помилок порівняно з базовим рівнем). Субшкали індексу швидкості обробки, як правило, вимірюють змішані результати між аналізованими субшкалами і часовими точками. Показники за субшкалами запам’ятовування цифр у прямому й зворотному порядку були гранично статистично вірогідними на користь групи лікування.
Усе це надає чіткий доказ щодо ефективності засобу Мемопрув у посиленні нейровідновлення після перенесеного супратенторіального ішемічного інсульту, що сприяє поліпшенню когнітивних і психічних показників.
Вторинний аналіз пілотного рандомізованого контрольованого дослідження фази IV N-PEP-12 STROKE, проведений L.L. Popa et al., був присвячений подальшому вивченню впливу Мемопруву на електричну активність мозку, яка була оцінена за допомогою показників електроенцефалографії (ЕЕГ), виміряних в активному стані та стані спокою на початковому етапі й через 90 днів після лікування пацієнтів з ішемічним інсультом. Вторинною кінцевою точкою було виявлення взаємозв’язків між параметрами ЕЕГ і показниками доступних нейропсихологічних шкал. ЕЕГ і нейро-психологічні оцінки двох візитів були вилучені з архіву дослідження: Т1 (базовий рівень, 30–120 днів після інсульту) і Т2 (90 днів після Т1).
Для аналізу було доступно п’ять нейропсихологічних шкал: 1) Монреальська когнітивна шкала; 2) індекс швидкості обробки (шкала інтелекту Векслера для дорослих, третє видання, PSI) — 2 субшкали (пошук символів (PSC), кодування цифрових символів (PSS));
3) запам’ятовування цифр (шкала інтелекту Векслера для дорослих, третє видання (DSF, DSB)); 4) госпітальна шкала тривоги і депресії (HADS-d, HADS-a) і
5) тест відновлення послідовності кольорів — 2 субшкали (CL1, CL2).
Проведення аналізу
Сигнали біоелектричної активності головного мозку реєструвалися за допомогою 32-канального електроенцефалографа Nicolet® (Natus Medical). Записи ЕЕГ проводилися для кожного пацієнта як у стані спокою, так і при виконанні когнітивних завдань у наступній послідовності: 1) очі відкриті (EO1) — 5 хв; 2) очі закриті (EC1) — 5 хв; 3) когнітивні завдання, які виконувалися на планшетному пристрої з використанням CANTAB (Cambridge Neuropsychological Test Automated Battery) з чутливістю до виявлення змін у нейропсихологічних показниках (швидкість реакції — COG1; увага — COG2; робоча пам’ять — COG3) — 10 хв; 4) очі відкриті (EO2) — 5 хв; 5) очі закриті (EC2) — 5 хв. Програмне забезпечення Brain Vision Analyzer використовувалося для попередньої обробки, видалення непотрібних сигналів і аналізу отриманих даних ЕЕГ. Для проведення статистичного аналізу сигналів ЕЕГ були виконані додаткові процедури реструктуризації даних (перетворення в довгий формат, об’єднання з використанням середніх значень) за допомогою Microsoft Excel.
Вплив лікування, часу й абсолютної потужності ЕЕГ, виміряної у двох часових точках (T1 = 30–120 днів після інсульту і T2 = 90 днів після T1) у різних частотних діапазонах, тестували з використанням дисперсійного аналізу повторних вимірювань ANOVA. Взаємозв’язки між когнітивними порушеннями, виміряними за допомогою нейропсихологічних шкал (MoCA, HADS-d, HADS-a, CL1, CL2, DSF, DSB, PSC, PSS), і абсолютною спектральною потужністю в різних частотних діапазонах були оцінені за допомогою коефіцієнта кореляції Спірмена (ρ). Усі статистичні тести, використані при аналізі даних, були двосторонніми. Через багаторазове тестування (тета, бета, альфа, дельта, співвідношення дельта/альфа (DA) і співвідношення (дельта + тета)/(альфа + бета) (DTAB)) рівень значущості оцінювали при α’ = 0,008, застосовуючи поправку Бонферроні (α-cкоригований = 0,05/6). Усі статистичні аналізи були проведені з використанням R версії 4.0.3 (R Foundation for Statistical Computing, Vienna, Austria).
Результати
Зі 112 пацієнтів, які брали участь у початковому пілотному рандомізованому контрольованому дослідженні фази IV N-PEP-12 STROKE, для подальшого аналізу були відібрані 57 хворих: 39 у групі Мемопруву і 18 у групі контролю. У цих групах не було зареєстровано суттєвих відмінностей за віком (Мемопрув: 61,59 ± 11,11 року порівняно з контрольною групою: 64,50 ± 9,81 року; p = 0,345), статтю (частка пацієнтів чоловічої статі Мемопрув = 88,9 % порівняно з конт-рольною групою = 76,9 %; р = 0,473), клінічними характеристиками (табл. 3).
Дисперсійний аналіз повторних вимірювань ANOVA, який використовувався для порівняння груп на початковому рівні дослідження (T1 = 30–120 днів після інсульту), не виявив статистично значущих відмінностей для альфа, бета, дельта, тета, DA і DTAB частот у часовій точці T1 (WTS = 1,19, p = 0,284 для альфа, WTS = 1,73, p = 0,195 для бета, WTS = 0,11, p = 0,744 для дельта, WTS = 5,16, p = 0,028 для тета, WTS = 0,24, р = 0,634 для DA і WTS = 0,04, p = 0,855 для DTAB).
На початковому рівні спектральна щільність потужності в діапазоні частот альфа, дельта, DA і DTAB показала значні відмінності між аналізованими сегментами ЕЕГ (WTS = 31,66, p = 0,002 < 0,008 в альфа-діапазоні, WTS = 122,54, p < 0,001 для дельти, WTS = 86,91, p < 0,001 для DA, WTS = 75,36, p < 0,001 для DTAB).
Основні та взаємопов’язані ефекти часу, сегментів ЕЕГ і груп на глобальну абсолютну спектральну потужність, вимірювану в діапазоні частот альфа, бета, дельта, тета, DA і DTAB
У табл. 2 показано вплив режимів ЕЕГ, часових точок (T1 = 30–120 днів після інсульту і T2 = 90 днів після T1), груп лікування (щоденний прийом Мемопруву у дозі 90 мг порівняно з контролем), міжсуб’єктних, внутрішньосуб’єктних факторів на абсолютну спектральну потужність. Для доведення закономірності змін значень абсолютної потужності залежно від часу (Т2 проти Т1) використовувався термін «взаємодія груп за часовими точками», який не виявив значущого взаємозв’язку між групою лікування і часом в альфа (р = 0,364), бета (р = 0,876), тета (p = 0,644), дельта (p = 0,642), DA (p = 0,516) і DTAB (p = 0,348) частотних діапазонах.
Дисперсійний аналіз повторних вимірювань ANOVA показав значні відмінності в абсолютній потужності між станами ЕЕГ в альфа (Р = 0,001), бета, тета, дельта, DA і DTAB частотних діапазонах (р < 0,001). Істотних відмінностей у середніх значеннях абсолютної потужності між T1 (альфа: m = 0,259, SD = 0,097; бета: М = 0,193, SD = 0,053; дельта: M = 0,359, SD = 0,106; тета: M = 0,232, SD = 0,066; DA: M = 1,513, SD = 0,582; і DTAB: M = 1,353, SD = 0,378) і T2 (альфа: m = 0,259, SD = 0,113; бета: m = 0,197, SD = 0,058; дельта: М = 0,345, SD = 0,102; тета: М = 0,232, SD = 0,072; DA: М = 1,493, SD = 0,626; і DNAB: М = 1,333, SD = 0,396) у всіх частотних діапазонах (p > 0,008) не спостерігалося.
Аналогічні результати були отримані для різниці середніх значень абсолютної спектральної щільності потужності між групами Мемопруву і контролю в усіх частотних діапазонах (табл. 4), за винятком тета-діапазону, де спостерігалася значуща різниця в абсолютній потужності на рівні α = 0,05 (Mcontrol = 0,218, SDcontrol = 0,063 порівняно з MN-PEP-12 = 0,239, SDN-PEP = 0,071, р = 0,023). При рівні α = 0,008 це відмінності були незначними.
Отже, результати табл. 2 не показали суттєвої взаємодії між групою, часовими точками й режимами ЕЕГ (р > 0,008), за винятком спектральної щільності потужності для тета-частот, де абсолютна потужність у досліджуваних сегментах ЕЕГ значно відрізнялася при α = 0,05, але незначно — при α’ = 0,008 (сегмент ЕЕГ за часовими точками: р = 0,03) (рис. 3).
Кореляції між глобальною абсолютною спектральною потужністю, виміряною в різних сегментах ЕЕГ, і показниками нейропсихологічних шкал
У сегменті EO2 (стан спокою, очі відкриті) в групі Мемопруву при T2 спостерігалися значущі позитивні кореляції на рівні α = 0,05 між показниками шкал MoCA, DSB і абсолютною спектральною потужністю альфа-частоти (ρ = 0,35, p = 0,029), а також PSS і абсолютною спектральною потужністю альфа-частоти (ρ = 0,33, р = 0,041). Аналогічних асоціацій не виявлялося при T1 (р > 0,008) в обох досліджуваних групах.
Під час активного стану (COG1) у групі Мемопруву при T2 виявлялися значні позитивні кореляції на рівні α = 0,05 між показниками шкали PSC, MoCA і DA і спектральною потужністю тета-частоти (ρ = 0,36, p = 0,023). Подібних асоціацій не було в обох досліджуваних групах при T1 (p > 0,008).
Обговорення
У вторинному аналізі пілотного рандомізованого контрольованого дослідження фази IV N-PEP-12 STROKE оцінювався вплив Мемопруву на ЕЕГ і взаємозв’язок між параметрами ЕЕГ і показниками нейропсихологічних шкал у пацієнтів середнього і літнього віку з недавнім (30–120 днів) супратенторіальним ішемічним інсультом.
Протягом останніх 15 років кілька досліджень зосереджувались на оцінці ЕЕГ після гострого або підгострого ішемічного інсульту, використовуючи сигнали спокою, зафіксовані за допомогою 19–64 електродних ЕЕГ, розташованих відповідно до міжнародних стандартів 10–20 або 10–10. В одному з досліджень аналіз даних ЕЕГ проводили за допомогою єдиного електрода шкіри голови, розміщеного в лобно-тім’яній ділянці. Порівняно з попередніми роботами дане дослідження має більш високу методологічну складність завдяки 32-канальній ЕЕГ, а також вимірюванню сигналів мозку в трьох різних умовах (з відкритими очима, із закритими очима і когнітивними завданнями), що демонструє більш детальну картину електронейрофізіології мозку й сприяє кращому розумінню клінічної еволюції після ішемічного інсульту.
Захисний ендогенний механізм, який діє після пошкодження мозку й сприяє відновленню нервової системи в гострій і наступних фазах інсульту, може стимулюватися застосуванням мультимодальних засобів і немедикаментозних втручань. У цьому дослідженні час початку використання Мемопруву відповідав підгострій фазі інсульту, що дозволяло модулювати й посилювати ендогенну нейропластичність.
Найважливіша коливальна активність у людському мозку належить альфа-частоті (8–13 Гц), яка обумовлює переривання психічної напруги й перешкоджає отриманню несуттєвої інформації. Вона також пов’язана з пам’яттю, сприйняттям та увагою. Тета-частоти — повільнохвильові коливання (4–8 Гц) відповідають за робочу пам’ять, відновлення епізодичної пам’яті, просторову орієнтацію і процеси емоційної регуляції. Бета-частоти (13–30 Гц) пов’язані з інтеграцією вхідної сенсорної інформації (зорової, слухової, соматосенсорної, рухів), вибірковою увагою, короткочасною пам’яттю, розпізнаванням, емоційними станами, перцептивним і асоціативним навчанням і творчими завданнями. Коливання тета- і бета-частотних діапазонів корелюють з процесами актуалізації пам’яті, пошуку інформації й емоційним збудженням.
З 1981 року було постульовано, що дельта-активність є найвищою в ішемізованій ділянці й найбільше корелює зі зниженням регіонарного церебрального кровотоку в пацієнтів із супратенторіальним одностороннім інфарктом головного мозку. Через два десятиліття доведено, що до появи дельта-активності може спостерігатися ослаблення й уповільнення бета- і альфа-активності. У 2007 році Cuspineda et al. продемонстрували, що підвищення активності альфа- і тета-частот є предикторами кращого короткострокового результату, а підвищення дельта-активності — предиктором кращого довгострокового результату при гострому ішемічному інсульті. Згодом маркери судинних уражень DA та DTAB стали використовуватися для моніторингу й прогнозування результату інсульту. Для оцінки ефективності втручання при судинних когнітивних порушеннях ці маркери можуть бути застосовані в кореляції з нейропсихологічними шкалами.
У цьому дослідженні, незважаючи на відсутність статистично значущих середніх відмінностей абсолютної спектральної потужності між T1 і T2 у всіх частотних діапазонах (р > 0,008), спектральна щільність потужності на ЕЕГ у певні моменти часу була змінною в альфа-, бета-, дельта- і тета-частотах у всіх учасників дослідження (рис. 1). Ці зміни можуть свідчити про динамічну реорганізацію мозку і нейропластичність. Середні значення спектральної щільності потужності тета-частоти на ЕЕГ істотно відрізнялися при α = 0,05 і незначно — при α’ = 0,008 (рис. 1). Як було показано в попередніх дослідженнях, альфа-активність пов’язана з обробкою інформації та когнітивними процесами, зокрема з увагою. У дослідженні, у якому взяли участь понад 200 пацієнтів, було виявлено, що через 1 і 3 місяці після інсульту найбільш вразливою когнітивною функцією є увага, а уповільнення альфа-активності може відображати недостатнє відновлення когнітивних порушень. І навпаки, збільшення альфа-активності, головним чином у лобових ділянках, позитивно корелює зі шкалою MoCA і є сприятливим прогностичним фактором у пацієнтів, які перенесли ішемічний інсульт.
/28.jpg)
При першому відвідуванні (T1) не було виявлено суттєвих групових відмінностей у спектральній щільності потужності, виміряної за 32-канальною ЕЕГ в альфа-, бета- і дельта-частотних діапазонах. Єдина значна різниця на рівні α = 0,05 спостерігалася в спектрі тета-потужності на користь групи Мемопруву (WTS = 5,16, p = 0,028), але вона не залишалася значущою на рівні α’ = 0,008. При другому відвідуванні (T2) були отримані аналогічні результати.
Наявність тета-частот у цьому дослідженні може мати подвійну інтерпретацію. По-перше, тета-активність збільшується під час виконання складних розумових завдань залежно від робочої пам’яті та індивідуального емоційного статусу. Більш високі рівні префронтальної тета-активності були пов’язані з поліпшенням уваги, вербальної пам’яті і виконавчих функцій у 73 здорових літніх людей (56–70 років), що визначає її як маркер здорового нейрокогнітивного старіння. В інших дослідженнях зниження лобової тета-активності корелювало зі зниженням робочої пам’яті в літніх людей. По-друге, повідомлялося, що висока тета-активність найчастіше зустрічається при судинних і нейрогенеративних когнітивних розладах. При 1-річному спостереженні за пацієнтами з оборотним ішемічним неврологічним дефіцитом збільшення альфа- і тета-частоти виявлялося в 91,28 % випадків. Низька тета- і підвищена дельта-активність корелювали з гіршим когнітивним прогнозом.
Як продемонстровано на рис. 1, через 90 днів після другого відвідування (T2) у групі N-РЕР-12 реєструвалось збільшення альфа-активності в сегментах EC1 і EO2, збільшення величини спектральної щільності бета-потужності на EC1, COG1, EO2 і EC2 порівняно з групою плацебо. На рис. 2 показано невелике збільшення абсолютної тета-потужності на сегментах COG1, COG3 і EO2. Це свідчить, що призначення 90 мг Мемопруву протягом 90 днів після інсульту спряє підвищенню активності в усіх частотних діапазонах, особливо тета-активності при α = 0,05.
У рамках вторинної мети дослідження вивчався можливий зв’язок між параметрами ЕЕГ і нейропсихологічними шкалами. Недавні дослідження показали позитивну кореляцію між середнім значенням альфа-частоти на ЕЕГ і показниками шкали MoCA в пацієнтів з підгострим правостороннім інсультом, а також помірні й високі кореляції між співвідношеннями дельта-/тета-потужності (DTR), тета- і дельта-потужністю й показниками шкали DAR. У цьому аналізі були виявлені статистично значущі випадки, коли пацієнти в групі Мемопруву мали позитивні кореляції між параметрами ЕЕГ і нейропсихологічними шкалами як у стані спокою, так і в активному стані. У контексті раніше задокументованих асоціацій між прийомом Мемопруву і поліпшенням показників шкал оцінки когнітивних функцій і депресії зв’язок між діапазонами спектральної потужності ЕЕГ у всіх сегментах і часових точках і доступними нейропсихологічними шкалами важко інтерпретувати, головним чином через різницю в розмірах вибірки між цими двома дослідженнями, що може бути усунуто за допомогою багатовимірного аналізу ефективності, який одночасно розглядає всі наявні результати.
Деякі обмеження даного дослідження полягають в широкому інтервалі включення (1–4 місяці від початку інсульту), відсутності стратифікації на основі тяжкості або локалізації пошкодження судин, у можливій упередженості відбору через якість збору сигналу в осіб, включених у дослідження. Щоб компенсувати згадані вище обмеження щодо контролю тяжкості й ділянки ураження в популяції, яка перенесла інсульт, було проведено усереднення за всіма показниками, що призвело до значно менш вірогідних результатів, чого слід уникати в майбутніх аналізах.
Отже, результати пілотного рандомізованого конт-рольованого клінічного дослідження фази IV N-PEP-12 STROKE і вторинний аналіз цього дослідження продемонстрували ефективність засобу Мемопруву щодо посилення процесів нейровідновлення в пацієнтів після супратенторіального ішемічного інсульту, що підтверджувалося поліпшенням показників за шкалами MoCA, HADS, тестом встановлення послідовності кольорів 1, субшкалою запам’ятовування цифр, підвищенням активності альфа-, бета- і тета-частот і їх позитивною кореляцією з показниками нейропсихологічних шкал.
/30.jpg)

/28.jpg)
/29.jpg)
/30_2.jpg)
/32.jpg)
/33.jpg)
/34.jpg)