Журнал «Медицина неотложных состояний» Том 19, №8, 2023
Вернуться к номеру
Серцево-судинні захворювання і енергодефіцит: патогенетичні шляхи корекції
Авторы: Черська М.С., Кухарчук Х.М.
ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
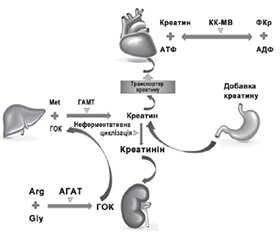
Серцево-судинні захворювання залишаються одними з найпоширеніших і найбільш впливових причин смерті у всьому світі, оскільки серце відіграє ключову роль у людському організмі. Енергетична кардіопротекторна терапія міокарда є важливим фактором захисту, регулює синтез та використання енергії клітинами міокарда, при цьому справляє невеликий вплив на серцевий ритм, артеріальний тиск та кровопостачання. Фосфокреатин відіграє важливу роль у внутрішньоклітинній системі буферизації та транспортування енергії, забезпечуючи перенесення енергії від місця її утворення до місця використання, щоб відповідати високим та змінним потребам серця. Дослідження показують, що фосфокреатин може мати позитивний вплив на пацієнтів із ішемічною хворобою серця, серцевою недостатністю та тих, хто переніс кардіохірургічні операції. Накопичена інформація підтверджує перспективи використання фосфокреатину у клінічній практиці для поліпшення результатів лікування пацієнтів із серцевими захворюваннями.
Cardiovascular disease remains one of the most common and influential causes of death worldwide, as the heart plays a key role in the human body. Energetic cardioprotective therapy of the myocardium is an important protective factor, regulating the synthesis and use of energy by myocardial cells, while having a little effect on heart rate, blood pressure, and blood supply. Phosphocreatine plays an important role in the intracellular energy buffering and transport system, ensuring energy transfer from the site of production to the site of use to meet the high and variable demands of the heart. Research shows that phosphocreatine can have a positive effect on patients with coronary heart disease, heart failure, and those who have undergone cardiac surgery. The accumulated information confirms the prospects of using phosphocreatine in clinical practice to improve treatment outcomes in patients with heart diseases.
серцево-судинні захворювання; енергодефіцит; фосфокреатин
cardiovascular diseases; energy deficiency; phosphocreatine
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Yi-Dan Hao, Ying-Xin Zhao, Shi-Wei Yang, Yu-Jie Zhou. High-Energy Phosphates and Ischemic Heart Disease: From Bench to Bedside. Frontiers in Cardiovascular Medicine. 2021. № 8. https://www.frontiersin.org/articles/10.3389/fcvm.2021.675608. DOI=10.3389/fcvm.2021.675608.
- Christen F., Desrosiers V., Dupont-Cyr B.A., Vandenberg G.W., Le François N.R., Tardif J.-C., et al. Thermal tolerance and thermal sensitivity of heart mitochondria: Mitochondrial integrity and ROS production. Free Radical Biology and Medicine. 2018. 116. 11-18. https://doi.org/10.1016/j.freeradbiomed.2017.12.037.
- Ballinger S.W. Mitochondrial dysfunction in cardiovascular disease. Free Radic. Biol. Med. 2005.
- Lemieux H. et al. Dietary fatty acids and oxidative stress in the heart mitochondria. Mitochondrion. 2011.
- Kolwicz S.C., Tian R. Metabolic therapy at the crossroad: how to optimize myocardial substrate utilization. Trends Cardiovasc. Med. 2009. 19. 201-7. 10.1016/j.tcm.2009.12.005.
- Fruchart J.C., Davignon J., Hermans M.P., Al-Rubeaan K., Amarenco P., Assmann G., et al. Residual macrovascular risk in 2013: what have we learned. Cardiovasc. Diabetol. 2014. 13. 26. 10.1186/1475-2840-13-26.
- Mallet R.T., Manukhina E.B., Ruelas S.S., Caffrey J.L., Downey H.F. Cardioprotection by intermittent hypoxia conditioning: evidence, mechanisms, and therapeutic potential. Am. J. Physiol. Heart Circ. Physiol. 2018. 315. H216-32. 10.1152/ajpheart.00060.2018.
- Ait-Aissa K., Blaszak S.C., Beutner G., Tsaih S.W., Morgan G., Santos J.H., et al. Mitochondrial oxidative phosphorylation defect in the heart of subjects with coronary artery disease. Sci. Rep. 2019. 9. 7623. 10.1038/s41598-019-43761-y.
- Marshall R.P., Droste J.N., Giessing J., Kreider R.B. Role of Creatine Supplementation in Conditions Involving Mitochondrial Dysfunction: A Narrative Review. Nutrients. 2022. 14(3). 529. Published 2022 Jan 26. doi: 10.3390/nu14030529.
- Huertas J.R., Casuso R.A., Agustín P.H., Cogliati S. Stay Fit, Stay Young: Mitochondria in Movement: The Role of Exercise in the New Mitochondrial Paradigm [published correction appears in Oxid Med. Cell Longev. 2021 Jan 18. 2021. 9274841]. Oxid Med. Cell. Longev. 2019. 2019. 7058350. Published 2019 Jun 19. doi: 10.1155/2019/7058350.
- Lenaz G., Genova M.L. Kinetics of integrated electron transfer in the mitochondrial respiratory chain: random collisions vs. solid state electron channeling. American Journal of Physiology-Cell Physiology. 2007. 292(4). C1221-C1239. doi: 10.1152/ajpcell.00263.2006.
- Conley K.E. Mitochondria to motion: optimizing oxidative phosphorylation to improve exercise performance. The Journal of Experimental Biology. 2016. 219(2). 243-249. doi: 10.1242/jeb.126623.
- Meinild Lundby A.-K., Jacobs R.A., Gehrig S., et al. Exercise training increases skeletal muscle mitochondrial volume density by enlargement of existing mitochondria and not de novo biogenesis. Acta Physiologica. 2018. 222(1). doi: 10.1111/apha.12905.
- Axelrod C.L., Fealy C.E., Mulya A., Kirwan J.P. Exercise training remodels human skeletal muscle mitochondrial fission and fusion machinery towards a pro-elongation phenotype. Acta Physiologica. 2018. 225 (4, article e13216). doi: 10.1111/apha.13216.
- Kreider R.B., Kalman D.S., Antonio J., Ziegenfuss T.N., Wildman R., Collins R., et al. International Society of Sports Nutrition position stand: safety and efficacy of creatine supplementation in exercise, sport, and medicine. J. Int. Soc. Sports Nutr. 2017. 14. 18. 10.1186/s12970-017-0173-z.
- Barcelos R.P., Stefanello S.T., Mauriz J.L., Gonzalez-Gallego J., Soares F.A. Creatine and the liver: metabolism and possible interactions. Mini Rev. Med. Chem. 2016. 16. 12-8. 10.2174/1389557515666150722102613.
- Iqbal F., Hoeger H., Lubec G., Bodamer O. Biochemical and behavioral phenotype of AGAT and GAMT deficient mice following long-term creatine monohydrate supplementation. Metab. Brain Dis. 2017. 32. 1951-61. 10.1007/s11011-017-0092-3.
- Kashani K., Rosner M.H., Ostermann M. Creatinine: from physiology to clinical application. Eur. J. Intern. Med. 2020. 72. 9-14. 10.1016/j.ejim.2019.10.025.
- Bonilla D.A., Kreider R.B., Stout J.R., Forero D.A., Kerksick C.M., Roberts M.D., Rawson E.S. Metabolic Basis of Creatine in Health and Disease: A Bioinformatics-Assisted Review. Nutrients. 2021. 13. 1238.
- Candow D.G., Forbes S.C., Chilibeck P.D., Cornish S.M., Antonio J., Kreider R.B. Effectiveness of Creatine Supplementation on Aging Muscle and Bone: Focus on Falls Prevention and Inflammation. J. Clin. Med. 2019. 8. 488.
- Brosnan M.E., Brosnan J.T. The role of dietary creatine. Amino Acids. 2016. 48. 1785-1791.
- Kreider R.B., Stout J.R. Creatine in Health and Disease. Nutrients. 2021. 13. 447.
- Wallimann T., Tokarska-Schlattner M., Schlattner U. The creatine kinase system and pleiotropic effects of creatine. Amino Acids. 2011. 40. 1271-1296.
- Negro M., Avanzato I., D’Antona G. Chapter 2.7 — Creatine in Skeletal Muscle Physiology. In: Nonvitamin and Nonmineral Nutritional Supplements. Nabavi S.M., Silva A.S., Eds.; Academic Press: Cambridge, MA, USA, 2019. Р. 59-68.
- Guo-han C., Jian-hua G., Xuan H., Jinyi W., Rong L., Zhong-min L. Role of creatine phosphate as a myoprotective agent during coronary artery bypass graft in elderly patients. Coron. Artery Dis. 2013. 24. 48-53. 10.1097/MCA.0b013e32835aab95.
- Landoni G. et al. Cardiac protection with phosphocreatine: a meta-analysis, Interactive CardioVascular and Thoracic Surgery. 2016 Oct. 23, Iss. 4. 637-646. https://doi.org/10.1093/icvts/ivw171.
- Lygate C.A., Fischer A., Sebag-Montefiore L., Wallis J., ten Hove M., Neubauer S. The creatine kinase energy transport system in the failing mouse heart. J. Mol. Cell Cardiol. 2007. 42. 1129-36.
- Cheng S.X., Hu Q.H. Cardioprotective effect of exogenous phosphocreatine in patients undergoing open heart surgery. Hunan Yi Ke Da Xue Bao. 2001. 26. 353-5.
- Eremenko A.A., Galanikhina E.A. Efficiency of different medical methods for the prevention of atrial fibrillation in patients after coronary bypass operations. Cardiol. Cardiovasc. Surg. 2014. 7. 53-57.
- Ke-Wu D., Xu-Bo S., Ying-Xin Z., Shi-Wei Y., Yu-Jie Z., Dong-Mei S. et al. The effect of exogenous creatine phosphate on myocardial injury after percutaneous coronary intervention. Angiologу. 2015. 66. 163-8.
- Khapiy K.K., Filippovskaya Z.S., Khapiy I.K., Lopatin A.F. Evaluation of neoton efficacy in postoperative period. Bull. Intensive Ther. 2012. 4. 34-7.
- Lygate C.A., Bohl S., ten Hove M., Faller K.M., Ostrowski P.J., Zervou S. et al. Moderate elevation of intracellular creatine by targeting the creatine transporter protects mice from acute myocardial infarction. Cardiovasc. Res. 2012. 96. 466-75.
- Zhang W., Zhang H., Xing Y. Protective effects of phosphocreatine administered post-treatment combined with ischemic post-conditioning on rat hearts with myocardial ischemia/reperfusion injury. J. Clin. Med. Res. 2015. 7. 242-7.
- Li T., Wang N., Zhao M. Neuroprotective effect of phosphocreatine on focal cerebral ischemia-reperfusion injury. J. Biomed. Biotechnol. 2012. 2012. 168756.
- Genius J., Geiger J., Bender A., Möller H.J., Klopstock T., Rujescu D. Creatine protects against excitoxicity in an in vitro model of neurodegeneration. PLoS One. 2012. 7. e30554.
- Tokarska Schlattner M., Epand R.F., Meiler F., Zandomeneghi G., Neumann D., Widmer H.R. et al. Phosphocreatine interacts with phospholipids, affects membrane properties and exerts membrane-protective effects. PLoS One. 2012. 7. e43178.
- Horjus D.L., Oudman I., van Montfrans G.A., Brewster L.M. Creatine and creatine analogues in hypertension and cardiovascular disease. Cochrane Database of Systematic Reviews. 2011. 11.
- Strumia E., Pelliccia F., D’Ambrosio G. Creatine phosphate: pharmacological and clinical persectives. Advances in Тherapy. 2012. 29. 99-123.